镉致糖尿病肾病小鼠不同组织损伤及原花青素的保护作用
2017-12-02赵天雷翁竞玉皮思慧马力勇肖徐阳杨文娟
龚 频, 赵天雷, 翁竞玉, 皮思慧, 马力勇, 肖徐阳, 杨文娟
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
镉致糖尿病肾病小鼠不同组织损伤及原花青素的保护作用
龚 频, 赵天雷, 翁竞玉, 皮思慧, 马力勇, 肖徐阳, 杨文娟
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
研究了重金属镉导致糖尿病肾病小鼠脑及肺部的损伤作用及原花青素对镉致糖尿病肾病小鼠的保护作用.采用高脂高糖饲养并佐以腹腔注射1 mg/(kg·day)的CdCl2溶液诱导小鼠发生糖尿病肾病,通过检测各组小鼠脑及肺部中的谷胱甘肽(GSH)、丙二醛(MDA)及一氧化氮(NO)的含量变化,揭示DN小鼠不同组织中各类指标的变化规律.结果显示,DN组小鼠在镉的影响下,脑及肺部中的GSH明显下降(Plt;0.05)、MDA上升(Plt;0.05)、NO浓度下降(Plt;0.05),说明DN小鼠组织中氧化应激水平升高并产生炎症反应;通过对比原花青素保护组与DN组小鼠体内以上化合物含量的差异,并结合原花青素相关的作用机制,说明原花青素对脑及肺部具有保护作用,可以降低组织中MDA的含量并缓解组织中GSH含量的下降趋势,有效降低DN小鼠脑及肺部的氧化应激水平.研究了对DN小鼠脑及肺部的损伤变化,并且对原花青素的保护作用进行说明,为糖尿病肾病的临床诊断及相关药物的开发提供实验依据.
镉; 原花青素; 脑; 肺; 氧化损伤
0 引言
糖尿病肾病(DN)属于糖尿病的微血管并发症,是糖尿病微血管并发症中最常见、最严重的一种.其病理表现主要为肾小球基底膜增厚和系膜基质增生,故又称糖尿病肾小球硬化症[1].
重金属镉是一类广泛应用于工业生产中的人体非必需元素,易通过食物链在动物及人体内蓄积,具有生物半衰期长、代谢率低等特点,主要蓄积在肝脏及肾脏中,会损伤器官,造成机体功能的紊乱[2-4].
原花青素是自然界中广泛存在的一类由儿茶素、表儿茶素或没食子酸聚合而成的多酚类黄酮化合物,是目前国际上公认的清除人体内自由基最有效的天然氧化剂[5].原花青素具有保护心血管系统、清除自由基、抗氧化、抗突变、抗癌、抗辐射、促进细胞增殖等多种生物学作用[6].图1为原花青素的结构式.

图1 原花青素结构式
本研究以镉致糖尿病肾病小鼠模型为研究对象,对小鼠脑部及肺部中的氧化指标、抗氧化指标、炎症因子的含量进行检测,发现糖尿病肾病小鼠不同组织中各类指标的变化规律,并通过原花青素的干预作用,研究药物保护对糖尿病肾病小鼠不同组织中各类指标的影响,为进一步阐明糖尿病肾病的作用机制及相关药物的开发提供支持.
1 材料与方法
1.1 实验材料
SPF级雄性昆明小鼠购自西安交通大学实验动物中心;氯化镉(CdCl2)、N-(1-萘基)-乙二胺购自天津市福晨化学试剂厂;30%过氧化氢购自天津市河东区红岩试剂厂;生理盐水购自西安京西双鹤药业有限公司;其他试剂均为分析纯.
1.2 实验动物与模型建立
雄性昆明小鼠32只,体重(20±2)g,实验前适应性饲养一周,自由取食饮水.随机将小鼠分为4组,每组8只.模型构建具体如表1所示.每日早晨定时给药1次,氯化镉的给药浓度为1 mg/(kg· day),胃饲原花青素10 mg/(kg· day).整个饲养过程中保持温度、光照、湿度等环境条件平行,每日供应饮食、饮水总量一致.连续饲养10周,末次处理前,禁食12 h,断颈处死,取血和新鲜脑及肺部组织,于-80 ℃冷冻保存,用于检测镉致糖尿病肾病小鼠不同组织的指标变化.

表1 构建镉损伤小鼠模型给药方式
1.3 样品测定方法及指标
将脑及肺部组织制备成10%的组织匀浆.采用硫代巴比妥酸法检测脂质过氧化指标丙二醛(MDA)的活性;DTNB(5,5′-二硫代-双,2-硝基苯甲酸)法检测还原型谷胱甘肽(GSH)的活性;采用Griess试剂法测定组织中NO的浓度[17].进而分析镉致糖尿病肾病小鼠与正常小鼠组织之间的差异.
1.4 统计学方法
所有的实验数据都表示为mean±SE,平均值用单向方差分析法(one-way analysis of variance,ANOVA)和相应的t-检查(Student′st-test)进行统计学分析,统计学上Plt;0.05认为差异有统计学意义.
2 结果与讨论
2.1 镉致糖尿病肾病对脑部的损伤及原花青素的保护作用
图2表示镉致DN小鼠脑部谷胱甘肽活性的对比.由图2可以看出,在建模11周后,损伤组脑部的GSH含量明显低于空白组(Plt;0.05),而原花青素可以有效缓解GSH的下降趋势,保护效果明显.谷胱甘肽由谷氨酸、半胱氨酸及甘氨酸组成,存在于机体内的各个组织中.GSH和超氧化物歧化酶(SOD)、过氧化氢酶(CAT)一起通过清除O2-·、H2O2,防止·OH、O2产生,以减轻和阻断脂质过氧化作用[7],是机体抗氧化防御系统的重要组成部分.说明在脑部,原花青素可以很大程度减少GSH的损耗,起到保护作用.
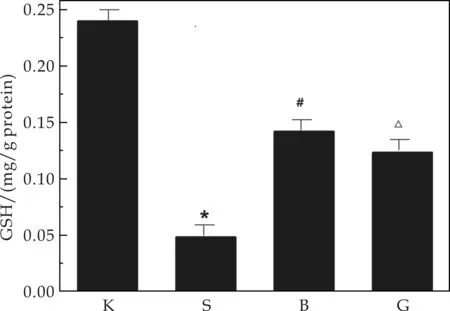
注:①K代表空白组,S代表镉损伤组,B代表原花青素保护组,G代表高脂高糖组;②与空白组比较,*Plt;0.05;与镉损伤组相比,#Plt;0.05
图3表示镉致DN小鼠脑部丙二醛活性的对比.由图3可以看出,在建模11周后,损伤组脑部的丙二醛含量明显高于空白组(Plt;0.05),而原花青素保护组小鼠脑内MDA活性降低.镉的毒性与细胞脂质过氧化密切相关[8],MDA的含量可以反映体内脂质过氧化损伤水平,这说明镉中毒诱发了脂质过氧化反应,而原花青素减轻了氧化应激水平,使MDA活性降低,证明其保护作用.
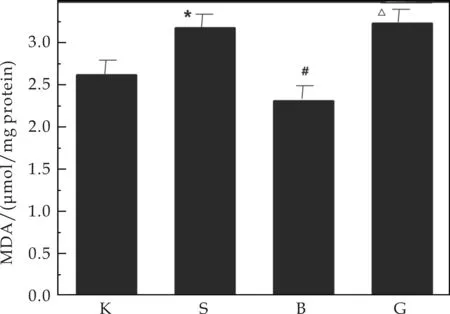
注:①K代表空白组,S代表镉损伤组,B代表原花青素保护组,G代表高脂高糖组;②与空白组比较,*Plt;0.05;与镉损伤组相比,#Plt;0.05
图4表示镉致DN小鼠脑部一氧化氮浓度的对比.由图4可以看出,在建模11周后,损伤组脑部的NO含量与空白组相比有所下降(Plt;0.05).随着疾病的发展,尿蛋白的排泄逐渐增加,氧自由基增多,大量的生长因子生成,而山梨醇通路的活化等因素使NO合成、稳定性及活性降低[9].原花青素可以有效缓解NO的下降趋势,这说明在脑部,原花青素可以保持NO活性,减少了NO的损耗,从而起到保护作用.
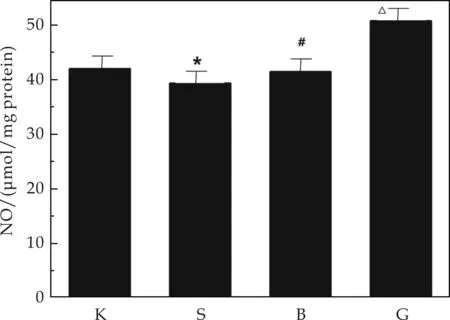
注:①K代表空白组,S代表镉损伤组,B代表原花青素保护组,G代表高脂高糖组;②与空白组比较,*Plt;0.05;与镉损伤组相比,#Plt;0.05
2.2 镉致糖尿病肾病对肺部的损伤及原花青素的保护作用
图5表示镉致DN小鼠肺部谷胱甘肽活性的对比.由图5可以看出,在建模11周后,损伤组肺部的GSH含量明显低于空白组(Plt;0.05),而原花青素可以有效缓解GSH的下降趋势,保护效果明显.这说明在肺部,原花青素可以有效的增强GSH活性,减少了GSH的损耗,从而起到保护作用.
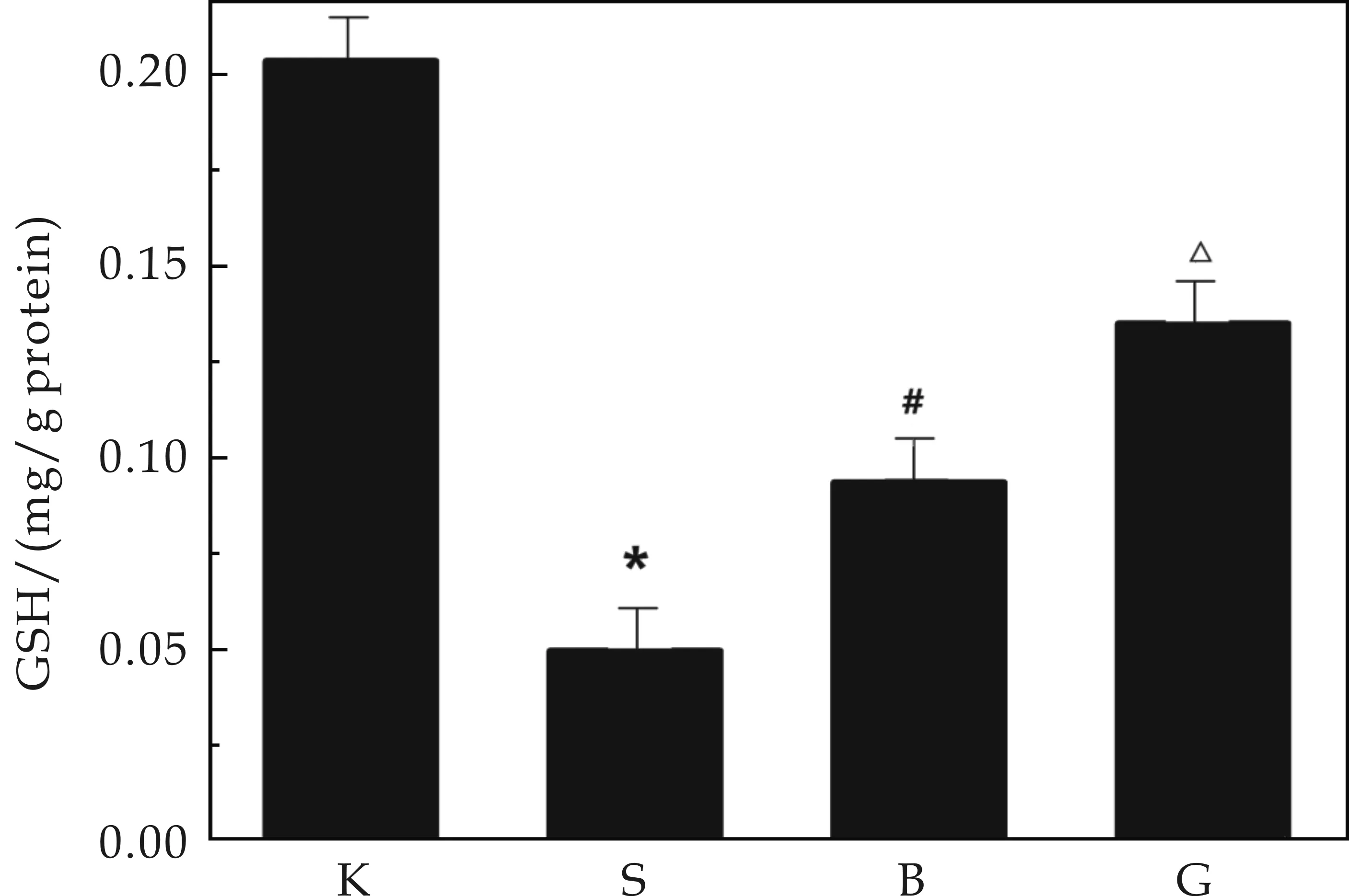
注:①K代表空白组,S代表镉损伤组,B代表原花青素保护组,G代表高脂高糖组;②与空白组比较,*Plt;0.05;与镉损伤组相比,#Plt;0.05
图6表示镉致DN小鼠肺部丙二醛的对比.由图6可以看出,损伤组肺部的MDA含量明显高于于空白组(Plt;0.05),而原花青素可以一定程度上减少肺内MDA含量.丙二醛是脂质氧化终产物,会影响线粒体呼吸链复合物及关键酶的活性.这说明在肺部,镉的毒性可以诱发脂质过氧化反应,原花青素可以稍降低肺组织氧化水平,使MDA活性降低,而起到一定的保护作用.
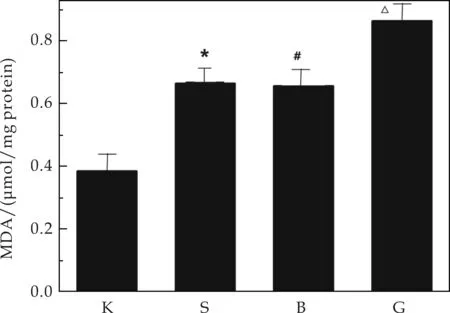
注:①K代表空白组,S代表镉损伤组,B代表原花青素保护组,G代表高脂高糖组;②与空白组比较,*Plt;0.05;与镉损伤组相比,#Plt;0.05
图7表示镉致DN小鼠肺部一氧化氮含量的对比.由图7可以看出,损伤组脑部的NO含量与空白组相比有所下降(Plt;0.05),而原花青素可以有效缓解NO的下降趋势.这说明在脑部,原花青素可以保持NO活性,减少了NO的损耗.

注:①K代表空白组,S代表镉损伤组,B代表原花青素保护组,G代表高脂高糖组;②与空白组比较,*Plt;0.05;与镉损伤组相比,#Plt;0.05
3 结论
金属镉通过进入机体后形成金属硫蛋白,从而蓄积于各个器官,产生较持久的毒性[10].本实验通过镉致糖尿病肾病小鼠脑部及肺部的GSH、MDA及NO含量改变,说明DN小鼠组织内氧化应激水平改变并发生炎症反应.同时,原花青素作为一种高效的抗氧化剂,可以降低DN小鼠不同组织的氧化水平,改善镉损伤改变的抗氧化体系活性,减轻组织内的氧化应激反应[11].
实验结论证明镉所致的氧化损伤可能是糖尿病肾病的潜在发病机制之一[12,13],原花青素对自由基引发的氧化反应具有显著的改善作用[14],能有效对脑部及肺部的氧化损伤产生保护,这可能与原花青素改变了部分体内抗氧化酶系统的氧化环境与抗氧化能力有关[15-17].
[1] 朱宜临,钱秋海,张新颖.糖尿病肾病中西医研究进展[J].山东中医杂志,2017,36(1):82-84,88.
[2] 杜丽娜,余若祯,王海燕,等.重金属镉污染及其毒性研究进展[J].环境与健康杂志,2013,30(2):167-174.
[3] 谢黎虹,许梓荣.重金属镉对动物及人类的毒性研究进展[J].浙江农业学报,2003,15(6):52-57.
[4] 顾俊莲,王 波,刘亚男,等.吸烟相关剂量镉对大鼠心肌的损伤作用及其分子机制[J].吉林大学学报(医学版),2011,37(4):591-595,562.
[5] 吴英俊,梁忆非,董嘉楠.葡萄籽原花青素的研究进展[J].热带医学杂志,2010,10(8):1 025-1 028.
[6] 步文磊,王 茵.原花青素的生物活性及作用机制研究进展[J].国外医学(卫生学分册),2007,34(5):311-315.
[7] 周 玫,陈 瑗.谷胱甘肽过氧酶——一种抗氧化酶[J].生理科学进展,1984,15(4):348-351.
[8] Stohs S J,Bagchi D.Oxidative mechanisms in the toxicity of metal ions[J].Free Radical Biology amp; Medicine,1995,18(2):321-336.
[9] 吴丹荣,张韬威.一氧化氮、内皮素及其比值与糖尿病肾病的相关研究[J].中国糖尿病杂志,2001,9(6):22-25.
[10] 杨建泉,倪 慧,王玲玲,等.镉损伤肝细胞体外模型的建立[J].现代农业科技,2013(22):241-243,245.
[11] 刘国安,冯筱璐,牛 娟,等.原花青素抗氧化活性及对细胞氧化损伤的保护作用[J].西北师范大学学报(自然科学版),2011,47(6):58-62.
[12] 李光先,余日安.镉毒性作用干预方法及其机制研究进展[J].中国职业医学,2014,41(2):222-226.
[13] 杨 望,赵先英,张定林,等.镉的毒性及损伤机制研究进展[J].职业与健康,2013,29(8):1 001-1 003.
[14] 孙 芸,徐宝才,谷文英.葡萄籽原花青素抗氧化作用的研究[J].中国粮油学报,2007,22(6):129-134.
[15] 尹 进,胡怡秀,胡余明,等.葡萄籽原花青素提取物对小鼠MDA、SOD和GSH-Px的影响[J].中国热带医学,2007,7(8):1 285-1 286.
[16] 王 颖,张桂芳,徐炳政,等.葡萄籽原花青素提取物对糖尿病小鼠血糖的影响[J].天然产物研究与开发,2012,24(9):1 191-1 195.
[17] 龚 频,文 和,王 兰,等.咖啡酸苯乙酯对糖尿病大鼠肾的保护作用[J].中国临床药理学杂志,2016,36(11):1 021-1 023,1 030.
【责任编辑:陈佳】
Differenttissuesdamageofcadmium-induceddiabeticnephropathyinmiceandprotectionofprocyanidins
GONG Pin, ZHAO Tian-lei, WENG Jing-yu, PI Si-hui, MA Li-yong, XIAO Xu-yang, YANG Wen-juan
(School of Food and Biological Engineering, Shaanxi University of Science amp; Technology, Xi′an 710021, China)
To explore the damage of brain and lung in mice with cadmium induced diabetic nephropathy,and research the protective effect of procyanidin on mice with cadmium induced diabetic nephropathy.In current study,The mice were fed with high fat and high glucose diet and injected 1 mg / (kg·day) CdCl2solution to induce the occurrence of diabetic nephropathy.The changes of glutathione (GSH),malondialdehyde (MDA) and nitric oxide (NO) in the brain and lung of mice were detected.The changes of indexes in these tissues of DN mice were revealed.The results showed that the GSH content of brain and lungs decreased significantly (Plt;0.05),MDA content increased (Plt;0.05) and NO concentration decreased (Plt;0.05) .Indicating that oxidative stress in DN mice increased and inflammatory response occurred.The effects of procyanidins on the brain and lungs were revealed by comparing the procyanidins protecting group and the DN group mice.Procyanidins can protect the brain and lung,reducing the levels of GSH and MDA,it can reduce the oxidative stress of brain and lung of DN mice.In this study,the changes of brain and lung in diabetic nephropathy mice and the protective effect of procyanidinswere were described,and to provide experimental basis for the clinical diagnosis of diabetic nephropathy and the development of related drugs.
cadmium; procyanidins; brain; lung; oxidative damage
2017-08-06
国家自然科学基金项目(21407104,81402815); 国家级大学生创新创业训练计划项目(201610708036)
龚 频(1983-),女,湖南邵阳人,副教授,博士,研究方向:药理生理
2096-398X(2017)06-0131-04
R99
A
