超声作用下脂肪酶催化菜籽油水解反应研究
2017-12-02陈倩楠石青云陈雪峰
刘 宁, 陈倩楠, 石青云, 陈雪峰, 李 骋, 李 超
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
超声作用下脂肪酶催化菜籽油水解反应研究
刘 宁, 陈倩楠, 石青云, 陈雪峰, 李 骋, 李 超
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
以菜籽油为原料,研究了不同反应器中脂肪酶Lipozyme TL IM催化油脂水解反应效果.结果表明,探头式超声波作用下,Lipozyme TL IM催化菜籽油水解效果较好,其工艺条件为:温度55 ℃、底物摩尔比(水/油)60∶1、加酶量0.9%(w/w)、超声发生模式50%,经20 min反应时间,最终可得到水解液酸价为82.74 mg KOH/g.若仅采用搅拌器方式,达到同等水解效果,需用时300 min,可见超声波作用大大缩短了反应时间.利用GC-MS分析了样品的脂肪酸组成,发现菜籽油在水解后不饱和脂肪酸含量略有降低.
超声波; 菜籽油; 水解; 脂肪酶Lipozyme TL IM; 脂肪酸组成
0 引言
油菜是我国主要的油料作物之一,油菜籽的含油量为37.5%~46.3%,菜籽油常作为普通食用油,目前其深加工开发利用程度较低.将植物油水解后,可得到脂肪酸等产品,作为进一步开发的基料,如制备单甘酯、甘油二酯、生物柴油等新产品[1-3].近年来,利用脂肪酶对油脂进行水解的研究日益受到重视[4,5].
随着多学科的相互交叉、渗透和声学技术的发展,研究者们发现超声波对多种反应体系具有广泛的适用性,其应用领域不断拓展[6-10].利用超声辅助油脂水解,可有效提高水解反应速率和水解效果[11].由于酶催化和超声技术都具有条件温和、副反应少、环境友好等特点,本文对超声作用下脂肪酶Lipozyme TL IM催化菜籽油水解反应的影响因素进行了研究,包括反应温度、底物摩尔比、加酶量、超声强度和反应时间等,并利用GC-MS对产品进行了分析,研究结果可为菜籽油的深度开发提供理论依据.
1 材料与方法
1.1 材料与试剂
菜籽油,益海嘉里(兴平)食品工业有限公司;脂肪酶Lipozyrne TL IM,脂肪酶Lipozyme RI IM,磷脂酶Lecitase Ultra,丹麦诺维信公司;三丁酰甘油酯,日本东京株式会社;氢氧化钾、乙醇等均为分析纯.
1.2 仪器与设备
探头式超声波发生器,苏州海纳科技有限公司;KQ-250DE型数控超声波清洗器,昆山市超声仪器有限公司;JBZ-14H型磁力搅拌器,上海大浦仪器有限公司;HH-4数显电子恒温水浴锅,江苏金坛宏华仪器厂;Trace Ultra气相色谱-质谱联用仪,美国Thermo Finnigan公司.
1.3 实验方法
1.3.1 脂肪酶活性的测定
采用水解三丁酰甘油酯pH-stat法测定脂肪酶活力,参考Mishra等[12]的方法.反应缓冲液为0.005 mol/L的Tris-HCl缓冲液(pH7.5,含0.025 mol/L CaCl2),测定温度为37 ℃.酶活定义为:在一定条件下,1 min水解三丁酰甘油酯产生1μmol丁酸所需的酶量,即为一个酶活力单位(U).
1.3.2 酸价测定
参考GB5009.229-2016食品中酸价的测定.
1.3.3 菜籽油水解反应
实验研究了三种不同脂肪酶对菜籽油的水解效果,包括游离磷脂酶Lecitase Ultra、固定化脂肪酶Lipozyme RI IM、固定化脂肪酶Lipozyme TL IM.比较了四种不同处理方式对菜籽油水解效果的影响,包括磁力搅拌器、超声清洗器、超声发生器、超声发生与磁力搅拌器联用.超声清洗器的功率为250 W,频率为40 KHz.超声发生器功率为200 W,频率为20 KHz.其中,磁力搅拌与超声发生器联用装置示意图见图1所示.

A:超声发生器 B:超声波探头 C:磁力搅拌器 D:温控装置
实验过程中,将一定量菜籽油、水、脂肪酶加入到50 mL烧杯中,在水浴作用下,分别于四种不同反应器中进行反应.待反应结束后,将水解液在10 000 r/min转速下离心10 min,测定上层油相的酸价.
1.3.4 脂肪酸组成分析
采用气相色谱-质谱联用仪(GC-MS)分析样品的脂肪酸组成,脂肪酸甲酯的制备参考汪勇[13]的方法.GC系统为Trace Ultra GC(美国ThermoFinnigan公司),配备Trisplus自动进样器和四级杆DSQ II质谱分析仪(MS).气相色谱柱为TR-5MS毛细管柱(30 m×0.2 mm,0.25μm,美国ThermoFinnigan公司).样品的进样体积为1.0μL,分流比100∶1.以氦气为载气,流速1.0 mL/min.进样口温度250 ℃,离子源温度230 ℃.气相色谱程序升温条件为:初始炉温40 ℃(保持1 min),以10 ℃/min升温速率升至150 ℃(保持2 min),再以10 ℃/min升温速率升至220 ℃,最后以5 ℃/min升温速率升至280 ℃(保持3 min).每次进样前,设备系统温度保持在40 ℃.质谱扫描范围为50~500 m/z.
2 结果与讨论
2.1 酶活测定
实验选用游离磷脂酶Lecitase Ultra、固定化脂肪酶Lipozyme RI IM和固定化脂肪酶Lipozyme TL IM进行实验,首先测定了它们的活力,结果分别为2 835 U/g、2 060 U/g和3 033 U/g,可见三种酶的活力均较好.
2.2 不同反应器对酶促水解效果的影响
以磷脂酶Lecitase Ultra、脂肪酶Lipozyme RI IM、脂肪酶Lipozyme TL IM分别在同等条件下,于4种不同反应器中进行菜籽油水解催化反应,反应15 min后,测定上层油相酸价,比较各反应效果,结果如表1所示.

表1 不同反应器中所得样品酸价(mg KOH/g)
注:同一行的不同字母表示差异显著(plt;0.05).
由表1可知,在4种反应器中,不同脂肪酶对菜籽油水解反应均有一定的催化能力,其催化能力大小顺序为:Lipozyme TL IMgt;Lecitase Ultragt;Lipozyme RI IM.不同反应器的作用效果由强到弱依次为:反应器四gt;反应器三gt;反应器一gt;反应器二.综合来看,在反应器四(超声发生+磁力搅拌器)中,Lipozyme TL IM较其他两种酶所得产物酸价最高,水解最为彻底.这可能是因为超声发生器具有较强的空化效应,能促使酶分子发挥其催化活力[14].同时在搅拌作用下,酶在体系中的状态更为分散,因而该反应器中水解效果远优于其他样品.故在后续实验中均采用这一方法.
2.3 脂肪酶水解菜籽油工艺条件研究
2.3.1 温度的影响
以菜籽油为底物,在加酶量0.5%(w/w)、底物摩尔比(水/油)70∶1、超声作用下(反应器四)反应20 min,改变体系的温度,测定45 ℃、50 ℃、55 ℃、60 ℃、65 ℃时水解液的酸价,研究温度对水解反应效果的影响.实验结果见图2所示.
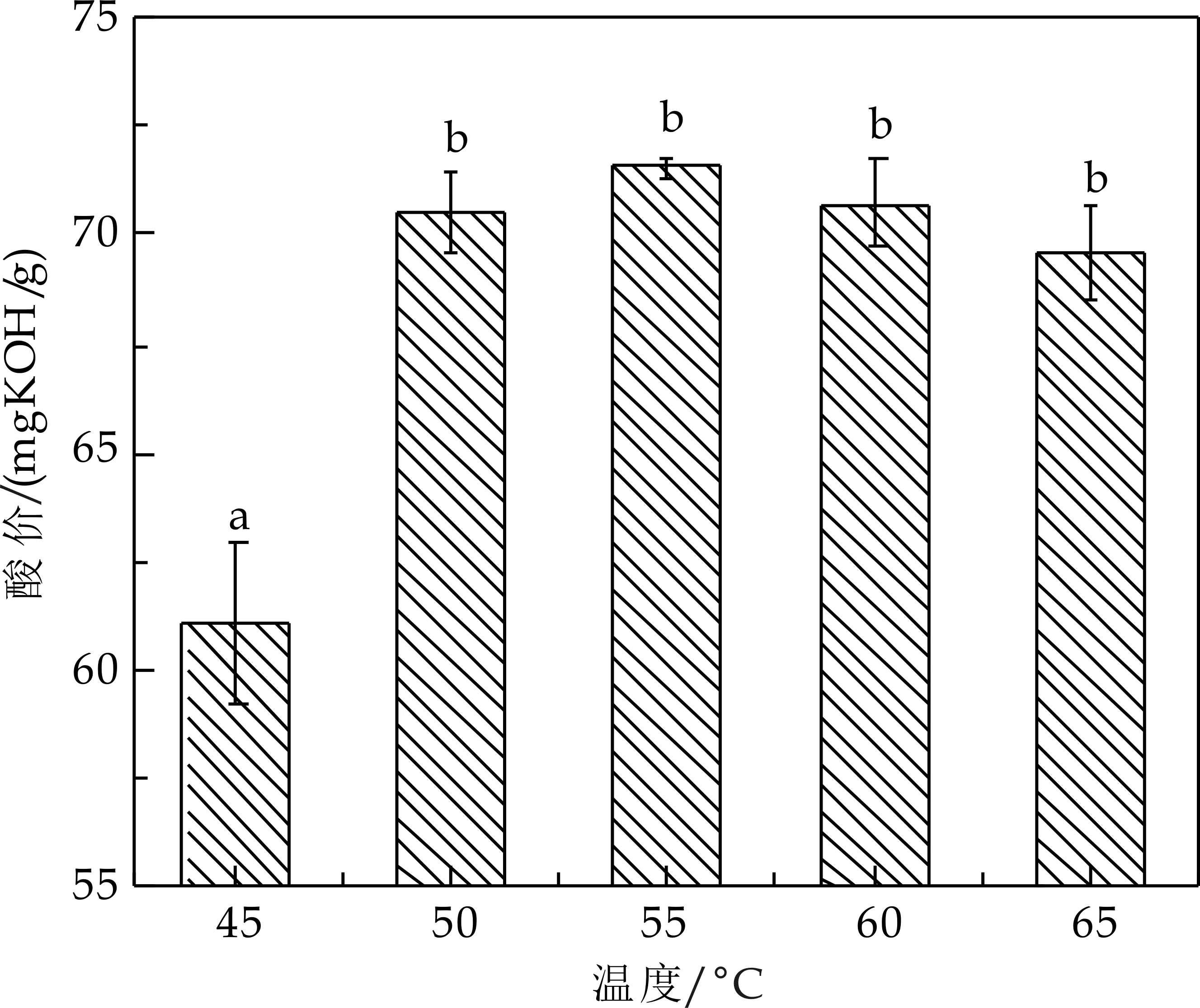
图2 温度对水解效果的影响
由图2可知,当反应温度低于55 ℃时,随着温度的升高,酸价增大.温度为55 ℃时,酸价最高,为71.55 mg KOH/g,这可能是由于该酶在此时处于最适酶活温度,催化效率最大.当温度为55 ℃~65 ℃时,则随着温度的升高,酸价降低,水解程度下降.根据余旭亚等[15]研究结果,温度对酶促作用的影响表现为:在低温范围内,随着温度的升高,反应体系分子活化能增加,分子碰撞几率增加,反应速率加快,表现为酶催化活力升高;由于大多数酶是蛋白质,当温度超过酶的最适温度时,酶蛋白就会逐渐产生变性作用而减弱甚至丧失催化活性,酶分子发生不可逆热变性而失活,引起催化反应速率下降,催化活力降低.酶所表现的最适温度就是这两种影响的综合结果,此时酶的催化活力表现为最大.因此,本实验最终选择菜籽油水解反应温度为55 ℃.
2.3.2 底物摩尔比的影响
以菜籽油为底物,在加酶量0.5%(w/w)、反应温度55 ℃、超声作用(反应器四)下反应20 min,改变体系的底物摩尔比(水/油),测定其30∶1、50∶1、60∶1、70∶1、90∶1时水解液的酸价,研究底物摩尔比对水解反应效果的影响.实验结果如图3所示.

图3 底物摩尔比对水解效果的影响
从图3可以发现,在水解过程中,当底物摩尔比(水/油)小于60∶1时,随着摩尔比的增加,酸价不断增大;当底物摩尔比大于60∶1时,酸价呈现递减的趋势.当摩尔比分别是30∶1、60∶1、70∶1和90∶1时,所得酸价值的差异较显著(plt;0.05).当底物摩尔比为60∶1时,酸价最高,为70.80 mg KOH/g.这与黄健花等[16]的研究结果较为一致,在超声作用下加入少量的水即可达到较好的水解效果,可认为与超声波能够促进反应体系的乳化作用有关,可以形成更大的油/水界面,从而实现水的"充分利用";当加水量逐渐增加,使得酶的相对浓度减小,造成酸价减小.因此,本实验最终选择反应底物摩尔比(水/油)为60∶1.
2.3.3 加酶量的影响
以菜籽油为底物,在反应温度55 ℃、底物摩尔比(水/油)60∶1、超声作用(反应器四)下反应20 min,改变体系的加酶量,测定其0.1%、0.5%、0.9%、1.2%、2.0%、3.0%时水解液的酸价,研究加酶量对水解反应效果的影响.实验结果见图4所示.

图4 加酶量对水解效果的影响
在一定条件下,反应速度随着加酶量的增加而加快,当反应界面被酶所饱和时,反应速率达最大;继续增大加酶量,反应速率不再增加[6].由图4可知,在超声作用下,当加酶量在0.1%~0.9%时,反应效率随着加酶量的增大而提高,且呈现显著性差异(plt;0.05).加酶量为1.2%时,其水解液酸价和加酶量0.9%所得样品相比,无显著性差异性.当其超过1.2%后,反应速率随着加酶量的增加反而有所降低.造成这种现象的原因可能是,过高的加酶量导致了酶分子聚结,不利于其有效分散,从而使反应效率降低[17].另外,由于酶的价格相对较贵,如酶的用量太高不利于工业化生产.因此,本实验最终选择菜籽油水解反应加酶量为0.9%.
2.3.4 超声发生模式的影响
本实验所用探头式超声发生器有20%、50%和连续式3种超声发生模式.前述实验均采用50%发生模式.以菜籽油为底物,在加酶量0.9%(w/w)、反应温度55℃、底物摩尔比(水/油)60∶1条件下反应20 min,研究不同超声发生模式对酶促反应影响,实验结果见表2所示.

表2 超声发生模式对水解效果的影响
注:同一列的不同字母表示差异显著(plt;0.05).
由表2可知,超声发生模式对酶催化水解反应有较大影响.若不运用超声处理,仅使用磁力搅拌,对照样的酸价仅18.52 mg KOH/g.当超声模式为20%时,反应水解液酸价为69.64 mg KOH/g;而连续的超声模式对酶的催化反应起到一定的抑制作用(其水解液酸价为71.39 mg KOH/g),这可能是由于超声强度过大,其空化效应、机械效应等引起了酶分子一定程度的失活[18].可以发现,50%的超声发生模式下Lipozyme TL IM催化能力最强,水解产物酸价最高,为82.74 mg KOH/g,较其他模式呈显著性差异(plt;0.05).因此,本实验选择较适宜超声发生模式为50%.
2.3.5 反应时间的影响
以菜籽油为底物,在加酶量0.9%(w/w)、反应温度55 ℃、底物摩尔比(水/油)60∶1,超声发生模式50%条件下进行反应,测定一定反应时间后水解液的酸价,研究反应时间的影响.同时与搅拌条件下(反应器一)的反应效果进行对比,实验结果见图5所示.
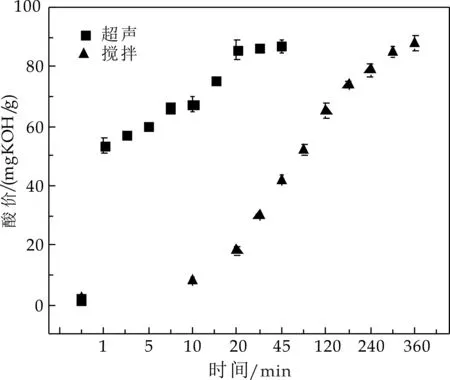
图5 反应时间对水解效果的影响
由图5可以发现,两种反应器中水解液酸价随反应时间的延长而增加,但分别在20 min和300 min后逐渐趋于稳定.这可能是因为水解反应在此时已接近平衡,即使延长反应时间,对反应效果没有明显的提高[19].超声作用(反应器四)时间为20 min时,酶催化作用达到最大,反应液酸价为82.74 mg KOH/g,而搅拌模式(反应器一)达到相近的催化效果则需300 min.因此,超声作用对水解反应的促进效果明显,可将反应时间从300 min缩短至20 min,大大节省了反应时间,提高了反应效率.
2.4 脂肪酸组成分析
采用气相色谱-质谱联用仪(GC-MS)测定了水解前后菜籽油的脂肪酸组成,结果如表3所示.

表3 菜籽油水解前后脂肪酸组成分析
由表3可以发现,菜籽油中所含脂肪酸包括棕榈酸、硬脂酸、油酸、亚油酸、亚麻酸、花生酸、花生烯酸等,以不饱和脂肪酸为主.水解后,油相中饱和脂肪酸含量有所增加,而不饱和脂肪酸含量略有降低.这与汪勇研究大豆油水解反应的结果类似[13].由于本实验所用原料为低芥酸菜籽油,水解前后均无芥酸检出.
3 结论
采用探头式超声发生器与磁力搅拌联用,以脂肪酶Lipozyme TI IM催化菜籽油水解反应,表现出较好的催化反应效率.最终得到菜籽油水解的工艺条件为:温度55 ℃、底物摩尔比(水/油)60∶1、加酶量0.9%(w/w)、超声发生模式50%、水解时间20 min,所得水解液油相的酸价为82.74 mg KOH/g.若仅采用磁力搅拌,达同等反应效果需用时300 min,可见超声作用大大提高了催化效率.本论文研究结论可为探头式超声装置在油脂催化中的应用提供一定的参考依据.
[1] 毕艳兰.油脂化学[M].北京:化学工业出版社,2005.
[2] 何东平.油脂精炼与加工工艺学[M].2版.北京:化学工业出版社,2012.
[3] 刘 宁,李 超,陈雪峰,等.脂肪酶Palatase M.miehei的固定化及催化菜籽油水解研究[J].陕西科技大学学报(自然科学版),2016,34(4):131-135.
[4] Talukder MMR,Wu JC,Chua LPL.Conversion of waste cooking oil to biodiesel via enzymatic hydrolysis followed by chemical esterification[J].Energy Fuels,2010,24(3):2 016-2 019.
[5] 武林贺,白新鹏,吴 谦,等.脂肪酶水解椰子油动力学研究[J].食品研究与开发,2016,37(16):65-69.
[6] Babicz I,Leite SGF,De Souza ROMA,et al.Lipase-catalyzed diacyglycerol production under sonochemical irradiation [J].Ultrasonics Sonochemistry,2010,17(1):4-6.
[7] 李 奥,彭凯迪,冯 伟,等.超声法制备婴儿配分营养油乳液工艺的优化[J].中国粮油学报,2017,32(3):110-117.
[8] Santos FFP,Malveira JQ,Cruz MGA,et al.Production of biodiesel by ultrasound assisted esterification of oreochromis niloticus oil [J].Fuel,2010,89(2):275-279.
[9] 刘树兴,石 凯.超声辅助酶解谷朊粉制备ACE抑制肽工艺优化[J].陕西科技大学学报(自然科学版),2014,32(6):110-114.
[10] 杨 辉,李朝阁.八月瓜籽油的超声波提取及其理化性质[J].陕西科技大学学报(自然科学版),2015,33(6):127-131.
[11] 刘亚轩.超声作用下脂肪酶催化豆油水解反应的研究[D].无锡:江南大学,2008.
[12] Mishra M K,Kumaraguru T,Sheelu G,et al.Lipase activity of lecitase ultra:Characterization and applications in enantioselective reactions[J].Tetrahedron:Asymmetry,2009,20(24):2 854-2 560.
[13] 汪 勇.磷脂酶A1(Lecitase Ultra)催化水解植物油研究[D].广州:华南理工大学,2009.
[14] Lin G,Liu HC.Ultrasound-promoted lipase-catalyzed reactions[J].Tetrahedron Letters,1995,36(34):6 067-6 068.
[15] 余旭亚,黄遵锡,林 海.生物酶法制备生物柴油的研究进展[J].中国油脂,2009,34(6):44-48.
[16] 黄健花,刘亚轩,金青哲,等.超声波对无溶剂体系脂肪酶催化大豆油水解的影响[J].中国油脂,2009,34(6):44-48.
[17] Duan ZQ,Du W,Liu DH.Novozym 435-catalyzed 1,3-diacylglycerol preparation via esterification in t-butanol system[J].Process Biochemistry,2010,45(12):1 923-1 927.
[18] Yu D,Tian L,Wu H,et al.Ultrasonic irradiation with vibration for biodiesel production from soybean oil by novozym 435[J].Process Biochemistry,2010,45(4):519-525.
[19] Liu Y,Jin Q,Shan L,et al.The effect of ultrasound on lipase-catalyzed hydrolysis of soy oil in solvent-free system[J].Ultrasonics Sonochemistry,2008,15(4):402-407.
【责任编辑:蒋亚儒】
Studyonultrasonicassistedlipase-catalyzedhydrolysisofrapeseedoil
LIU Ning, CHEN Qian-nan, SHI Qing-yun, CHEN Xue-feng, LI Cheng, LI Chao
(School of Food and Biological Engineering, Shaanxi University of Science amp; Technology, Xi′an 710021, China)
In the present study,the lipase Lipozyme TL IM-catalyzed hydrolysis of rapeseed oil in different reactors was studied. The result showed under the action of probe-type ultrasonic,the hydrolysis conditions of rapeseed oil catalyzed by Lipozyme TL IM were as follows:reaction temperature of 55 ℃,the molar ratio of substrates (water/oil) of 60∶1,enzyme load of 0.9% (w/w),ultrasonic mode of 50%,and reaction time of 20 min.The acid value of hydrolyzate was determined as 82.74 mg KOH/g.However,when a stirrer reactor was employed,it needed 300 min to obtain the same hydrolysis result.It was showed that the ultrasonic can reduce the reaction time to a large extent.GC-MS was employed to analyze the fatty acid compositions of rapeseed oil and its hydrolyzate.The result revealed that after hydrolysis,the content of unsaturated fatty acids decreased slightly.
ultrasonic; rapeseed oil; hydrolysis; lipase Lipozyme TL IM; fatty acid composition
2017-10-11
国家自然科学基金项目(31501443); 陕西省科技厅自然科学基础研究计划项目(2014JQ3111); 陕西科技大学博士科研启动基金项目(BJ15-02); 陕西省2017年大学生创新创业训练计划项目(201710708041)
刘 宁(1984-),男,四川巴中人,讲师,博士,研究方向:粮油食品加工、食品乳状体系
2096-398X(2017)06-0109-05
Q814.2
A
