温度、光照和GA3对黑种草(Nigella damascena L.)种子萌发的影响
2017-12-02湖北民族学院林学园艺学院种子生物学实验室湖北恩施445000湖北省利川市毛坝乡特产服务中心湖北利川4454湖北省恩施土家族苗族自治州气象局湖北恩施445000
, , , , (.湖北民族学院,林学园艺学院,种子生物学实验室, 湖北 恩施 445000;.湖北省利川市毛坝乡特产服务中心, 湖北 利川 4454;.湖北省恩施土家族苗族自治州气象局, 湖北 恩施 445000)
通迅作者:邓志军(1980— ),男,河北省青龙满族自治县人;博士,硕士研究生导师,主要从事种子生物学研究;E-mail:zhijundeng@qq.com。
温度、光照和GA3对黑种草(Nigella damascena L.)种子萌发的影响
朱艳芳1,向先斌2,熊莉军3,胡晓芳1,邓志军1
(1.湖北民族学院,林学园艺学院,种子生物学实验室, 湖北 恩施 445000;2.湖北省利川市毛坝乡特产服务中心, 湖北 利川 445422;3.湖北省恩施土家族苗族自治州气象局, 湖北 恩施 445000)
研究了黑种草种子的吸水特性以及温度、光照和GA3对其萌发的影响。结果表明:新采收的黑种草种子吸水迅速,具有明显的迅速吸水期和吸水平台期,不存在吸水障碍;具有一定程度的浅生理休眠和热抑制现象,且为需光种子,在恒温条件下仅在10,15 ℃有少量萌发,其中交替光照下的萌发率显著高于黑暗处理;在15 ℃/25 ℃变温和交替光照条件下的萌发率较高,但也仅有(61.5±7.6)%;0.1 mmol/L的GA3溶液可有效解除其休眠,使黑种草种子在15 ℃交替光照条件下的萌发率从(33.5±2.2)%升高至(76.7±7.0)%。
黑种草; 种子休眠; 萌发; 需光种子; 热抑制
黑种草(NigelladamascenaL.)为毛茛科(Ranunculaceae)一年生草本植物,原产欧洲南部[1],现已广泛分布于欧洲温带地区[2],在我国很多地方(尤其是新疆)有栽培,是一种集观赏[3-4]、食用[3,5]和药用[3,5-6]等价值于一身的潜在多用途新作物[7]。
之前对于黑种草的研究主要聚焦于其种子的化学成分[3-5,8-10]、药理活性[4,6]及农艺性状[7]等方面,对其种子萌发特性鲜有研究[11],而这方面的研究对于该多用途植物资源的引种、栽培和育种具有重要意义。
1 材料与方法
1.1 材 料
黑种草种子于2011年采集自广西壮族自治区药用植物园(东经108°19′,北纬22°51′,海拔72~113 m),于室内阴凉处摊晾1周后用于萌发等试验。种子含水量为(27.6±8.3)%(n=4),千粒重为(2.2±0.1)g(n=4)。
1.2 方 法
1.2.1 含水量测定
参照国际种子检验规程[12]的方法,设4次重复,每次重复随机取20粒种子,先称量称量瓶的重量W0及称量瓶与新鲜种子的重量W1,然后将装有新鲜种子的称量瓶敞口置于(103±1)℃烘箱中烘干,17 h后从烘箱中取出装有已烘干种子的称量瓶(取出前盖好盖子),在干燥器中冷却至室温后称取称量瓶与已烘干种子的重量W2。通过下式以鲜重为基础计算含水量(%)。
种子含水量(%)=(W1-W2)/(W1-W0)×100%。
1.2.2 吸水百分率的测定
参照Deng等[13]的方法,设4次重复,每次重复50粒种子,均匀播于垫有2层湿润滤纸的培养皿中,然后置于15 ℃恒温光照(12 h 光照/12 h 黑暗,于PPFD=121μmol/(m2·s)培养箱中吸胀。每隔一定时间取出种子,用吸水纸吸干表面水分后称重,计算种子的吸水百分率。
吸水百分率(%)=(Wt-W0)/W0×100%。
式中,W0为吸胀试验开始前种子的初始重量,Wt为吸胀一定时间后的种子重量。
1.2.3 GA3处理
参照潘春柳等[14]的方法,每个处理设4次重复,每次重复50粒种子,播于垫有2层滤纸的培养皿中,分别添加5 mL浓度为0.000 1,0.001,0.01,0.1,1 mmol/L和2.5 mmol/L的GA3溶液,以蒸馏水作为对照处理,用封口膜密封后置于15 ℃光照(12 h 光照/12 h 黑暗,于PPFD=121μmol/(m2·s)的培养箱中进行萌发测试。
1.2.4 萌发测试
每个处理设4次重复,每次重复50粒种子,播于垫有2层滤纸的培养皿中,添加蒸馏水或GA3溶液(需用封口膜密封以防止试剂蒸发)后在10,15,20,25 ℃和30 ℃恒温及15 ℃/25 ℃变温光照培养箱中培养,交替光照(12 h 光照/12 h 黑暗,变温条件下光照对应于高温,PPFD=121μmol/(m2·s)或黑暗(用锡箔纸包裹培养皿以避光),19 d(萌发率连续5 d不再增加)后计算萌发率。以胚根突破种皮作为萌发标准。
1.2.5 数据分析
用SPSS 22.0软件对数据进行统计分析。采用单因素方差分析(one-way ANOVA)和Student-Newman-Keuls多重比较法对各种处理的萌发率数据进行显著性检验(p=0.05)。萌发率数据在方差分析前进行反正弦转换;对迅速吸水阶段(phaseⅠ)的吸水百分率进行线性回归分析。统计数据以平均值±标准误形式表示。所有统计图通过GraphPad Prism 5软件完成。
2 结果与分析
2.1 吸水进程
吸水开始的7 h内,吸水百分率呈线性增加(y=7.7923x,R2=0.979 1,plt; 0.01),即迅速吸水期(phaseⅠ);吸水9 h后,吸水百分率不再显著增加(pgt;0.05),即吸水平台期(phaseⅡ)(图1)。
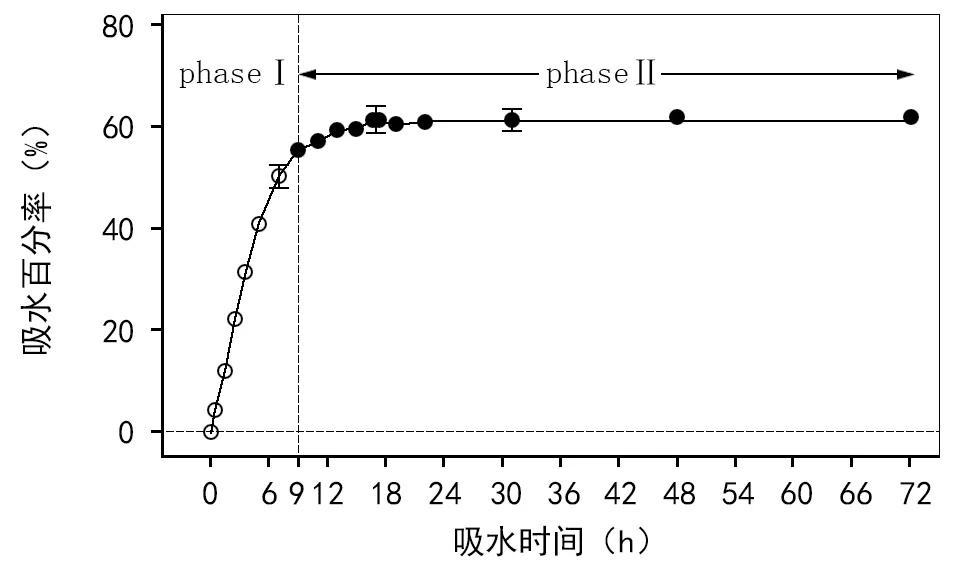
注:“○”标示的数值间差异显著,“●”标示的数值间无显著性差异。4次重复,每次重复50粒种子,在15 ℃和交替光照(12 h 光照/12 h 黑暗,PPFD = 121 μmol/(m2·s)条件下吸胀。每个统计数值表示的是平均值±标准误。图1 黑种草种子的吸水进程
2.2 温度和光照对种子萌发的影响
不管是在恒温条件下,还是在变温条件下,光照都有利于黑种草种子的萌发,黑暗则对萌发有较强的抑制作用(图2)。
相对于恒温条件,变温条件更有利于黑种草种子的萌发。在所有测试温度条件中,15 ℃/25 ℃变温和交替光照条件下的萌发率最高,达(61.5±7.6)%(图2)。恒温条件下,仅在10 ℃和15 ℃(交替光照和黑暗)时有少量萌发,其中10 ℃交替光照和15 ℃交替光照条件下的萌发率最高,分别为(33.5±4.6)%和(33.5±2.2)%,但后者的萌发速率要快于前者;其他恒温条件下几乎不萌发(图2)。
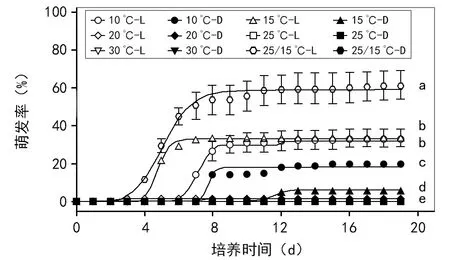
注:L表示交替光照[12 h 光照/12 h 黑暗,PPFD=121 μmol/(m2·s)];D表示黑暗。每个处理设4次重复,每次重复50粒种子,培养19 d。每个统计数值表示的是平均值±标准误,标有相同小写英文字母的数值间无显著性差异(p=0.05)。图2 温度和光照对黑种草种子萌发的影响
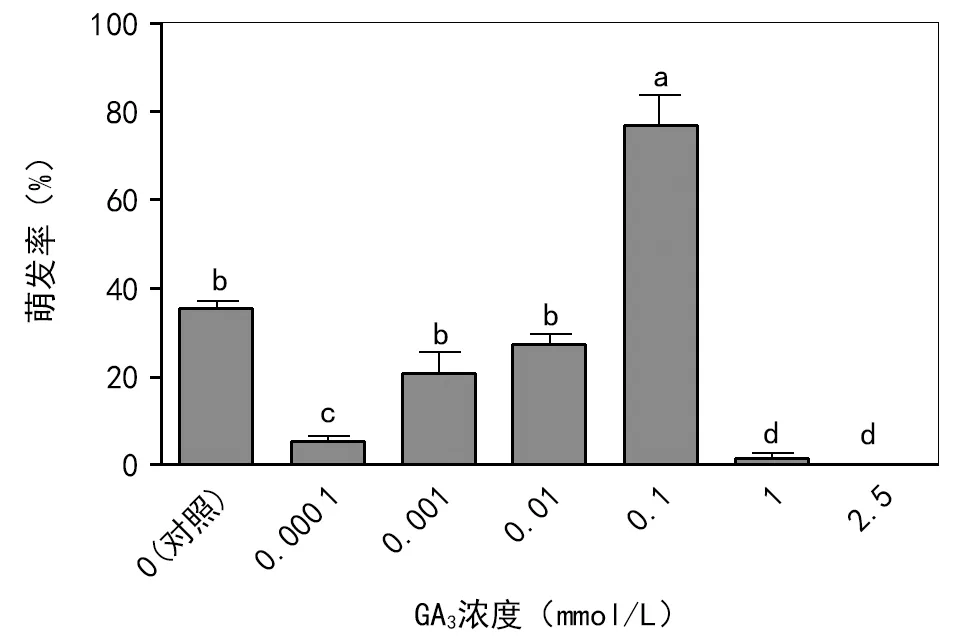
注:每个处理设4次重复,每次重复50粒种子,密封后在15 ℃和交替光照[12 h 光照/12 h 黑暗,PPFD=121 μmol/(m2·s)]条件下培养19 d。每个统计数值表示的是平均值±标准误,标有相同小写英文字母的数值间无显著性差异(p=0.05)。图3 GA3对黑种草种子萌发的影响
2.3 GA3对种子萌发的影响
GA3溶液浓度对黑种草种子的萌发率具有显著性影响(plt;0.05),随着GA3溶液浓度的升高,种子萌发率呈现先升后降的变化趋势(图3)。在0.000 1~0.1 mmol/L的浓度范围内,种子萌发率随GA3溶液浓度的升高而增加,GA3溶液浓度为0.1 mmol/L时的萌发率最高,达到(76.7±7.0)%,而当GA3溶液的浓度高于0.1 mmol/L时,萌发率又随浓度升高而下降,浓度为2.5 mmol/L时萌发率为0。与对照处理相比,GA3溶液浓度过低和过高都抑制黑种草种子的萌发。
3 结论与讨论
种子的萌发特性是植物对栖息地环境长期适应的结果。新采收的黑种草种子在恒温条件下仅在10 ℃和15 ℃有少量萌发,在其他恒温条件下几乎不萌发(图2),表明黑种草种子有萌发热抑制现象和一定程度的休眠现象。黑种草是原产欧洲南部的一种一年生草本植物,果实成熟在每年的8月份,萌发热抑制和浅生理休眠现象可以防止刚刚成熟的种子在9、10月份的短期高温条件下萌发,因为一旦萌发,幼苗将来不及开花结实即被冬季严寒冻死,不利于该物种的生存和繁衍。因此,黑种草种子的萌发热抑制和休眠现象是一种生态适应特征。
新采收的黑种草种子吸水迅速,具有明显的迅速吸水期和吸水平台期(图1),故无物理休眠[15];在低温条件下有少量萌发,且一定浓度的GA3溶液可有效解除其休眠(图3),因此,黑种草种子很可能具有浅生理休眠[15]。故若想使新采收种子快速整齐地萌发,需采取措施打破其休眠。GA3溶液处理可作为其休眠解除方法之一,除此之外,冷层积处理对大多数种子休眠的解除都有很好的效果,因此这方面也可作进一步研究。
不论是在恒温条件下还是在变温条件下,黑暗都抑制黑种草种子的萌发,而交替光照则促进其萌发(图2),表明黑种草种子应为需光性种子,这与Pamukov和Schneider[11]的研究结果正好相反。因此,从本研究的结果来看,播种时不宜深播,以防覆土太厚遮光,不利于种子萌发成苗。
黑种草种子的生理休眠、萌发热抑制现象和需光性很可能会限制其引种、种植和育种工作,因此,如何有效解除其生理休眠,使其快速、整齐萌发,以及如何克服其萌发热抑制现象和需光性,值得进一步研究。
[1]中国科学院中国植物志编辑委员会.中国植物志(第27卷)[M].北京:科学出版社,1979:112.
[2]Fico,G.,Braca,A.,Tome,F.,et al.Phenolic derivatives fromNigelladamascenaseeds[J].Pharmaceutical Biology,2000,38:371-373.
[3]Sajfrtova,M.,Sovova,H.,Karban,J.Enrichment ofNigelladamascenaextract with volatile compounds using supercritical fluid extraction[J].Journal of Supercritical Fluids,2014,94:160-164.
[4]Toma,C.-C.,Olah,N.-K.,Vlase,L.,et al.Comparative studies on polyphenolic composition,antioxidant and diuretic effects ofNigellasativaL.(Black Cumin) andNigelladamascenaL.(Lady-in-a-Mist)Seeds[J].Molecules,2015,20:9560-9574.
[5]Telci,I.,Sahin-Yaglioglu,A.,Eser,F.,et al.Comparison of Seed Oil Composition ofNigellasativaL.andN.damascenaL.During Seed Maturation Stages[J].Journal of the American Oil Chemists Society,2014,91:1 723-1 729.
[6]Bekemeier, H., Leuschner,G.,Shmollack,W.Antipyretische,antioedematöse und analgetische wirkung von damascenin im vergleich mit acetylsalicylsäure und phenylbutazon[J].Archives Internationales De Pharmacodynamie Et De Thérapie,1967,168:199-211.
[7]D'Antuono,L.F.,Moretti,A.,Lovato,A.F.S.Seed yield,yield components,oil content and essential oil content and composition ofNigellasativaL.andNigelladamascenaL.[J].Industrial Crops and Products,2002,15(1):59-69.
[8]Fico,G.,Braca,A.,Tome,F.,et al.A new phenolic compound fromNigelladamascenaseeds[J].Fitoterapia,2001,72:462-463.
[9]Moretti,A.,D’Antuono,L.F.,Elementi,S.,et al.Essential oils ofNigellasativaL.andNigelladamascenaL.seed [J].Journal of Essential Oil Research,2004,16:182-183.
[10]Rchid,H.,Nmila,R.,Bessiere,J.M.,et al.Volatile components ofNigelladamascenaL.andNigellasativaL.seeds[J].Journal of Essential Oil Research,2004,16:585-587.
[11]Pamukov,K.,Schneider,M.J.Light inhibition of nigella germination:the dependence of a high irradiance reaction on 720-nm irradiance[J].Botanical Gazette,1978,139(1):56-59.
[12]International Seed Testing Association. International rules for seed testing[J].Seed Science and Technology,1999,27(Supplement):47-50.
[13]Deng,Z.J.,Cheng,H.Y.,Song,S.Q.Effects of temperature,scarification,dry storage,stratification,phytohormone and light on dormancy-breaking and germination ofCotinuscoggygriavar.cinerea(Anacardiaceae) seeds[J].Seed Science and Technology,2010,38:572-584.
[14]潘春柳,邓志军,黄燕芬,等.绞股蓝种子休眠机理及其破除方法研究[J].西北植物学报,2013,33(8):1 658-1 664.
[15]Baskin,J.M.,Baskin,C.C.A classification system for seed dormancy[J].Seed Science Research,2004,14:1-16.
Effects of Temperature,Light and Gibberellic Acid on Germination ofNigelladamascenaL. (Ranunculaceae) Seeds
ZHUYanfang1,XIANGXianbin2,XIONGLijun3,HUXiaofang1,DENGZhijun1
(1.Seed Biology Laboratory,College of Forestry and Horticulture,Hubei University for Nationalities,Enshi Hubei 445000,China;2.Specialty Service Center of Maoba Town,Lichuan Hubei 445422,China;3.Meteorological Bureau of Enshi Tujia amp; Miao Autonomous Prefecture,Enshi Hubei 445000,China)
Water absorption characteristics and effects of temperature,light and GA3on germination inNigelladamascenaseed were investigated.The results showed,that the fresh harvested seeds imbibed rapidly water,with remarkable phaseⅠand phaseⅡ,without water absorption barrier,and that there was a non-deep physiological dormancy and the germination thermoinhibition phenomenon,and they were positively photoblastic seed,and they only germinated less at the constant temperature regimes of 10 ℃ and 15 ℃,and the germination percentage under alternating light regime was significantly higher than that under the dark regime,and that although the germination percentage under the variable temperature regime of 25 ℃/15 ℃ and alternating light conditions was higher,but only (61.5±7.6)%,and that GA3solution of 0.1 mmol/L could effectively release the seed dormancy,so that the germination percentage under 15 ℃ and an alternating light regimes was advanced from (33.5±2.2)% to (76.7±7.0)%.
Nigelladamascena; seed dormancy; germination; positively photoblastic seed;thermoinhibition
2016-10-10
国家自然科学基金青年基金项目(81303169);广西自然科学基金项目(2013 GXNSFBA 019169);湖北省教育厅科学研究计划资助项目(Q 20141902);生物资源保护与利用湖北省重点实验室开放课题(PKLHB 1304);湖北民族学院博士科研启动基金项目(MY 2013 B 014)。
朱艳芳(1992— ),女,湖北省咸宁人;在读硕士研究生,研究方向:园林植物种质资源;E-mail:1334662659@qq.com。
10.16590/j.cnki.1001-4705.2017.02.012
S 567.21+9
A
1001-4705(2017)02-0012-04
