光照对黑豆种子萌发进程的影响研究
2017-12-02吉林大学生命科学学院分子酶学工程教育部重点实验室长春130012
, , , , , , (吉林大学 .生命科学学院; .分子酶学工程教育部重点实验室, 长春 130012)
光照对黑豆种子萌发进程的影响研究
王亚文a,袁俊杰a,马沐青a,吴家安b,辛鑫a,周毓麟a,周杰a
(吉林大学 a.生命科学学院; b.分子酶学工程教育部重点实验室, 长春 130012)
植物种子的萌发过程涉及一系列生理生化反应,为研究不同波长光线对种子萌发进程的影响以及在萌发过程中种子中物质与能量代谢的变化,对黑豆种子萌发前后呼吸代谢、蛋白质含量、糖含量以及核酸含量的变化进行研究。结果表明,在黑豆种子萌发过程中,种子呼吸速率的变化符合“S”形曲线,存在明显的呼吸滞缓期;萌发前后,种子内蛋白质总量下降47%;可溶性糖含量下降47%;DNA含量增加171%,RNA含量未见明显变化。经不同波长光线照射后,种子萌发强度变化明显,其中可见光区域内,长波长光线较短波长光线对种子萌发有更加明显的促进作用,而280 nm的紫外光也显著提高种子萌发强度。研究结果可为适当调整种子萌发外界条件,提高种子萌发率提供理论参考。
种子萌发; 呼吸代谢; 蛋白质; 糖; 核酸
植物种子的萌发是植物生长发育过程中的最早阶段, 也是其个体发育中最为关键的时期。种子萌发过程涉及到一系列基因表达以及复杂的生理生化代谢反应。在此期间,植物种子细胞内光合作用与呼吸作用等生理活动相互调节,能量与物质代谢十分活跃。针对植物种子萌发过程中发生的分子事件的研究和探讨,是现代植物分子生物学与生物化学研究的重要课题[1-5]。目前对于种子萌发这一复杂过程的研究主要集中在单一方面,如蛋白质[6]、核酸[7]等,鲜有全面研究种子萌发前后物质与能量代谢的报道,而关于环境光的波长对种子萌发的影响未见报道。本研究选择黑豆种子为试材,利用瓦氏呼吸仪,研究种子萌发早期光与呼吸代谢的强度关系,探索种子萌发早期能量与物质代谢的调控方式。通过测定蛋白质、核酸、糖类在黑豆种子萌发前后的含量变化以及不同代谢相关酶在种子萌发早期的活性变化,分析种子萌发早期发生的分子事件,旨在为进一步研究萌发种子发育的生理状态、营养成分变化,为适当调整种子萌发外界条件、提高种子萌发率提供理论参考。
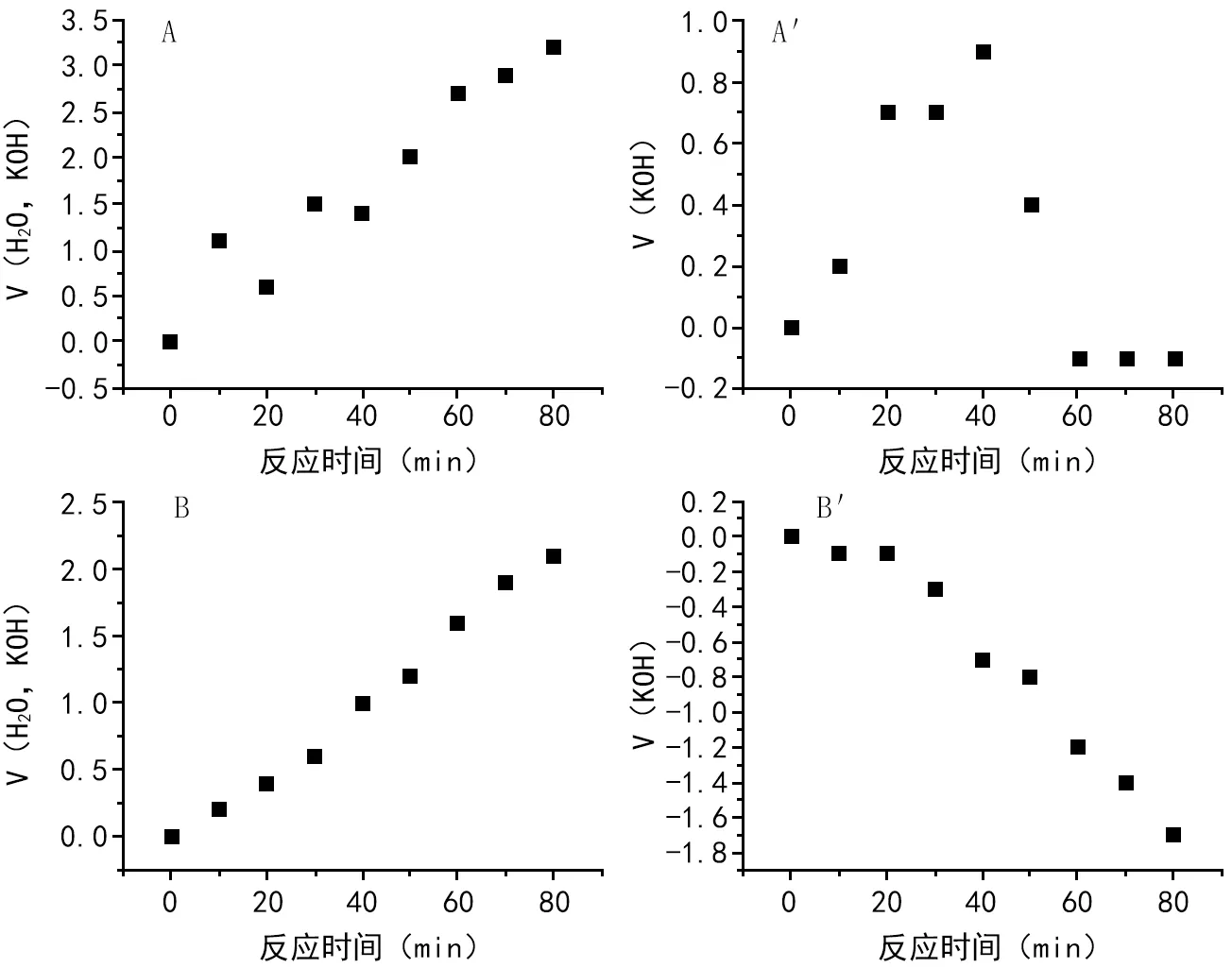
注:图中A,A′指示暗反应;B,B′指示光反应。图1 黑豆种子的呼吸代谢变化
1 材料与方法
1.1 材料培养
黑豆(Glycinemax(L.)Merr)种子,购自黑龙江黑尚乌农业发展有限公司。实验前挑取形状、大小相近的饱满黑豆种子,经过去离子水洗涤,室温下去离子水浸泡12 h作为萌发种子样品(G);未浸泡种子为萌发前种子样品(pG),除呼吸代谢研究所需种子外,其它实验中萌发前种子及萌发种子均用恒温鼓风干燥箱105 ℃脱水,种子经充分脱水后研磨成粉末待用。
1.2 呼吸代谢变化测定
采用Warburg法[8],取1粒黑豆种子,用滤纸吸干水,称重,记录(WB),用排水法测体积(VB)。将黑豆种子放入反应瓶中,加水,使水与黑豆种子总体积为5 mL;在中央小管中加入0.3 mL KOH(2 mol/L)溶液,在KOH溶液中放入一小片滤纸,增加CO2吸收面积。将压力计固定在振荡板上,反应瓶浸入水中2/3。打开压力计活塞,振荡30 min,以使反应瓶内外温度达到平衡。调节压力计右侧的液面达到150 mm处,准确记下压力计左侧液面的高度,记为初始数据(V0)。关闭三通活塞,每隔10 min记录1次双侧的数据(VL 1、VR 1,VL 2、VR 2,……)。
1.3 蛋白质含量测定
采用双缩脲法[9],取0.3 g黑豆种子干粉,加入1 mL四氯化碳和10 mL 0.05 mol/L的KOH,再加入40 mL双缩脲试剂,在振荡器上剧烈振荡10 min后室温下放置1 h。离心(8 000 r/min×10 min),取上清液,测OD540,根据标准曲线计算蛋白质含量。
1.4 糖含量测定
采用硫酸-蒽酮法[10],取2 g黑豆种子干粉,加入90 mL水,60 ℃回流2 h后冷却到室温,离心8 000 r/min×8 min,取上清定容至100 mL,从中取出10 mL,加入150 mL无水乙醇,4 ℃静置过夜,然后离心8 000 r/min×15 min取沉淀,用去离子水溶解后定容至100 mL,制备成可溶性碳水化合物检测液。取2 mL样品检测液,加入6 mL硫酸蒽酮溶液,100 ℃反应15 min,冷却后,测上清OD625,在葡萄糖标准曲线上查出对应可溶性碳水化合物含量。
1.5 核酸含量测定
取2 g黑豆种子干粉,加入10 mL预冷的核酸分离缓冲液(3%CTAB;1.4 mol/L NaCl;20 mmol/L EDTA,pH=8.0),摇匀0 ℃放置10 min后离心。上清液用于提取RNA,沉淀用于提取DNA。将提取的RNA沉淀用去离子水溶解,测量样品的OD260, RNA浓度=40×OD260×稀释倍数。将提取的DNA沉淀用TE buffer溶解,测量样品的OD260, DNA浓度=50×(OD260-OD280)×稀释倍数[11]。
2 结果与分析
2.1 种子萌发过程中呼吸代谢的变化
暗反应阶段将Warburg呼吸仪罩住,使种子萌发过程在无光照条件下进行。结果如图1所示,在暗反应无KOH条件下,种子萌发时,迅速释放CO2,50 min内反应器内气体变化量由0 mL升至2 mL,随着种子萌发进行,封闭体系中O2不断被消耗,60 min后,体系内的CO2产生速率下降,80 min时气体变化量为3.2 mL。在暗反应有KOH条件下,种子萌发释放的CO2大部分被KOH吸收,50 min时气体变化量为0.4 mL,60 min以后O2消耗速率大于CO2释放的速率,体积差为-0.1 mL。在光反应无KOH条件下,种子萌发时,CO2的释放与O2利用同时进行, 50 min内反应器内气体变化量由0 mL升至1.2 mL,80 min时气体变化量为2.1 mL。在光反应有KOH条件下,释放的CO2全部被KOH吸收,只有O2消耗,50 min时气体变化量为-0.8 mL,80 min时气体变化量为-1.8 mL。

图2 光与种子萌发活性的关系
2.2 种子萌发前后蛋白质含量的变化
采用双缩脲法测定,黑豆种子萌发后蛋白质含量较萌发前减少了46.77%,也就是说种子萌发进程中大幅度地消耗了种子内贮存的蛋白质,这部分蛋白质的含量变化包含种子中贮存的蛋白消耗和萌发进程中新产生蛋白之间的差值。
2.3 种子萌发前后糖含量的变化
黑豆种子萌发前,样品OD625为0.192,在糖标准曲线上计算出样品中糖含量为0.039 mg/mL。种子萌发后,样品OD625为0.118,糖含量为0.020 mg/mL,通过计算可知,种子萌发进程中可溶性碳水化合物的含量从萌发前的0.48%转变为萌发后的0.25%,这表明黑豆,萌发过程中主要的能量来源不是碳水化合物。
2.4 种子萌发前后核酸含量的变化
黑豆种子萌发前后,种子内的DNA含量出现了明显的变化,萌发前黑豆种子内DNA占干重的1.21%,萌发后黑豆种子内的DNA含量占干重的3.28%,变化幅度为171.0%;黑豆种子萌发前后,种子内的RNA含量变化相对较不明显,RNA占干重的质量百分比从萌发前的0.031%变化为萌发后的0.022%,变化幅度仅为29%。
2.5 光与种子萌发活性的关系
在Warburg氏呼吸计的恒温槽中加入不同颜色染料,使允许透过波长产生不同变化,观察经不同波长照射后,种子萌发活性的变化(结果如图2)。
3 讨论与结论
呼吸代谢是一切生物所共有的生理功能,其重要作用是释放能量供各种代谢的需要。种子萌发过程中糖氧化降解是通过呼吸代谢途径进行的,胚乳中的糖需经氧化分解才能为胚的生长提供可利用的能量,并为新器官、新组织的形成提供重要原料。种子萌发过程中,不同的呼吸代谢途径为胚的生长提供不同的能荷和还原力,呼吸代谢途径及强度的转变影响种子萌发的正常进行,因此研究种子萌发过程中的呼吸代谢具有重要的意义[12-14]。在本实验中,通过采用Warburg氏呼吸计测定暗反应和光反应条件下,黑豆种子萌发时释放的二氧化碳与利用的氧气量之间的变化关系。结果发现,萌发早期在暗反应无KOH条件下,种子萌发时,迅速释放二氧化碳,随着种子萌发进行,封闭体系中氧不断被消耗,体系内的二氧化碳产生速率下降。在暗反应有KOH条件下,种子萌发释放的二氧化碳大部分被KOH吸收,60 min以后氧消耗速率大于二氧化碳释放的速率。在光反应无KOH条件下,种子萌发时,二氧化碳的释放与氧的利用同时进行,气体变化量小于暗反应。在光反应有KOH条件下,释放的二氧化碳全部被KOH吸收,只有氧气的消耗。总体来说,黑豆种子呼吸速率的变化符合“S”形曲线,存在明显的呼吸滞缓期。
为了向胚提供形成新组织的材料和发芽的能量, 种子中贮藏了富含化学能的蛋白质。蛋白质为种子萌发以及萌发之后的幼苗生长提供营养,与种子活力的形成和保持有密切关系。一般认为,种子活力与蛋白质合成能力有关,当种子活力下降时,蛋白质合成量减少,酶结构遭到破坏[15]。种子中蛋白质的含量还与多种环境胁迫因素相关:如脱水胁迫[16]、贮藏温度改变[17]、渗透胁迫[18]、人工老化[19]等。在本实验中,采用双缩脲法测定黑豆种子内蛋白质含量在种子萌发前后的变化,发现随时间的推移,种子内蛋白质含量逐渐减少,可能是由于受外界环境的影响,种子内酶的活力下降,蛋白质合成减少。
糖类是种子萌发至转入光合自养前的主要呼吸底物,主要包括蔗糖、果糖、鼠李糖、木糖、肌醇、氨基葡糖等[20]。在本实验中,采用硫酸蒽酮法测定黑豆种子萌发前后糖含量的变化,发现种子萌发后,由于呼吸代谢对糖的分解作用,种子内糖的含量明显降低,进一步证明了糖是种子萌发最主要的能量供应物质。
种子的萌发活力与DNA合成能力密切相关[21-26],其中染色体断裂是种子萌发过程中最易发生的致命缺陷之一,在本实验中,测得黑豆种子萌发后,种子内DNA与RNA的含量均有所下降,就极有可能与染色体断裂有关。
经不同波长光线照射后,种子萌发强度变化明显,其中可见光区域内,长波长光线较短波长光线对种子萌发有更加明显的促进作用,而280 nm的紫外光也显著提高种子萌发强度。研究结果可为适当调整种子萌发外界条件,提高种子萌发率提供理论参考。
综上所述, 在黑豆种子的萌发过程中,能量与营养物质呈现动态变化,呼吸代谢和各种营养物质包括糖、蛋白质和核酸都发生了复杂的变化,其中呼吸代谢和糖的变化更为复杂,除了受到种子自身因素影响外,还受到诸如光照条件等多种外界因素的影响,而不同波长以及不同光强照射对于不同植物种子萌发进程的影响,还有待进一步研究。
[1]林琼,黄华,李辉,等.凤仙花种子萌发过程中的生理生化变化[J]. 贵州农业科学,2009,37(6):48-50.
[2]王文君,罗晓丹,张日清,等.刺槐种子萌发过程中的生理生化变化[J].河南林业科技,2009,29(2):1-2.
[3]吴能表,王图锦.萝卜种子萌发过程中部分生理指标的动态变化[J].西南师范大学学报(自然科学版),2006,31(6):117-120.
[4]白永富,卢秀萍.烟草种子萌发期间可溶性蛋白质含量与游离氨基酸含量的相关性研究[J].中国农学通报,2006,22(8):286-288.
[5]柴家荣.白肋烟种子萌发的生理生化动态研究[J].中国烟草科学,2006,27(2):32-36.
[6]王霞霞,李龑,唐杰伟,等.盐胁迫对燕麦种子萌发期蛋白质组影响的研究[J].华北农学报,2015,30(3):48-53.
[7]曹婧,李晓荣,王翠,等.外源激素ABA影响新疆荒漠盐生植物异子蓬异型种子萌发机制初探[J].生态学报,2015,35(20):6 666-6 677.
[8]潘建国,王开发,郑尧隆,等.用Warburg法测定蜂花粉中过氧化氢酶活性[J].植物学通报,2001,18(4):505-508.
[9]刘邻渭,陶健,毕磊.双缩脲法测定荞麦蛋白质[J].食品科学,2004,25(10):258-261.
[10]李合生.现代植物生理学[M].北京:高等教育出版社,2000.
[11]周学权.油松种子萌发过程中核酸和蛋白质的变化[J].北京林业大学学报,1989,11(3):46-53.
[12]陈立培,王国霞,沈永宝.油松种子萌发初始阶段的呼吸代谢[J].林业科学,2012,48(5):150-153.
[13]Fang S Z,Wang J Y.Changes in the biochemical composition and enzyme activity during dormancy release of Cyclocarya paliurus seeds[J].Forestry Studies in China,2007,9(1):7-13.
[14]刘双平,周青.种子萌发过程中呼吸代谢对环境变化的响应[J].中国生态农业学报,2009,17(5):1 035-1 038.
[15]Abdul-Baki A.A..Biochemical aspects of seed vigor[J].Hort Science,1980,15:765-771.
[16]刘箭,陆旺金,傅家瑞.黄皮种子发育、萌动和脱水胁迫时蛋白的合成[J].中山大学学报(自然科学版),1998,37(3):129-130.
[17]齐宁,刘忠堂,韩玉章,等.大豆种子脂肪蛋白质含量与萌发期耐冷性关系初探[J].中国油料,1990(3):39-41.
[18]路苹,汪沛洪.渗透胁迫下小麦种子萌发成苗与蛋白质变化的关系[J].北京农学院学报,1996,11(1):22-27.
[19]范国强,秦文静,刘玉礼.花生种子人工老化过程中发芽率和蛋白质的变化[J].河南农业大学学报,1995,29(4):337-340.
[20]Sheikh M.B..The component of soluble sugar in peanut[J].Journal of agricultural and food chemistry,1992,40(5):780-783.
[21]汪晓峰,景新明,林坚,等.超干贮藏榆树种子萌发过程中ATP和可溶性糖含量的变化[J].植物生理学报,2001,27(5):413-418.
[22]孙国容,陈月艳,关旸,等.盐胁迫下星星草种子萌发过程中有机物、呼吸作用及其几种酶活性的变化[J].植物研究,1999,19(4):445-451.
[23]毛培胜,韩建国,王培,等.无芒雀麦种子发育过程中的生理生化变化[J].中国草地,2001,23(1):26-31.
[24]Vazques-Tamos J.M.,Lopez S.,Vasquez E.,et al.DNA integrity and DNA polymerize activity in deteriorated maize embryo axes[J].Plant Physiology,1988,133:600-604.
[25]Bewley J.D.,Black M..Physiology and biochemistry of seeds(Vol.2,Viability,dormancy and environmental control)[J].1982,New York:Spring-Verlag.
[26]Gidrol X.,et al.Bio chemical changes induced by accelerated aging in sunflower seeds:I RNA population and proteins synthesis[J].Physiological plantarlum,1990,80:598-604.
The Effect of Illumination on the Germination Process of Black Soybean Seed
WANGYawena,YUANJunjiea,MAMuqinga,WUJiaanb,XINXina,ZHOUYulina,ZHOUJiea
2016-10-25
王亚文(1991—),女,山西省人;硕士,研究方向:生物化学与分子生物学。
周 杰(1976—),女,辽宁省人;博士,主要从事天然产物分离及性质研究;E-mail:jzhou@jlu.edu.cn。
10.16590/j.cnki.1001-4705.2017.02.099
S 529
A
1001-4705(2017)02-0099-04
