上海单中心2012至2016年门诊腹泻婴幼儿腺病毒流行病学特点
2017-12-02卢丽娟钟华清徐梦华苏犁云曹凌峰董妞妞董左权
卢丽娟 钟华清 徐梦华 苏犁云 曹凌峰 董妞妞 董左权 徐 锦
上海单中心2012至2016年门诊腹泻婴幼儿腺病毒流行病学特点
卢丽娟 钟华清 徐梦华 苏犁云 曹凌峰 董妞妞 董左权 徐 锦
目的 了解上海市门诊腹泻婴幼儿中腺病毒(HAdV)的流行病学特征。方法 收集2012年1月1日至2016年12月31日每周三在复旦大学附属儿科医院(我院)门诊就诊、≤5岁、病程≤14 d的急性腹泻患儿临床病毒检测后的剩余粪便标本,以系统抽样,采用PCR法检测HAdV、星状病毒、轮状病毒和诺如病毒,并通过基因测序和进化树分析确定HAdV的型别。 结果 共1 010例样本进入本文分析,2012至2014年每年144例,2015年265例,2016年313例;男628例;0~6、~12、~24、~36、~48和~60月龄分别为246、578、79、45、18和44例。①5年HAdV总检出率为 5.2%(53/1 010),2012至2016年依次为6.9%(10/144)、10.4%(15/144)、5.6%(8/144)、4.5%(12/265)和2.6%(8/313),不同年份差异无统计学意义。②不同性别、不同月龄患儿和不同月份HAdV检出率差异均无统计学意义。③53例共检测到10种HAdV型别,肠道腺病毒(EAdV)包括HAdV 41型 (31/53,58.5%) 和 40 型(3.8%),非肠道腺病毒(NEAdV)包括HAdV 31型 (11.3%)、1 型(5.7%)、3 型(5.7%)、2 型(3.8%)、 5 型(3.8%)、 6 型(3.8%)、4 型(1.9%)和7 型(1.9%)。各年份均以HAdV 41型为主。④HAdV单一感染占73.6%(39/53),EAdV、NEAdV单一感染分别为49.1%(26/53)和24.5%(13/53);14例为HAdV和其他腹泻病毒混合感染,主要为HAdV与轮状病毒(13.2%,7/53)或诺如病毒(9.4%,5/53)的两两混合感染。结论 上海地区门诊腹泻婴幼儿中HAdV流行型别多样,常年散在流行,且主要为单独感染引发婴幼儿腹泻。
门诊; 婴幼儿; 腹泻; 腺病毒; 型别
以往引起婴幼儿腹泻的病毒主要为轮状病毒(RV),随着近年来RV疫苗的使用,由RV引发的婴幼儿腹泻在全球范围内有所下降,而诺如病毒(NoV)、人星状病毒(HAstV)和腺病毒(HAdV)在婴幼儿腹泻中的地位越来越引起重视[1-6]。HAdV根据免疫学、生物学及基因组差异分为A~G 7 个亚种,至少有70种血清型和基因型[7]。F亚种的HAdV 40和41型是导致婴幼儿急性腹泻的主要型别,又称肠道腺病毒(EdAV)[8],已知的其他型别HAdV则被称为非肠道腺病毒(NEAdV),也有研究报道腹泻婴幼儿粪便标本中检测到 HAdV 1、3、5、7、8、12和 31型等NEAdV[5,8,9]。目前国内外有关门诊腹泻婴幼儿病原体的报道主要集中在RV和NoV,对HAdV流行情况的报道不多[10-14]。本研究从复旦大学附属儿科医院(我院)门诊腹泻婴幼儿的粪便标本中抽样,采用PCR法检测HAdV并通过测序确定其型别,以此了解HAdV在上海市婴幼儿腹泻中的流行情况。
1 方法
1.1 粪便标本来源 2012年1月1日至2016年12月31日每周三我院临床检验中心门诊窗口用于临床检测腹泻病毒的患儿的剩余粪便标本,标明收集日期和病史查阅系统中的编号后,送至临床检验中心病毒室统一保存(-20℃,1年以上保存于-70℃)。每月底统一在我院病史查阅系统中查询本月收集的粪便标本的临床信息,筛选满足本文纳入和排除标准的标本。每年年底采用系统抽样法从各月份收集的粪便标本中抽取12例,进行HAdV检测。2015年底预分析数据时,发现HAdV检出率低,故于2015年和2016年增加抽样量。
1.2 纳入标准 同时满足以下4项:①≤5岁儿童;②因急性腹泻就诊,病程≤14 d;③大便呈稀水样、蛋花汤样或稀糊样改变,肉眼无黏冻和(或)血丝;④粪便镜检WBClt;5个/高倍视野。
1.3 排除标准 ①粪便标本量不足;②粪便为黏液便、脓血便;③确诊为非腹泻疾病患儿;④患儿年龄、性别和临床诊断信息缺失等。
1.4 腹泻病毒检测及型别鉴定 用于病毒检测的反转录试剂盒和Ex-Taq酶购自宝生物工程(大连)有限公司。
1.4.1 RNA/DNA提取 采用TIANamp病毒DNA/RNA抽提试剂盒[天根生化科技(北京)有限公司]。先以0.9%氯化钠溶液制备10%~20%(W/V)的粪便悬液,低速离心后取200 μL上清液,加入20 μL的蛋白酶K及200 μL carrierRNA工作液,按试剂盒的操作步骤提取RNA和DNA(均以50 μL焦碳酸二乙酯水溶解)。
1.4.2 HAdV检测 取PCR引物参照文献[15]。反应体系:引物0.2 μmol,三磷酸脱氧核糖核苷(dNTP)100 μmol,Taq酶2.5 U,总体积50 μL。反应条件:94℃3 min;94℃3 s,55℃30 s,72℃1 min,共35个循环;72℃7 min。目的片段长度为482 bp。
1.4.3 RV、NoV和HAstV的检测 RV检测采用一步法RT-PCR[12],NoV[13]和HAstV[16]采用两步法RT-PCR。
1.4.4 病毒型别鉴定 将HAdV、HAstV和NoV检测结果阳性的PCR产物送至上海生工生物工程股份有限公司行Sanger法测序。
1.4.5 进化树分析 采用软件MEGA6.0将HAdV株的测序结果与Pubmed中查询到的不同型别的HAdV全长比对株进行比对分析和进化树的绘制,以明确HAdV的型别。
1.5 统计学方法 采用SPSS 16.0软件进行统计学分析。计数资料以百分比表示,多组间比较根据不同条件采用χ2检验或Fisher's确切概率法。Plt;0.05为差异有统计学意义。
2 结果
2.1 一般情况 2012至2016年到我院门诊就诊的腹泻患儿分别为9 867例、16 054例、15 953例、16 034例及20 156例;5年间满足本研究纳入和排除标准的总体样本量为4 412例,2012至2016年分别为656、862、908、962和1 024例;抽取样本量2012至2014年每年144例,2015年265例,2016年313例。1 010例腹泻患儿中,男628例,~6、~12、~24、~36、~48和~60月龄分别为246、578、79、45、18和44例。
2.2 HAdV检出情况 5年HAdV总检出率为5.2%(53/1 010),2012至2016年依次分别为6.9%(10/144)、10.4%(15/144)、5.6%(8/144)、4.5%(12/265)和2.6%(8/313),各年份差异无统计学意义(χ2=13.436,P=0.09)。表1显示,不同性别、月龄、月份HAdV检出率差异均无统计学意义,2012年6月(4例)和2013年6月(5例)为单月检出例数最多的月份。
2.3 HAdV型别分布 图1显示HAdV生物进化树。53例HAdV阳性者测序均成功,共10种型别,EAdV中41型31例(58.5%),40型2例(3.8%);NEAdV中31型6例(11.3%),1和3型各3例,2、5和6型各2例(3.8%),4和7型各1例。2012年HAdV 1、5和31型各1例,41型7例;2013年HAdV2型1例,31型2例,41型12例;2014年HAdV 1、7和31型各1例,3型2例,41型3例;2015年HAdV 4和5型各1例,2和31型各2例,41型6例;2016年HAdV3型1例,2和40型各2例,41型3例。2012至2016各年份HAdV型别的分布有所不同,但均以HAdV 41型为主,2014和2015年均检测到5种型别,2012和2016年均为4种,2013年3种。
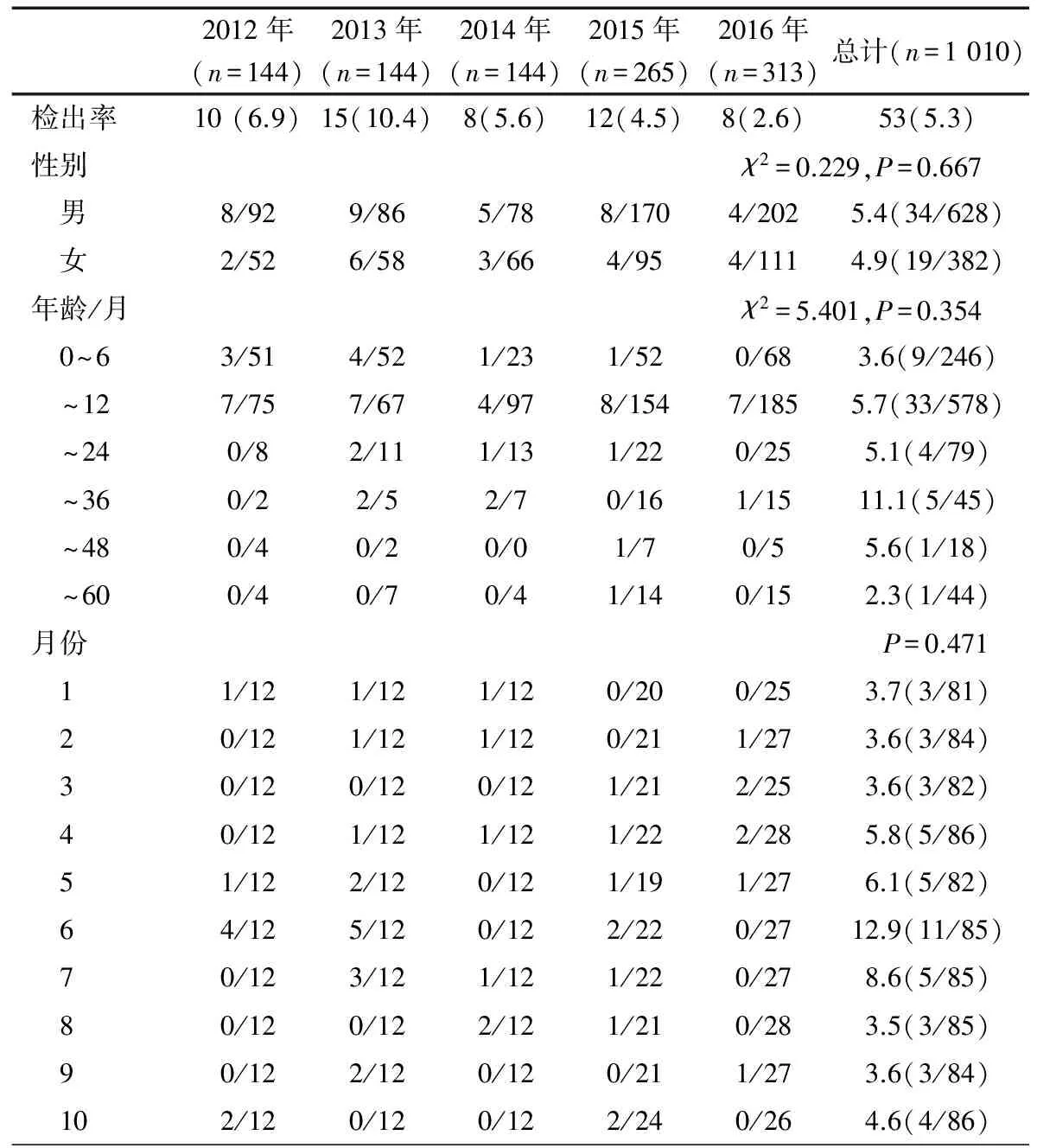
表1 2012至2016年上海地区腹泻儿童腺病毒感染的性别、年龄和月份分布 [(n/N)]
2.4 HAdV感染与其他腹泻病毒混合感染的情况 53例HAdV阳性标本中,HAdV单一感染39例(73.6%),EAdV和NEAdV单一感染分别为49.1%(26/53)和24.5%(13/53);其余14例HAdV均检测到其他腹泻病毒,HAdV与RV、NoV、HAstV两两混合感染分别为7例(13.2%)、5例(9.4%)和1例(1.9%),1例(1.9%)同时感染HAdV、RV和HAstV。
3 讨论
HAdV属哺乳动物腺病毒属,最早在切除的婴幼儿扁桃体腺体细胞的自发性退化中发现[17],为无包膜、二十面体对称的线性双链DNA病毒,病毒颗粒直径65~80 nm,由蛋白衣壳、核心蛋白和双链DNA组成,蛋白衣壳由六邻体、五邻体和纤突3种主要的蛋白构成。HAdV感染在全球范围内广泛流行且传染性较强,不仅是呼吸道、结膜和肠道感染中较常见的病原体,还可引起无菌性脑膜炎、心肌炎、脑炎和肝炎等,也是免疫功能低下人群中的常见感染因素。HAdV主要通过手-口、污染的食物和水传播,除婴幼儿散发性腹泻外,在院内感染腹泻的发病中也起重要作用[18-21]。HAdV引起的腹泻多为自限性疾病,但常伴有病程较长的水样腹泻和呕吐。
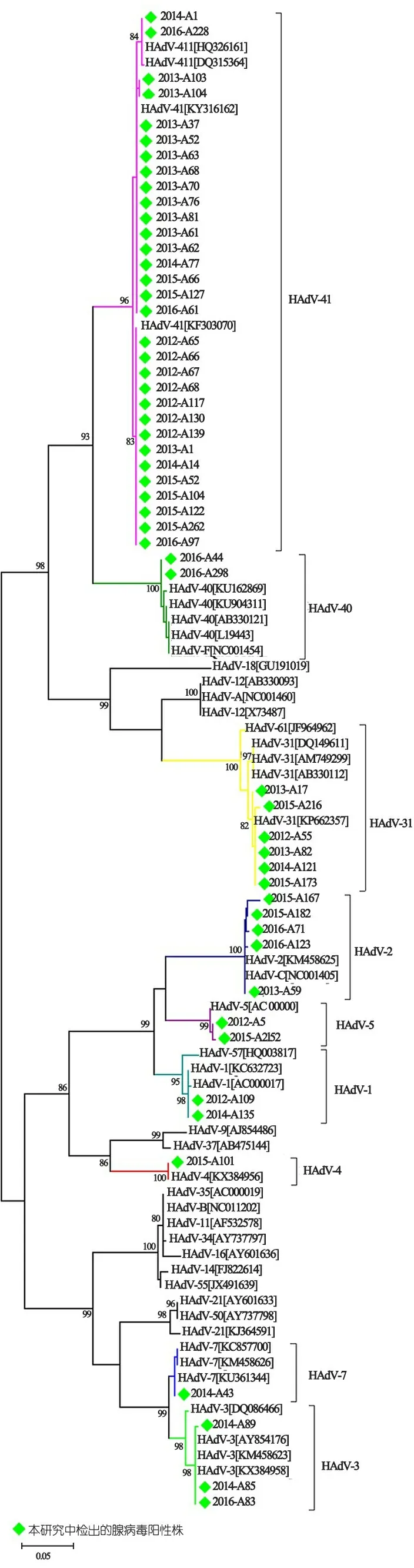
图12012至2016年上海地区门诊腹泻婴幼儿中腺病毒基因型别进化树分析
目前尚缺乏有关上海市门诊腹泻婴幼儿中HAdV的流行病学资料。本研究从2012至2016年我院门诊≤5岁的急性腹泻婴幼儿的粪便标本中抽样1 010例,通过PCR法检测显示,5年HAdV总检出率5.2%,除了2013年(10.4%)外其他年份均lt;7.0%,各年份间差异无统计学意义,但总体呈下降趋势。回顾近年来国内外文献报道的腹泻婴幼儿中HAdV检出率,泰国(9.3%,2010至2016)、韩国(2.6%,2001至2005)、孟加拉国达卡市(1.9%,2004至2005年)、越南(3.2%, 2002至3003年)以及我国重庆(6.3%,2010年)、兰州(4.4.%,2005至2007年;5.1%,2010至2011年)、成都(2.0%,2006至2008年)、南京(2.7%,2009至2010年)和甘肃(6.9%,2009至2013年)均lt;10%[5,15,22-29];而孟加拉国2005至2006年高达65.2%,土耳其2004至2005年52.0%,我国天津2008至2009年也较高(17.6%)[6,30],提示HAdV的流行存在地域差异。
本研究中不同性别HAdV检出率差异无统计学意义,与天津、兰州和北京的报道一致[26,30,31],提示HAdV感染没显示出性别差异。腹泻婴幼儿中RV和NoV以秋冬季流行为主[10-13],与此不同,本研究中HAdV检出率在全年各月份差异无统计学意义,2012年6月和2013年6月单月检出例数最多。巴西、澳大利亚以及我国兰州、成都和北京的报道显示HAdV感染无明显的季节规律[26,27,31-33]。印度报道2011至2013年腹泻婴幼儿的HAdV感染高峰在1~3月份[34],我国天津市报道2008至2009年腹泻婴幼儿HAdV感染的高峰季节在夏季[30],湖南省报道2009至2010年HAdV流行季节主要为冬春季[35]。因此,腹泻婴幼儿中HAdV是否全年呈散在流行,还是有季节流行特征,尚待长期更大规模的流行病学监测。本研究中各年龄组中HAdV的检出率差异无统计学意义,HAdV阳性患儿主要集中在0~12月龄(79.2%,42/53),这与腹泻患儿主要集中在0~12月龄(81.6%,824/1 010)相一致,与韩国以及我国天津和兰州的报道一致[23,26,30]。
我院2012至2016年门诊腹泻婴幼儿HAdV感染中以HAdV 41 型(58.5%)为主要优势流行株,与我国重庆、兰州、成都、南京、北京和湖南等省市报道一致[5,26-28,30,31,35]。在孟加拉国的达卡市[22],则以HAdV 40型的流行为主。本研究NEAdV占全部HAdV感染的37.7%,其中HAdV-31型占11.3%。已有研究表明,HAdV 31型可感染肠道并产生与EAdV感染相似的临床症状[36]。本研究中检出的6例HAdV-31型感染腹泻婴幼中4例为单独感染,提示HAdV 31型是引发婴幼儿腹泻的HAdV中一个重要型别。此外,本研究还检测到HAdV 1~5和7 型。韩国、日本和我国兰州、天津等地也曾在腹泻婴幼儿检测到HAdV 1~3、5~8、12、18 和31 型[5,9,18,23,24,26,30 ]。本研究门诊腹泻婴幼儿中NEAdV单一感染的比例达24.5%,提示NEAdV在婴幼儿急性腹泻的发病中可能起重要作用,临床医生在诊治由NEAdV引发的疾病时,还应关注婴幼儿是否出现了胃肠道症状,以防延误病情。
多项研究表明,HAdV与其他腹泻病毒的混合感染在腹泻婴幼儿占有一定比例[5,15,26,28,30]。本研究中,HAdV与其他腹泻病毒的混合感染为26.4%,与我国甘肃和天津等地的报道相近[15,26,28,30]。本研究中混合感染形式主要为HAdV与RV或NoV的两两混合感染。
综上所述,通过检测和分析2012至2016年我院急性腹泻婴幼儿HAdV的流行情况和型别, 为了解上海地区婴幼儿HAdV的流行病学特征提供了证据,但存在一些不足,比如未在研究设计时进行样本量估算,可能对结果的代表性造成一定影响。
[1] Lopman BA, Steele D, Kirkwood CD, Parashar UD.The vast and varied global burden of norovirus: prospects for prevention and control. PLoS Med, 2016, 13(4): e1001999
[2] Anderson EJ. Prevention and treatment of viral diarrhea in pediatrics. Expert Rev Anti Infect Ther, 2010, 8(2): 205-217
[3] Yen C, Tate JE, Hyde TB, et al. Rotavirus vaccines: current status and future considerations. Hum Vaccin Immunother, 2014, 10(6):1436-1448
[4] Ramani S, Kang G. Viruses causing childhood diarrhoea in the developing world. Curr Opin Infect Dis, 2009, 22(5): 477-482
[5] Ren Z, Kong Y, Wang J, et al. Etiological study of enteric viruses and the genetic diversity of norovirus, sapovirus, adenovirus, and astrovirus in children with diarrhea in Chongqing, China. BMC Infect Dis, 2013, 13:412-417
[6] Mitui MT, Bozdayi G, Ahmed S, et al. Detection and Molecular Characterization of Diarrhea Causing Viruses in Single and Mixed Infections in Children: A Comparative Study Between Bangladesh and Turkey. J Med Virol, 2014, 86(7):1159-1168
[7] Hage E, Gerd Liebert U, Bergs S, et al. Human mastadenovirus type 70: a novel, multiple recombinant species D mastadenovirus isolated from diarrhoeal faeces of a haematopoietic stem cell transplantation recipient. J Gen Virol, 2015, 96(9):2734-2742
[8] Verma H, Chitambar SD, Varanasi G. Identification and characterization of enteric adenoviruses in infants and children hospitalized for acute gastroenteritis. J Med Virol, 2009, 81(1): 60-64
[9] Li L, Phan TG, Nguyen TA, et al. Molecular epidemiology of adenovirus infection among pediatric population with diarrhea in Asia. Microbiol Immunol. 2005, 49(2): 121-128
[10] Zeng M, Xu X, Zhu C, et al. Clinical and Molecular Epidemiology of Norovirus Infection in Childhood Diarrhea in China. J Med Virol, 2012 Jan;84(1):145-151
[11] Xu J, Yang Y, Sun J, et al. Molecular Epidemiology of Norovirus Infection Among Children With Acute Gastroenteritis in Shanghai, China, 2001-2005. J Med Virol, 2009, 81(10): 1826-1830
[12] Xu J, Yang Y, Sun J, et al. Molecular epidemiology of rotavirus infections among children hospitalized for acute gastroenteritis in Shanghai, China, 2001 through 2005. J Clin Virol, 2009, 44(1): 58-61
[13] Lu LJ, Zhong HQ, Xu MH, et al. Molecular epidemiology of human calicivirus infectionsin children with acute diarrhea in Shanghai: a retrospective comparison between inpatients and outpatients treated between 2006 and 2011. Arch Virol, 2014, 159(7):1613-1621
[14] 卢丽娟, 钟华清, 苏犁云, 等. 2008至2011年上海单中心住院腹泻儿童轮状病毒型别别流行特征. 中国循证儿科杂志, 2013, 8(2): 98-104
[15] Liu X, Meng L, Li J, et al. Etiological epidemiology of viral diarrhea on the basis of sentinel surveillance in children younger than 5 years in Gansu, northwest China, 2009-2013. J Med Virol, 2015, 87(12): 2048-2053
[16] 卢丽娟,徐锦,钟华清,等. 住院和门诊腹泻儿童中星状病毒的分子流行病学特点. 中华传染病杂志, 2016, 34(8): 463-468
[17] Rowe WP, Huebner RJ, Gilmore LK, et al. Isolation of a cytopathogenic agent from human adenoids undergoing spontaneous degeneration in tissue culture. Proc Soc Exp Biol Med, 1953, 84(3): 570-573
[18] Ghebremedhin B. Human adenovirus: Viral pathogen with increasing importance. Eur J Microbiol Immunol (Bp), 2014, 4(1):26-33
[19] Langley JM, LeBlanc JC, Hanakowski M, et al. The role of Clostridium difficile and viruses as causes of nosocomial diarrhea in children. Infect Control Hosp Epidemiol, 2002, 23(11):660-664
[20] Ford-Jones EL, Mindorff CM, Gold R, et al. The incidence of viral-associated diarrhea after admission to a pediatric hospital. Am J Epidemiol, 1990, 131(4): 711-718
[21] Kotloff KL, Losonsky GA, Morris JG, et al. Enteric adenovirus infection and childhood diarrhea: an epidemiologic study in three clinical settings. Pediatrics, 1989, 84(2): 219-225
[22] Dey SK, Shimizu H, Phan TG, et al. Molecular epidemiology of adenovirus infection among infants and children with acute gastroenteritis in Dhaka City, Bangladesh. Infect Genet Evol, 2009, 9(4): 518-522
[23] Huh JW, Kim WH, Moon SG, et al. Viral etiology and incidence associated with acute gastroenteritis in a 5-year survey in Gyeonggi province, South Korea. J Clin Virol, 2009, 44(2): 152-156
[24] Jin Y, Cheng WX, Yang XM, et al. Viral agents associated with acute gastroenteritis in children hospitalized with diarrhea in Lanzhou, China. J Clin Virol, 2009, 44(3): 238-241
[25] Nguyen T A, Yagyu F, Okame M, et al. Diversity of viruses associated with acute gastroenteritis in children hospitalized with diarrhea in Ho Chi Minh City, Vietnam. J Med Virol, 2007, 79(5): 582-590
[26] 王永霞, 金玉, 章青, 等. 2010-2011年兰州地区5岁以下腹泻患儿杯状病毒和腺病毒感染的流行特征. 中华实验和临床病毒学杂志, 2012, 26(1): 8-10
[27] 谢晓丽, 张伟, 廖雪春, 等. 成都地区婴幼儿病毒性腹泻分子流行病学研究.中华实验和临床病毒学杂志, 2012, 26(1): 2-4
[28] 林谦, 金玉, 周进苏, 等. 2009至2010年南京儿童医院5岁以下儿童病毒性腹泻分子流行病学特点. 中国循证儿科杂志, 2012, 7(1): 31-36
[29] Chansaenroj J, Tuanthap S, Thanusuwannasak T et al. Human enteroviruses associated with and without diarrhea in Thailand between 2010 and 2016. PLoS One, 2017, 12(7):e0182078
[30] Ouyang Y, Ma H, Jin M, et al. Etiology and epidemiology of viral diarrhea in children under the age of five hospitalized in Tianjin, China. Arch Virol, 2012, 157(5): 881-887
[31] Liu L, Qian Y, Zhang Y, et al. Adenoviruses Associated with Acute Diarrhea in Children in Beijing, China. PLoS One. 2014, 9(2):e88791
[32] Filho EP, da Costa Faria NR, Fialho AM, et al. Adenoviruses associated with acute gastroenteritis in hospitalized and community children up to 5 years old in Rio de Janeiro and Salvador, Brazil. J Med Microbiol. 2007, 56(Pt 3):313-319
[33] Barnes GL, Uren E, Stevens KB, et al. Etiology of acute gastroenteritis in hospitalized children in Melbourne, Australia, from April 1980 to March 1993. J Clin Microbiol, 1998, 36(1):133-138
[34] Akhil C, Suresha PG, Sabeena S, et al. Genotyping of human adenoviruses circulating in Southwest India. Virus Dis, 2016, 27(3): 266-270
[35] 李俊华, 周帅锋, 刘运芝, 等. 2009- 2010年湖南省哨点医院婴幼儿病毒性腹泻病原学研究. 实用预防医学, 2012, 19(3): 337-341
[36] Krajden M, Brown M, Petrasek A, et al. Clinical features of adenovirus enteritis: a review of 127 cases. Pediatr Infect Dis J, 1990, 9(9):636-641
2017-09-22
2017-10-12)
(本文编辑:孙晋枫)
Single-centreepidemiologyandgenotypingofhumanadenovirusinoutpatientchildrenwithsporadicdiarrheainShanghai
LULi-juan,ZHONGHua-qing,XUMeng-hua,SULi-yun,CAOLing-feng,DONGNiu-niu,DONGZuo-quan,XUJin
(ClinicalLaboratoryCenter,Children'sHospitalofFudanUniversity,Shanghai201102,China)
Xu Jin, E-mail:jinxu_125@163.com
ObjectiveTo characterize the molecular epidemiology of human adenoviruses (HAdVs) and understand their association with acute diarrhea in outpatient children in Shanghai.MethodsFecal samples were collected from children under five years who were admitted to Children's Hospital of Fudan University as outpatients and diagnosed as acute diarrhea (Duration of diarrhea ≤14 days) from January 2012 to December 2016. All selected stool samples were subjected to reverse transcriptase PCR (RT-PCR) or PCR to detect group A rotavirus (RVA), human calicivirus (HuCV), human astrovirus (HAstV) and HAdV.ResultsA total of 1 010 fecal specimens were prospectively enrolled in this study with annual total of 144, 144, 144, 265 and 313 samples collected respectively from 2012 to 2016. Among the enrolled patients, 628 of them were boys and 382 were girls. Among them, 246 individuals aged 0 to 6 months, 578 individuals aged 7 to 12 months, 79 individuals aged 13 to 24 months, 45 individuals aged 25 to 36 months, 18 individuals aged 37 to 48 months and 44 individuals aged 49 to 60 months. ①HAdV infections were detected in 5.2%(53/1010) specimens and the detection rate was 6.9%(10/144), 10.4%(15/144), 5.6%(8/144), 4.5%(12/265) and 2.6%(8/313) respectively from 2012 to 2016. And they did not achieve statistical significance(χ2=13.436,P=0.09). ②There was no significant difference of HAdV detection rate among different gender groups, age groups and each month. ③Of the 53 HAdV-positive samples, 62.3% (33/53) were classified as EAdV including HAdV 41(31/53, 58.5%) and -40 (3.8%, 2/53) while the others were NEAdV including HAdV-31 (11.3%), -1 (5.7%), -3 (5.7%), -2(3.8%), -5 (3.8%), -6 (3.8%), -4 (1.9%) and -7 (1.9%). HAdV 41 was the most prevalent HAdV genotype in each year. ④Among the HAdVs positive specimens, 49.1%(26/53) were EAdV mono-infections and 24.5%(13/53) were NEAdV mono-infections while others were mixed infection with other diarrhea viruses. Among the mixed-infection cases, HAdVs mixed with RV (13.2%, 7/53) or NoV (9.4%, 5/53) were the most patterns.ConclusionThese results clearly indicated the high diversity of the HAdVs genotypes detected in outpatient children with acute diarrhea and most of them were HAdV mono-infection cases.
Outpatient; Infants; Diarrhea; Human adenovirus; Genotype
复旦大学附属儿科医院临床检验中心 上海, 201102
徐锦,E-mail:jinxu_125@163.com
10.3969/j.issn.1673-5501.2017.05.007
