GA处理下咖啡黄葵种子萌发及与α-淀粉酶相关性研究
2017-12-01,,,,
, , , ,
(1.贵州师范大学, 贵阳 550025; 2.贵州大学动物科学学院, 贵阳 550025)
GA处理下咖啡黄葵种子萌发及与α-淀粉酶相关性研究
李燕1,汝姣1,姬越1,姚红艳2,罗充1
(1.贵州师范大学, 贵阳 550025; 2.贵州大学动物科学学院, 贵阳 550025)
[目的]研究不同浓度赤霉素处理对咖啡黄葵种子萌发的影响,以及种子萌发与α-淀粉酶的相关性。[方法]以蒸馏水为对照,选用不同浓度GA(1、5、10、50、100 mg/L)处理咖啡黄葵种子,发芽7 d,每2 d测定发芽率、胚根-胚轴总长、α-淀粉酶活性。[结果]随GA处理浓度增加,咖啡黄葵种子的发芽势、发芽指数及发芽率均呈先增后减的趋势;GA处理下,胚根-胚轴的伸长生长在萌发中期最快;α-淀粉酶活性随GA处理时间增加先升高后降低,发芽初期,α-淀粉酶活性极显著高于对照;赤霉素显著缩短其发芽时间,至少缩短2 d;综合考虑,5 mg/L GA处理对种子萌发效果最佳。[结论]不同GA浓度及处理时间对咖啡黄葵种子萌发有显著影响,低浓度的GA可以对咖啡黄葵种子萌发起促进作用,高浓度GA处理表现为抑制作用,且持续高浓度处理,抑制作用逐渐增强;促进胚根-胚轴伸长生长,发芽中期促进作用尤为明显;还显著提高发芽初期α-淀粉酶活性,从而影响咖啡黄葵种子萌发。
赤霉素; 咖啡黄葵;α-淀粉酶; 发芽率
咖啡黄葵(AbelmoschusesculentusL.),别名黄秋葵、越南芝麻(湖南)、洋辣椒(福建)、羊角豆(广东)、秋葵等,系锦葵科(Malvaceae)秋葵属(Abelmoschus)一年生草本植物[1]。咖啡黄葵是一种新型保健蔬菜,主要以嫩果为食,果实营养丰富,其嫩果干物质中约含总糖19.92%、蛋白22.98%、黄酮2.56%和脂肪9.4%[2],早已被欧美等国列入21世纪最佳绿色食品名录,同时许多国家将其定为运动员首选蔬菜[3]。近年来,对咖啡黄葵的报道较多,但大多都集中于化学成分[2,4-5]、药用价值[6-7]、生物学特性和栽培技术[8-9]及组织培养[10]等方面;仅有少量研究咖啡黄葵种子萌发特性[11]的报道。
赤霉素(GA)在种子萌发过程中起着“原初作用”,外源赤霉素预处理种子可打破种子休眠、促进种子发芽。赤霉素运用于牧草、水果、谷物种子的研究较多,运用于咖啡黄葵种子萌发的研究鲜有报道,而外源赤霉素处理对咖啡黄葵种子萌发过程中酶动态变化的研究极少。咖啡黄葵种壳硬且厚,直接播种出苗往往不整齐,不便管理,影响产量。因此,本试验拟研究GA处理对咖啡黄葵种子萌发的影响及对其生理生化指标——α-淀粉酶的影响,探讨GA影响咖啡黄葵种子萌发的机制,以便为咖啡黄葵播种育苗、高产量种植及推广种植提供参考。
1 材料与方法
1.1 材 料
试验材料为购自河北庆丰种业的咖啡黄葵种子(绿色品种,“杨贵妃”A.esculentusL.cv“yangguifei”)。
1.2 方 法
1.2.1 试验设计
随机选取咖啡黄葵种子,35 ℃恒温水浴条件下蒸馏水预浸种2 h后,用GA溶液处理。GA溶液浓度设6个水平,分别为:0(蒸馏水,ck)、1、5、10、50、100 mg/L,每个浓度水平随机取100粒预处理过的种子,每个处理重复3次。在培养皿里放3至4层定量滤纸作为发芽床。光照培养箱中25 ℃进行萌发试验,7 d发芽结束。
1.2.2 测定指标与方法
从放入光照培养箱的第1天开始,每2 d观察并记录当天发芽咖啡黄葵种子数(种子萌发以胚根伸出种皮3 mm为发芽标志),测量胚根-胚轴总长度,每2 d取样,测定α-淀粉酶活性,至第7天发芽结束。采用ISTA法测定并计算发芽率、发芽势及发芽指数[12-13]。
表1 不同GA浓度及时间处理咖啡黄葵种子累计发芽率
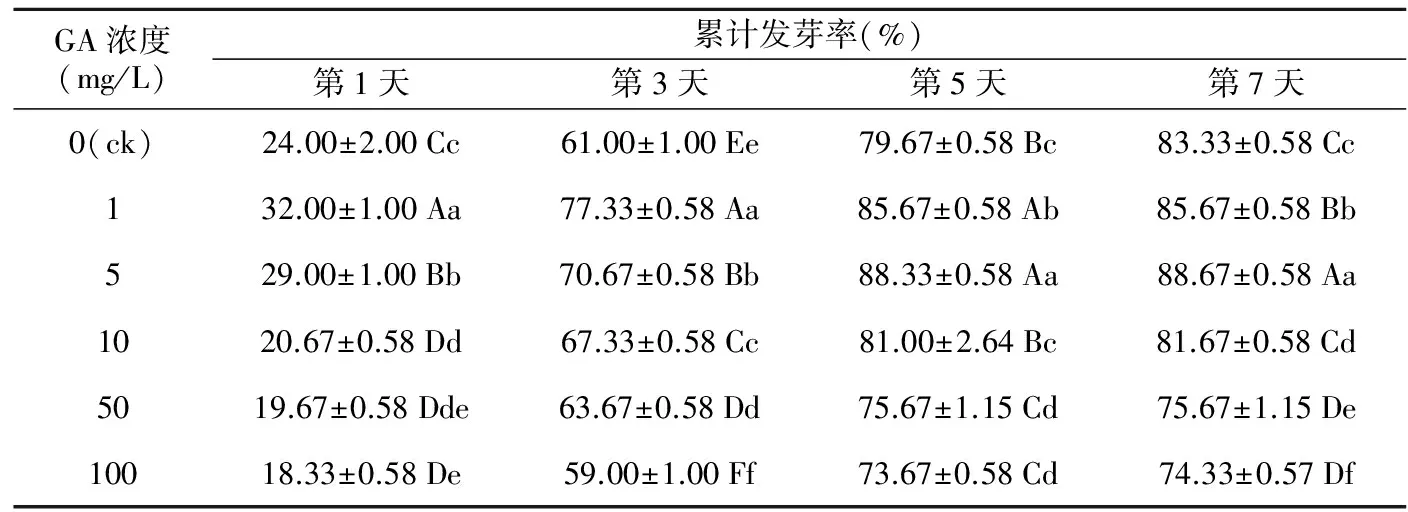
GA浓度(mg/L)累计发芽率(%)第1天第3天第5天第7天0(ck)24.00±2.00Cc61.00±1.00Ee79.67±0.58Bc83.33±0.58Cc132.00±1.00Aa77.33±0.58Aa85.67±0.58Ab85.67±0.58Bb529.00±1.00Bb70.67±0.58Bb88.33±0.58Aa88.67±0.58Aa1020.67±0.58Dd67.33±0.58Cc81.00±2.64Bc81.67±0.58Cd5019.67±0.58Dde63.67±0.58Dd75.67±1.15Cd75.67±1.15De10018.33±0.58De59.00±1.00Ff73.67±0.58Cd74.33±0.57Df
注:表中数据均为平均值±标准差;同一列不同大写字母表示在0.01水平上差异显著;同一列不同小写字母表示在0.05水平上差异显著。下同。
表2 不同浓度GA处理对咖啡黄葵种子发芽势、发芽指数及发芽率的影响

GA浓度(mg/L)发芽势(%)发芽指数发芽率(%)0(ck)61.00±1.00Ee40.59±1.18Cc83.33±0.58Cc177.33±0.58Aa48.78±0.75Aa85.67±0.58Bb570.67±0.58Bb46.67±0.64Bb88.67±0.58Aa1067.33±0.58Cc39.24±0.10Cd81.67±0.58Cd5063.67±0.58Dd36.73±0.53De75.67±1.15De10059.00±1.00Ff34.92±0.61Ef74.33±0.57Df
种子发芽率(%)=发芽种子数/供试发芽种子总数×100%;
种子发芽势(%)=3 d内发芽种子数/供试种子总数×100%;
种子发芽指数=∑(Gt/Dt),式中:Gt代表开始发芽后第t天的发芽种子数,Dt为相应的发芽日数。
α-淀粉酶活性采用3,5-二硝基水杨酸法[14],单位酶活力(U)定义:单位时间单位鲜重样品分解淀粉得到1 mg麦芽糖的酶量为1个酶活力单位值(U)。
1.3 数据处理
数据采用SPASS 19.0和Excel 2010软件进行统计与分析。
2 结果与分析
2.1 不同GA浓度及时间处理对咖啡黄葵种子累计发芽率的影响
表1中,当GA浓度为1~5 mg/L时,累计发芽率在整个时期都极显著高于对照;在发芽初期,GA浓度大于10 mg/L时发芽率极显著低于对照;而第3天中高浓度(10~50 mg/L)的发芽率极显著高于对照,后期发芽率又表现为逐渐低于对照。随处理时间的延长,GA处理组的萌发率均在第5天接近峰值甚至已达最高发芽率,而对照在第7天趋于峰值。研究结果表明,累计发芽率随着GA处理浓度升高表现为先增加后降低,低浓度促进其萌发,高浓度表现为抑制作用,且持续高浓度处理,抑制作用逐渐增强;赤霉素处理还可明显缩短其发芽时间。说明咖啡黄葵的萌发受GA浓度与处理时间共同作用。
2.2 不同GA浓度处理对咖啡黄葵种子发芽势、发芽指数及发芽率的影响
表2中,在低和中高GA浓度(1~50 mg/L)处理下,咖啡黄葵发芽势极显著高于对照;发芽指数和发芽率在低浓度(1~5 mg/L)GA处理下均极显著高于对照,在GA浓度大于50 mg/L时又都极显著低于对照,而在浓度为10 mg/L时发芽指数和发芽率与对照差异显著。研究结果表明,随GA浓度增加,发芽势、发芽指数及发芽率均先增大后减小;浓度梯度对其发芽率、发芽指数和发芽率的影响极显著,低浓度极显著提高其发芽势、发芽指数及总发芽率,浓度在1~5 mg/L时,其发芽率、发芽指数和发芽势处于高水平,其种子活力、萌发速度和发芽整齐度较好,而GA浓度过高会降低其发芽势、发芽指数及总发芽率,高浓度对发芽指数和发芽率的抑制作用更明显。
2.3 咖啡黄葵种子在不同浓度GA处理下胚根-胚轴总长的动态变化
在咖啡黄葵萌发过程中,胚根-胚轴生长动态的变化见表3。由表3可知发芽初期,GA对胚根-胚轴生长影响不显著;第3天后随着GA浓度升高胚根-胚轴总长均显著高于对照,且第5天和第7天均达到极显著水平。GA浓度为5~10 mg/L时,第7天胚根-胚轴总长均超过7.00 cm,显著高于其他浓度处理。对照组胚根-胚轴增长幅度比GA处理组增长幅度平缓,各组的胚根-胚轴增长幅度都在第3~5天达到最大值,但是各GA处理组在第3~5天和第5~7天的增长幅度都极显著高于对照。研究结果表明,GA可以显著促进咖啡黄葵胚根-胚轴的伸长生长,发芽中期促进其生长作用最明显;促进效果最显著的浓度范围为5~10 mg/L。
2.4 咖啡黄葵种子对α-淀粉酶活性的影响
由表4可看出,各GA处理组与对照相比,α-淀粉酶活性在第1天和第3天均极显著高于对照(plt;0.01),且α-淀粉酶活性均在第3天达到高峰值,而对照组的α-淀粉酶活性在第5天达到高峰值。咖啡黄葵种子α-淀粉酶活性增幅与累计发芽率的增幅趋势一致,α-淀粉酶活性达到峰值的时间均比累计发芽率达到最大值的时间早2 d,说明咖啡黄葵种子萌发过程中,α-淀粉酶活性与发芽率密切相关。α-淀粉酶活性与胚根-胚轴长呈极显著相关(plt;0.01)。研究结果表明,咖啡黄葵萌发过程中,α-淀粉酶活性随着萌发天数增加呈先骤增后减小趋势;GA处理可显著提高其发芽初期α-淀粉酶活性。
表3 咖啡黄葵种子在不同浓度GA处理下胚根-胚轴总长的动态变化
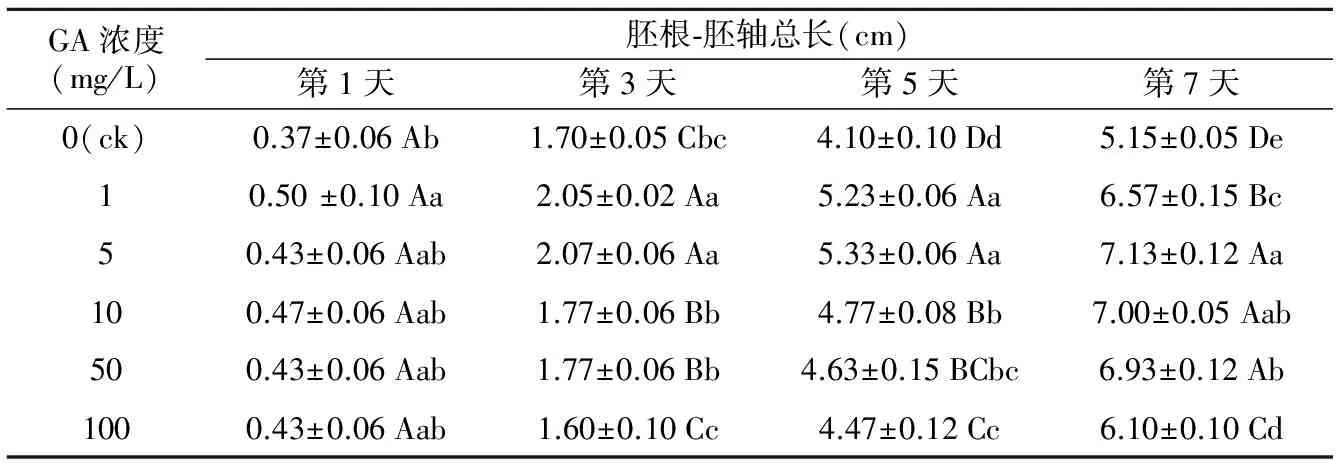
GA浓度(mg/L)胚根⁃胚轴总长(cm)第1天第3天第5天第7天0(ck)0.37±0.06Ab1.70±0.05Cbc4.10±0.10Dd5.15±0.05De10.50±0.10Aa2.05±0.02Aa5.23±0.06Aa6.57±0.15Bc50.43±0.06Aab2.07±0.06Aa5.33±0.06Aa7.13±0.12Aa100.47±0.06Aab1.77±0.06Bb4.77±0.08Bb7.00±0.05Aab500.43±0.06Aab1.77±0.06Bb4.63±0.15BCbc6.93±0.12Ab1000.43±0.06Aab1.60±0.10Cc4.47±0.12Cc6.10±0.10Cd
表4 不同GA浓度处理下咖啡黄葵种子α-淀粉酶活性的变化

GA浓度(mg/L)α⁃淀粉酶活性[U/(g·min)]第1天第3天第5天第7天0(ck)3.55±0.34Cd6.51±0.40Dd14.93±0.13Aa4.83±0.07Aa18.35±0.31Aa15.96±0.32Bb7.45±0.16Cc3.71±0.10Bb58.24±0.21Aa16.87±0.07Aa8.24±0.23Bb3.17±0.11Cc107.35±0.19Bb16.12±0.29Bb6.61±0.06Dd3.25±0.14Cc506.82±0.24Bc15.09±0.09Cc6.30±0.16Dd3.20±0.09Cc1006.73±0.19Bc14.79±0.10Cc5.44±0.48Ee4.96±0.05Aa
3结论与讨论
赤霉素是一种重要植物激素,农业生产育苗时常作为外源物质处理以破除休种子休眠,提高种子发芽整齐度及发芽率等,特别是应用于休眠周期长、出芽不整齐类的种子。关于赤霉素对种子发芽影响的研究也颇多,大多研究结果表明,赤霉素可以提高植物种子发芽整齐度及发芽活力等[15-16]。
本研究结果表明,咖啡黄葵种子萌发除了受GA浓度的影响,还受GA作用时间长短的影响,低浓度的GA对发芽率(GR)、发芽势(GP)和发芽指数(GI)表现为显著促进作用,而高浓度GA处理表现为抑制作用,且持续高浓度处理,抑制作用增强;GA处理可明显缩短其发芽时间,至少缩短2 d。研究结果同孟春芬等[15]和黄开顺等[17]的一致,GA有缩短发芽时间的效果。本研究中,GA处理浓度为1~5 mg/L时其种子活力与发芽整齐度较好;而浓度为5~10 mg/L时促进胚根-胚轴生长效果较好,表明5 mg/L GA处理对咖啡黄葵种子萌发的综合影响效果最佳,这与孟春芬等[15]的研究结果不一致,可能是因为GA处理方法及种子来源不同。
已有研究表明,GA可提高种子萌发过程中α-淀粉酶活性,但未表明其作用时期[16]。本研究结果还发现,GA处理咖啡黄葵种子可在其萌发初期显著提高α-淀粉酶活性,促进其胚根-胚轴的生长和发育,且发芽中期促进作用尤为明显。GA可能是在咖啡黄葵发芽初期在转录水平触发α-淀粉酶基因表达,并在转录后水平提高α-淀粉酶活性,从而触发并促进淀粉水解途径(淀粉→糊精→麦芽糖→葡萄糖),淀粉大量分解为葡萄糖从储藏器官子叶运往胚处,以此在中后期促进种子发芽及促进胚根-胚轴的生长和发育。本研究结果对咖啡黄葵播种育苗有一定参考意义,但赤霉素处理对咖啡黄葵种子萌发过程中生理生化指标及其他酶的影响还待进一步研究。
[1]黄捷,陈晓斌,叶花兰,等.16份黄秋葵种质的ISSR分析[J].中国农学通报,2008,24(5):403-408.
[2]黄阿根,陈学好,高云中,等.黄秋葵的成分测定与分析[J].食品科学,2007,28(10):451-455.
[3]单承莺,马世宏,张卫明.保健蔬菜黄秋葵的应用价值与前景[J].中国野生植物资源,2012,31(2):68-71.
[4]刘东祥,叶花兰,刘国道.14个黄秋葵品系叶黄素和β-胡萝卜素产量比较试验[J].中国农学通报,2006,22(6):425-427.
[5]廖海兵,施湘君,刘婷,等.RP-HPLC法同时测定黄秋葵中3个黄酮苷的含量[J].药用分析杂志,2012,32(12):2 194-2 197.
[6]陈艳珍,宋新华.黄秋葵粉对衰老小鼠抗疲劳和免疫功能的影响[J].食品研究与开发,2012,33(10):170-172.
[7]朱一闻,方树远,徐天资,等.黄秋葵多糖抗小鼠运动性疲劳及其作用机理的研究[J].浙江中医药大学学报,2013,37(7):902-904.
[8]D Oppong-Sekyere,R Akromah,E Y Nyamah,et al.Evaluation of some okra (AbelmoschussppL.)germplasm in Ghana[J].African Journal of Plant Science,2012,6(5):166-178.
[9]李学智,徐志豪,董文其,等.设施栽培黄秋葵食用嫩荚的品质变化研究[J].浙江农业学报,2004,16(1):12-15.
[10]张悦,王秀峰,马艺荞,等.黄秋葵再生体系的建立及毛状根的诱导[J].安徽农业科学,2013,41(24):9 927-9 929.
[11]陈禅友,童莉.黄秋葵种子萌发生理特性分析[J].种子,2004,23(11):14-17.
[12]International Seed Testing Association (ISTA).International Rules for Seed Testing.Edition[S].2010:15.
[13]高荣岐,张春庆.种子生物学[M].北京:中国农业出版社,2009:169-226.
[14]王学奎,章文华,郝再彬,等.植物生理生化实验原理和技术[M].高等教育出版社,2006:174-176.
[15]孟春芬,严峻,曾涛,等.赤霉素对秋葵种子发芽的影响[J].种子,2012,31(11):100-102.
[16]顾振新,陈志刚,蒋振晖.赤霉素处理对糙米发芽力及其主要成分变化的影响[J].南京农业大学学报,2003,26(1):74-77.
[17]黄开顺,陈金艳,黄剑,等.赤霉素和浓硫酸对单面针种子萌发的影响[J].西部林业科学,2015,44(2):161-164.
Study on the Germination ofA.esculentusSeeds and theRelationship Between Germination andα-amylase
LIYan1,RUJiao1,JIYue1,YAOHongyan2,LUOChong1
2016-10-25
功能性保健植物明日叶的种苗繁育及优质高产栽培技术集成与示范(编号:黔科合NZ字[2012]3024号)。
李 燕(1990—),女,硕士研究生,主要从事植物生理生态方面的研究;E-mail:yudianersc@163.com。
罗 充(1970—),男,教授,硕士生导师,E-mail:gzluochong@sina.com。
10.16590/j.cnki.1001-4705.2017.03.080
S 649
A
1001-4705(2017)03-0080-04
