正交设计在峨眉金线莲组织培养中的应用
2017-12-01熊铁一
鲁 松,熊铁一
(1.四川省自然资源科学研究院,四川 成都 610015;2.峨眉山生物资源实验站,四川 峨眉山 614201)
正交设计在峨眉金线莲组织培养中的应用
鲁 松1,2,熊铁一1,2
(1.四川省自然资源科学研究院,四川 成都 610015;2.峨眉山生物资源实验站,四川 峨眉山 614201)
以野生峨眉金线莲的茎段腋芽为外植体,采用正交设计L16(45)对野生峨眉金线莲丛生芽诱导、生根的4个因素(基本培养基、6-BA、NAA、AC(活性炭))在4个水平上进行组织培养优化试验,以期建立完整、高效、廉价的培养体系。结果表明:基本培养基、不同激素浓度配比等因素对峨眉金线莲的分化、生根有着显著影响。外植体最佳消毒方案是75%酒精浸泡10s,0.1%的HgCl2浸泡消毒10min;峨眉金线莲最佳丛生芽诱导培养基为:MS+10%香蕉+6-BA3mg/L+NAA 0.5mg/L+AC 3g/L;最佳生根壮苗培养基为:1/2MS+10%土豆+NAA 2mg/L+6-BA 0.5mg/L+AC 3g/L。该体系对峨眉金线莲种质资源保护与开发利用具有一定的参考意义。
峨眉金线莲;正交设计;组织培养;茎段腋芽;无性繁殖
峨眉金线莲(Anoectochilus.roxburghiiK.Y.Lang.)隶属于兰科(Orchidaceae)开唇兰属(Anoectochilus)[1],是以峨眉山命名的峨眉地区特有种,与开唇兰属的其他种金线莲一道统称金线莲,别名金线兰、金丝草。金线莲在民间有“药中之王”的美誉,治疗范围广泛,多用于治疗小儿急惊风、高烧不退、肾炎、膀胱炎、高血压、糖尿病、心脏病、风湿性关节炎、肝脾病、肺痨肺病、咳嗽血虚、血热吐血、小儿发育不良、毒蛇咬伤等。金线莲除了具有较高的药用价值外,由于其金色或白色网状脉,还是观赏价值极高的室内观叶珍品[2]。由于该植物自然生态条件独特、繁殖率低、生长缓慢,加上虫类与鸟类嗜食,特别是由于价格昂贵,当地人们过度采挖,使金线莲野生资源日渐枯竭[3]。
许多研究表明,人工组织培养(简称“组培”)繁育的金线莲组培苗与野生金线莲同样具有很高的药用价值。顾慧芬等比较了金线莲组培苗与野生金线莲药材中多糖、氨基酸和总黄酮的含量[4],结果表明金线莲组培苗与台湾野生金线莲中多糖的含量相近,而广西种的多糖含量较低,组培苗与野生种的18种氨基酸组成相同含量相近,总氨基酸的含量组培苗远高于台湾地区和广西的野生种,总黄酮含量组培苗与野生植株的含量比较接近。李鸣等比较了野生、人工栽培与组织培养金线莲的药理作用[5],发现三种来源的金线莲在安定、镇痛剂抗炎效果上无显著差异,认为其药理作用基本相近。黄高凌等比较了大棚栽培和野生金线莲的粗蛋白、粗脂肪、总糖、维生素C、氨基酸、无机元素等成分的含量[6],结果表明,大棚栽培金线莲的含水量、维生素C、粗蛋白、粗脂肪和氨基酸含量较高,而灰分和总糖分含量则比野生植株低,刘润东等的结果与上述一致[7]。唐健等比较了野生金线莲与福建和台湾组培金线莲中水分、灰分、无机元素的含量[8],发现不同来源的金线莲的水分、灰分含量没有很大差异,但微量元素含量有较大差异。胡国海等的实验表明[9],野生与人工种植比较,其Fe、Mn、Zn、Co、Cu元素均比人工种植的高,而Cr元素含量人工种植比野生高,有害元素在人工种植和野生中的含量都很低或未检出。综上所述,通过组织培养方法进行金线莲野生资源的开发利用具有重要的实践意义。
目前金线莲的开发种类主要为常被称作福建金线莲的花叶开唇兰(A.roxburghii)、台湾开唇兰(A.formosanus),台湾开唇兰因其叶面具有白色网脉常被称为“台湾银线莲”。组织培养常见的有福建金线莲、台湾金线莲、滇越金线莲(A.chapaensis)、白马山地区金线莲等[10,11],但对峨眉金线莲的组织培养报道近乎空白。本文拟以正交法研究几种因素对峨眉金线莲组织培养体系构建的影响,拟建立人工快速繁殖(简称“快繁”)体系,为保护、开发和利用这一资源提供具有实用价值的资料。
1 材料与方法
1.1 实验材料
野生峨眉金线莲(AnoectochilusemeiensisK.Y.Lang.)于2014年7—8月采自四川省峨眉山海拔1000m的林区。
1.2 实验方法
消毒试验设计:选取健康粗壮、剪去叶片的野生峨眉金线莲茎段,在流水下用细毛刷刷洗干净(特别是根部),再用肥皂水振荡洗涤后流水冲洗2h,采用两因素三水平完全随机试验设计,设置75%酒精处理(时间10s、20s、30s)、0.1%的HgCl2处理(时间为8min、10min、15min)各3个水平,共9个处理。消毒完成后,剪成1—2cm只留一个腋芽的茎段,平铺于灭菌后的MS培养基上,每处理20瓶,每瓶10个茎段,每处理3个重复。统计两周内的污染率,四周后统计成活率。
丛生芽的诱导:试验选用L16(45)表进行正交实验设计,选择基本培养基、6-BA、NAA、活性炭(AC)四因素,浓度各设四水平(表1),共有16个试验组合。每组合接种10瓶,每瓶10个茎段,60天后统计丛生芽增殖数,计算增殖率。
生根壮苗:将健壮的丛生芽接种于生根壮苗培养基上,选择基本培养基、6-BA、NAA、活性炭(AC)四因素,浓度各设四水平(表2),共有16个试验组合,每组合接种10瓶,每瓶10个丛生芽,120天后取出植株洗净培养基后统计根数、叶片数、株高、单株重。丛生芽诱导、增殖及生根壮苗培养的培养条件都为光照16h/天,光强15—30μmol.m2/s,温度23±2℃。

表1 不同消毒处理对外植体灭菌效果的影响
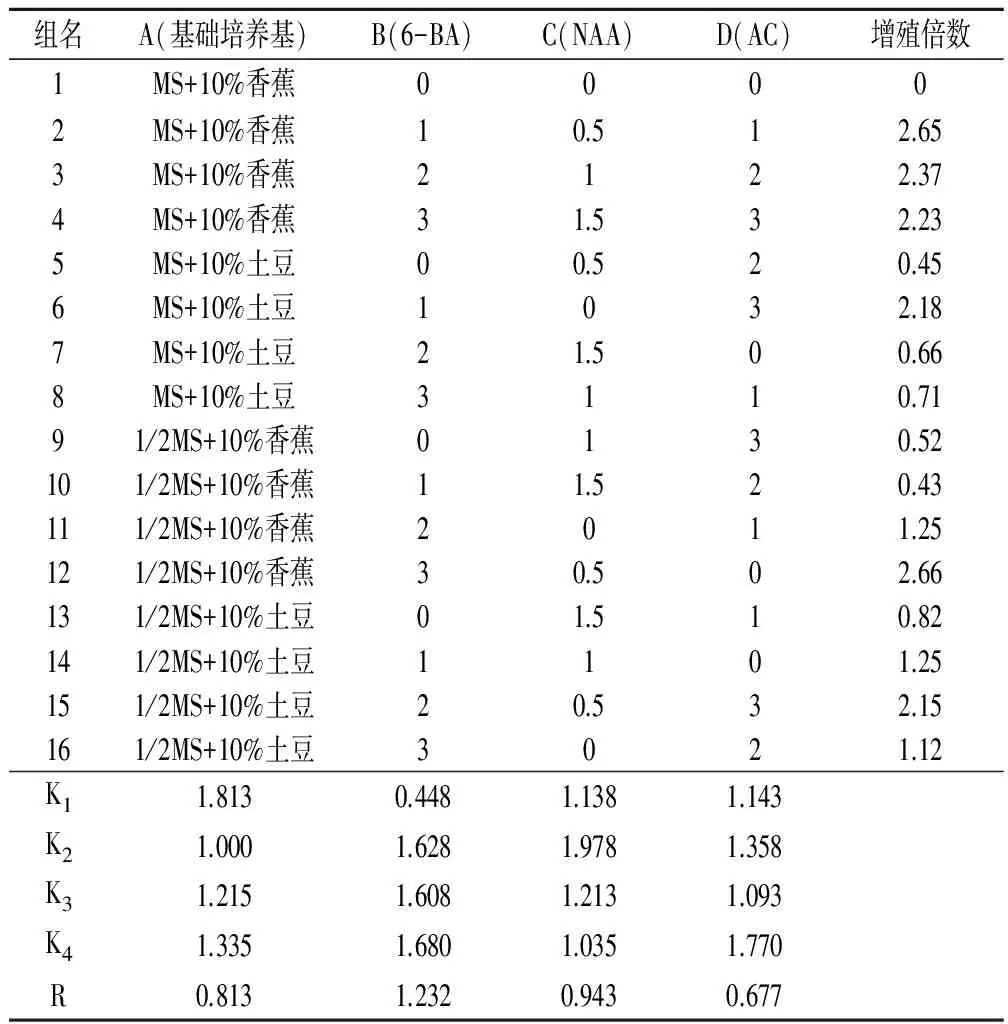
表2 丛生芽诱导正交试验结果
1.3 数据统计分析
本文采用SPSS22.0数据分析系统和Microsoft Excel对试验观察数据资料进行方差分析、LSD多重比较等。结果统计中所涉及的测定项目计算公式为:污染率=污染的外植体数/接种的外植体数×100%;成活率=存活的外植体数/接种的外植体数×100%;增殖倍数=丛生芽个数/接种的外植体数;生根数=每处理生根的总数/诱导出根的试管苗数;叶片数=叶片总数/接种的丛生芽数×100%。
2 实验结果
2.1 不同灭菌处理对外植体灭菌效果的影响
峨眉金线莲茎段灭菌试验结果表明(表1),75%酒精灭菌时间10s、20s、30s处理下茎段的污染率和成活率皆有显著差异,而0.1%的HgCl2灭菌时间(8min、10min、15min)对污染率和成活率的影响也达到显著水平,0.1%的HgCl210min和15min处理下的污染率差异不明显。综合分析表明,处理2和处理3的灭菌效果较好,考虑到成活率峨眉金线莲茎段的灭菌效果以75%酒精灭菌10s、0.1%的HgCl2灭菌10min最好,外植体污染率为22%,成活率达55.32%。
2.2 不同培养基种类对丛生芽诱导的影响
我们将峨眉金线莲茎段置入丛生芽诱导、增殖培养基后,约1—2周时间茎段腋芽处开始分化出乳白色的不定芽,4周后可见明显的丛生芽。从表2可见,不同组合对金线莲茎芽的诱导有不同效果,其中未添加激素的培养基中芽体可继续生长,不分化为不定芽,4—5个月后可长成高8cm以上的完整植株。此外,由极差分析可知,6-BA和NAA对丛生芽的增殖影响显著,其中6-BA影响最大,4种因素作用强弱依次是:6-BAgt;NAAgt;基础培养基gt;AC。在本实验设计范围内得到的峨眉金线莲丛生芽诱导和增殖的最佳组合为A1B4C2D4,即MS+10%香蕉+6-BA 3mg/L+NAA0.5mg/L+AC 3g/L。我们把灭菌茎段接种于组合A1B4C2D4的培养基后,4周后原球茎的平均增值率达到2.71,比正交实验中的任何一个组合都高,从而证实了正交筛选的结果。
2.3 不同培养基种类对生根壮苗的影响
我们对经继代进行增殖,长度大于2cm的丛生芽置入生根壮苗培养基,通过分析不同组合的促根结果可知(表3),不同组合对生根和苗的生长影响很大。
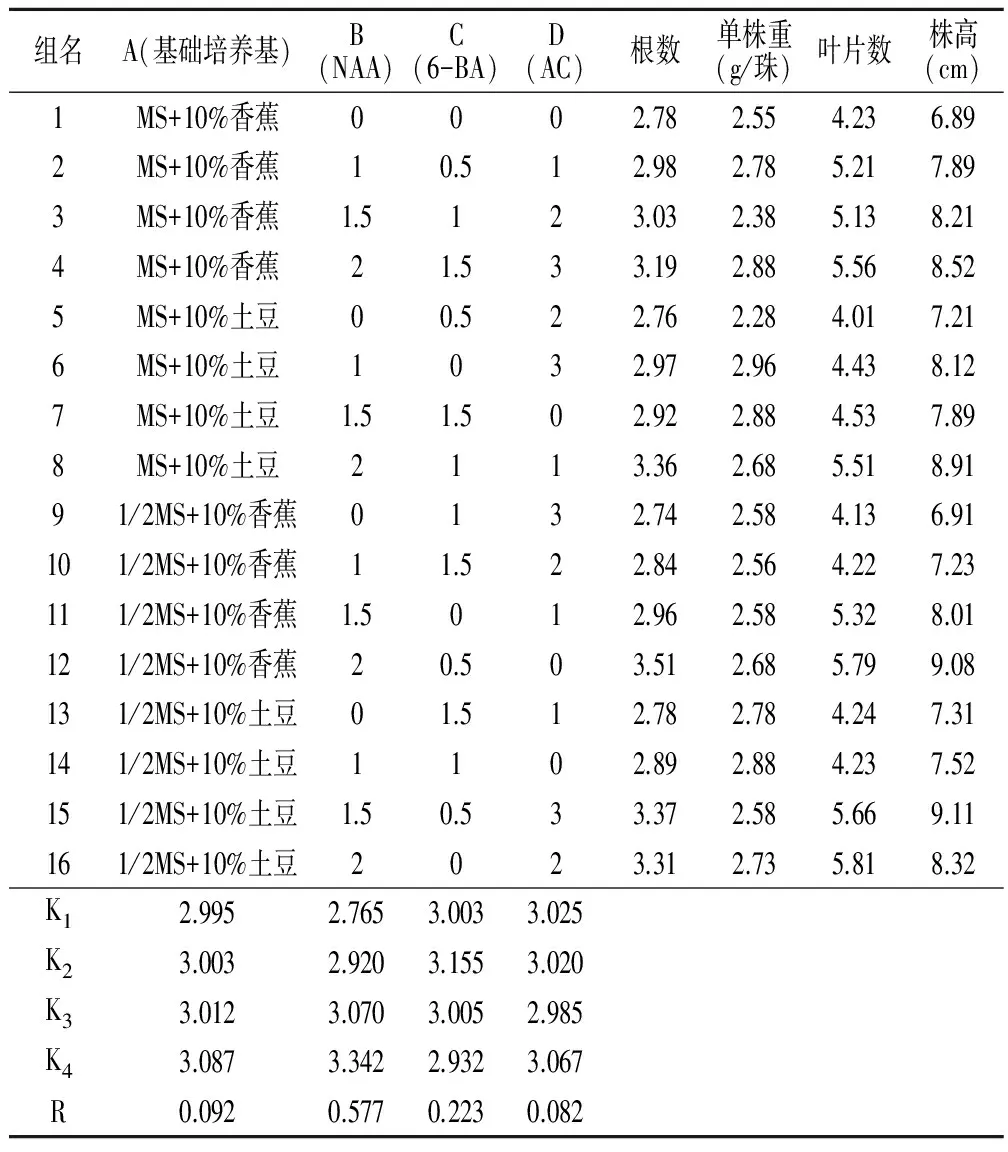
表3 生根壮苗正交试验结果
就本实验设计而言,由极差分析可知,NAA对生根及苗的生长影响显著,4种因素作用强弱依次是:NAAgt;6-BAgt;基础培养基gt;AC。在本实验设计范围内得到的峨眉金线莲生根壮苗的最佳组合为A4B4C2D4,即1/2MS+10%土豆+NAA 2mg/L+6-BA 0.5mg/L+AC 3g/L。我们将2—3cm高的丛生芽100株,每株10瓶置入A4B4C2D4组合配制的培养基中,经过150天的培养统计,平均生根率3.46、平均叶数5.83、平均株重2.89g、平均株高9.10cm,整体长势比正交设计中的组合高,证实了正交筛选的结果。
3 讨论
以带腋芽的金线莲茎段作为外植体进行组织培养实验时消毒常用70%—75%的酒精与0.1%—0.2%的HgCl2的组合。由于金线莲含水量较高,高浓度酒精易造成茎段脱水而影响芽体的成活与生长,本实验的结果也证明了这点。在75%酒精处理20s和30s的组合中,成活率显著低于短时间的处理。研究证明,在0.1—0.2%的HgCl26—15min处理范围内茎段芽体的灭菌效果与成活率最好。罗晓青、宋丽莎在贵州金线莲的实验中证明,以0.1%的HgCl210min的消毒处理为宜[12,13];刘丹的实验证明,在福建金线莲中以0.1%的HgCl2处理10min[14],污染率可低至12.22%,成活率却能达到82.22%;李艳冬等研究显示,在福建金线莲中用0.1%的HgCl2处理8—10min的效果最佳[15];阚世超等以0.15%的HgCl2处理云南金线莲4min就可达到较好的效果[16]。本实验中用0.1%的HgCl2处理10min可达到有效效果,污染率低至22%,而成活率可达55.32%。有部分研究表明,添加表面活性剂吐温-20可降低处理时间,如戴小英等加入吐温-20后发现灭菌处理5—6min就可有效对外植体进行消毒[17]。由于金线莲在野外常匍匐生长,因此近腐殖质的部分灭菌难度较大。实验表明,金线莲顶部茎段采用0.1%的HgCl2消毒9min可达到最佳效果,而基部匍匐茎段则需要13min。除了常用的金线莲茎段以外,也有实验曾采用叶片和种子作为外植体,表明叶片不适合作为外植体[18]。以福建金线莲和广东金线莲种子为外植体的实验表明,虽然蒴果中种子含量高、易萌发,但长成的植株纤弱,需连续几次继代才可达到工厂化母苗的要求,周期时间太长,推广意义不大[19,20]。
金线莲增殖一般可分为原球茎和丛生芽两种方式,以种子为外植体的常先经过原球茎诱导,而以茎段为外植体的则常选择丛生芽诱导的增殖方式[21]。常用的培养基多为MS或1/2MS等。MS为金线莲丛生芽提供了较丰富的有效成分。但有实验认为,MS中大量元素的浓度过高会影响丛生芽的生长与壮苗,而推荐以降低氮源等大量元素浓度的1/2MS或1/4MS为培养基[22],但也有部分文献认为MS培养基的增殖效果更好[21],本实验的结果也证实了这点。天然添加物的加入往往会影响丛生芽的生长,本实验选择了香蕉汁、马铃薯汁与活性炭,实验结果显示香蕉汁在对峨眉金线莲丛生芽诱导上有多种促进作用,效果强于添加马铃薯汁,表现在丛生芽较健壮,且能促进叶片发育,这与欧阳凡等在铁皮石斛上的结果相似[23]。活性炭的加入可吸附瓶苗的代谢废物以改善生长环境,可促进丛生芽增殖,本实验得到了证实。丛生芽诱导中常用的生长调节物为6-BA、NAA、ZT、KT、IBA、2,4-D等[12,13],发现上述激素在各自的实验中都有明显影响,但常用的仍是6-BA和NAA的组合。有报道显示,在诱导培养时,6-BA的最佳浓度为0.2mg/L,高于该浓度则有一定下降。但本实验的结果显示,峨眉金线莲的茎段在丛生芽的诱导和增殖时对6-BA有一定的耐受力,在6-BA 3.0mg/L时增殖效果最好,增殖倍率最高,这与周伟香等人的结果一致[24]。陈永快等的实验结果表明,福建金线莲在6-BA 4mg/L、台湾金线莲在5mg/L时增殖效果最佳[25]。由此可见,不同物种、不同产地对生长调节物的最佳适应剂量差异较大。此外,郭捷华在白马山金线莲组培实验中发现,金线莲中部和基部茎段的增殖效果好于顶芽,中部茎段诱导的芽体质量好于基部茎段[11]。
在金线莲产业化生产中,幼苗根系的粗细和发达程度大大影响后续土壤栽培的成活率与产量,而在生产中为了降低成本将生根和壮苗环节常合并在一起。众多实验表明,1/2MS培养基有利于生根[26,27],即降低了无机盐的浓度,而不同的有机添加物在生根和壮苗实验用也常利用。因此,本实验除验证了MS培养基外还验证了低盐培养基下的生根状况,并附加不同浓度的NAA和6-BA诱导根的形成,同时添加了不同的天然添加物。在本实验中,NAA对峨眉金线莲的生根和壮苗影响显著,而MS与1/2MS培养基之间在本实验中并未显现出显著差异,6-BA含量的变化也未对峨眉金线莲的生根有显著影响,这与陈永快等实验结果一致[25]。此外,活性炭在生根和壮苗环节具有吸附植物体分泌的酚类等有害物质,缓慢释放激素,防止褐化的发生,为根系提供暗环境的作用。但在本试验中,活性炭含量变化对生根壮苗并未显现出显著影响。
[1]中国科学院中国植物志编辑委员会.中国植物志(第17卷)[M].北京:科学出版社,2000∶223.
[2]范子南,肖华山,范晓红,等.金线莲的组织培养研究[J].福建师范大学学报(自然科学版),1997,13(2)∶82-87.
[3]于雪梅,郭顺星.金线莲与内生真菌共生培养体系的建立[J].中国中药杂志,2000,25(2)∶81.
[4]顾慧芬,庄意丽,梅其春.野生与组培金线莲有效成分的比较及RAPD分析[J].中成药,2011,33(8)∶1364-1367.
[5]李鸣,邹丹.3种不同来源金线莲的药理研究[J].海峡药学,1995,7(4)∶12-14.
[6]黄高凌,蔡慧农,林顺长,等.金线莲的大棚栽培及其重要成分分析[J].集美大学学报(自然科学版),2012,17(2)∶96-100.
[7]刘润东,郭文杰,林忠宁,等.金线莲组织培养及营养成分的分析研究[J].广西农业科学,2006,37(5)∶506-509.
[8]唐健,邓元荣,卓仪荣.金线莲的药理活性研究进展[J].海峡药学,2008,20(12)∶77-79.
[9]胡国海,李洪潮,解成骏.云南文山人工种植金线莲中的微量元素含量测定[J].安徽农业科学,2010,38(14)∶7294-7295.
[10]张铁,田雪琪,李彬.滇越金线莲快速繁殖技术研究[J].文山师范高等专科学校学报,2006,19(3)∶110-114.
[11]郭捷华.白马山金线莲组培快繁关键技术研究及其药用成分比较[D].福州:福建农林大学硕士学位论文,2015.
[12]罗晓青,蒙秋伊,查兰松,等.兴仁金线莲丛生芽诱导增殖研究[J].安徽农业科学,2012,(22)∶11231-11232.
[13]宋丽莎,邓伟,文治瑞,等.荔波野生金线莲芽的诱导及增殖[J].贵州农业科学,2011,39(10)∶43-46.
[14]刘丹.福建戴云山金线莲工厂化育苗关键性技术研究[D].福州:福建农林大学园艺学院硕士学位论文,2013.
[15]李艳冬,叶红霞,陈丽萍,等.金线莲组培快繁技术体系的研究[J].江西农业学报,2013,254)∶52-54.
[16]阚世超,张明生,李花.金线莲丛生芽诱导研究[J].安徽农业科学,2009,37(3)∶981-982.
[17]戴小英,朱恒,宋晓琛,等.金线莲离体快繁及植株再生[J].江西林业科技,2012,(1)∶25-27.
[18]王雅英,林小华,洪璇.金线莲外植体筛选及愈伤组织诱导研究[J].亚热带植物科学,2011,40(3)∶41-43.
[19]罗安雄,孟志霞,陈晓梅,等.福建金线莲种子萌发及幼苗培养研究[J].中国医学,2012,47(15)∶1199-1203.
[20]伍成厚,冯毅敏,贺漫媚,等.金线莲种子培养的研究[J].中国野生植物资源,2008,27(1)∶47-50.
[21]杨柏云,高荫榆,李春华,等.金线莲原球茎的诱导与快速繁殖[J].安徽农业科学,2008,36(10)∶3999-4001.
[22]魏翠华,谢宇,秦建彬,等.金线莲高产优质栽培技术[J].福建农业科技,2012,(6)∶31-33.
[23]欧阳凡,董文宾,付瑜,等.铁皮石斛茎段快繁技术的研究[J].生物技术通报,2016,6,32(3)∶63-67.
[24]周伟香,龚宁,李光.花叶开唇兰种子非共生萌发的研究[J].中草药,2007,38(4)∶610-613.
[25]陈永快,林一心,邹晖.福建金线莲和台湾金线莲的组培快繁技术[J].现代园艺,2008,(10)∶9-12.
[26]程云清,刘剑锋,王占武,等.鞍杂杨组培快繁技术[J].东北林业大学学报,2011,39(2)∶11-12,20.
[27]邓建军,李芳东,乔杰,等.白花泡桐优树试管嫁接幼化及组培快繁技术研究[J].林业科学研究,2011,24(5)∶646-650.
ApplicationofOrthogonalDesigninTissueCultureofAnoectochilusemeiensisK.Y.Lang.
LU Song1,2,XIONG Tie-yi1,2
(1.Sichuan Academy of Natural Resource Sciences,Chengdu 610015,China; 2.Emei Mountain Biotic Resource Experimental Station,Emei 614201,China)
The genusAnoectochilus(Orchidaceae) was a perennial herb,which comprised more than 40 species that were widespread throughout tropical regions.Several species of this genus were used in Chinese folk medicines,such as A.roxburghii,A.formosanusand A.koshunensis.AnoectochilusemeiensisK.Y.Lang.was an endangered medicinal plant in Emei Mountain,also called “king medicine”,because of its diverse pharmacological effects such as the treatment of hypertension,fever,liver,and lung disease.With the exploitation and the deterioration of the natural conditions,its wild resources were on the brink of exhaustion.In this experiment,the wild plants ofAnoectochilusemeiensisfrom Emei Mountain in Sichuan,were used as the materials for the optimizing studies of industrial-scale micropropagation.Culture in Vitro and propagation were carried out with stems segments and axillary buds ofAnoectochilusemeiensis.The system was optimized by using orthogonal design with 4 levels of 5 factors (Medium,6-BA、NAA、AC(activated carbon)).The result showed that the best explants disinfection solution was to immerse 10s in 75% alcohol plus 0.1%HgCl210min,MS+10% banana+6-BA 3mg/L+NAA 0.5mg/L+AC 3g/L was the most suitable for bud induction and the optimum for rooting and seedling was 1/2MS+10% potato juice+NAA 2mg/L+6-BA 0.5mg/L+AC 3g/L.This system could provide theoretical help for the protection and utilization ofAnoectochilusemeiensis.
AnoectochilusemeiensisK.Y.Lang.;orthogonal design;tissue culture;stem segment with axillary buds;asexual propagation
10.3969/j.issn.1005-8141.2017.05.017
Q945.52;Q949.71+8.43
A
1005-8141(2017)05-0595-04
2017-03-21;
2017-04-16
国家自然科学基金项目(编号:31470479);四川省基本科研业务费项目资助。
及通讯作者简介:鲁松(1979-),男,山东省泰安人,副研究员,主要从事珍稀濒危植物保护研究。
