CD68、CD133和TGF-β在肝癌及癌旁组织中的表达及其在临床转归中的意义
2017-12-01宋晨鑫丛明华邹宝华于雷
宋晨鑫 丛明华 邹宝华 于雷
CD68、CD133和TGF-β在肝癌及癌旁组织中的表达及其在临床转归中的意义
宋晨鑫 丛明华 邹宝华 于雷
目的研究CD68+肿瘤相关巨噬细胞(TAMs)、CD133+肿瘤干细胞(CSCs)及TGF-β在肝癌及癌旁组织中的表达及其在临床转归中的意义。方法选取2014年1月至2016年1月在中国医学科学院肿瘤医院综合科进行手术治疗的89例肝癌患者为研究对象。收集患者手术标本,进行免疫组化染色(IHC),采用半定量积分法对免疫组化分析正常、癌及癌旁组织中CD68+肿瘤相关巨噬细胞(TAMs)、CD133+肿瘤干细胞(CSCs)及TGF-β表达情况,结合随访资料对其意义进行分析,其表达水平与临床病例资料之间关系采用c2检验或Fisher确切概率法检验或Wilcoxon秩和检验,相关性分析采用Spearman检验。结果CD68+TAMs细胞在癌组织中阳性率为59.55﹪,癌旁组织为37.08﹪,差异具有统计学意义(Z=-3.182,P=0.001);CD133+细胞在癌组织中阳性率为52.81﹪,癌旁组织中为57.30﹪,表达差异无统计学意义(Z=- 0.558,P=0.557);TGF-β在癌组织阳性率为70.79﹪,癌旁组织中为56.18﹪,差异具有统计学意义(Z=-2.306,P=0.021)。CD68、CD133、TGF-β表达水平与患者肿瘤分化程度及淋巴结转移情况密切相关,差异具有统计学意义(P<0.05);TGF-β表达水平与Child-Pugh分级相关,差异具有统计学意义(c2=10.930,P=0.001)。HCC癌组织中CD68与TGF-β表达,CD133与 TGF-β 表达之间存在正相关关系,相关系数分别为(r=0.579、0.611,P=0.026、0.020)。Kaplan-Meier生存曲线分析可知,3种分子均无表达的患者中位生存时间最长,为23.4个月,3种分子均有表达的患者中位生存期最短,仅为6.3个月(P=0.021)。结论CD68+TAMs细胞与CD133+CSCs细胞之间存在相关性,二者之间具体机制有待进一步研究,以便为肝细胞癌(HCC)治疗提供有力依据。
肝细胞癌; CD68; CD133; 转化生长因子β
肝细胞癌(hepatocellular carcinoma,HCC)是一种严重威胁我国人民群众生命健康的恶性肿瘤。据统计,我国肝癌年新发病例及死亡病例数分别为36.2万例和31.6万例,分别占全球统计数据的50.5﹪和51.4﹪[1-2]。当前,肝癌的主要治疗方案仍是肝切除术及肝移植术,但两者术后复发率始终居高不下,5年复发率分别可达70﹪和15﹪以上,使得肝癌患者总体生存情况较差。因此,研究肝癌复发、转移的机制,找出新的治疗靶点是最终克服肝癌的根本之道。肿瘤干细胞(cancer stem cells,CSCs)具有自我更新,无限增殖、多向分化和高成瘤性的特征,与肿瘤的起源、转移、耐药及复发密切相关[3]。CD133是肿瘤干细胞的重要表面标志物,通过测量其表达水平可以评估肝癌患者的预后[4]。除肿瘤干细胞的作用外,肿瘤的发生、发展和演进离不开肿瘤微环境的影响,其中各类炎症细胞的浸润和活化,各类炎症因子的释放发挥了重要作用,也和肿瘤干细胞之间存在密切关系[5-6]。肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)是一类在肿瘤微环境中具有重要地位的免疫细胞,能够合成并释放多种细胞因子,参与了肿瘤发生演进的整个过程,表达水平和功能状态是肿瘤预后的重要标志[7]。本研究拟通过研究肝癌患者组织标本中CSCs、TAMs及相关细胞因子表达水平来分析其间关系,并结合随访资料研究两种细胞对患者预后的影响。
资料与方法
一、一般资料
(一)病例资料
选取自2014年1月至2016年1月在中国医学科学院肿瘤医院综合科进行手术治疗的89例肝癌患者为研究对象。男51例,女38例,年龄28 ~66岁,中位年龄(57±8)岁;肿瘤单发37例,多发52例;肿瘤最大直径≤5 cm者54例,>5 cm者35例;Child-Pugh分级A级50例,B级39例。本研究符合医学伦理标准,经我院伦理委员会批准,并在其监督下进行,患者及家属签署书面知情同意意见(伦理编号为ZZL2013101789)。
(二)纳入及排除标准
1.纳入标准:(1)所有患者症状、体征及影像学、病理学检查结果符合肝癌诊断标准[8];(2)癌肿局限于一叶或两叶,肝功能代偿良好;(3)心、肺、肾功能良好,无明显器官功能衰竭;(4)术前未经放射治疗、化疗或其他免疫、生物治疗。
2.排除标准:(1)同时伴有其他组织或系统恶性肿瘤;(2)患者肝功能Child-Pugh分级为C级以上或存在肝外转移。
(三)试剂
即用型羊血清封闭液、即用型兔抗多克隆转化生长因子-β(transforming growth factor-β,TGF-β)单克隆抗体、羊抗小鼠或抗兔IgG抗体及全套免疫组化试剂盒均购自武汉博士德公司,小鼠抗人CD133单克隆抗体购自美国Abcam公司,显微镜购自德国Leica公司。病理组织包埋及切片由本院病理科技师进行,二甲苯、酒精、水浴锅、微波炉、烤箱及冰箱等常规试剂或仪器由病理科提供。
二、研究方法
1.免疫组化染色(IHC):组织标本收集后立即使用PBS溶液(pH 7.4)冲洗干净,之后使用4﹪多聚甲醛固定;常规脱水、透明、置蜡,切片(厚度5 μm);烤片过夜后二甲苯脱蜡,梯度乙醇水化。使用柠檬酸溶液于高压下进行抗原热修复,3﹪H2O2中浸泡10 min阻断内源性过氧化物酶;羊血清封闭后滴加的小鼠抗人CD68单克隆抗体、小鼠抗人CD133单克隆抗体稀释液(1 : 100)或兔抗人TGF-β单克隆抗体稀释液(1 : 50),4 ℃孵育过夜;室温下复温1 h后,滴加HRP标记的羊抗小鼠或抗兔IgG抗体,37 ℃孵育1 h;PBS洗后滴加DAB显色液(武汉博士德公司),镜下观察显色反应,PBS终止,苏木素复染,盐酸酒精分化,自来水返蓝;使用酒精、二甲苯脱水透明后树胶封片。以PBS溶液代替一抗作为阴性对照,阳性对照片由公司提供。结果判定:根据染色强度和(或)阳性细胞所占比例采用半定量积分法对免疫组化结果进行判定(因肿瘤干细胞数量少,CD133染色只考虑染色强度)[9]:光学显微镜高倍视野下(×200)随机选择3个视野,计数200个细胞;阳性细胞数<5﹪ 0分,5﹪~24﹪1分,25﹪~50﹪ 2分,51 ﹪~74﹪ 3分,≥75﹪ 4分 ;每张切片阳性细胞的着色强度按无着色0分,淡黄色1分,棕黄色2分,棕褐色3分。两项积分相加判定最终评分结果 :0 分阴性(-),1~2 分弱阳性(+),3~5 分中等阳性(++),6~7 分强阳性(+++)。每例均设有HE切片作对照观察。
2.患者随访:通过电话、QQ及微信等联系方式对患者进行随访,截止日期为2017年4月,随访频率为间隔3个月随访1次,连续2次无法联系定为失访。
三、统计学分析方法
使用SPSS22.0软件包对数据进行分析,CD68、CD133、TGF-β表达水平与临床病例资料之间关系采用c2检验或Fisher确切概率法检验或Wilcoxon秩和检验,相关性分析采用Spearman检验。以P<0.05为差异具有统计学意义。(56.18﹪)表达差异具有统计学意义(P<0.05,表1,图 1)。
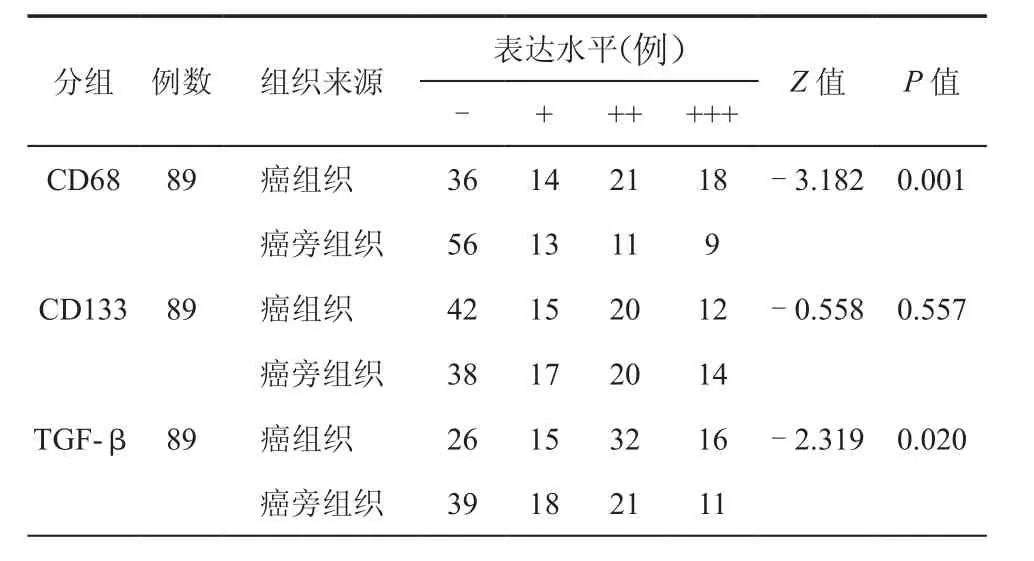
表1 CD68、CD133及TGF-β在HCC组织及癌旁组织中的表达
结 果
一、CD68、CD133、TGF-β在HCC组织中的表达
免疫组化结果显示,CD68于TAMs细胞的细胞膜、细胞质及细胞核中均有表达,阳性细胞呈巢状或弥漫状分布于癌组织及癌旁组织中,癌组织表达水平(59.55﹪)较高,与癌旁组织中表达(37.08﹪)差异具有统计学意义(P<0.05);CD133细胞内定位于CSCs的细胞膜及细胞质中,细胞核表达相对较少,阳性细胞散在分布于癌组织(52.81﹪)及癌旁组织(57.30﹪)中,表达差异无统计学意义(P>0.05);TGF-β细胞内定位于阳性细胞细胞膜、细胞质及细胞核,阳性细胞在癌组织及癌旁组织中均有分布,癌组织(70.79﹪)表达水平较高,与癌旁组织
二、CD68、CD133、TGF-β表达与临床病理参数的关系
结果分析显示,CD68、CD133、TGF-β表达水平与患者年龄、性别、病灶数量、肿瘤大小无关,差异无统计学意义(P>0.05),与患者肿瘤分化程度及淋巴结转移情况密切相关,差异具有统计学意义(P<0.05);CD68、CD133 表达水平与 Child-Pugh分级无相关,差异无统计学意义(P>0.05),TGF-β表达水平与Child-Puge分级相关,差异具有统计学意义(P<0.05,表 2)。
三、CD68、CD133、TGF-β 表达的相关性
统计结果显示,HCC癌组织中CD68与TGF-β表达,CD133与TGF-β表达之间存在正相关关系,分别为(r=0.579、0.611,P=0.026、0.020);CD68与CD133表达之间无相关关系(P> 0.05)。
四、CD68、CD133、TGF-β表达与患者生存期之间的关系
将患者资料录入软件,通过Kaplan-Meier生存曲线分析可知,3种分子均无表达的患者中位生存时间为23.4个月,单分子阳性患者中位生存时间为20.4个月,有2种分子表达的患者的中位生存时间为9.7个月,3种分子均有表达的患者中位生存期最短,仅为6.3个月,经Log-rank检验证实结果具有统计学意义(P=0.021,图 2)。
讨 论
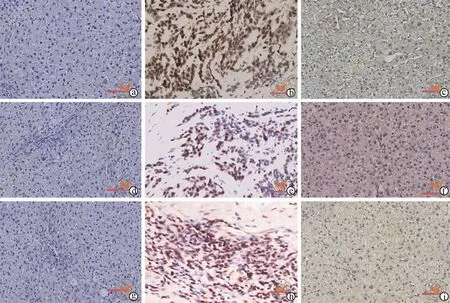
图1 Leica光学显微镜下观察CD68、CD133及TGF-β在正常、HCC及癌旁组织中的表达(×200)
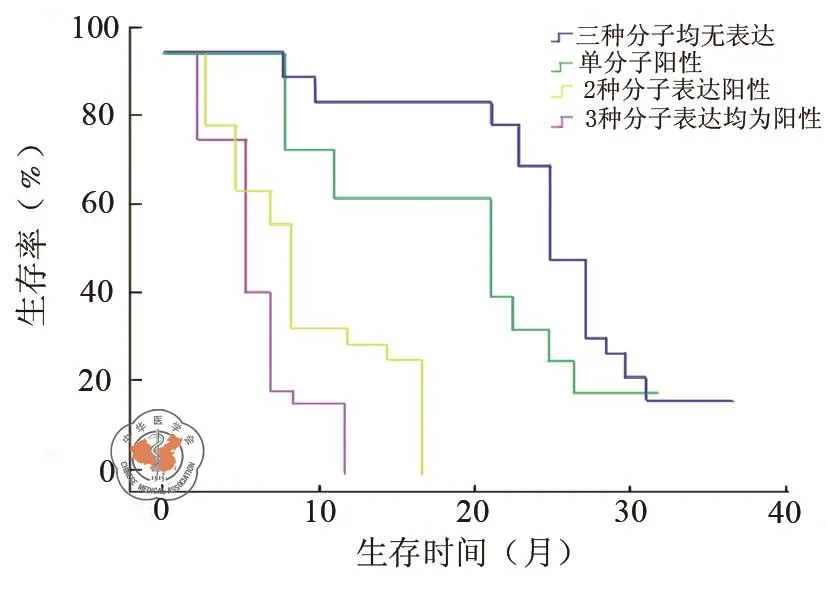
图2 CD68、CD133、TGF-β表达与患者生存期之间关系
癌组织由许多具有不同分化等级的细胞亚群所组成,这些细胞亚群有可能来自单一细胞克隆。肿瘤干细胞学说认为,少数具有自我更新、无限增殖和多向分化潜能的细胞在肿瘤的形成、发展、转移、耐药和复发中处于中心地位,这一理论已在乳腺癌、脑胶质瘤和结肠癌的相关研究中得到了证实[10]。CD133是CSCs的特异性标志物,能够影响CSCs的成瘤活性、分化潜能、侵袭潜能以及对化疗药物的敏感性。研究表明,CD133阳性的HCC细胞在动物模型中能够更快成瘤,荷瘤体积更大,并且经检测其瘤细胞内有关侵袭及上皮间质转化的相关基因较CD133阴性细胞均表达上调,因此CD133可以作为患者复发、转移的新型标志物[11]。You等[12]研究证实TGF-β可通过Smads信号通路在HCC细胞系中上调CD133表达,并增强肿瘤细胞成瘤活性。此外,体外实验证实通过siRNA下调HCC细胞系中CD133表达能够降低癌细胞的增殖活性和集落形成能力,促进细胞凋亡,因此CD133也可能成为HCC治疗的重要靶点[10]。
肿瘤微环境对其生物学功能的发挥有着重要的影响,TAMs是构成肿瘤微环境的重要一员。TAMs按生物学功能不同可以分为经典巨噬细胞(M1-like macrophages)和替代巨噬细胞(M2-like macrophages)两类,两者作用相反,前者具有抗感染、抗肿瘤的活性,而后者可抑制免疫反应,促进肿瘤发生和进展,两者可以相互转化[13]。一方面,M2型巨噬细胞处于肿瘤微环境中多种细胞因子的调控之下,另一方面又可以通过分泌TGF-β、IL-10等多种因子参与肿瘤细胞的生物学功能发挥以及肿瘤血管的发生、发育。陈利军等[14]研究表明在HCC组织中CD68+TAMs密度越大,肿瘤细胞ki-67表达水平越高,说明其增殖活性越强,且随访资料统计结果表明患者生存时间也就越短。本研究中患者癌组织CD68+TAMs表达量远高于癌旁组织,且表达水平越高肿瘤细胞分化程度也就越差,淋巴道转移率也越高,患者生存期越短。
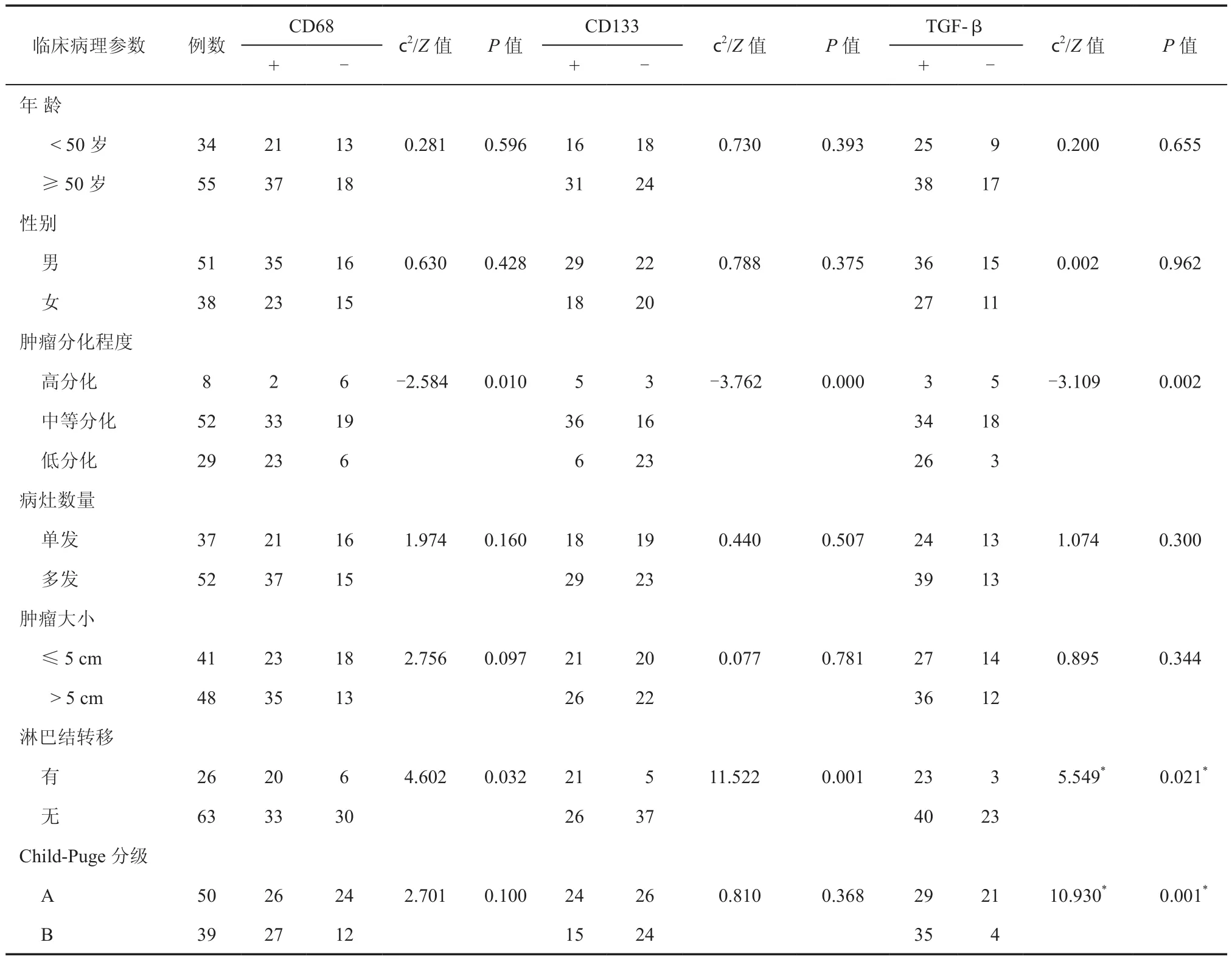
表2 CD68、CD133、TGF-β表达与临床病理参数的关系(例)
为了研究CD68+TAMs以上功能的实现是否与HCC中CSCs细胞有关,Fan等[15]考察了HCC肿瘤组织中TAMs细胞数量与CSCs细胞密度之间的关系,结果发现二者存在正相关性,且细胞学实验表明TAMs细胞数量越多,TGF-β水平越高,可以使CD133启动子区甲基化而表达上调,进而增强CSCs的侵袭能力。本研究通过免疫组化实验探讨了两者在组织表达中相关性,结果显示两者之间并不存在直接的相关关系,但是TAMs与CSCs均与HCC组织中TGF-β表达水平存在相关关系,而且随着三种分子表达率的增加,患者生存时间明显缩短,因此推测TAMs有可能通过分泌TGF-β作用于CSCs。然而,也有研究认为TGF-β与HCC组织中的CSCs之间存在的是负相关关系,前者可以能够减少CD133阳性细胞的数量、降低其密度,抑制CSCs干性基因表达[16]。对于这些不同结论,本研究认为其机制仍有待进一步探讨,特别是TGF-β在何种条件下展现何种生物学功能有待进一步研究来明确。
综上所述,CD68+TAMs细胞与CD133+CSCs细胞之间存在相关性,未来将进一步进行深入实验以找出二者相互作用的具体机制,以便为HCC治疗提供有力依据。
1 赫捷. 2013年中国恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2017,26(1):1-7.
2 魏矿荣, 彭侠彪, 梁智恒, 等. 全球肝癌流行概况[J]. 中国肿瘤, 2015,24(8):621-630.
3 Medema JP. Cancer stem cells: the challenges ahead[J]. Nat Cell Biol,2013, 15(4):338-344.
4 张华, 李苏宜. CD133与肿瘤干细胞研究进展[J]. 癌症, 2010,29(3):259-264.
5 黄波. 肿瘤微环境中免疫与炎症的调节[J]. 中国肿瘤生物治疗杂志,2012, 19(2):111-115.
6 喻杨, 王喻义, 王乙钦, 等. 肿瘤干细胞与肿瘤微环境相互作用的研究进展[J]. 华西医学, 2015 (9):1784-1788.
7 贺璐璐, 张红新, 陈奎生. 肿瘤相关巨噬细胞在肿瘤微环境中的相互作用研究进展[J]. 河南大学学报(医学版), 2016, 35(4):294-300.
8 杨秉辉. 原发性肝癌的临床诊断与分期标准[J]. 肿瘤防治研究,2002, 29(1):83.
9 刘莉, 陆远, 王媛, 等. EGFR、HER2、CXCR4在非小细胞肺癌中的表达及临床意义[J]. 现代生物医学进展, 2014, 14(6):1069-1073.
10 牛坚, 朱乐乐, 王月, 等. 下调CD133表达对肝癌细胞恶性生物学行为的影响[J]. 中国普通外科杂志, 2016, 25(1):77-82.
11 姚若全. CD133在肝癌干细胞中的表达及作用[D]. 长沙: 中南大学,2013 .
12 You H, Ding W, Rountree CB. Epigenetic regulation of cancer stem cell marker CD133 by transforming growth factor-beta[J]. Hepatology,2010, 51(5):1635-1644.
13 Montana G, Lampiasi N. Substance P induces HO-1 expression in RAW 264.7 cells promoting Switch towards M2-Like macrophages[J].PLoS One, 2016, 11(12):e0167420.
14 陈利君, 陈静琦, 曾波航. 肝癌组织中CD68+肿瘤相关巨噬细胞数量与Ki-67蛋白表达及原发性肝癌预后的关系[J]. 肿瘤防治研究, 2016,43(9):774-778.
15 Fan QM, Jing YY, Yu GF, et al. Tumor-associated macrophages promote cancer stem cell-like properties via transforming growth factor-beta1-induced epithelial-mesenchymal transition in hepatocellular carcinoma[J]. Cancer Lett, 2014, 352(2):160-168.
16 刘兰兰, 杨兆娟, 邹飞雁, 等. 转化生长因子β1对肝癌细胞干性表型的调节作用[J]. 肿瘤, 2012, 32(4):227-233.
2017-06-14)
(本文编辑:陈媛媛)
宋晨鑫,丛明华,邹宝华,等. CD68、CD133和TGF-β在肝癌及癌旁组织中的表达及其在临床转归中的意义[J/CD].中华细胞与干细胞杂志(电子版),2017,7(5):291-296.
Expression and clinical significance of CD68, CD133 and TGF-β in hepatocellular carcinoma and adjacent normal tissues
Song Chenxin, Cong Minghua, Zou Baohua, Yu Lei. General Department, National Cancer Center/Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100021,China
Yu Lei,Email:songchenxin1@qq.com
ObjectiveTo study the expression of CD68+tumor-associated macrophages(TAMs), CD133+cancer stem cells (CSCs) and TGF-β in hepatocellular carcinoma (HCC) and correlation with the prognosis of patients.Methods89 patients with HCC, who underwent surgery at our center from Jan 2014 to Jan 2016, were enrolled in this study. The tissue samples were processed by IHC to analyze the expression of CD68+TAMs, CD133+CSCs and TGF-β by semi-quantative scoring methods. The data were further interpreted with the follow-up information of patients, and c2, Fisher or Wilcoxon rank sum test was used to analyze the relation between the expression of CD68+TAMs, CD133+CSCs and TGF-β and the follow-up information of patients. The correlation of CD68+TAMs, CD133+CSCs and TGF-β with the survival of HCC patients was analyzed by the Spearman test.ResultsThe tumors had significantly higher levels of CD68+TAMs (59.55﹪) and TGF-β (70.79﹪) expression than their adjacent normal tissues (37.08﹪ and 56.18﹪) respectively(Z=-3.182,P=0.001,Z=-2.306,P=0.021) . No significant difference was found in the CD133+CSCs expression levels between the tumors (52.81﹪) and their adjacent normal tissues (57.30﹪)(Z=-0.558,P=0.557). The expression levels of CD68, CD133 and TGF-β were positively correlated with the degree of tumor differentiation and lymphatic metastases (P<0.05). The TGF-β expression levels were positively correlated with the Child-Pugh scores (c2=10.930,P=0.001). In the HCC tissue, positive correlations were found between the CD68 and TGF-β levels (r=0.579,P<0.05), and the CD133 and TGF-β levels (r=0.611,P<0.05), respectively. Patients with negative expression of all the three molecules had the longest survival time, which was 23.4 months, and patients with positive expression of all the three molecules had the shortest survival time, which was 6.3 months as analyzed by Kaplan-Meier assay.ConclusionCD68+TAMs may influence CD133+CSCs, and further study is needed to elaborate the possible mechanism for the treatment of HCC in clinic.
Hepatocellular carcinoma; CD68; CD133; Transforming growth factor beta
10.3877/cma.j.issn.2095-1221.2017.05.007
100021 北京,国家肿瘤中心/中国医学科学院肿瘤医院综合科
于雷,Email:songchenxin1@qq.com
