不同注射途径的脂肪间充质干细胞对大鼠肠炎疗效的实验研究
2017-12-01付正伟张振宇葛海燕
付正伟 张振宇 葛海燕
不同注射途径的脂肪间充质干细胞对大鼠肠炎疗效的实验研究
付正伟 张振宇 葛海燕
目的探讨脂肪间充质干细胞(ADMSCs)腹腔及静脉注射对三硝基苯磺酸(TNBS)诱导肠炎疗效的影响。方法将32只大鼠完全随机分成正常组、腹腔注射组、静脉注射组及模型组,每组8只。用TNBS诱导炎症性肠病(IBD)动物模型,腹腔及静脉注入ADMSCs,记录大鼠的疾病活动指数(DAI)、观察结肠宏观损伤及微观变化、测定结肠的髓过氧化物酶(MPO)活性、检测结肠Ki-67+细胞的表达、比较血液中IL-1β、TNF-α浓度及结肠TGF-β、IL-6、IL-17A、IL-10的基因表达水平。采用单因素方差分析及独立t检验进行统计学分析。结果ADMSCs腹腔注射组(98.05±0.63)g高于静脉注射组 [(94.32 ± 0.48)g,t=12.281,P=0.000],同时腹腔注射组DAI评分1.71±0.75低于静脉注射组3.57 ± 0.97,(t=-3.980,P=0.002)。另外发现腹腔注射组结肠组织内髓过氧化物酶MPO浓度(95.75±5.52)U/g低于静脉注射组(74.37±5.12)U/g,(t=-7.513,P=0.000),腹腔注射组结肠病理评分2.14 ± 0.69低于静脉注射组3.57±0.76,(t=-3.612,P=0.004)。结肠免疫荧光检查发现腹腔注射组比静脉注射组有更多的Ki-67+细胞。酶联免疫吸附测定(ELISA)发现腹腔注射组血浆中 IL-1β 的浓度(130.71 ± 7.08)pg/ml比静脉注射组(163 ± 9.09)pg/ml低,(t=-8.518,P=0.000),同样腹腔注射组血浆中TNF-α的浓度(201.71±6.75)pg/ml也比静脉注射组(242.28 ±8.30)pg/ml低,(t=-10.033,P=0.000)。此外,结肠组织实时定量聚合酶联反应(RT-qPCR)的结果显示腹腔注射组IL-6 mRNA的表达4.34±0.48比静脉注射低6.15 ± 1.05,(t=-4.147,P=0.001),腹 腔 注 射 组 IL-17A mRNA 的 表 达 2.61±0.53也 比 静脉 注 射 低3.57 ± 0.46,(t=-4.301,P=0.001)。然而,腹腔注射组 IL-10 mRNA 的表达水平 37.75 ± 4.46比静脉注射组高27.68±2.25,(t=5.327,P=0.001),腹腔注射组TGF-β mRNA的表达水平15.82 ± 0.99 也比静脉注射组高 11.97±2.25,(t=3.740,P=0.003)。结论ADMSCs腹腔注射优于静脉注射并可能成为ADMSCs治疗IBD的较好选择。
炎症性肠病; 脂肪间充质干细胞; 注射途径
炎症性肠病(in fl ammatory bowel disease,IBD)是一种病因不明的慢性肠道炎症性疾病,包括克罗恩病(Crohn's disease,CD)和溃疡性结肠炎(ulcerative colitis,UC)。该病主要发生在欧美,近年来亚洲呈指数增长[1-2]。发病病因及机制不明确,内科主要控制炎症活动及调节免疫紊乱[3],外科主要治疗并发症,但效果均不理想[4-5]。因此,人们期待找到治愈IBD的更好办法[6-11]。Drakos等[12]首次报道了1例非霍奇金淋巴瘤合并CD患者在接受同种异体造血干细胞后其CD得到改善,此后逐渐有血液疾病合并IBD患者行干细胞移植后IBD得到缓解的报道,这引起了学者的大量关注,开启了干细胞移植治疗IBD的研究。近年来,国内外形成了主要用造血干细胞及间充质干细胞来治疗IBD的研究并显示具有广阔的应用前景[13]。这些研究主要集中在疗效上,但干细胞注射方式对IBD的疗效影响研究较少且结果相互矛盾[14-15]。为探讨脂肪间充质干细胞(adipose tissue derived mesenchymal stem cells,ADMSCs)的最佳注射途径,本研究ADMSCs的腹腔及静脉注射对三硝基苯磺酸(trinitrobenzenesulfonic acid,TNBS)诱导肠炎的疗效影响。
材料与方法
一、主要材料及试剂
Ⅰ型胶原酶、三硝基苯磺酸购自美国Sigma公司,DMEM/F12培养基、青(链)霉素、胰酶-EDTA、胎牛血清(etalbovine serum,FBS)、转化生长因子(transforming growth factor,TGF)、磷酸盐缓冲液(phosphate buffered saline,PBS)购自美国GIBCO公司,大鼠脂肪间质干细胞成脂、成骨诱导分化培养基购于广州华粤瑞科有限公司,CD29-FITC、CD90-APC、CD106-PE、CD34-FITC、CD44-PE、CD45-APC、CD11b-PE流式抗体购于美国BD公司,大便隐血试验试剂盒购于珠海Baso公司,髓过氧化物酶(myeloperoxidase,MPO)活性检测试剂盒购于南京建成生物工程研究所,抗TSG-6及 TNF-α酶链免疫反应(enzyme-linked immunoassays,ELISA)试剂盒购于中国CUSABIO公司,RNA提取试剂盒(trizol)购于美国 Ambion公司,FastQuant RT及SYBR Green SuperRealPreMix Plus试剂盒购于TIANGEN BIOTECH(BEIJING)公 司,抗Ki-67抗体、HRP标记二抗、牛血清蛋白(bovine serum albumin,BSA)、DAPI染液、引物合均来自于生物工程上海股份有限公司。
二、实验方法
1.实验动物:32只 8周 SD 雄性大鼠(250 ~280 g/只),购于上海斯耐克实验动物中心,喂养在同济大学动物实验中心普通级喂养间,温度20℃ ~24℃,湿度50﹪,昼夜节律交替12 h/12 h。每笼5只,定时喂养,自由饮水。本实验通过了同济大学动物实验中心的动物伦理审查,伦理编号:TJLAC-016-014。
2.实验设计:大鼠适应性喂养1周,将32只大鼠完全随机分成正常组,腹腔注射组,静脉注射组及模型组,每组8只。造模前24 h大鼠禁食不禁水,第1天,用TNBS诱导结肠炎,正常组用PBS液灌肠1次。第2天将ADMSCs(2×106个/只)分别用腹腔及静脉注射方式注入两组结肠炎大鼠,正常组及模型组不治疗,按表1的标准每天记录大鼠的疾病活动指数(disease Activity Index,DAI),第 7 天处死大鼠,取标本检测。

表1 疾病活动指数(DAI)评分
3.动物造模:禁食24 h,用3﹪异戊巴比妥钠溶液行腹腔麻醉,麻醉成功后将5﹪ TNBS溶液0.6 ml加入到50﹪等体积的乙醇中充分混匀,用内径4 mm的乳胶管经肛门插入结肠,插入8 cm,将混合液缓慢推入,推入后大鼠倒立1 min,待其自然清醒,自由食水。正常组用PBS液灌肠1次。
4.ADMSCs的分离培养及纯化:大鼠麻醉后消毒,取出附睾旁及肾周脂肪,用含有1﹪青(链)霉素PBS液洗3次,剃出可见血管并剪成1~2 mm3的组织块,将组织块放入625 μl/mlⅠ型胶原酶的DMEM/F12培养基中并在37 ℃水浴锅中消化1 h,10﹪FBS的DMEM/F12培养基终止消化,消化液通过滤网后离心,760 ×g离心10 min,去上清液,用1 ml含有10﹪FBS、1﹪青(链)霉素及20 ng/μl TGF培养基重悬,取10 μl细胞悬液用台盼蓝计数,后按30×103个/cm2将细胞接种到培养皿中,置入37 ℃、5﹪CO2培养箱中培养。3 d后换培养基清除未黏附的细胞,当细胞长满底板约80﹪时,用0.25﹪胰酶-EDTA-PBS稀释液消化黏附细胞并传代继续培养,3~4代细胞用于实验。
5.ADMSCs的标记及鉴定:取培养扩增后的第2代ADMSCs,吸出原培养液,用2.5 g/L 胰酶消化,含10 g/L血清白蛋白的PBS洗涤后制成ADMSCs单细胞悬液,加入EP管中,再分别加入CD29-FITC、CD90-APC、CD106-PE、CD34-FITC,CD44- PE,CD45-APC,CD11b-PE 各 2 μl和同型对照流式抗体,4 ℃避光孵育30 min,PBS漂洗,空白对照用PBS代替,用含10 g/L BSA 的PBS洗涤后,流式细胞仪检测,Flowjo软件分析。用大鼠ADMSCs成骨、成脂诱导分化培养基进行成骨、成脂分化实验。
6.组织病理学分析:大鼠麻醉后,切除结肠并沿长轴打开并用预冷的PBS液冲洗,4﹪的多聚甲醛固定,石蜡包埋,组织块切成5 μm的薄片并黏附于载玻片后行HE染色。结肠的微观及宏观评分按文献执行[16-17]。
7.大便隐血实验:收集大鼠新鲜大便用大鼠隐血实验试剂盒检测,检测方法按说明书进行。
8. MPO检测:取约1 g组织用预冷的PBS液冲洗并放入玻璃匀浆器置于冰上匀浆,1600×g离心10 min,取上清液用于MPO检测,其方法及结果计算按说明书进行。
9.血浆中细胞因子的检测:取腹腔动脉血于EP管中,1500×g离心 15 min,取上清液保存于-80℃冰箱,血浆中TNF-α,IL-1β浓度用TNF-α,IL-1β ELISA试剂盒检测,检测方法及结果计算按照ELISA试剂盒的说明书进行。
10.实时定量聚合酶联反应(real time quantitative polymerase chain reaction,RT-qPCR):用Trizol试剂提取样本总RNA,测其质量及浓度,用FastQuantcDNA合成试剂盒将2 μg的RNA逆转录成cDNA。反应结束后置于-80℃保存用SuperReal荧光定量预混试剂增强版试剂盒将反应体系置于ABI 7500 Real time PCR仪进行PCR反应,采用2-ΔΔT相对定量分析法进行结果分析,GAPDH mRNA作为内参,引物由软件Primer Premier 5.0设计,生物工程上海股份有限公司合成与纯化,目标基因的引物序列见表2。
11.免疫荧光染色:结肠组织样本嵌入树脂,液氮罐中快速冷冻,保存于-80℃冰箱,组织在冰冻切片机上切成6 mm的薄片,风干,组织包埋剂包埋,96 ℃抗原修复15 min,PBS液冲洗3次,BSA常温封闭40 min,PBS液清洗,加入抗体Ki-67常温过夜,PBS液清洗,加入连接Cy3羊抗鼠二抗,常温避光孵浴2 h,PBS液清洗,加入DAPI负染,常温15 min,PBS液清洗,倒置荧光显微镜拍片。
三、统计学分析方法
采用SPSS 17.0统计软件进行统计分析。大鼠体重的变化、DAI、结肠长度、结肠宏观及微观评分、血浆细胞因子的浓度及结肠细胞因子的mRNA的表达等均采用± s表示,组间比较采用单因素方差分析及独立t检验。以P<0.05为差异有统计学意义。
结 果
一、ADMSCs的生物学特性
从大鼠附睾旁及肾周脂肪分离ADMSCs并行体外培养及分化实验。图1显示ADMSCs呈现典型的纺锤样形态,具有成脂、成骨的分化潜能。图2显示ADMSCs对CD29、CD44高表达,而对CD34、CD106低表达。
二、比较不同注射途径的ADMSCs对肠炎的缓解作用
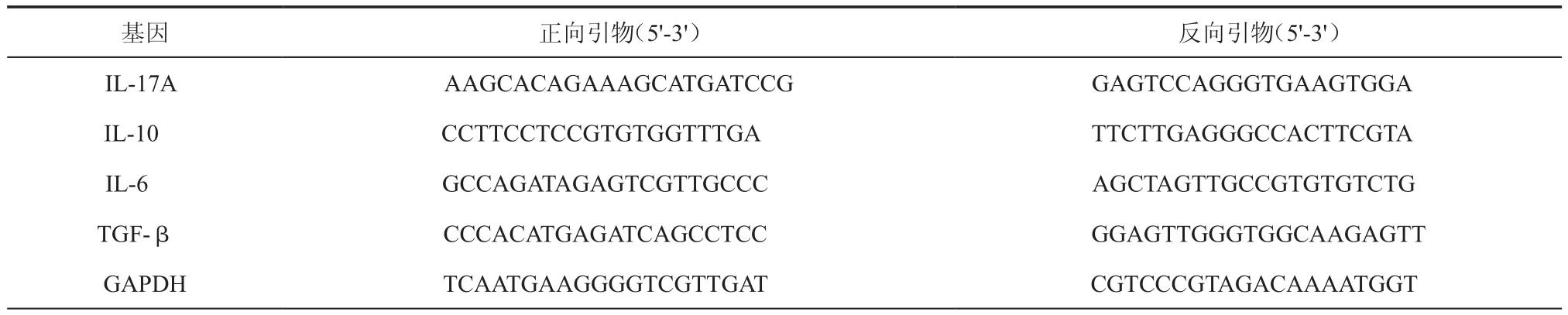
表2 RT-qPCR中的引物序列
表3 各组大鼠每日的相对体重变化(± s)
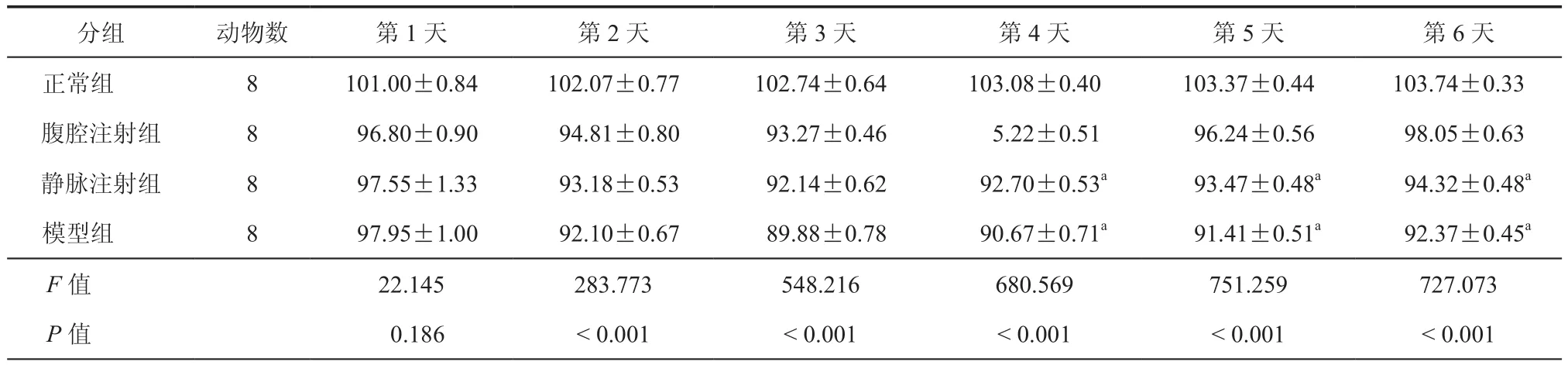
表3 各组大鼠每日的相对体重变化(± s)
注:与腹腔注射组比较,aP<0.05
分组 动物数 第1天 第2天 第3天 第4天 第5天 第6天正常组 8 101.00±0.84 102.07±0.77 102.74±0.64 103.08±0.40 103.37±0.44 103.74±0.33腹腔注射组 8 96.80±0.90 94.81±0.80 93.27±0.46 5.22±0.51 96.24±0.56 98.05±0.63静脉注射组 8 97.55±1.33 93.18±0.53 92.14±0.62 92.70±0.53a 93.47±0.48a 94.32±0.48a模型组 8 97.95±1.00 92.10±0.67 89.88±0.78 90.67±0.71a 91.41±0.51a 92.37±0.45a F值 22.145 283.773 548.216 680.569 751.259 727.073 P 值 0.186 <0.001 <0.001 <0.001 <0.001 <0.001
图1 倒置荧光显微镜下观察脂肪间充质干细胞(×100)
用TNBS诱导IBD的动物模型,与CD症状相似[18],表现严重腹泻,血便及体重降低。从表3可以看出ADMSCs腹腔注射大鼠的体重降低比静脉注射下降慢。治疗后第3天,大鼠的体重逐渐恢复,但腹腔注射组体重恢复更快。在第6天,腹腔注射组的体重恢复比静脉注射组高,差异有统计学意义(t=12.281,P=0.000)。从表4发现大鼠DAI评分在造模后开始逐渐增高,在第3天各组评分达到最高,DAI评分逐渐下降,在第6天时,腹腔注射组DAI评分低于静脉注射组,差异有统计学意义(t=-3.980,P=0.002)。从表5发现结肠组织中MPO的浓度腹腔注射组也低于静脉注射组,差异有统计学意义(t=-7.513,P=0.000),从图 3a~d 看
到治疗组结肠肠壁充血水肿及腹腔粘连好于模型组,但进一步比较发现腹腔注射组更优于静脉注射组。接着切除全部结肠,行结肠长度及结肠黏膜损伤的宏观比较,从表5及图3e发现腹腔注射组的结肠长度长于静脉注射组,差异有统计学意义(t=5.487,P=0.000)。从图3f发现腹腔注射组结肠黏膜充血、水肿、溃疡较静脉注射组轻。从表5可以发现黏膜宏观损伤评分腹腔注射组低于静脉注射组,差异有统计学意义(t=-3.000,P=0.011)。为比较结肠微观变化,结肠组织行HE染色。从图4可以看出腹腔注射组较静脉注射组黏膜修复好,较少的炎性细胞浸润、黏膜溃疡及缺损。从表 5可以看出腹腔注射组结肠病理评分低于静脉注射组,差异有统计学意义(t=-3.612,P=0.004)。同时,为了进一步评价结肠黏膜的修复情况,结肠炎性组织进行了Ki67的免疫荧光实验,从图5发现在腹腔注射组的结肠黏膜内发现更多Ki67+细胞,表明腹腔注射组的结肠黏膜比静脉注射组增殖更活跃。
表4 各组大鼠每日疾病活动指数(DAI)评分(± s)
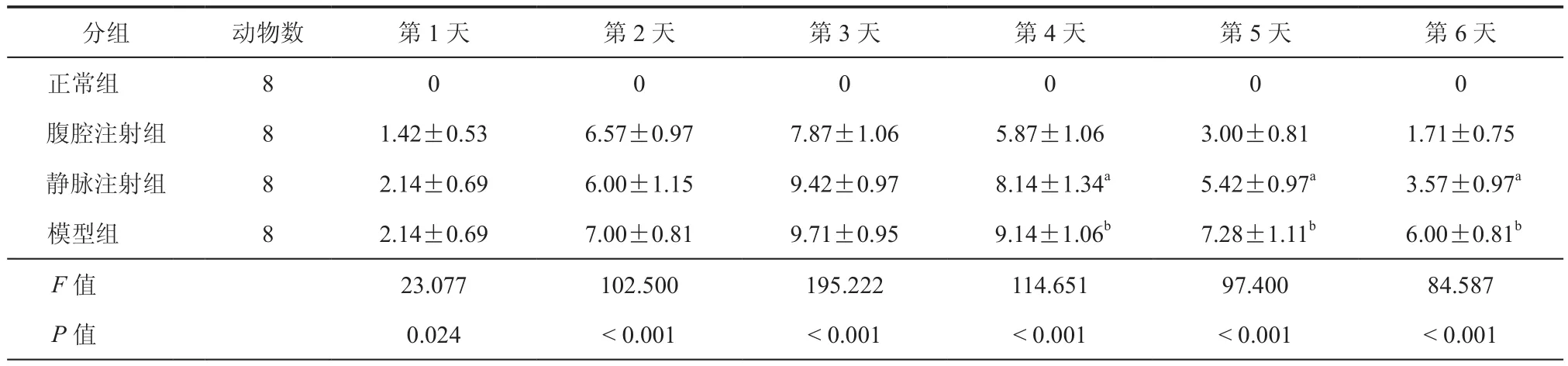
表4 各组大鼠每日疾病活动指数(DAI)评分(± s)
注:与腹腔注射组比较,aP<0.05
分组 动物数 第1天 第2天 第3天 第4天 第5天 第6天正常组 8 0 0 0 0 0 0腹腔注射组 8 1.42±0.53 6.57±0.97 7.87±1.06 5.87±1.06 3.00±0.81 1.71±0.75静脉注射组 8 2.14±0.69 6.00±1.15 9.42±0.97 8.14±1.34a 5.42±0.97a 3.57±0.97a模型组 8 2.14±0.69 7.00±0.81 9.71±0.95 9.14±1.06b 7.28±1.11b 6.00±0.81b F值 23.077 102.500 195.222 114.651 97.400 84.587 P值 0.024 <0.001 <0.001 <0.001 <0.001 <0.001
表5 大鼠结肠髓过氧化物酶(MPO)浓度、结肠长度、结肠宏观损伤评分及组织学评分(± s)

表5 大鼠结肠髓过氧化物酶(MPO)浓度、结肠长度、结肠宏观损伤评分及组织学评分(± s)
注:与腹腔注射组比较,aP<0.05
分组 动物数 MPO(U/g) 结肠长度(cm) 宏观损伤评分 组织学评分正常组 8 56.41±5.57 19.92±1.59 0.18±0.06 0.17±0.07腹腔注射组 8 74.37±5.12 18.01±0.99 1.57±0.53 2.14±0.69静脉注射组 8 95.75±5.52a 15.38±0.78a 2.42±0.53a 3.57±0.76a模型组 8 172.61±11.27a 14.45±1.06a 4.28±0.75a 7.87±0.69a F值 340.746 32.841 71.795 188.748 P 值 <0.001 <0.001 <0.001 <0.001
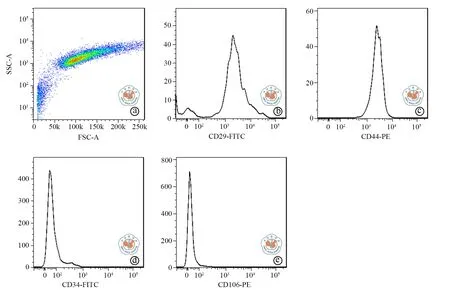
图2 流式细胞术对脂肪间充质干细胞特征性标记物的检测
三、不同注射途径的ADMSCs对TNBS诱导肠炎炎症因子的影响

图3 脂肪间充质干细胞不同注射途径对肠炎宏观损伤的影响
注:a、b、c、d图为结肠的宏观表现,图片箭头显示腹腔注射组肠管充血、水肿、粘连较静脉注射组轻;e图为结肠长度变化,图片显示腹腔注射组结肠长度比静脉注射组长;f图显示为腹腔注射组结肠黏膜水肿,溃疡较静脉注射轻
表6 大鼠血清炎性因子的浓度及结肠局部炎性因子的mRNA的表达(± s)
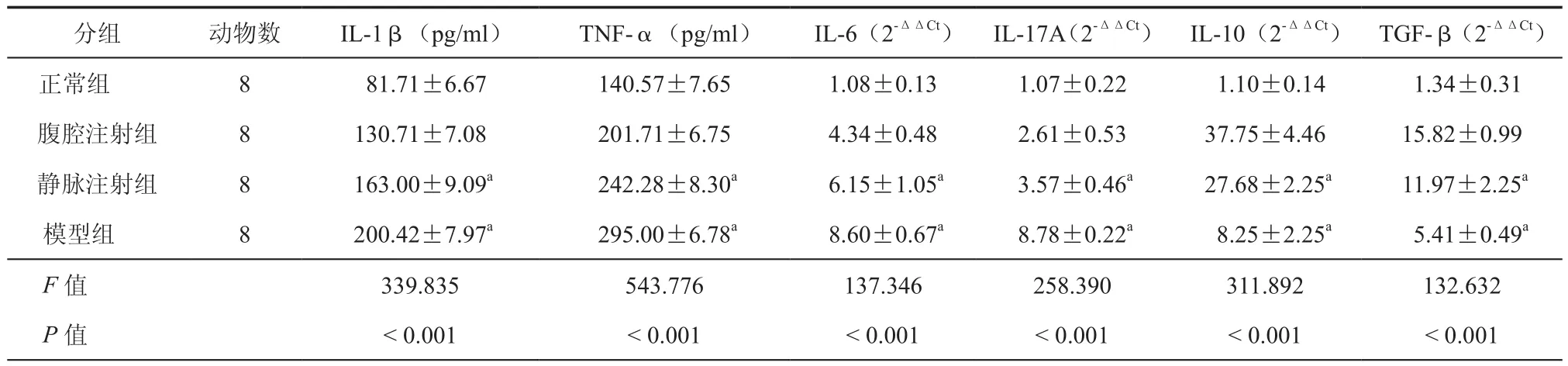
表6 大鼠血清炎性因子的浓度及结肠局部炎性因子的mRNA的表达(± s)
注:与腹腔注射组比较,aP<0.05
分组 动物数 IL-1β(pg/ml) TNF-α(pg/ml) IL-6(2-ΔΔCt) IL-17A(2-ΔΔCt) IL-10(2-ΔΔCt) TGF-β(2-ΔΔCt)正常组 8 81.71±6.67 140.57±7.65 1.08±0.13 1.07±0.22 1.10±0.14 1.34±0.31腹腔注射组 8 130.71±7.08 201.71±6.75 4.34±0.48 2.61±0.53 37.75±4.46 15.82±0.99静脉注射组 8 163.00±9.09a 242.28±8.30a 6.15±1.05a 3.57±0.46a 27.68±2.25a 11.97±2.25a模型组 8 200.42±7.97a 295.00±6.78a 8.60±0.67a 8.78±0.22a 8.25±2.25a 5.41±0.49a F值 339.835 543.776 137.346 258.390 311.892 132.632 P 值 <0.001 <0.001 <0.001 <0.001 <0.001 <0.001
为了研究ADMSCs的腹腔及静脉注射对肠炎炎症因子的影响,大鼠血浆中IL-1β及TNF-α的浓度用了ELISA进行检测,用RT-PCR的方法检测炎性结肠组织中IL-6、IL-17A、IL-10及TGF-β的mRNA的表达情况。从表6可以看出ADMSCs的两种植入方式均能降低血浆中IL-1β及TNF-α的浓度,但腹腔注射组血浆中IL-1β的浓度比静脉注射组低,差异有统计学意义(t=-8.518,P=0.000)。同样腹腔注射组血浆中TNF-α的浓度也比静脉注射组低,差异有统计学意义(t=-10.033,P=0.000)。表6也显示ADMSCs的两种植入方式均抑制了结肠组织中炎症因子IL-6、IL-17 AmRNA的表达,增加了抗炎因子IL-10、TGF-βmRNA的表达。但进一步比较发现ADMSCs的腹腔注射组IL-6、IL-17A mRNA的表达比静脉注射组低,差异有统计学意义(t=-4.147,-4.301,P均=0.001)。然而,腹腔注射组IL-10、TGF-β mRNA的表达水平比静脉注射组高,差异有统计学意义(t=5.327,3.740,P=0.001,0.003)。
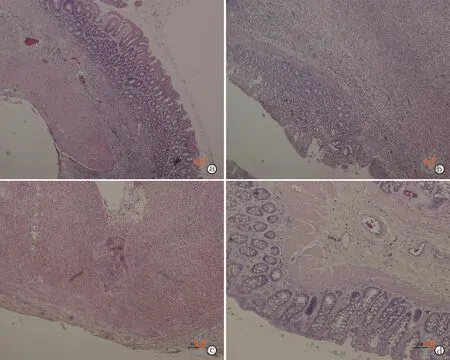
图4 正置荧光显微镜下观察脂肪间充质干细胞不同注射途径对肠炎的病理影响(HE染色,×100)
讨 论
间充质干细胞作为干细胞治疗的种子广泛应用于组织再生、损伤修复及免疫系统疾病的治疗。ADMSCs是间充质干细胞的一种,它不仅具有一般干细胞生物特性及更强的免疫调节功能外,还具有来源广,取材方便,易于分离纯化且无免疫排斥等优点,因此,ADMSCs可以作为治疗IBD的一个重要细胞来源。ADMSCs治疗IBD有很好的运用前景,但至今还未解决的诸如细胞的最佳剂量,注射途径及时间点,有效性及安全性问题阻碍了ADMSCs的临床转化。目前,最佳的给药途径不仅是化学药物重要的临床问题,而且是细胞治疗临床疾病的关键问题,治疗的细胞到达靶器官与细胞的给药方式有很大的关系。因此,ADMSCs的给药方式有必要进行深入的研究。
ADMSCs容易分离纯化及培养。跟目前研究一样[19],ADMSCs为一种纺锤样结构,呈现了成脂、成骨的分化潜能以及典型免疫表型的表达。跟文献结果一致[14],ADMSCs腹腔注射比静脉注射更能缓解体重降低,结肠缩短;更能改善结肠充血、水肿及黏膜溃疡;更能减少结肠炎性细胞浸润及加快结肠黏膜修复。
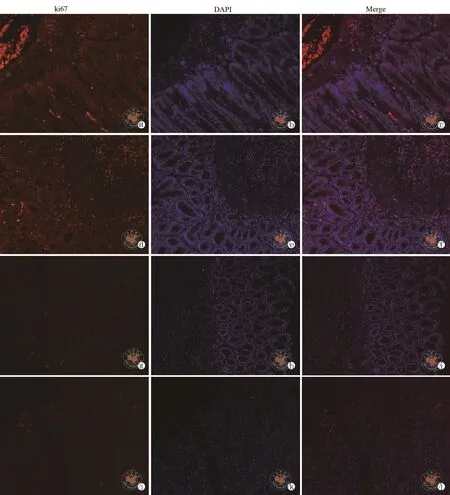
图5 正置荧光显微镜下观察脂肪间充质干细胞不同注射途径对肠炎结肠黏膜修复的影响(免疫荧光染色,×100)
MPO是中性粒细胞激活的重要标志[20],是用来评估药物在IBD的动物模型疗效的重要方法[21]。此实验结果显示ADMSCs的腹腔注射比静脉注射更能降低MPO浓度。TNF-α and IL-1β在CD患者及TNBS动物模型都出现表达增高[22-23]。TNF-α是IBD患者炎症过程中关键因子,抗TNF-α的药物强调了TNF-α在IBD病理过程中的重要作用并作为治疗IBD的靶点[24]。IL-1β是对肽聚糖分子快速固有免疫反应中重要的前炎症因子[25]。在本研究中发现ADMSCs的腹腔及静脉注射都降低了TNF-α and IL-1β的水平,这与已有的研究结果一致[26],但发现ADMSCs的腹腔注射组TNF-α,IL-1β的下降水平更明显。Ki67+细胞反应了黏膜的增殖,ADMSCs腹腔注射也发现肠道上皮有更多的Ki67+细胞,这与TNF-α,IL-1β可以调节肠道上皮的增殖和凋亡一致[27]。
IL-17A及IL-6是IBD重要的致炎因子,IL- 17A的分泌量与IBD的严重程度成正相关[28],IL- 17A的缺乏可改善小鼠的结肠炎症状[29]。TGF-β和IL-6是Th17细胞分化必需的细胞因子[30]。低浓度TGF-β诱导Th17细胞分化,而高浓度抑制Th17细胞分化并促进调节性T细胞的作用[31]。IL-10及TGF-β是由调节性T细胞分泌的重要抗炎因子,能够识别自身抗原、保护组织损伤及抑制自身免疫反应[32]。IL-10维持肠道共生菌的自我平衡起到了重要作用[33]。目前的研究证明间充质干细胞和Th0细胞共育时减少了前炎症因子IL-17A及IL-6的水平,增加了抗炎因子IL-10及TGF-β的水平[34]。本研究也发现ADMSCs的腹腔及静脉注入均抑制了IL-17A及IL-6 mRNA的表达,增加了IL-10及TGF-β mRNA的表达。这与目前的研究结论一致[35]。但ADMSCs的腹腔植入对炎症因子调节更为明显。实验结果支持ADMSCs腹腔注射优于静脉注射,这与Castelo-Branco等[14]研究结果一致,但与Gonçalves等[15]研究的结果完全相反,其原因可能在于本研究所使用的动物模型不一致,这篇文章中用的是TNBS诱导的肠炎,而文献报道用的是葡聚糖硫酸钠(DSS)诱导的肠炎,这两种动物模型目前都是世界上最常用的IBD动物模型,这两种模型从诱导发病的机理存在差异,导致结果差异。Antunes等[36]已经研究了不同的间充质干细胞及不同注射方式对实验性肺气肿有不同的治疗效果。据此推测不同的间充质干细胞用不同注射方式在不同的肠炎模型会出现结果的差异。为什么腹腔注射优于静脉注射,静脉注射出现的肺阻塞效应可能是一个重要问题[37],实验证实了大部分细胞在肺部被清除[38],显示少于1﹪的细胞在靶器官被探测到[39]。并且Wang等[40]发现注入的间充质干细胞在非靶向的肝脾也有聚集,因此这大大减少了细胞进入靶器官的量,从而减少了治疗效果。已有文献研究了细胞剂量或许是影响干细胞治疗效果的重要问题[41]。腹腔注射的ADMSCs是怎样迁移到炎症部位而产生治疗作用的机理不清楚,分析是否与ADMSCs在腹腔内进一步扩增从而增大了细胞的数量且直接通过腹膜进入了靶点有关。这些设想需要后面的实验进一步研究。
综上所述,本研究的结果表明ADMSCs的腹腔注射优于静脉注射,腹腔注射可能是ADMSCs治疗TNBS诱导肠炎的一种较好选择。这对ADMSCs的临床转化及后续研究有重要的意义。
1 Wang Y, Ouyang Q. APDW 2004 Chinese IBD working group.ulcerative colitis in China:retrospective analysis of 3100 hospitalized patients[J]. J Gastroenterol Hepatol, 2007, 22(9):1450-1455.
2 APDW2004 Chinese IBD Working Group. Retrospective analysis of 515 cases of Crohn's disease hospitalization in China: nationwide study from 1990 to 2003[J]. J Gastroenterol Hepatol, 2006, 21(6):1009-1015.
3 Danese S. New therapies for inflammatory bowel disease: from the bench to the bedside[J]. Gut, 2012, 61(6):918-932.
4 樊利芳, 董卫国. 肠干细胞与结直肠肿瘤干细胞研究进展[J]. 世界华人消化杂志, 2008, 16(36):4075-4080.
5 Gao X, Yang RP, Chen MH, et al. Risk factors for surgery and postoperative recurrence: analysis of a South China cohort with Crohn's disease[J]. Scand J Gastroenterol, 2012, 47(10):1181-1191.
6 Danese S, Rutella S, Vetrano S. Mesenchymal stromal cells in inflammatory bowel disease:conspirators within the 'colitogenic niche'?[J]. Gut, 2013, 62(8):1098-1099.
7 Liang J, Zhang H, Wang D, et al. Allogeneic mesenchymal stem cell transplantation in seven patients with refractory in fl ammatory bowel disease[J]. Gut, 2012, 61(3):468-469.
8 Bortolotti F, Ukovich L, Razban V, et al.In vivotherapeutic potential of mesenchymal stromal cells depends on the source and the isolation procedure[J]. Stem Cell Reports, 2015, 4(3):332-339.
9 Ding DC, Chang YH, Shyu WC, et al. Human umbilical cord mesenchymal stem cells: a new era for stem cell therapy[J]. Cell Transplant, 2015, 24(3):339-347.
10 Pacini S, Petrini I. Are MSCs angiogenic cells? New insights on human nestin-positive bone marrow-derived multipotent cells[J]. Front cell Dev Biol, 2014, 2:20.
11 Freeman FE, Haugh MG, Mcnamara LM. Anin vitrobone tissue regeneration strategy combining chondrogenic and vascular priming enhances the mineralization potential of mesenchymal stem cells in vitro while also allowing for vessel formation[J]. Tissue Eng Part A,2015, 21(7/8):1320-1332.
12 Drakos PE, Nagler A, Or R. Case of crohn's disease in bone marrow transplantation[J]. Am J Hematol, 1993, 43(2):157-158.
13 Griffin MD, Elliman SJ, Cahill E, et al. Concise review:adult mesenchymal stromal cell therapy for in fl ammatory diseases: how well are we joining the dots?[J]. Stem Cells, 2013, 31(10):2033-2041.
14 Castelo-Branco MT, Soares ID, Lopes DV, et al. Intraperitoneal but not intravenous cryopreserved mesenchymal stromal cells home to the in fl amed colon and ameliorate experimental colitis[J]. PLoS One, 2012,7(3):e33360.
15 Gonçalves Fda C, Schneider N, Pinto FO, et al. Intravenous vs intraperitoneal mesenchymal stem cells administration: what is the best route for treating experimental colitis?[J]. World J Gastroenterol, 2014,20(48):18228-18239.
16 Obermeier F, Kojouharoff G, Hans W, et al. Interferon-gamma (IFN-gamma)- and tumour necrosis factor (TNF)-induced nitric oxide as toxic effector molecule in chronic dextran sulphate Sodium (DSS)-induced colitis in mice[J]. Clin Exp Immunol, 1999, 116(2):238-245.
17 Rivera DG, Hernández I, Merino N, et al. Mangifera indica L. extract(Vimang) and mangiferin reduce the airway inflammation and Th2 cytokines in murine model of allergic asthma[J]. J Pharm Pharmacol,2011, 63(10):1336-1345.
18 Strober W, Fuss IJ, Blumberg RS. The immunology of mucosal models of in fl ammation[J]. Annu Rev Immunol, 2002, 20(1):495-549.
19 Dominici M, Le Blanc K, Mueller I, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement[J]. Cytotherapy, 2006,8(4):315-317.
20 Bradley PP, Priebat DA, Christensen RD, et al. Measurement of cutaneous inflammation:estimation of neutrophil content with an enzyme marker[J]. J Invest Dermatol, 1982, 78(3):206-209.
21 Tozaki H, Fujita T, Odoriba T, et al. Validation of a pharmacokinetic model of colon-specific drug delivery and the therapeutic effects of chitosan capsules containing 5-aminosalicylic acid on 2,4,6-trinitroben zenesulphonic acid-induced colitis in rats[J]. J Pharm Pharmacol, 1999,51(10):1107-1112.
22 Bouma G, Strober W. The immunological and genetic basis of in fl ammatory bowel disease[J]. Nat Rev Immunol, 2003, 3(7):521-533.
23 Neurath MF, Pettersson S, Meyer Zum Büschenfelde KH, et al. Local administration of antisense phosphorothioate oligonucleotides to the p65 subunit of NF-kappa B abrogates established experimental colitis in mice[J]. Nat Med, 1996, 2(9):998-1004.
24 Sands BE, Anderson FH, Bernstein CN, et al. In fl iximab maintenance therapy for fistulizing Crohn's disease[J]. N Engl J Med, 2004,350(9):876-885.
25 Li LL, Zhang S, Zhang Y, et al. Paracrine action mediate the anti fi brotic effect of transplanted mesenchymal stem cells in a rat model of global heart failure[J]. Mol Biol Rep, 2009, 36(4):725-731.
26 Nasef A, Mathieu N, Chapel A, et al. Immunosuppressive effects of mesenchymal stem cells: involvement of HLA-G[J]. Transplantation,2007, 84(2):231-237.
27 Begue B, Wajant H, Bambou JC, et al. Implication of TNF-related apoptosis-inducing ligand in inflammatory intestinal epithelial lesions[J]. Gastroenterology, 2006, 130(7):1962-1974.
28 Liu Z, Colpaert S, Broeck CD, et al. Expression of interleukin-15 in in fl ammatory bowel disease[J]. Gastroenterology, 1998, 114(4):A1024.
29 Zhang Z, Zheng M, Bindas J, et al. Critical role of IL-17 receptor signaling in acute TNBS-induced colitis[J]. In fl amm Bowel Dis, 2006,12(5):382-388.
30 Mangan PR, Harrington LE, O'quinn DB, et al. Transforming growth factor-beta induces development of the T(H)17 lineage[J]. Nature,2006, 441(790):231-234.
31 Manel N, Unutmaz D, Littman DR. The differentiation of human T(H)-17 cells requires transforming growth factor-beta and induction of the nuclear receptor RORgammat[J]. Nat Immunol, 2008,9(6):641-649.
32 Sakaguchi S. Naturally arising CD4+regulatory t cells for immunologic self-tolerance and negative control of immune responses[J]. Annu Rev Immunol, 2004, 22(22):531-562.
33 Izcue A, Coombes JL, Powrie F. Regulatory T cells suppress systemic and mucosal immune activation to control intestinal in fl ammation[J].Immunol Rev, 2006, 212(1):256-271.
34 Prevosto C, Zancolli M, Canevali P, et al. Generation of CD4+or CD8+regulatory T cells upon mesenchymal stem cell-lymphocyte interaction[J]. Haematologica, 2007, 92(7):881-888.
35 Parekkadan B, Upadhyay R, Dunham J, et al. Bone marrow stromal cell transplants prevent experimental enterocolitis and require host CD11b+splenocytes[J]. Gastroenterology, 2011, 140(3):966-975.
36 Antunes MA, Abreu SC, Cruz FF, et al. Effects of different mesenchymal stromal cell sources and delivery routes in experimental emphysema[J]. Respir Res, 2014, 15:118.
37 Fischer UM, Harting MT, Jimenez F, et al. Pulmonary passage is a major obstacle for intravenous stem cell delivery: the pulmonary fi rstpass effect[J]. Stem Cells Dev, 2009, 18(5):683-692.
38 Schrepfer S, Deuse T, Reichenspurner H, et al. Stem cell transplantation: the lung barrier[J]. Transplant Proc, 2007, 39(2):573-576.
39 Von Bahr L, Batsis I, Moll G, et al. Analysis of tissues following mesenchymal stromal cell therapy in humans indicates limited longterm engraftment and no ectopic tissue formation[J]. Stem Cells, 2012,30(7):1575-1578.
40 Wang M, Liang C, Hu H, et al. Intraperitoneal injection (IP),Intravenous injection (IV) or anal injection (AI)? Best way for mesenchymal stem cells transplantation for colitis[J]. Sci Rep, 2016, 6:30696.
41 Lm MM. The problem is obvious, the solution is not:numbers do matter in cardiac cell therapy!EXPERT'S PERSPECTIVE[J]. Cardiovasc Res,2012, 96(2):210-213.
2017-05-19)
(本文编辑:蔡晓珍)
付正伟,张振宇,葛海燕,等. 不同注射途径的脂肪间充质干细胞对大鼠肠炎疗效的实验研究[J/CD].中华细胞与干细胞杂志(电子版),2017,7(5):277-286.
Effect of adipose tissue derived mesenchymal stem cells via different routes of injection on rats with colitis
Fu Zhengwei, Zhang Zhenyu, Ge Haiyan. Department f Gastrointestinal Surgery,Shanghai East Hospital, Tongji University School of Medicine, Shanghai 201200, China
ObjectiveTo investigate the effect of adipose tissue derived mesenchymal stem cells (ADMSCs) via intraperitoneal and intravenous injection on colitis induced by trinitrobenzenesulfonic acid (TNBS).MethodsTotally 32 rats were randomly divided into a normal group, an intraperitoneal injection group, an intravenous injection group and a model group (n=8).The animal model of inflammatory bowel disease (IBD) was induced by TNBS and ADMSCs were administrated intraperitoneally and intravenously. Disease activity index (DAI) were recorded, the microscopic changes and macroscopic damage of colon were observed, myeloperoxidase (MPO) activity were determined and the expression of Ki-67+cell were measured in colon. The expressions of IL-1β and TNF-α in the peripheral blood were compared and the expression level of gene (TGF-α, IL-6, IL-17A, IL-10) were determined in the colon. Single factor analysis of variance and independentttest were used for statistical analysis.ResultsWeight recovery in the intraperitoneal injection group 98.05±0.63 was higher than that in the intravenous injection group 94.32±0.48, (t=12.281,P=0.000) in day 6. At the same time, the DAI score in the intraperitoneal injection group 1.71±0.75 was significantly lower than that in intravenous injection group 3.57±0.97, (t=-3.980,P=0.002). In addition, the MPO concentration of colon tissues in the intraperitoneal injection group (95.75±5.52) U/g was lower than that in the intravenous injection group (74.37 ± 5.12)U/g, (t=-7.513,P=0.000). The pathological score of colon in the intraperitoneal injection group 2.14 ± 0.69 was lower than that in the intravenous injection group 3.57 ± 0.76, (t=-3.612,P=0.004). The immunofluorescence of the colonic tissues revealed more Ki67+cells in the intraperitoneal injection group than in the intravenous injection group.ELISA showed that the intraperitoneal injection group(130.71±7.08)pg/ml had lower concentration of IL-1β in plasma than did the intravenous injection group (163 ± 9.09) pg/ml, (t=-8.518,P=0.000).The plasma concentration of TNF-α in the intraperitoneal injection group (201.71±6.75) pg/ml was also lower than that in the intravenous injection group (242.28 ± 8.30) pg/ml, (t=-10.033,P=0.000).In addition, the results of RT-qPCR in the colon tissues showed that the expression levels of IL-6 mRNA in the intraperitoneal injection group (4.34±0.48) were lower than those in the intravenous injection group (6.15±1.05,t=-4.147,P=0.001) and the expression levels of IL-17A mRNA in intraperitoneal injection group 2.61±0.53 were also lower than those in the intravenous injection group (3.57±0.46,t=-4.301,P=0.001). However, the expression levels of IL-10 mRNA in the intraperitoneal injection group (37.75 ± 4.46) were higher than those in the intravenous injection group (27.68±2.25,t=5.327,P=0.001) and the expression levels of TGF-β mRNA in the intraperitoneal injection group (15.82±0.99) were higher than those in the intravenous injection group (11.97±2.25,t=3.740,P=0.003).ConclusionIntraperitoneal injection of ADMSCs is better than intravenous injection, which may be a better route of administration for ADMSCs treating IBD.
Inflammatory bowel disease; Adipose tissue derived mesenchymal stem cells; Routes of injection
10.3877/cma.j.issn.2095-1221.2017.05.005
上海市科学技术委员会面上项目(34119b0600;16411970800);上海市卫生局面上项目(20134194)
201200 上海,同济大学附属东方医院胃肠外科
葛海燕,Email:gesurgery@163.com< class="emphasis_italic">Corresponding author: Ge Haiyan, Email: gesurgery@163.com
Ge Haiyan, Email: gesurgery@163.com
