碱性成纤维生长因子转染骨髓间充质干细胞移植对心肌病心力衰竭大鼠心功能的影响
2017-12-01赖增华窦学凯贾春文姜朝晖
赖增华 窦学凯 贾春文 姜朝晖
碱性成纤维生长因子转染骨髓间充质干细胞移植对心肌病心力衰竭大鼠心功能的影响
赖增华 窦学凯 贾春文 姜朝晖
目的探讨碱性成纤维生长因子(bFGF)转染的骨髓间充质干细胞(BMSCs)移植对心肌病心力衰竭大鼠心功能的影响。方法通过腹腔注射阿霉素建立心肌病心力衰竭SD大鼠模型,存活33只大鼠随机分成3组:模型组、BMSCs组和BMSCs+bFGF组,每组11只。另设正常对照组(n=8)。取体外培养的第三代SD大鼠BMSCs,质粒-bFGF转染BMSCs,BrdU标记后,分别将BMSCs(3×106个)、bFGF转染的BMSCs(3×106个)或等体积培养基通过尾静脉注射的方法进行移植。用生物信号采集系统检测大鼠心功能,大鼠心脏切片行免疫组化了解移植细胞在受体心脏的存活情况,实时荧光定量PCR和Western Blotting检测心室组织bFGF的表达水平。多组间比较采用单因素方差分析或精确概率法。结果BMSCs移植4周后,正常对照组大鼠的心功能指标LVSP(121.13±12.28)mmHg,LVDEP(3.86±1.25)mmHg,LV+dP/dt(3671.25±172.50)mmHg/s和 LV-dP/dt(3221.63±259.57)mmHg/s;模型组心功能指标 LVSP(81.29±12.39)mmHg,LVDEP(16.43±4.12)mmHg,LV+dP/dt(2344.29 ±98.63)mmHg/s和 LV-dP/dt(2244.29±103.10)mmHg/s;BMSCs组心功能指标 LVSP(97.00 ±6.39)mmHg,LVDEP(12.00±2.73)mmHg,LV+dP/dt(2876.25±118.31)mmHg/s 和 LV-dP/dt(2726.25 ± 303.23)mmHg/s;BMSCs+bFGF 组心功能指标 LVSP(109.38±12.78)mmHg,LVDEP(9.25 ±1.67)mmHg,LV+dP/dt(3037.50±161.22)mmHg/s 和 LV-dP/dt(3000.13±149.77)mmHg/s,移植组各指标均有改善,比较差异有统计学意义(F=17.29、36.61、111.11、26.54,P均<0.01)。免疫组织化学检查示细胞移植组大鼠的心室组织切片上可见BrdU阳性细胞存在。模型组大鼠心室心肌组织bFGF mRNA表达水平高于正常对照组(1.28±0.06vs1.00±0.00,t=10.46,P<0.01),BMSCs组高于模型组(1.37±0.05vs1.28±0.06,t=3.39,P<0.01),而BMSCs+bFGF 组高于 BMSCs组(1.44±0.03vs1.37±0.05,t=2.86,P=0.01)。Western Blotting示,正常对照组大鼠心室组织bFGF蛋白表达最低,模型组高于正常对照组(1.31±0.09vs1.00 ±0.00,t=5.48,P=0.01),BMSCs组高于模型组(1.46±0.05vs1.31±0.09,t=2.68,P=0.03),而 BMSCs+bFGF 组高于 BMSCs组(1.84±0.09vs1.46±0.05,t=6.79,P<0.01)。结论转染bFGF基因的BMSCs移植可提高阿霉素所致心肌病心力衰竭大鼠心脏的bFGF水平,改善大鼠心功能,其效果优于单纯BMSCs移植。
碱性成纤维生长因子; 间充质干细胞; 细胞移植; 心力衰竭
非缺血性心肌病可引起心室结构改变和心肌壁功能受损,导致心脏功能进行性障碍,心脏功能随时间不断恶化,临床治疗棘手[1]。骨髓间充质干细胞(bone marrow mesenchemal stem cell, BMSCs)具有多向分化潜能的特点,可通过旁分泌机制或分化为心肌的方式促进非缺血性心肌病所致心力衰竭的心功能恢复,但效果还不理想[2-4]。碱性成纤维细胞生长因子(basic fi broblast growth factor, bFGF)具有多重细胞生物学效应,在多种细胞的增殖、分化中起重要作用,与心肌损伤及其修复关系密切[5]。本研究将Ad-bFGF转染至分离培养的BMSCs中,观察BMSCs移植对阿霉素诱导的心肌病心力衰竭大鼠心功能的改善情况,为利用干细胞临床治疗心肌损伤奠定实验基础。
材料与方法
一、材料
近交系12周龄雄性SD大鼠45只,体质量200~250 g(上海斯莱克实验动物有限公司),bFGF cDNA的质粒PBR322-bFGF(军事医学科学院),注射用盐酸阿霉素(国药准字H33021980),兔抗人碱性成纤维细胞生长因子抗体(博士德生物制品公司),LipofectamineTM2000脂质体转染试剂(美国Gibco公司),5-溴-2'脱氧尿苷(BrdU)及小鼠抗大鼠Brdu单克隆抗体(美国Sigma公司),RNA提取试剂盒(日本BioFlux公司),EvoScipt RNA SYBR Green I Master试剂盒(美国Roche公司),ECL蛋白显色液(美国Advansta公司)。
二、实验方法
(一)心肌病心力衰竭大鼠模型的建立和分组
45只SD大鼠先随机选取8只作为对照组,余37只大鼠用于复制心肌病心力衰竭模型。建模方法:注射用阿霉素以生理盐水稀释成2 mg/ml,按2 mg/kg大鼠体重的剂量,腹腔注射,每周1次,连续6周。对照组大鼠每周腹腔注射同量生理盐水。6周后,37只建模大鼠存活33只,再随机分为3组(每组 11 只):(1)BMSCs组 :尾静脉注射 50 μl(含3×106个细胞);(2)BMSCs+bFGF 组 :尾静脉注射50 μl转染bFGF的BMSCs细胞悬液(含3×106个细胞);(3)模型组尾静脉注射50 μl培养液。
(二)大鼠BMSCs的纯化培养、鉴定
大鼠处死后无菌条件下获取股骨和胫骨,剪除干骺端,反复冲洗骨髓腔,获取骨髓细胞。离心,弃上清及脂肪层。重新混悬细胞,加到淋巴细胞分离液,以密度梯度离心法分离纯化细胞,接种于含10﹪胎牛血清的DMEM培养液中,37℃、5﹪CO2、90﹪相对湿度细胞培养箱中培养。采用第3代BMSCs进行实验。BMSCs经流式细胞仪检测,细胞表型符合BMSCs的表型特征:CD90(+)、CD105(+)、CD34(-)、CD44(-)。
(三)荧光染色标记的质粒-bFGF转染BMSCs
质粒扩增、纯化后,-80℃保存备用。于细胞移植前进行转染,按LipofectamineTM2000脂质体转染法进行操作。将纯化的质粒、脂质体和骨髓BMSCs室温下混匀,37 ℃、5﹪ CO2、90﹪相对湿度细胞培养箱中培养6 h。换液,培养36 h后观察转染情况。
(四)BMSCs的BrdU标记
BMSCs移植前,加入终浓度为50 mg/L的BrdU液,于37 ℃、5﹪ CO2、90﹪相对湿度细胞培养箱中培养48 h。
(五)BMSCs移植
大鼠腹腔阿霉素末次注射后1周,用DMEM培养液将BrdU标记好的BMSCs混悬成3×106/50 μl。大鼠经戊巴比妥钠(30 mg/kg)腹腔注射麻醉,经尾静脉注射进行细胞移植。BMSCs组大鼠给予50 μl单纯BMSCs,BMSCs+bFGF组给予50 μl bFGF转染的BMSCs,模型组给予50 μl DMEM培养基。
(六)大鼠心功能的测定
BMSCs移植后4周,大鼠腹腔注射戊巴比妥钠麻醉,固定后分离出颈总动脉,远心端结扎,近心端插入自制硅胶管导管,接RM6240型四道生物信号采集处理系统(成都仪器制造厂),测定大鼠心率(HR)、最大左室收缩压(LVSP)和左室舒张末压(LVDEP)以及左室内压最大变化速率(±dP/dt max)。
(七)心脏标本免疫组织化学分析
大鼠心功能测定完毕后处死,取出部分心室组织,4﹪甲醛固定,常规梯度酒精脱水,石蜡包埋后切片,行BrdU免疫组织化学染色,按试剂盒SABC法进行操作。光学显微镜观察,高倍镜下每张切片任取5个视野,计算每个视野的BrdU阳性细胞数,取其均值作为每组的BrdU阳性细胞数。
(八)实时荧光定量PCR检测大鼠心室组织bFGF mRNA表达
大鼠处死后取心室组织,液氮保存。匀浆后加入裂解液,Trizol法提取组织总RNA。按照逆转录试剂盒说明进行Realtime PCR检测,采用两步法反应,Reps:40,95 ℃,5 s,60 ℃,32 s。了解各组bFGF mRNA水平和最佳抑制时间,抑制率≥75﹪、维持≥72 h为有效系列。bFGF上游引物:5'-CGC CGCGCACCAGGGGCCGG-3',下游引物 :5'-ATGG CCACATCTAATCTCAT-3’。内参 GAPDH,上游引物 :5'-GACGACATCAAGAAGGTGGT -3’,下游引物 :5'- AAACTGTGAAGAGGGGCAGA-3'(上海申工生物公司合成)。
(九)Western Blotting检测大鼠心室组织bFGF蛋白表达
取液氮保存的心室组织,充分研浆,加入裂解液提取总蛋白,Bradford比色法测定蛋白质浓度。蛋白经10﹪ PAGE凝胶电泳,转至PVDF膜,封闭后加入稀释的一抗,4 ℃孵育过夜,加入二抗,室温下继续孵育1 h。利用辣根过氧化物酶HRP-ECL发光法曝光、显影、定影,标定Marker,进行扫描与分析。
三、统计学分析处理
采用SPSS12.0版统计学软件进行统计分析。心功能指标、BrdU阳性细胞数、bFGF表达水平等
结 果
一、各组大鼠存活情况比较
BMSCs移植前,造模大鼠均有不同程度的中毒症状,包括精神委靡、腹泻、皮毛无光泽、进食减少、腹水等,症状进行性加重。至实验结束,对照组8只大鼠全部存活(100﹪),而模型组存活 7只(63.64﹪),BMSCs组存活8只(72.73﹪),BMSCs+bFGF组存活8只(72.73﹪)。各组间存活率差异无统计学意义(P=0.32)。
表1 各组大鼠经BMSCs移植术后第4周左室功能比较(± s)
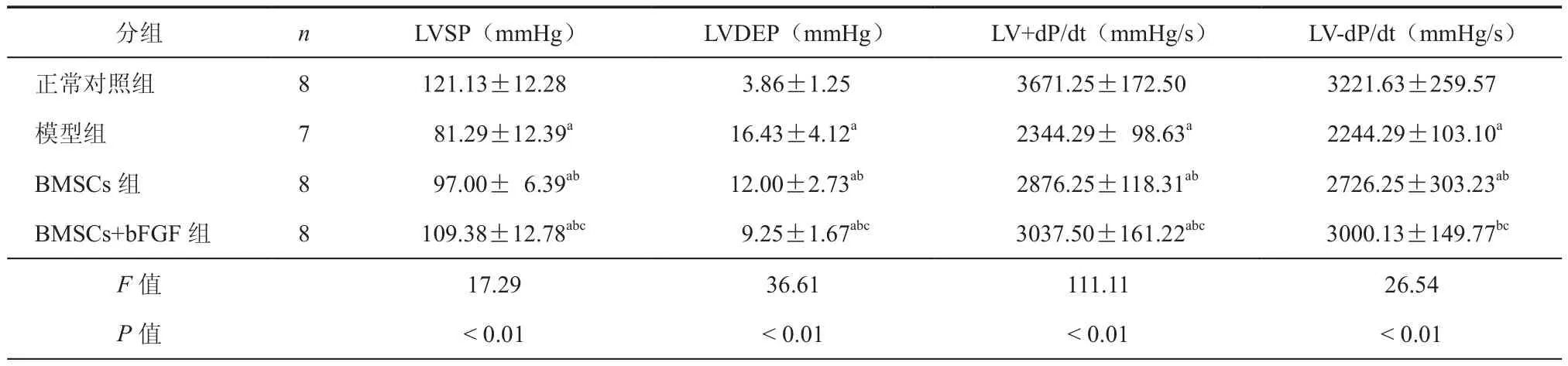
表1 各组大鼠经BMSCs移植术后第4周左室功能比较(± s)
注 :与正常对照组比较,aP<0.05 ;与模型组比较,bP<0.05 ;与 BMSCs组比较,cP<0.05
分组 n LVSP(mmHg) LVDEP(mmHg) LV+dP/dt(mmHg/s) LV-dP/dt(mmHg/s)正常对照组 8 121.13±12.28 3.86±1.25 3671.25±172.50 3221.63±259.57模型组 7 81.29±12.39a 16.43±4.12a 2344.29± 98.63a 2244.29±103.10a BMSCs组 8 97.00± 6.39ab 12.00±2.73ab 2876.25±118.31ab 2726.25±303.23ab BMSCs+bFGF 组 8 109.38±12.78abc 9.25±1.67abc 3037.50±161.22abc 3000.13±149.77bc F值 17.29 36.61 111.11 26.54 P 值 <0.01 <0.01 <0.01 <0.01
二、经BMSCs移植术后第4周各组大鼠心功能比较
与正常对照组相比,模型组LVSP、LV+dP/dt和 LV-dP/dt均下降(t=6.86、18.02、8.53,P均 <0.01),而LVDEP 升高(t=9.30,P<0.01),表明心力衰竭的大鼠模型已成功建立。与模型组相比,BMSCs组大鼠的LVSP、LV+dP/dt 和 LV-dP/dt均升高(t= 2.70、7.22、4.22、P均<0.05),而LVDEP 降低(t=3.28,P<0.01);与模型组相比,BMSCs+bFGF组大鼠的LVSP、LV+dP/dt和 LV-dP/dt也均升高(t=4.83、9.41、6.59、P均<0.05),而 LVDEP 降低(t= 5.31,P<0.01)。与 BMSCs组相比,BMSCs+bFGF组大鼠的LVSP、LV+dP/dt 和LV-dP/dt均 升 高(t= 2.20、2.27、2.46,P 均<0.05),而 LVDEP 降低(t= 2.11,P<0.05)(表 1)。
三、心室组织切片BrdU免疫组织化学检查结果
正常对照组、模型组大鼠心室组织切片上均未见BrdU阳性细胞,而细胞移植组大鼠的心室组织切片上可见BrdU阳性细胞存在,在心肌间及血管壁上可见呈棕黄色的BrdU阳性标记的移植细胞(图1)。BMSCs+bFGF组心室组织切片每高倍视野的BrdU阳性细胞数与BMSCs组比较,差异无统计学意义(5.13±1.89vs4.13±1.73,t=1.11,P=0.28)。
四、BMSCs移植对大鼠心室组织bFGF mRNA表达的影响
实时荧光定量PCR检测各组大鼠心室组织的bFGF表达情况,以正常对照组心室组织bFGF mRNA表达水平的相对定量值为1,其余各组大鼠心室组织bFGF mRNA表达的相对定量值除以正常对照组×100﹪表示。结果显示,模型组bFGF mRNA表达水平高于正常对照组(1.28±0.06vs1.00±0.00,t=10.46,P<0.01),BMSCs组高于模型组(1.37±0.05vs1.28±0.06,t=3.39,P<0.01),而BMSCs+bFGF组高于 BMSCs组(1.44±0.03vs1.37±0.05,t=2.86,P=0.01),差异均有统计学意义。

图1 光学显微镜下观察大鼠心脏心脏切片的BrdU免疫组化(SABC,×400)
五、BMSCs移植对大鼠心室组织bFGF蛋白表达的影响
Western Blotting法检测结果如图2、图3所示,正常对照组大鼠心室组织bFGF蛋白表达最低,模型组bFGF蛋白表达水平高于正常对照组(1.31 ± 0.09vs1.00 ± 0.00,t=5.48,P=0.01),BMSCs组高于模型组(1.46 ± 0.05vs1.31 ± 0.09,t=2.68,P=0.03),而 BMSCs+bFGF 组大鼠心室组织bFGF mRNA表达量最高,高于BMSCs组(1.84 ± 0.09vs1.46 ± 0.05,t=6.79,P<0.01)。

图2 Western Blotting法检测BMSCs移植对大鼠心室组织bFGF蛋白表达的影响
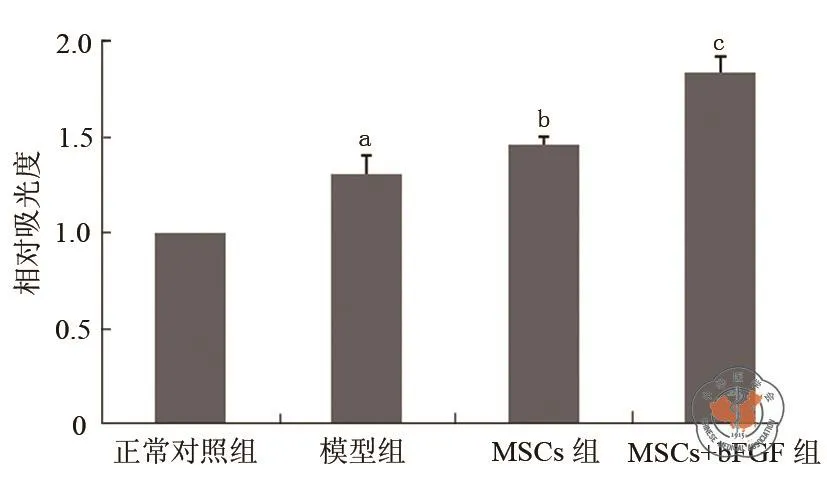
图3 Western Blotting法检测BMSCs移植对大鼠心室组织bFGF蛋白表达的影响
讨 论
非缺血性心肌病是由于心脏冠状动脉病变以外的原因所导致的一大类心肌疾病,发病隐匿,早期可无症状,发现时往往已发展到慢性充血性心力衰竭阶段[1]。与缺血性心肌病(主要是冠心病)不同,血管重建等手段并不能使非缺血性心肌病的病情得到缓解,晚期病人只能进行心脏移植。因此寻求新的治疗方法具有重要临床意义。本研究采用阿霉素诱导建立心肌病心力衰竭大鼠模型,这一成熟的造模方法已被广泛应用于动物实验[2-4,6]。本研究中发现,造模大鼠在连续腹腔注射阿霉素后,出现了进行性加重的心力衰竭异常症状,包括精神委靡、皮毛无光泽、消瘦、腹水(表现为腹部逐渐膨隆),甚至死亡;大鼠处死后,发现均有不同程度的腹水、肝淤血、胸水。生物信号采集处理系统行左心功能检测发现,模型组 LVSP、LV+dP/dt 和 LV-dP/dt均下降,而 LVDEP升高。这些症状、体征及检查指标,符合文献所报道的心力衰竭判断标准,表明心力衰竭的大鼠模型已成功建立[2-4,6]。
BMSCs具有多向分化潜能,在特定的诱导环境下可分化为心肌细胞,在细胞移植治疗方面具有巨大的应用前景[7-8]。早期的研究发现,心肌局部注射BMSCs,局部的心脏微环境可诱导移植到体内的BMSCs分化为心肌样细胞,后者可与原有心肌产生同步收缩,改善心脏功能[9]。进一步的研究发现,BMSCs具有特殊的“归巢”作用,受损心肌局部的微环境改变,可诱发静脉注射的BMSCs迁移到受损心肌处[10-11]。因此,本研究采用尾静脉注射的方法进行BMSCs移植。移植后心脏标本的免疫组织化学检查发现,在移植大鼠心脏标本的心肌间及血管壁上可见BrdU标记的移植细胞,表明有部分移植的BMSCs细胞“归巢”到受损心脏并在局部生存。
目前已有多个研究证实,采用BMSCs移植可改善阿霉素所致心肌病心力衰竭动物的心功能,但效果还不理想[2-4,6]。此外,越来越多的研究表明,BMSCs移植改善心功能的作用机制,除了直接分化为心肌样细胞外,更主要机制可能在于通过BMSCs的旁分泌作用,即通过释放多种细胞因子、抗凋亡因子、生长因子而促进心肌内源性修复、改善心功能[12-13]。鉴于BMSCs是基因治疗的理想靶细胞,如果能将在心脏修复中起重要作用的目的细胞因子基因转染至BMSCs后再进行移植,将基因治疗与细胞移植结合起来,必将增强BMSCs的旁分泌作用,促进心功能的恢复。
bFGF是成纤维细胞生长因子蛋白家族中的一员,是一种广谱的有丝分裂原,可刺激血管形成、促进创伤愈合,具有广泛的生物学作用[14]。bFGF与心肌肥大关系密切,其经AMPK传递的信号途径是介导压力超负荷所致心肌肥大的重要机制之一。研究证实,心力衰竭发生后,心脏组织bFGF的表达上升,且与心脏射血分数呈正相关[15]。心肌细胞是多肽生长因子调控的靶细胞,而bFGF可以自分泌及(或)旁分泌发挥作用[16]。动物研究发现,BMSCs旁分泌的细胞因子中,包括了bFGF等促血管生长因子,对受损心肌产生保护作用[13]。作为一种重要的目的基因,bFGF已被广泛用于BMSCs的基因修饰,移植治疗颅脑损伤、肺动脉高压、糖尿病、心肌梗塞等疾病[17-20],但目前尚无采用bFGF基因修饰的BMSCs移植治疗非缺血性心肌病的报道。
BFGF含量与本研究将bFGF基因成功转入BMSCs,再进行BMSCs移植,以使BMSCs分泌更多的bFGF,改善微环境,促进心功能的恢复。本研究实时定量PCR和Western Blotting结果显示,正常大鼠心室组织bFGF水平很低,在阿霉素诱导心肌损伤后,bFGF水平升高,可能与机体在心肌受损后的自我修复作用有关。BMSCs移植可增加心脏局部的bFGF水平,说明了BMSCs可通过上调bFGF水平而促进心功能恢复,与文献报道一致。而BMSCs+bFGF组大鼠心室组织bFGF水平最高,证实bFGF基因修饰后的BMSCs移植,可极大提高心脏局部的bFGF水平而发挥修复作用。BMSCs+bFGF组心室组织切片每个高倍视野的BrdU阳性细胞数高于BMSCs组,但差异无统计学意义,而BMSCs+bFGF组大鼠心脏组织bFGF蛋白的水平则升高,因此我们推测,其bFGF蛋白可能来源于“归巢”至心脏的BMSCs在心脏局部表达bFGF以及未归巢的BMSCs所分泌的bFGF两方面。与bFGF表达水平相一致的是,BMSCs组和BMSCs+bFGF组大鼠的心功能指标均较模型组好转,而BMSCs+bFGF组大鼠的心功能指标改善更为显著。
综上所述,转染bFGF基因的BMSCs移植可提高阿霉素所致心肌病心力衰竭大鼠心脏的bFGF水平,改善大鼠心功能,其效果优于单纯BMSCs移植。关于BMSCs的移植数量和基因转染的临床安全性、具体的作用机制等尚有待进一步研究。
1 彭澍, 吴平生. 曲美他嗪治疗中国人群非缺血性心肌病慢性心力衰竭临床疗效的Meta分析[J]. 临床荟萃, 2011, 26(21):1848-1851, 1855.
2 肖丽, 智永超. 骨髓间充质干细胞联合环磷酸腺苷葡胺治疗心力衰竭大鼠的实验研究[J]. 临床和实验医学杂志, 2017, 16(2):118-120.
3 艾金伟, 刘盈, 刘楚繁, 等. 自体骨髓间充质干细胞治疗扩张性心肌病:安全和有效性的Meta分析[J]. 中国组织工程研究, 2017,38(5):780-788.
4 侯永兰, 杨东伟. 静脉移植骨髓间充质干细胞对心肌病心力衰竭心功能的影响[J]. 2016, 20(23):3413-3418.
5 何作云, 冯兵, 周小波. 急性压力超负荷心脏局部碱性成纤维细胞生长因子和肾素血管紧张素系统的变化及其意义[J]. 中华心血管病杂志, 1999, 27(1):64-67.
6 王本臻, 毛成刚, 李荣, 等. 人脐带间充质干细胞肌肉注射对多柔比星诱导扩张型心肌病大鼠心功能及心肌超微结构的影响[J]. 中华实用儿科临床杂志, 2016, 31(1):28-32.
7 Huang J, Zhang Z, Guo J, et al. Genetic modi fi cation of mesenchymal stem cells overexpressing CCR1 increases cell viability, migration,engraftment, and capillary density in the injured myocardium[J]. Circ Res, 2010, 106(11):1753-1762.
8 Van Den Akker F, Deddens JC, Doevendans PA, et al. Cardiac stem cell therapy to modulate in fl ammation upon myocardial infarction[J].Biochim Biophys Acta, 2013, 1830(2):2449-2458.
9 Tse HF, Kwong YL, Chan JK, et al. Angiogenesis in ischaemic myocardium by intramyocardial autologous bone marrow mononuclear cell implantation[J]. Lancet, 2003, 361(9351):47-49.
10 Kocher AA, Schuster MD, Szabolcs MJ, et al. Neovascularization of ischemic myocardium by human bone-marrow-derived angioblasts prevents cardiomyocyte apoptosis, reduces remodeling and improves cardiac function[J]. Nat Med, 2001, 7(4):430-436.
11 Ciulla MM, Lazzari L, Pacchiana R, et al. Homing of peripherally injected bone marrow cells in rat after experimental myocardial injury[J]. Haematologica, 2003, 88(6):614-621.
12 冯吉. 骨髓间充质干细胞的旁分泌作用[J]. 重庆医学, 2011, 40(13):1332-1333.
13 Tang YL, Zhao Q, Qin X, et al. Paracrine action enhances the effects of autologous mesenchymal stem cell transplantation on vascular regeneration in rat model of myocardial infarction[J]. Ann Thorac Surg,2005, 80(1):229-236; discussion 236-237.
14 丁焕文, 何锡煌. 碱性成纤维细胞生长因子的生物学功能[J]. 中华创伤杂志, 1995 (3):189-191.
15 李琦, 张荣利, 李贻奎, 等. 心肌梗死后心力衰竭大鼠超声心动指标与体内VEGF,BNP的变化关系[J]. 现代检验医学杂志, 2009,24(1):73-75.
16 倪菁, 李伟明, 郭荣. 细胞内信号通路对心肌肥大调控作用的研究进展[J]. 临床与病理杂志, 2017, 37(1):168-176.
17 张琳, 居士明, 王敢, 等. 成纤维细胞生长因子修饰的骨髓间充质干细胞移植对颅脑损伤模型大鼠神经功能的改善机制分析[J]. 临床和实验医学杂志, 2016, 15(12):1137-1140.
18 宋燕峰, 曹洁. 碱性成纤维细胞生长因子转染骨髓间充质干细胞移植治疗肺动脉高压[J]. 中国组织工程研究, 2015, 19(6):918-922.
19 田雪品, 刘海英. 碱性成纤维细胞生长因子基因真核表达载体转染骨髓间充质干细胞移植治疗糖尿病[J]. 中国组织工程研究, 2016,20(36):5385-5391.
20 王晓艳, 苏又苏, 苏卓娃, 等. hbFGF基因治疗心肌梗死的实验研究[J]. 中西医结合心脑血管病杂志, 2009, 7(6):707-709.
2017-05-19)
(本文编辑:李少婷)
赖增华,窦学凯,贾春文,等.碱性成纤维生长因子转染骨髓间充质干细胞移植对心肌病心力衰竭大鼠心功能的影响[J/CD].中华细胞与干细胞杂志(电子版),2017,7(5):271-276.
Influence of transplantation with basic fibroblast growth factor gene-transfected bone mesenchymal stem cells on heart function in rats with heart failure
Lai Zenghua, Dou Xuekai,Jia Chunwen, Jiang Chaohui. Department of Cardiology, the 174th Hospital of the PLA, Affiliated Chenggong Hospital of Xiamen University, Xiamen 360001, China
Lai Zenghua, Email: laizenghua1984@163.com
ObjectiveTo explore the influence of transplantation with basic fibroblast growth factor (bFGF) gene-transfected bone mesenchymal stem cells (BMSCs) on heart function in rats with heart failure.MethodsA heart failure model of SD rats was induced by intraperitoneal injection with adriamycin. The 33 survived rats were randomly divided into 3 groups: a model group, a BMSCs group and a BMSCs+bFGF group (n=11 for all). Another 8 rats served as control.BMSCs at the third passage were transfected with bFGF and labeled with BrdU. BMSCs (3×106),bFGF-transfected BMSCs (3×106), or culture medium were respectively transplanted into rats via the tail vein. Cardiac function was evaluated with the use of a physiological recorder. The hearts were analyzed by immunohistochemical staining to identify the transplanted BrdU-labeled cells.The expressions of bFGF protein and mRNA in the heart tissues were respectively determined by Western Blotting and real time PCR. One-Way ANOVA or Fisher's exact test was used in the analysis as appropriately.ResultsFour weeks after transplantation, hemodynamic measurements showed LVSP (121.13±12.28) mmHg, LVDEP (3.86±1.25) mmHg, LV +dP/dt (3671.25±172.50) mmHg/s,LV-dP/dt (3221.63±259.57) mmHg/s in the normal control group; LVSP (81.29±12.39) mmHg,LVDEP (16.43±4.12) mmHg, LV+dP/dt (2344.29±98.63) mmHg/s, LV-dP/dt (2244.29±103.10)mmHg/s in the model group; LVSP (97.00±6.39) mmHg, LVDEP (12.00±2.73) mmHg, LV+dP/dt(2876.25±118.31) mmHg/s, LV-dP/dt (2726.25±303.23) mmHg/s in the BMSCs group, and LVSP(109.38±12.78) mmHg, LVDEP (9.25±1.67) mmHg, LV+dP/dt (3037.50±161.22) mmHg/s, LV-dP/dt (3000.13±149.77) mmHg/s in the BMSCs+bFGF group. The parameters were all significantly improved (F=17.29, 36.61, 111.11 and 26.54 respectively,Pall<0.01) after the transplantation.BrdU-labeled transplanted BMSCs could be found in the hearts of the recipients. The expression of bFGF mRNA in the heart tissues were significantly increased in the model group (1.28±0.06) than in the control group (t=10.46,P<0.01); in the BMSCs group (1.37±0.05) than in the model group (t=3.39,P<0.01); and in the BMSCs+bFGF group (1.44±0.03) than in the BMSCs group (t=2.86,P=0.01). As shown by Western Blotting test, the bFGF protein expression level of the heart tissues was the lowest in the normal control, but significantly higher in the model group than in the control group(1.31±0.09vs1.00±0.00,t=5.48,P=0.01), in the BMSCs group than in the model group (1.46 ±0.05vs1.31±0.09,t=2.68,P=0.03), and in the BMSCs+bFGF group than in the BMSCs group(1.84±0.09vs1.46±0.05,t=6.79,P<0.01).ConclusionTransplantation with BMSCs or bFGF-transfected BMSCs can both improve cardiac function in rats with adriamycin-induced heart failure,while the effect of bFGF-transfected BMSCs may be better than BMSCs only.
Basic fibroblast growth factor; Mesenchymal stem cells; Cell transplantation; Heart failure
10.3877/cma.j.issn.2095-1221.2017.05.004
360001 厦门,中国人民解放军第一七四医院(厦门大学附属成功医院)心内科
赖增华,Email:laizenghua1984@163.com
