超甜玉米果皮主要成分含量动态变化
2017-11-30张士龙贺正华焦春海杨园园黄益勤
张士龙+贺正华+焦春海+杨园园+黄益勤
摘要:以3份生育期一致、果皮柔嫩度存在梯度差異的超甜玉米(Zea mays L.)自交系为材料,探讨果皮细胞壁主要成分含量在子粒发育过程中的动态变化规律。结果表明,在湖北武汉(2014年春)和海南陵水(2014年冬),PE10(果皮柔嫩性好)、T105(果皮柔嫩性中)、S33205(果皮柔嫩性差)在授粉后第12~24天果皮半纤维素含量均呈逐渐增加的特点,木质素含量则呈单峰曲线变化,而纤维素含量始终在24%上下波动,果胶与灰分含量变化不大且没有明显的规律。在两种环境条件下,3份自交系除PE10在授粉后第12、14天外,其余各测试时间点的果皮主要成分含量均值由大到小的顺序始终为半纤维素、纤维素、木质素;授粉后第12天果皮的半纤维素含量均值由大到小的顺序均为S33205、T105、PE10,而PE10半纤维素平均累积速率大于T105和S33205;授粉后第12天至最大值时间段内的果皮木质素含量均值由大到小的顺序均为S33205、T105、PE10。环境改变影响半纤维素、木质素累积速率。
关键词:超甜玉米(Zea mays L.);果皮细胞壁;半纤维素含量;木质素含量;动态变化
中图分类号:S513 文献标识码:A 文章编号:0439-8114(2017)21-4023-04
DOI:10.14088/j.cnki.issn0439-8114.2017.21.007
Dynamic Variation of Main Ingredients in Pericarp of Super Sweet Corn
ZHANG Shi-long1,HE Zheng-hua1,JIAO Chun-hai2,YANG Yuan-yuan1,HUANG Yi-qin1,3
(1.Hubei Key Laboratory of Food Crop Germplasms and Genetic Improvement/Food Crop institute, Hubei Academy of Agricultural Science, Wuhan 430064, China; 2.Hubei Academy of Agricultural Science, Wuhan 430064, China; 3.Hubei Collaborative Innovation Center for Grain Industry, Yangtze University, Jinzhou 434025, Hubei, China)
Abstract: Three super sweet corn(Zea mays L.) inbreds with consistent growing season and gradient differences pericarp tenderness were used to investigate the dynamic variation law of main ingredient contents in pericarp cell wall during kernel growing. The results showed that for PE10(good pericarp tenderness),T105(medium pericarp tenderness) and S33205 (bad pericarp tenderness),from 12 to 24 days after pollination in the spring(Wuhan,Hubei) and winter(Lingshui,Hainan) of 2014,the cellulose content of pericarp presented the gradual increase feature;the lignin content appeared curve variation with a single peak;and the cellulose content fluctuated around 24% all the time. However,pectin and ash contents had weak change without obvious law. Under the two different circumstances,pericarp main ingredient average contents of three inbreds revealed the same descendant order of hemicellulose,cellulose,lignin except PE10 on the twelfth day and fourteenth day after pollination;Hemicellulose average content of pericarp indicated the same descendant order of S33205,T105,PE10 on the twelfth day after pollination;However,PE10 had higher average hemicellulose accumulation ratio than T105 and S33205;The content of pericarp presented the same descendant order of S33205,T105,PE10 from the twelfth day to the extremum day after pollination.The hemicellulose and lignin accumulation ratio were affected by circumstance change.endprint
Key words: super sweet corn(Zea mays L.); cell wall of pericarp; hemicellulose content; lignin content; dynamic variation
果皮柔嫩度作为衡量鲜食玉米(Zea mays L.)品质的重要指标[1-4],是一个受多种因素影响的复合品质性状,是国产品种品质进一步提高的瓶颈,在现代超甜玉米品质育种中正在被越来越多的育种家所重视。
甜玉米果皮是一层半透明状的薄膜,主要由细胞壁构成,其化学成分是纤维素、半纤维素、木质素、果胶多糖、灰分、油分和少量的淀粉及结构蛋白[5,6]。纤维素是自然界最为丰富的生物高分子之一[7],其结晶度阻碍生物质的酶消化[8-10]。半纤维素是一类异质多糖,在禾本科成熟的组织中主要以木聚糖的形式存在,能够阻碍植物木质纤维素结晶的形成从而提高生物质消化率[8]。木质素是一种非常稳定和复杂的疏水性酚类多聚物,主要由香豆醇、松柏醇、芥子醇构成[11,12],植株的易脆性与细胞壁的木质素含量有关[13-15]。
前人研究认为,超甜玉米子粒粗纤维含量较高[16];粗纤维与食用口感的相关系数为-0.965,达显著水平,粗纤维含量愈高,口感愈粗糙[17]。厚度并不是果皮柔嫩度的决定因素,但食用品质口感良好的超甜玉米不但要果皮薄、细胞层数少,而且还要具有果皮细胞壁纤维化和木质化程度低等特征[18]。果皮细胞壁的化学成分变化也可能影响甜玉米果皮柔嫩度。本研究采用硬度计法[19,20],系统探讨超甜玉米果皮主要化学成分含量的动态变化规律,以期为从化学成因角度解析果皮柔嫩度性状提供参考。
1 材料与方法
1.1 材料
所选用的3份超甜玉米自交系PE10(果皮柔嫩性好)、T105(果皮柔嫩性中)、S33205(果皮柔嫩性差)的子粒果皮柔嫩度存在梯度差异,且生育期一致,基因型为sh2sh2,均由湖北省农业科学院粮食作物研究所玉米课题组提供。
1.2 方法
1.2.1 材料种植和采样 在湖北省农业科学院粮食作物研究所核心试验基地选取地力均匀一致的地块种植上述3份材料。试验采用随机区组设计,3次重复。小区为4行区,每行种20株,行距0.67 m,株距0.33 m。管理方式同一般大田。2014年3月25日播种,6月上旬开花授粉。果穗吐丝前套上小纸袋,等同一份材料尽可能多的植株果穗吐丝齐后在同一天授粉。记载自交授粉时间。2014年11月12日再次以上述方案在海南省陵水县提蒙乡南繁试验基地种植上述试验材料及授粉。
3份材料均在套袋自交授粉后第12、14、16、18、20、22、24天取样。每次每份材料在小区中部随机选取10个典型果穗迅速保存于-70 ℃冰箱备用。
1.2.2 细胞壁成分分析 取出备用果穗样品,用刀片迅速剥取中部子粒冠部果皮,放在105 ℃下高温杀青20 min,然后于50 ℃条件下烘干至恒重。将烘干的果皮磨碎,过40目筛,保存在干燥器中备用。
1)样品的分馏及纤维素、半纤维素、木质素含量的测定。样品的分馏参考Peng等[21]和Xu等[8]的方法;纤维素、半纤维素、木质素以及灰分含量的测定参考Sluiter等[22]的方法。
2)果胶的测定。称取0.100 0 g干重样品,经过分馏去除可溶性糖、脂溶性物质及淀粉等成分获得样品沉淀,于沉淀中加入5.0 mL 0.5%(W/V)草酸铵,在沸水中加热1 h, 在这期间每隔10 min 摇匀,以免溶液表面的堆集。冷却后,3 000 g离心5 min,收集上清液。沉淀再依次用5 mL 0.5%草酸铵洗1次,5 mL去离子水洗2次, 收集所有上清液,定容。比色法测定Pentoses、Hexoses和糖醛酸。果胶含量为Pentoses、Hexoses、糖醛酸之和。
1.3 數据处理
采用Microsoft Excel软件对数据进行处理和作图。
2 结果与分析
2.1 超甜玉米果皮发育过程中主要成分含量动态变化
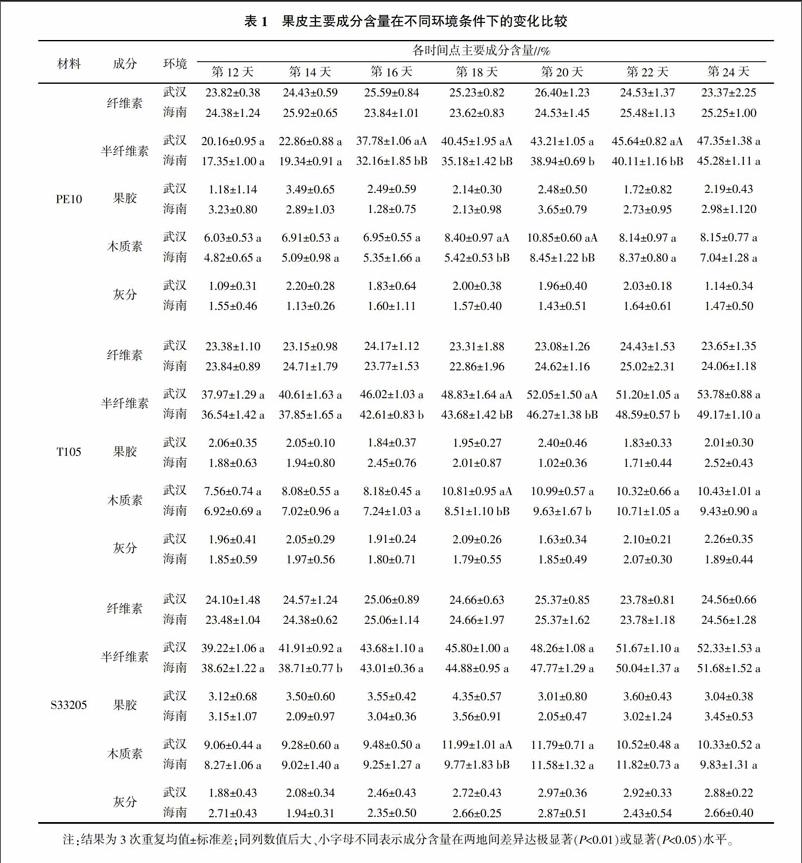
由表1可知,在授粉后第12~24天,在两种生长环境条件下,3份自交系果皮细胞壁主要成分中纤维素、半纤维素、木质素含量均明显高于果胶和灰分。除PE10授粉后第12、14天果皮纤维素含量大于半纤维素含量外,3份自交系果皮的主要成分含量均值的大小顺序始终为半纤维素>纤维素>木质素,这一规律不受生长环境影响。随着子粒的生长发育,3份自交系果皮半纤维素含量均呈现由小到大的逐渐增加特点;木质素含量则呈现单峰曲线变化,而纤维素含量始终在24%上下波动,果胶与灰分含量变化不大且没有明显的规律。
然而,果皮主要成分含量变化自交系间也有着各自的特点。授粉后第12~24天,PE10果皮半纤维素含量变幅在2014年春、冬季分别为27.19、27.93百分点,明显高于T105(15.81、12.63百分点)和S33205(13.11、13.06百分点),说明在子粒发育过程中,就果皮半纤维素累积速度而言,PE10大于T105和S33205。PE10在2014年春、冬季授粉后第12天和第24天的半纤维素含量分别为20.16%、17.35%和47.35%、45.28%,则明显低于T105(37.97%、36.54%和53.78%、49.17%)和S33205(39.22%、38.62%和52.33%、51.68%),且无论是春季还是冬季,授粉后第12天的半纤维素含量均值大小顺序均为S33205>T105>PE10。
随着子粒的生长发育,3份自交系果皮木质素含量均逐渐增加,达到峰值后略微下降稳定在一个较高的水平。在2014年春、秋两季达到最大值的时间各材料间有差异,PE10果皮木质素含量在两种环境条件下均在授粉后第20天达到最大值;而T105在春、冬季分别于授粉后第20、22天达到最大值,间隔2 d;S33205则分别在授粉后第18、22天达到最大值,间隔4 d。在2014年春季,3个自交系授粉后第12~24天木质素含量变幅大小顺序均为PE10>T105>S33205,而冬季则变为T105>PE10>S33205。在两种环境条件下,木质素含量在授粉后第12天至达到最大值前的均值大小顺序均为S33205>T105>PE10。endprint
2.2 果皮主要成分含量在不同環境条件下的动态变化比较
将果皮主要成分含量在两种环境条件下进行比较发现,PE10和T105在授粉后第12、14及24天春、冬两季间果皮半纤维素含量比较接近,差异不显著(表1),而在第16、18、20、22天则差异达显著或极显著水平,且在授粉后第12~24天各测定时间点的果皮半纤维素平均含量春季均高于冬季;S33205虽然在除第14天外的6个测定时间点春、冬两季间差异不显著,但是各测定时间点的果皮半纤维素平均含量春季均高于冬季。木质素含量均值亦呈现与半纤维素相似的特点,在各测试时间点,果皮木质素含量均值绝大多数春季高于冬季。除PE10外,T105与S33205的冬季木质素含量峰值均大于相同测试时间点的春季木质素含量。上述结果表明,果皮半纤维素和木质素的积累速率2014年春季(湖北武汉)明显高于2014年冬季(海南陵水)。3份材料的果皮纤维素、果胶、灰分含量均值在各测定时间点差异无明显规律(表1)。
3 小结与讨论
在鲜食超甜玉米生产实践中,果皮柔嫩度因关系到产品的口感好坏而受到高度重视,而人们对最适采收期果皮的柔嫩性尤为关注,因此本研究只对授粉后第12~24天,即灌浆初期-乳熟期-乳熟后期的果皮主要成分含量的变化规律进行了探讨。
在本试验测试时间段内,3份自交系果皮半纤维素含量均呈现由小到大逐渐增加的特点,木质素含量则呈现单峰曲线变化,而纤维素含量始终在24%上下波动,果胶与灰分含量变化不大且没有明显的规律。3份自交系果皮的纤维素、半纤维素、木质素含量均明显高于果胶和灰分含量。在两种环境条件下,除PE10在授粉后第12、14天外,3份自交系其余各测试时间点的果皮主要成分含量均值的大小顺序始终为半纤维素>纤维素>木质素;授粉后第12天果皮的半纤维素含量均值大小顺序均为S33205>T105>PE10,而PE10半纤维素累积平均速率大于T105和S33205;授粉后第12天至最大值时间段内的果皮木质素含量均值大小顺序均为S33205>T105>PE10。环境改变影响半纤维素、木质素累积速率。
参考文献:
[1] KRAMER A,GUYER R B,IDE L E. Factors affecting the objective and organoleptic evaluation of quality in sweet corn[J].Proceedings of the American Society for Horticultural Science,1949,54:342-356.
[2] GLENN M T,JAMES L,BREWBAKER J L. Genetic advance through mass selection for tenderness in sweet corn[J].J Amer Soc Hort Sci,1981,106(4):496-499.
[3] TRACY F,GALINAT W C. Thickness and cell layer number of the pericarp of sweet corn and some of its relatives[J].Hort Sci,1987,22(4):645-647.
[4] TRACY W F,JUVIK J A. Pericarp thickness of a sh2 population of maize selected for improved field emergence[J].Crop Sci,1989,29(1):72-74.
[5] ROONEY L W,MCDONOUGH C M,ANDRADE F H. The corn kernel[A].Corn:Origin,History,Technology and Production[C].Hoboken,NJ:John Wiley,2004.
[6] KEEGSTRA K. Plant cell walls[J].Plant Physiol,2010,154:483-486.
[7] CLOWES F A L,JUNIPER B E. Plant Cells[M].Oxford,UK: Blackwell Scientific Publications,1968.
[8] XU N,ZHANG W,REN S,et al. Hemicelluloses negatively affect lignocellulose crystallinity for high biomass digestibility under NaOH and H2SO4 pretreatments in Miscanthus[J].Biotechnol Biofuels,2012,5:58.
[9] LAUREANO-PEREZ L,TEYMOURI F,ALIZADEH H,et al. Understanding factors that limit enzymatic hydrolysis of biomass characterization of pretreated corn stover[J].Appl Biochem Biotechnol 2005,121-124:1081-1099.
[10] ZHANG W,YI Z,HUANG J,et al. Three lignocellulose features that distinctively affect biomass enzymatic digestibility under NaOH and H2SO4 pretreatments in Miscanthus[J].Bioresour Technol,2013,130:30-37.endprint
[11] RALPH J,LUNDQUIST K,BRUNOW G,et al. Lignins:Natural polymers from oxidative coupling of 4-hydroxyphenylpropanoids[J].Phytochem Rev,2004,3:29-40.
[12] GRABBER J H. How do lignin composition, structure, and cross-linking affect degradability?A review of cell wall model studies[J].Crop Sci,2005,45:820-831.
[13] TURNER,S R,SOMERVILLE,C R. Collapsed xylem phenotype of Arabidopsis identifies mutants deficient in cellulose deposition in the secondary cell wall[J].Plant Cell,1997,9:689-701.
[14] KOKUBO A,KUAISHI S,SAKURAI N. Culm strength of barley:Correlation among maximum bending stress,cell wall dimensions,and cellulose content[J].Plant Physiol,1989,91:876-882.
[15] KOKUBO A,SAKURAI N,KURAISHI S,et al. Culm brittleness of barley mutants is caused by smaller number of cellulose molecules in cell wall[J].Plant Physiol,1991,97:509-514.
[16] 王世恒,馮凤琴,徐仁政.超甜玉米营养品质分析[J].玉米科学,2004,12(1):61-62.
[17] 乐素菊,刘厚诚,张 璧,等.超甜玉米籽粒乳熟期碳水化合物变化及食用品质[J].华南农业大学学报(自然科学版),2003, 24(2):9-11.
[18] 乐素菊,肖德兴,刘鹏飞,等.超甜玉米果皮结构与籽粒柔嫩性的关系[J].作物学报,2011,37(11):2111-2116.
[19] HALE T A,HASSELL R L,PHILLIPS T,et al. Penetrometer and taste panel perception of pericarp tenderness in su,se, and sh2 sweet corn at three maturities[J].HortTechnology,2004,14(4):521-524.
[20] 张士龙,潘 登,王青峰,等.果实硬度计评定鲜食玉米果皮柔嫩度的可行性[J].作物杂志,2012(3):62-65.
[21] PENG L,HOCART CH,REDMOND J W,et al. Fractionation of carbohydrates in Arabidopsis root cell walls shows that three radial swelling loci are specifically involved in cellulose production[J].Planta,2000,211:406-414.
[22] SLUITER A,HAMES B,RUIZ R,et al. Determination of structural carbohydrates and lignin in biomass[EB/OL].https://www.nrel.gov/docs/gen/fy13/42618.pdf,2012-08-03.endprint
