生理性根吸收过程中乳牙牙髓干细胞通过α7 nAChR调节破骨细胞分化能力的研究
2017-11-30汪璐璐袁帅杜样周志斐邬礼政王小竞
汪璐璐 袁帅 杜样 周志斐 邬礼政 王小竞
生理性根吸收过程中乳牙牙髓干细胞通过α7 nAChR调节破骨细胞分化能力的研究
汪璐璐 袁帅 杜样 周志斐 邬礼政 王小竞
目的探讨生理性根吸收过程中乳牙牙髓干细胞(DDPSCs)通过 α7 亚型烟碱型乙酰胆碱受体(α7 nAChR)对破骨分化能力的调节作用。方法酶消化法和有限稀释法分离培养根吸收不同时期DDPSCs和恒牙牙髓干细胞(DPSCs)。采用实时定量PCR和Western blot,检测各组细胞α7 nAChR、RANKL、OPG的表达及其比值差异,以及阻断α7 nAChR后RANKL、OPG的表达及其比值变化。结果α7 nAChR表达及RANKL/OPG比值在根吸收中期DDPSCs中明显升高(Plt;0.05)。 阻断α7 nAChR后,RANKL/OPG明显下降(Plt;0.05)。结论在乳牙生理性根吸收过程中,α7 nAChR通过上调自身表达,参与对RANKL/OPG的调节,影响DDPSCs的破骨分化能力。
生理性根吸收; 乳牙牙髓干细胞; 烟碱型乙酰胆碱受体α7亚型
乳牙生理性根吸收是乳恒牙替换及恒牙咬合顺利建立的前提条件[1]。目前对于牙根吸收的认识主要集中于成骨细胞与破骨细胞所主导的骨吸收过程[2]。其中,RANKL和OPG在破骨细胞的分化成熟中发挥着重要作用[3-4]。乳牙牙髓干细胞(deciduous dental stem cells, DDPSCs)能够调控自身RANKL/OPG的表达[5],在乳牙生理性根吸收中发挥作用,但具体调控机制尚不清楚。α7亚型烟碱型乙酰胆碱受体(alpha 7 nicotinic acetylcholine receptors,α7 nAChR)被证实可介导骨吸收以及调控破骨细胞生成[6-7]。
本实验检测了α7 nAChR在不同根吸收时期DDPSCs中的表达及其对RANKL/OPG比值的影响,旨在探讨生理性根吸收过程中DDPSCs通过α7 nAChR对破骨分化能力的调节作用。
1 材料与方法
1.1 主要材料和试剂
12 颗6~7 岁儿童因乳牙滞留拔除的健康乳切牙和4 颗14 岁患者因正畸需要拔除的健康第一前磨牙(第四军医大学口腔医院儿童口腔科、颌面外科);α-MEM培养液,链霉素,青霉素钠,胎牛血清(Gibco,美国);Trizol Reagent(Invitrogen,美国);反转录试剂盒,Syber Green荧光定量PCR试剂盒(TaKaRa,日本);兔抗人β-actin抗体,兔抗人α7nAChR抗体,兔抗人RANKL抗体,兔抗人OPG抗体,山羊抗兔IgM二抗(Abcam,美国);PVDF膜(DUPONT,美国);甘氨酸,丙烯酰胺,过硫酸氨(AP),TEMED,Tris(上海生物工程公司);PCR仪,蛋白电泳仪,半干电转膜仪(BIO-RAD,美国);实时定量PCR系统(ABS7500,美国);培清扫描分析系统(上海培清)。
1.2 DDPSCs和恒牙牙髓干细胞的分离、培养
临床检查乳牙松动度,排除药物过敏史、全身疾病史以及家族遗传病史。将乳牙分为3 个时期:稳定期乳牙,乳牙根基本完整尚未吸收;吸收中期乳牙,乳牙根纵向吸收面处于牙根长度1/3~2/3;吸收晚期乳牙,吸收超过根长度2/3。
消毒后劈开牙齿取出牙髓。采用酶消化法(胶原酶消化60 min后组织块接种至6孔板)获取原代DDPSCs和恒牙牙髓干细胞(dental pulp stem cells, DPSCs)。采用有限稀释法克隆纯化。各组细胞分别标记为:稳定期(S),吸收中期(M),吸收晚期(F),恒牙组(P)。
1.3 α-BTX处理M组DDPSCs
取第4代M组DDPSCs,以 1×105个/ml接种于6孔板中。待其密度达到80%时向培养液中加入α-BTX(10-8mol/L),培养24 h。
1.4 实时定量PCR 检测
Trizol法提取第4代各期DDPSCs和DPSCs总RNA,反转录合成cDNA。以cDNA为模板,以β-actin为内参,采用ABI7500荧光实时定量PCR系统检测α7 nAChR、RANKL、OPG表达情况,实验重复3 次。各引物序列见表 1。
1.5 Western blot 检测
提取第4代各期DDPSCs和DPSCs总蛋白。根据测定的蛋白样品浓度确定上样量,保证每孔蛋白量一致,用10%SDS-PAGE胶进行电泳。电泳后将蛋白转移至PVDF膜,加入1∶1 000稀释的一抗4 ℃孵育过夜;TBST洗膜,二抗37 ℃孵育1 h;免疫反应条带用ECL增强化学发光(参照说明书)。对扫描条带用image-J进行平均灰度值测定,实验重复3 次。

表 1 各分子基因扩增引物序列
1.6 统计方法
采用SPSS 16.0计算机统计分析软件对所得数据进行分析。数据组间差异采用单因素方差分析方法(one-way ANOVA)进行统计,各组间两两比较采用t检验。Plt;0.05 表示差异具有统计学意义。
2 结 果
2.1 各期 DDPSCs 和 DDPSCs 形态
原代培养2 d后组织块呈颗粒状松解散开,5~7 d后组织块周围有牙髓细胞爬出,呈长梭形,胞核圆且占据胞体大部,两侧细胞突纤细较长(图 1A)。20 d左右细胞已长至6孔板底面积约3/4,细胞均呈放射或漩涡状分布排列(图 1B)。DPSCs与根吸收各期DDPSCs相比,爬出时间相对较晚,为7~10 d左右,胞体相对较大,但形态基本相似(图 2)。
2.2 不同根吸收期DDPSCs和DPSCs中α7 nAChR、RANKL和OPG的表达
实时定量PCR结果显示,α7 nAChR在M组DDPSCs中表达明显升高(Plt;0.05),RANKL/OPG基因表达比值也在M组显著升高(图 3A)(Plt;0.05)。
Western blot结果提示,M组DDPSCs中α7 nAChR和RANKL的表达显著高于其他各组(Plt;0.05),而OPG的表达在M组显著下调,RANKL/OPG蛋白表达比值在M组显著升高(图 3B,Plt;0.05)。与实时定量PCR结果一致。
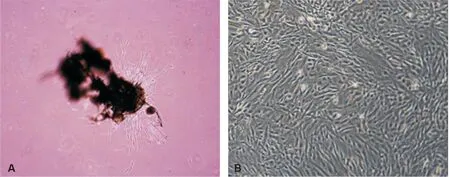
A: 5~7 d后细胞爬出; B: 20 d左右细胞形态
图 1 DDPSCs和DPSCs原代培养(×40)
A: Cells around tissue block after 5-7 day culture; B: Cells after 20 day culture
Fig 1 The primary culture of DDPSCs and DPSCs(×40)

A: S组DDPSCs; B: M组DDPSCs; C: F组DDPSCs; D:DPSCs
图 2 各组DDPSCs和DPSCs形态(×40)
A: DDPSCs of S group; B: DDPSCs of M group; C: DDPSCs of F group; D: DPSCs
Fig 2 Morphology of DDPSCs and DPSCs(×40)

A: α7 nAChR、RANKL/OPG的基因表达; B: α7 nAChR、RANKL/OPG蛋白表达
2.3 阻断DDPSCs α7 nAChR后RANKL/OPG比值的变化
实时定量PCR结果显示,α7 nAChR拮抗剂α-BTX作用24 h后,M组DDPSCs中RANKL/OPG比值显著下降(图 4A),差异具有统计学意义(Plt;0.05)。Western blot结果显示:α-BTX作用24 h后,M组DDPSCs中RANKL蛋白表达明显下降,而OPG表达则显著上升,其比值随之下降(图 4B,Plt;0.05),蛋白结果与实时定量PCR结果一致。

A: RANKL/OPG基因表达比值; B: RANKL和OPG蛋白表达
3 讨 论
生理性根吸收常起始于牙根外侧且靠近继承恒牙胚[8]。在继承恒牙胚先天缺失的情况下,牙根同样能缓慢吸收, 且吸收多起始于牙根髓腔一侧[9]。已有研究证实,在根吸收期的乳牙牙髓中,RANKL表达明显高于恒牙牙髓,提示牙髓可能参与调节牙根吸收[5]。恒牙和乳牙牙髓中均存在干细胞龛,可在外界刺激下快速增殖分化并参与组织修复[4,10-11]。
前期实验证实,尼古丁可通过与牙周膜细胞表达的α7 nAChR上调NF-κB、IL-1、IL-6、TNF-α等炎性因子的表达,还能通过CD4+T细胞,调控RANKL/OPG的比值,加重牙周组织炎性反应和支持骨组织的丧失[12-13]。同时还证实α7 nAChR可通过激活Wnt信号通路,调控成骨/破骨过程[14]。
目前已经证实,乳牙根吸收的过程存在吸收活跃期与静止期的交替[15]。因此,本实验将乳牙分为稳定期(S),吸收中期(M)和吸收晚期(F)3 组, 并加入恒牙组(P)作对照,分别进行DDPSCs和DPSCs的分离、培养。
本实验对各期DDPSCs和DPSCs中α7 nAChR的表达进行了检测,结果提示其基因和蛋白表达在M组DDPSCs中表达明显高于其他各组。结合根吸收进程的各期特点和前期研究所揭示的α7 nAChR在骨质吸收中的调节作用,作者认为,在乳牙生理性根吸收过程中,α7 nAChR同样可能参与了对DDPSCs的调控。
本实验在基因和蛋白水平检测了各组DDPSCs和DPSCs中RANKL和OPG的表达水平。目前较常采用计算RANKL/OPG比值的方法来具体呈现细胞破骨能力的高低[16]。本实验发现在破牙吸收较活跃的吸收中期,即M组DDPSCs中RANKL/OPG比值最高,说明DDPSCs可以促进这一时期破骨细胞的分化。在吸收晚期,RANKL/OPG比值明显下降,表示其调节破骨分化能力也随之下降。这一趋势也与α7 nAChR表达水平变化一致。
本实验对α7 nAChR高表达的M期DDPSCs进行干预,使用α-BTX阻断该受体后检测RANKL和OPG的基因/蛋白表达。结果显示,α7 nAChR被阻断后,DDPSCs中RANKL表达明显下降,而OPG表达上升,RANKL/OPG比值显著下降。进一步提示在乳牙生理性根吸收过程中,DDPSCs可能通过高于非吸收期的表达α7 nAChR参与对下游RANKL/OPG的调节,进而影响破骨调节能力的发挥。综上所述,本实验创新性的探究了α7 nAChR与乳牙生理性根吸收的关联,证实了DDPSCs中的特异性变构受体α7 nAChR可通过一定的细胞内分子途径调节RANKL/OPG比值,进而影响DDPSCs对破骨分化的调控能力。为乳牙生理性根吸收过程和乳恒牙替换机制的研究提供理论依据,也为临床上预防、治疗乳牙滞留以及保留继承恒牙胚缺失的乳牙提供新的思路。
[1] Sahara N. Cellular events at the onset of physiological root resorption in rabbit deciduous teeth[J]. Anat Rec, 2001, 264(4):387-396.
[2] Obersztyn A. Experimental investigation of factors causing resorption of deciduoud teeth[J]. J Dent Res, 1963, 42: 660-674.
[3] Ten Cate AR. Oral histology: Development, structure, and function[J]. Elsevier SP, 1990, 48(1):98-99 .
[4] Miura M, Gronthos S, Zhao M, et al. SHED: Stem cells from human exfoliated deciduous teeth[J]. Proc Natl Acad Sci USA, 2003, 100(10): 5807-5812.
[5] Zhu Y, Shang L, Chen X, et al. Deciduous dental pulp stem cells are involved in osteoclastogenesis during physiologic root resorption[J]. J Cell Physiol, 2013, 228(1):207-215.
[6] Grando SA, Kawashima K, Wessler I. Introduction: The non-neuronal cholinergic system in humans[J]. Life Sci, 2003, 72(18-19): 2009-2012.
[7] Mandl P, Hayer S, Karonitsch T, et al. Nicotinic acetylcholine receptors modulate osteoclastogenesis[J]. Art Res Ther, 2016, 18: 63.
[8] Harokopakis-Hajishengallis E. Physiologic root resorption in primary teeth: Molecular and histological events[J]. J Oral Sci, 2007, 49(1): 1-12.
[9] 杨杰, 赵玉鸣, 葛立宏. 恒牙胚缺失动物模型的建立及相应乳牙牙根的吸收[J]. 北京大学学报(医学版), 2008, 40(1): 60-63.
[10]路博闻,刘娜,徐璐璐, 等. 人脱落乳牙牙髓干细胞与人恒牙牙髓干细胞成骨分化及破骨能力的差异[J]. 南方医科大学学报, 2016, 36(2):180-185.
[11]孙艳艳,袁梦桐,胡伟平. 牙髓干细胞的研究与应用[J]. 实用口腔医学杂志, 2016,32(3):426-429.
[12]Wu Z, Zhou Y, Zhou Z, et al. Nicotine induces the production of IL-1β and IL-8 via the α7 nAChR/NF-κB pathway in human periodontal ligament cells: Aninvitrostudy[J]. Cell Physiol Biochem, 2014, 34(2): 423-431.
[13]Wu LZ, Duan DM, Liu YF, et al. Nicotine favors osteoclastogenesis in human PDL cells co-cultured with CD4+T cells by up-regulating IL-1β [J]. Int J Mol Med, 2013, 31(4): 938-942.
[14]Zhou ZF, Li B, Liu F, et al. Nicotine deteriorates the osteogenic differentiation of periodontal ligament stem cells through α7 nicotinic acetylcholine receptor regulating Wnt pathway[J]. PLoS One, 2013, 8(12): e83102.
[15]Li B, Zhang Y, Wang Q, et al. Periodontal Ligament Stem Cells Modulate Root Resorption of Human Primary Teeth via Runx2 Regulating RANKL/OPG System[J]. Stem Cells Dev, 2014, 23(20): 2524-2534.
[16]Silva I, Branco JC. Rank/Rankl/opg: Literature review[J]. Acta Reumatol Port, 2011, 36: 209-218.
(收稿: 2016-09-18 修回: 2016-10-17)
Decidiuousdentalpulpstemcellsregulatetheosteoclastdifferentiationviaα7nAChRduringphysiologicalrootresorption
WANGLulu1,YUANShuai1,DUYang1,ZHOUZhifei1,WULizheng2,WANGXiaojing1.
1. 710032Xi'an,StateKeyLaboratoryofMilitaryStomatologyamp;NationalClinicalResearchCenterforOralDiseasesamp;ShaanxiClinicalResearchCenterforOralDiseases,DepartmentofPediatricDentistry,SchoolofStomatology,TheFourthMilitaryMedicalUniversity,China; 2.DepartmentofStomatology,AffiliatedHospitalofLogisticUniversityofChinesePeople'sArmedPoliceForces,Tianjin
Objective: To explore the ability of decidiuous dental pulp stem cells(DDPSCs) in the regulation of osteoclast differentiation via α7 nAChR during physiological root resorption.MethodsDDPSCs from deciduous teeth in different stages of physiological root resorption and from permanent teeth were respectively culturedinvitro. Expression of α7 nAChR, RANKL and OPG were detected by quantitative real-time PCR and western blot analysis respectively. After α7 nAChR were blocked, expression difference of RANKL/OPG were detected again.ResultsThe expression of α7 nAChR and RANKL/OPG was upregulated in the middle stage of root resorption(Plt;0.05). When α7 nAChR were blocked, the expression ratio of RANKL/OPG was decreased significantly both in gene and protein levels(Plt;0.05).ConclusionDuring the procedure of physiological root resorption of deciduous teeth, the expression of α7 nAChR is up regulated and the osteoclast differentiation of DDPSCs is affected by the RANKL/OPG expression change.
Physiologicalrootresorption;Deciduousdentalpulpstemcells;Alpha7nicotinicacetylcholinereceptors
国家自然科学基金(编号: 81470743, 81500805)
710032 西安, 军事口腔医学国家重点实验室, 国家口腔疾病临床医学研究中心, 陕西省口腔疾病临床医学研究中心,第四军医大学口腔医院儿童口腔科(汪璐璐 袁帅 杜样 周志斐 王小竞); 中国人民武装警察部队后勤学院附属医院口腔科(邬礼政)
王小竞 E-mail: wxjing@fmmu.edu.cn
R780.2
A
10.3969/j.issn.1001-3733.2017.02.012
