EGCG和EGCG-3Me对根管牙本质粘接界面稳定性的作用
2017-11-30余昊翰张凌李芳刘正雅李银花陈吉华
余昊翰 张凌 李芳 刘正雅 李银花 陈吉华
EGCG和EGCG-3Me对根管牙本质粘接界面稳定性的作用
余昊翰 张凌 李芳 刘正雅 李银花 陈吉华
目的评价表没食子儿茶素没食子酸酯(EGCG)及其甲基化修饰物(EGCG-3Me)改性粘接剂对根管牙本质粘接界面稳定性的作用。方法将质量浓度为400 μg/ml的EGCG及EGCG-3Me添加到全酸蚀粘接剂Single Bond 2(SB2)中,制备改性粘接剂E-SB2及E3-SB2,SB2为对照组。激光共聚焦显微镜和分光光度法检测改性粘接剂抗粪肠球菌的性能。微拉曼光谱仪检测粘接剂双键转化率。制备纤维桩粘接试件,用于即刻和老化后的微推出实验。结果改性粘接剂可以抑制粪肠球菌生物膜形成,且EGCG-3Me作用更显著。 改性粘接剂与SB2的双键转化率和即刻微推出粘接强度差异无显著性(Pgt;0.05)。老化后改性粘接剂的微推出粘接强度显著高于SB2(Plt;0.05)。结论EGCG和EGCG-3Me改性的粘接剂均可抑制粪肠球菌增殖并提高树脂-根管牙本质粘接界面稳定性,EGCG-3Me抗菌性能较佳。
表没食子儿茶素没食子酸酯(EGCG); 甲基化表没食子儿茶素没食子酸酯(EGCG-3Me); 抗菌; 双键转化率; 微推出粘接强度; 冷热循环
纤维桩在残根、残冠的保存治疗中应用越来越广泛,已逐渐取代传统的铸造桩核金属桩成为主流的修复方式。但是,近年来纤维桩修复的远期成功率成为备受广大学者和临床医生关注的问题[1-2]。细菌感染、继发龋以及纤维桩失去粘接力从根管中脱落都是导致纤维桩修复失败的常见问题[3-4]。因此,开发具有抗菌和提高根管牙本质粘接稳定性的功能性粘接剂,是延长纤维桩修复体使用寿命的一项有效措施。本研究拟通过EGCG及EGCG-3Me对牙本质粘接剂进行功能改性,测定改性后粘接剂对根管常见致病菌粪肠球菌的抗菌性能、粘接剂双键转化率(degree of conversion,DC)以及冷热循环老化前后粘接剂与根管牙本质的粘接性能,初步探索EGCG及EGCG-3Me功能改性的粘接剂对根管牙本质粘接界面稳定性的作用,以期为提高纤维桩远期修复效果提供依据。
1 材料与方法
1.1 材料与设备
全酸蚀粘接剂Single Bond 2(N689951,3M ESPE,美国);复合树脂FiltekTM Z250(N655907,3M ESPE,美国);35%磷酸凝胶Ultra-Etch(ET4N6437,Ultradent Products,美国);脑心浸液培养基(Gibco,美国);EGCG标准品[(-)-Epigallocatechin gallate analytical standard, Sigma, 美国];EGCG-3Me(实验室制备);紫外可见分光光度计(UV-2550,Shimadzu,日本);LED光固化灯( EliparTMS10,3M ESPE,美国);活死菌染色试剂盒LIVE/DEAD®BacLightTMBacterial Viability Kit L7012(Molecular Probes,美国);慢速金刚石刀片切割机(沈阳科晶自动化设备制造有限公司);超声波细胞粉碎仪(天津科莱恩);万能材料试验机(AGS-10-KN,Shimadzu,日本);激光共聚焦显微镜(FluoViewTMFV1000,Olympus,日本);微拉曼光谱仪(HR800,Horiba JOBIN YVON,法国)。
1.2 改性粘接剂的制备
参考Du等[5]方法将EGCG和EGCG-3Me粉末以400 μg/ml的浓度添加至商品粘接剂Single Bond 2(SB2)中并充分搅拌,制备成改性粘接剂样本。实验分组如下:①EGCG 400 μg/ml改性Single Bond 2(E-SB2);②EGCG-3Me 400 μg/ml改性Single Bond 2(E3-SB2);③Single Bond 2(SB2)。
1.3 改性粘接剂抗菌性能检测
1.3.1 试件制备 粘接剂抗菌性能检测的试件制备参考Du等[5]的实验。每组制备6 个试件,环氧乙烷熏蒸消毒,分装备用[6]。
1.3.2 细菌培养及接种 根据文献报道[5],进行细菌培养及接种,菌种ATCC 29212由第四军医大学口腔医院检验科提供。细菌培养完成后对各组试件进行漂洗,并按照随机数字表随机分成2 组,每组3 个,分别用于激光共聚焦显微镜及分光光度计检测。
1.3.3 试件表面生物膜观察 根据Fang等[6]的描述,对试件表面细菌生物膜进行染色和观察。使用激光共聚焦显微镜配套软件FV10-ASW 3.1 Viewer(Olympus,日本)采集并分析图像。
参考Du等的实验[5],检测每组试件表面生物膜混悬液的A600值,每组最终值取各组试件检测值的平均值。
1.4 微推出粘接强度测试
1.4.1 根管预备及纤维桩粘接 经患者知情同意,取因牙周病或正畸治疗需要拔除的无龋单根前磨牙30 颗,按照随机数字表随机分为3 组,每组10 颗。参考Zhang等[7]的研究,对牙根进行根管预备和桩道预备,采用全酸蚀粘接技术,分别使用上述3 种粘接剂和RelyX-ARC(3M ESPE,美国)树脂水门汀粘固纤维桩。每个实验组的试件随机分为2 个亚组,分别用于即刻微推出粘接强度测试和老化处理后进行微推出粘接强度测试。本研究使用冷热循环5 000 次作为老化方式(5 ℃和55 ℃水浴,各温度浸渍时间60 s)。
1.4.2 微推出粘接强度测试 参考Zhang[7]等的研究,制备微推出粘接强度测试试件并参考其测试参数进行测试。探头加载速度为0.5 mm/min,将应力-时间曲线上波形陡降处的应力值计为最大断裂载荷处Fmax(N)。使用游标卡尺测量试件纤维桩横截面冠向半径R(mm),根向半径r(mm)和厚度H(mm),数据精确到0.01 mm。用如下公式计算粘接面积S(mm2)以及粘接强度P(MPa):P=Fmax/S,S=π(R+r)[H2+ (R-r)2]1/2。
1.5 双键转化率测试
取人无龋单根前磨牙18 颗,按照随机数字表随机分为3 组,每组6 颗。按照方法“1.4.1”进行根管预备和桩道预备。每组取3 颗牙根,沿牙体长轴的方向纵劈为二等份,暴露根管牙本质。表面酸蚀处理后涂布各组粘接剂,置于微拉曼光谱仪下,选取牙根上、中、下3 个部分随机进行点检测。每组剩余的3颗牙根,按照“1.4.1”中描述的方法进行纤维桩粘接,然后将牙根沿牙体长轴纵分为二。选取牙根上、中、下3 个部分选取随机位置,按照根方牙本质→粘接剂→树脂水门汀的顺序进行线扫。使用配套软件LabSpec 5采集光谱图,使用Origin 9.0软件对数据进行分析处理,得到粘接剂固化前特征峰值:记为r1 640 cm-1和r1 608 cm-1;粘接剂固化后特征峰值:记为R1 640 cm-1和R1 608 cm-1。用下面的公式计算粘接剂的双键转化率(degree of conversion,DC)[8]:
DC(%)=[1-(R1 640 cm-1/R1 608 cm-1)/(r1 640 cm-1/r1 608 cm-1)]× 100(%)
1.6 统计分析
各实验数据均具备方差齐性(Levene's test,Plt;0.05),使用SPSS 13.0软件(SPSS Inc, Chicago, USA)对微推出粘接强度测试结果进行双因素方差分析,试件表面生物膜A600值以及双键转化率进行单因素方差分析,选择Tukey检验进行组间两两比较,Plt;0.05认为差异具有统计学意义。
2 结 果
2.1 抗菌性能
荧光染色标记后,激光共聚焦显微镜下,活着的细菌被染为绿色,死亡的细菌被染为红色(图 1)。SB2组粘接剂固化后表面粘附着一层非常密集的细菌(图 1A),其中死亡细菌(红色)占总细菌量的比例很小;E-SB2组粘接剂表面细菌总数量较SB2组明显减少(图 1B),且死亡细菌(红色)所占比例有所增加。E3-SB2组粘接剂表面细菌与SB2组和E-SB2组相比,细菌总量显著减少,而且死亡细菌(红色)占总菌量比例明显增加(图 1C)。
试件表面生物膜吸光度值A600值结果见图 2。本实验中,A600值可以反应试件表面附着的细菌的数量。单因素方差分析显示,粘接剂种类对A600值有显著影响(Plt;0.001)。组间两两比较显示,E3-SB2组最低, E-SB2组及SB-2组依次升高(Plt;0.001)。
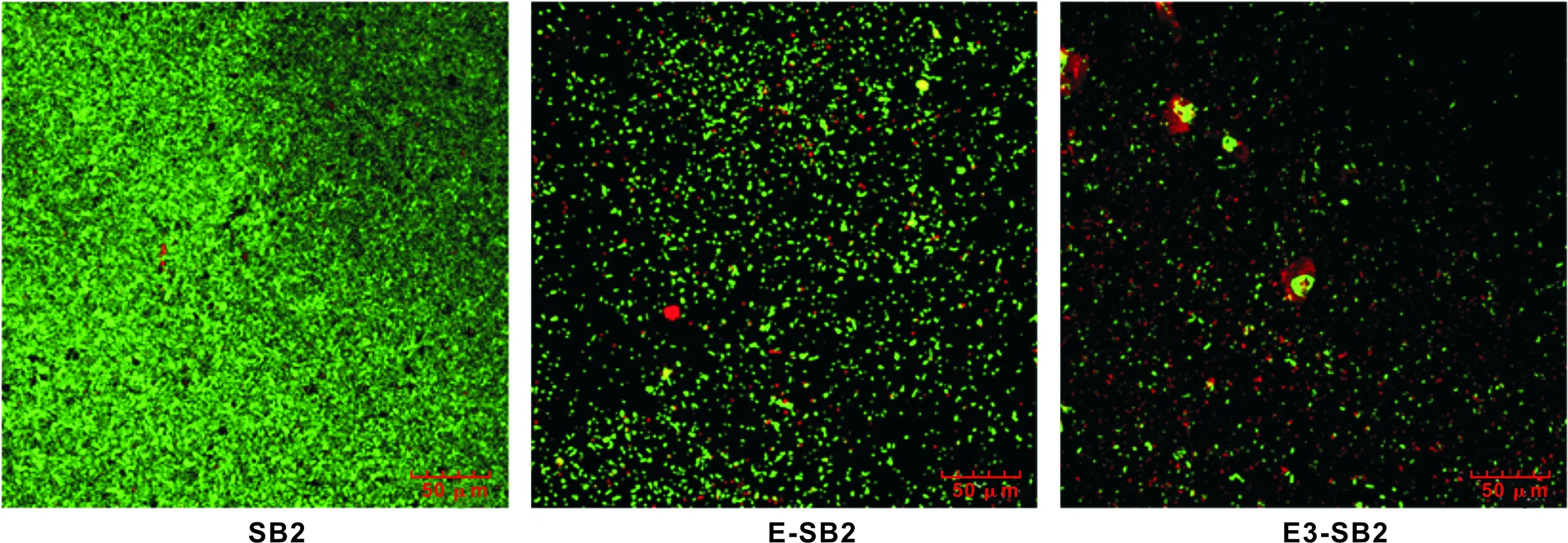
图 1 固化后粘接剂表面细菌生物膜的激光共聚焦显微镜观察

图 2 固化后粘接剂表面细菌生物膜A600值
Fig 2 A600values of E. faecalis biofilms on the specimens of cured adhesives
2.2 微推出粘接强度测试
各实验组微推出粘接强度的平均值和标准差见表 1。双因素方差分析显示,粘接剂种类对微推出粘接强度无显著影响(P=0.477),老化处理对微推出粘接强度有显著影响(P=0.004),粘接剂种类和老化处理之间无显著交互作用(P=0.261)。Tukey检验组间两两比较显示,各实验组间的即刻微推出粘接强度差异无显著性(Pgt;0.05)。冷热循环老化5 000 次后,各组微推出粘接强度较老化前均呈现下降趋势(Plt;0.05)。老化后,E-SB2和E3-SB2组微推出粘接强度均明显高于SB2组(Plt;0.05),E-SB2组和E3-SB2组老化后的微推出粘接强度无统计学差异(Pgt;0.05)。
2.3 粘接剂双键转化率测试


Tab 1 Push-out bond strength (MPa, ±s, n=10)
注: 同一列间,相同数字表示差异无统计学意义(Pgt;0.05);同一行间,相同的大写字母表示差异无统计学意义(Pgt;0.05)
各实验组双键转化率的平均值和标准差见表 2。单因素方差分析显示,粘接剂种类对双键转化率无显著影响(Pgt;0.05)。组间两两比较显示,对照组3 种粘接剂的双键转化率差异均无显著性(Pgt;0.05)。


Tab 2 Conversion rate of the adhensives (MPa, ±s, n=6)
注: 同一列间,相同大写字母表示差异无统计学意义,Pgt;0.05
3 讨 论
粪肠球菌(Enterococcusfaecalis,E.faecalis)是根管内最常见的致病细菌之一[9]。牙本质-树脂粘接界面在口腔中因温度变化、咬合力以及粘接剂本身性能等影响产生微渗漏[10],有利于细菌侵入牙体组织,进而引发修复体边缘继发龋或根管的逆行性感染[10]。EGCG可以抑制多种革兰氏阳性细菌,将EGCG添加至粘接剂中,其抗菌作用不随水存老化时间的延长而减弱[5]。然而,EGCG稳定性较差,在生理条件下易发生变性[11]。EGCG-3Me稳定性好,更易溶于血液,且抗过敏、抗血管紧张素、抗结核分枝杆菌等方面均优于EGCG[12-14]。激光共聚焦显微镜观察显示,当EGCG和EGCG-3Me的浓度为400 μg/ml时,试件表面粘附的细菌总数量明显下降且细菌中死菌数量明显增加。同浓度下,EGCG-3Me对粪肠球菌生长的抑制作用更强。A600结果显示,E-SB2和E3-SB2组的试件表面粪肠球菌生物膜的细菌数量显著低于SB2组,且E3-SB2组低于E-SB2组(Plt;0.05)。EGCG可能通过抑制细菌的叶酸代谢、诱导细菌内氧化应激的发生或产生羟自由基等机制杀伤细菌[5,15]。此外,它可以减少粪肠球菌分泌明胶酶、胶原链接抗原、细胞溶素以及蛋白酶等毒力因子的能力,抑制细菌生物膜的形成[16]。EGCG-3Me对某些革兰氏阳性菌的抗菌作用弱于EGCG[11],可能是因为EGCG-3Me结构中的一个羟基被甲基所取代,其产生羟自由基的能力减弱,进而其抗菌效果降低。本研究中,EGCG-3Me改性的粘接剂表现出更好的抗粪肠球菌生物膜形成的作用。可能是EGCG-3Me结构中的甲基增强了分子的稳定性和亲脂性,有利于EGCG-3Me的稳定及其与细菌细胞膜的结合能力,进而增强其抗菌效果[17]。
“MMPs(基质金属蛋白酶)降解牙本质胶原”被认为是牙本质-树脂粘接界面退变的主要机制[18]。氯己定、乙二胺四乙酸、季铵盐类抗菌单体等外源性MMPs抑制剂被学者们用来抑制MMPs的活性,从而保护牙本质-树脂粘接界面[19]。研究证明,EGCG对MMP-2和MMP-9有明显的抑制作用[20],EGCG改性粘接剂可以促进冠方牙本质粘接的稳定性[5]。EGCG及EGCG-3Me为茶叶提取物,相较于化学类MMPs抑制剂毒性小,应用于口腔中更安全[5]。冷热循环老化5 000 次可以加速冠方牙本质-树脂粘接界面的退行性变[21]。本研究中,各组微推出粘接强度在冷热循环老化5 000 次后均显著降低,证实冷热循环5 000 次用于模拟纤维桩修复体在口内的老化效果的可行性。微推出粘接强度测试显示, EGCG和EGCG-3Me可以显著提高树脂-根管牙本质粘接界面的稳定性。EGCG和EGCG-3Me可能是通过抑制牙本质源性MMPs的活性,进而提高树脂-根管牙本质粘接界面的稳定性。学者认为,EGCG通过改变MMPs的结构、与锌离子发生螯合作用影响MMPs活化来抑制MMPs的作用[20]。EGCG-3Me对MMPs的抑制作用目前尚未见报道,其作用机制可能与EGCG相似。有报道称,随着EGCG结构中甲基的增多,其对蛋白酶体的抑制作用降低[11];同时有研究发现,随着结构中甲基的增多,EGCG对血管紧张素转化酶的抑制作用有所提高[12]。本研究的结果显示,EGCG-3Me及EGCG改性粘接剂冷热循环5 000 次后的微推出粘接强度差异无显著性,提示2 种物质提高树脂-根管牙本质粘接界面稳定性的作用相近。然而,EGCG-3Me在中性以及碱性环境中,稳定性均优于EGCG。在长期复杂的口腔环境中,EGCG-3Me可能会表现出更持久的生物活性作用。在后期的实验中,我们将通过检测EGCG和EGCG-3Me对牙源性MMPs活性的抑制作用,深入探讨它们抗MMPs的作用以及提高根管牙本质粘接界面稳定性的可能机制。
双键转化率的结果显示,在EGCG和EGCG-3Me的添加浓度为400 μg/ml时,粘接剂固化性能并未受到影响。Du等[5]采用了傅里叶红外光谱法检测粘接剂双键转化率,发现当EGCG的添加量达到300 μg/ml时,粘接剂双键转化率轻微下降,但数值无统计学差异。两种检测方法所得到的结果一致。因此,采用离体牙-纤维桩粘接模型和微拉曼光谱仪检测粘接剂双键转化率是一种可靠的方法,具有较好的研究前景。
4 结 论
综上所述,本研究初步证明将400 μg/ml EGCG和EGCG-3Me添加到全酸蚀粘接剂Single Bond 2中对其进行功能改性具有可行性。改性粘接剂E3-SB2较E-SB2 表现出更好的抗粪肠球菌的作用。提示改性粘接剂E3-SB2用于有根尖周感染或根管感染病史的患牙的纤维桩修复,具有更好的远期应用前景。
[1] Baba NZ, Golden G, Goodacre CJ. Nonmetallic prefabricated dowels: A review of compositions, properties, laboratory, and clinical test results[J]. J Prosthodont, 2009, 18(6):527-536.
[2] Cagidiaco MC, Goracci C, Garcia-Godoy F, et al. Clinical studies of fiber posts: A literature review[J]. Int J Prosthodont, 2008, 21(4):328-336.
[3] Pashley DH, Tay FR, Yiu C, et al. Collagen degradation by host-derived enzymes during aging[J]. J Dent Res, 2004, 83(3):216-221.
[4] Weerheijm KL, Kreulen CM, de Soet JJ, et al. Bacterial counts in carious dentine under restorations: 2-yearinvivoeffects[J]. Caries Res, 1999, 33(2):130-134.
[5] Du X, Huang X, Huang C, et al. Epigallocatechin-3-gallate(EGCG) enhances the therapeutic activity of a dental adhesive[J]. J Dent, 2012, 40(6):485-492.
[6] Liu F, Weir MD, Chen J, et al. Comparison of quaternary ammonium-containing with nanosilver-containing adhesive in antibacterial properties and cytotoxicity[J]. Dent Mater, 2013, 29(4):450-461.
[7] Zhang L, Magni E, Radovic I, et al. Effect of curing modes of dual-curing luting systems and root regions on retention of translucent fiber posts in root canals[J]. J Adhes Dent, 2008, 10(3):219-226.
[8] 沈丽娟, 刘瑞瑞, 方明,等. 原花青素预处理对全酸蚀粘接系统双键转化率的影响[J]. 实用口腔医学杂志, 2013, 29(5):734-736.
[9] Nair PN. On the causes of persistent apical periodontitis: A review[J]. Int Endod J, 2006, 39(4):249-281.
[10]Sakaguchi RL. Review of the current status and challenges for dental posterior restorative composites: Clinical, chemistry, and physical behavior considerations. Summary of discussion from the Portland Composites Symposium(POCOS) June 17-19, 2004, Oregon Health and Science University, Portland, Oregon[J]. Dent Mater, 2005, 21(1):3-6.
[11]Huo C, Wan SB, Lam WH, et al. The challenge of developing green tea polyphenols as therapeutic agents[J]. Inflammopharmacology, 2008, 16(5):248-252.
[12]Kurita I, Maeda-Yamamoto M, Tachibana H, et al. Antihypertensive effect of Benifuuki tea containing O-methylated EGCG[J]. J Agric Food Chem, 2010, 58(3):1903-1908.
[13]Maeda-Yamamoto M, Ema K, Monobe M, et al. Epicatechin-3-O-(3''-O-methyl)-gallate content in various tea cultivars(Camellia sinensis L.) and itsinvitroinhibitory effect on histamine release[J]. J Agric Food Chem, 2012, 60(9): 2165-2170.
[14]Yang H, Landis-Piwowar K, Chan TH, et al. Green tea polyphenols as proteasome inhibitors: Implication in chemoprevention[J]. Curr Cancer Drug Targets, 2011, 11(3):296-306.
[15]Xu X, Zhou XD, Wu CD. The tea catechin epigallocatechin gallate suppresses cariogenic virulence factors ofStreptococcusmutans[J]. Antimicrob Agents Chemother, 2011, 55(3):1229-1236.
[16]Lee P, Tan KS. Effects of Epigallocatechin gallate againstEnterococcusfaecalisbiofilm and virulence[J]. Arch Oral Biol, 2015, 60(3):393-399.
[17]Kirita M, Honma D, Tanaka Y, et al. Cloning of a novel O-methyltransferase from Camellia sinensis and synthesis of o-methylated EGCG and evaluation of their bioactivity[J]. J Agric Food Chem, 2010, 58(12):7196-7201.
[18]Liu Y, Tjäderhane L, Breschi L, et al. Limitations in bonding to dentin and experimental strategies to prevent bond degradation[J]. J Dent Res, 2011, 90(8):953-968.
[19]Carrilho MR, Geraldeli S, Tay F, et al.Invivopreservation of the hybrid layer by chlorhexidine[J]. J Dent Res, 2007, 86(6):529-533.
[20]Demeule M, Brossard M, Pagé M, et al. Matrix metalloproteinase inhibition by green tea catechins[J]. Biochim Biophys Acta, 2000, 1478(1):51-60.
[21]徐帅, 张凌, 李芳,等. 三种老化方式对全酸蚀粘接系统牙本质粘接界面稳定性的影响[J]. 中华口腔医学杂志, 2014, 49(6): 367-370.
(收稿: 2016-09-30 修回: 2016-10-10)
TheeffectsofEGCGandEGCG-3Meonthebondingstabilityofdentin-adhensivetointraradiculardentin
YUHaohan1,ZHANGLing1,LIFang1,LIUZhengya1,LIYinhua2,CHENJihua1.
1. 710032Xi'an,StateKeyLaboratoryofMilitaryStomatologyamp;NationalClinicalResearchCenterforOralDiseasesamp;ShaanxiKeyLaboratoryofStomatology,DepartmentofProsthodontics,SchoolofStomatology,TheFourthMilitaryMedicalUniversity,China; 2.NationalResearchCenterofEngineeringTechnologyforUtilizetionofFunctionalIngredientsfromBotanicals,KeyLaboratoryofTeaScience,MinistryofEducation,HunanAgriculturalUniversity,Changsha
Objective: To evaluate the effect of epigallocatechin-3-gallate(EGCG) and epigallocatechin-3-O-(3-O-methyl)-gallate(EGCG-3Me) on the anti-bacterial effect and the stability of intraradicular dentin-adhesive interface.MethodsEGCG and EGCG-3Me with the concentration of 400 μg/ml were incorporated into Single Bond 2(SB2) respectively to obtain 2 modified adhesives E-SB2 and E3-SB2. Confocal laser scanning microscopy(CLSM) and ultraviolet spectrophotometry were used to evaluate the anti-bacterial effect of the modified adhesives. Micro-Raman spectrum was used to test the degree of conversion(DC) of the adhesives. Push-out bond strength test was conducted to examine the immediate bond strength and the bond strength after themocycling.ResultsE-SB2 and E3-SB2 both showed inhibiting effect on the proliferation ofE.faecalis, while E3-SB2 performed stronger inhibiting effect. DC and the immediate push-out bond strength of SB2 were not decreased with the incorporation of EGCG or EGCG-3Me(Pgt;0.05). E-SB2 and E3-SB2 showed significantly higher push-out bond strengths than that of SB2(Plt;0.05) after themocycling.ConclusionEGCG and EGCG-3Me modified adhesives have anti-bacterial effect and can enhance the stability of bonding between intraradicular dentin and adhesive,EGCG-3Me may have stronger anti-bacterial effect.
Epigallocatechin-3-gallate(EGCG);Epigallocatechin-3-O-(3-O-methyl)-Gallate(EGCG-3Me);Anti-bacterial;Degreeofconversion;Push-outbondstrength;Thermocycling
国家自然科学基金(编号: 51373198,81130078,81571019); 陕西省科技统筹创新工程计划项目(编号: 2015KTCL03-08); 长江学者和创新团队发展计划(编号: IRT13051)
710032 西安, 军事口腔医学国家重点实验室, 口腔疾病国家临床医学研究中心, 陕西省口腔医学重点实验室, 第四军医大学口腔医院修复科(余昊翰 张凌 李芳 刘正雅 陈吉华); 国家植物功能成分利用工程技术研究中心, 湖南农业大学茶学教育部重点实验室(李银花)
张凌 029-84776467 E-mail: ciaociaofan@qq.com
R783.1
A
10.3969/j.issn.1001-3733.2017.02.007
