珊瑚中五环半缩醛甾体的结构解析
2017-11-29吴嘉诚林嘉莉廖赣莉廖小健徐石海
吴嘉诚,林嘉莉,廖赣莉,廖小健,徐石海
(暨南大学 化学系,广东 广州 510632)
珊瑚中五环半缩醛甾体的结构解析
吴嘉诚,林嘉莉,廖赣莉,廖小健,徐石海*
(暨南大学 化学系,广东 广州 510632)
为研究珊瑚Sinulariasp.中五环半缩醛甾醇的分离与结构,运用普通色谱及高效液相色谱等色谱方法对珊瑚Sinulariasp.中五环半缩醛甾醇化合物进行分离纯化,通过分析该化合物的核磁共振谱与质谱确定其平面结构,测定并比较圆二色光谱计算值确定化合物的立体构型。结果从珊瑚Sinulariasp.中首次分离纯化得到结构独特的五环半缩醛甾醇化合物(8R,9S,10R,13R,14S,17R,18R,20S,22R)-胆甾-1,4-二烯-18-乙酰基-22-氧-3-酮-18,22-环缩醛。
珊瑚;五环半缩醛甾醇;结构解析
珊瑚属于腔肠动物门,其所生存的珊瑚礁生态系统中生物物种十分丰富,各种生物之间对食物和空间的竞争激烈。研究发现,珊瑚所产生的次级代谢产物在自卫防御系统中发挥着重要作用。生活在珊瑚礁环境中的柳珊瑚、软珊瑚等低等无脊椎动物具有排斥海藻生长,防止其它生物特别是污损生物附着的能力,多年来一直是化学家和药物学家研究的热点之一[1-2]。Sinularia属短指软珊瑚为珊瑚虫纲(Anthozoa)、八放珊瑚亚纲(Octocorallia)、海鸡冠目(或称软珊瑚目、Alcyona- cea)、海鸡殖亚目(Akyoniina)、海鸡冠科(Alcyoniid化)。据报道Sinularia属约有185个物种,其中涉及天然产物研究的有50多种,发现的次级代谢产物以甾醇、萜类、聚酮为主,这些次级代谢产物具有广泛的生物活性,如抗肿瘤、抗炎、抗附着、抑菌等,因此该属软珊瑚引起了国内外许多研究者的关注[3-12]。为进一步从珊瑚Sinulariasp.中发现抗肿瘤及抗海洋污损活性化合物,本课题组对珊瑚Sinulariasp.的活性成分进行了系统分离、分析、结构鉴定及活性测试,对从珊瑚Sinulariasp.中首次分离得到的结构特殊的五环半缩醛甾体进行结构解析。该化合物对藤壶(Balanus amphitrite)幼虫显示出较弱的抑制附着活性,EC50值为20.3 μg/mL;同时该化合物对人体宫颈癌细胞株(HeLa)具有较弱的抑制活性,IC50值为16.3 μg/mL[13]。
1 实验部分
1.1 材 料
样品珊瑚Sinulariasp.于2014年5月采自中国湛江硇洲岛,种属由荷兰阿姆斯特丹大学Rob van Soest教授鉴定。标本现保存于暨南大学化学系有机化学教研室,编号为2014-06。
1.2 仪器及测定条件
5-X国产显微熔点测定仪(上海精密科学仪器有限公司),温度计未校正;MAT95XP高分辨质谱仪;VG ZAB-HS液相色谱-质谱联用仪;日本电子JASCO J-180 型圆二色谱仪;1H NMR、13C NMR用Bruker-500型核磁共振波谱仪(德国Bruker公司)测定,以四甲基硅烷(TMS)为内标。1H NMR测定采用BBO多核正相液体探头,频率500 MHz;13C NMR测定采用BBO多核正相液体探头,频率125 MHz,以CDCl3(氘代氯仿)为溶剂。
1.3 样品制备
将新鲜的珊瑚Sinulariasp.样品(湿重5 kg)粉碎后,用95%乙醇浸提30 d,浓缩,重复3次,再用三氯甲烷-甲醇(体积比1∶1)浸提15 d,浓缩,重复2次,合并提取液,减压浓缩得褐色浸膏,将浓缩浸膏用乙酸乙酯萃取,萃取液浓缩得到乙酸乙酯相45 g。将乙酸乙酯相过常压硅胶柱层析,先用极性逐渐增加的石油醚-乙酸乙酯(100∶0~0∶100)体系进行梯度洗脱,再用极性逐渐增加的乙酸乙酯-甲醇(100∶0~ 0∶100)体系进行梯度洗脱。从石油醚-乙酸乙酯(体积比70∶30)洗脱液中得白色粉末,经HPLC纯化得到单体化合物(12 mg)。
2 结果与讨论
2.1 数据分析
通过HRESIMS[(m/z477.299 3[M + Na]+)(计算值为:477.299 4)谱,确定化合物的分子式为C29H42O4,具有9个不饱和度。
化合物的紫外光谱在245 nm处有最大吸收,红外光谱在 1 663、 1 635 cm-1处有较强吸收,提示该化合物含有α,β-不饱和酮基。分析其13C NMR(图1)及DEPT谱,推导该化合物具有甾体骨架[11]。该化合物含有5个甲基、8个亚甲基、11个次甲基及5个季碳信号;具有9个不饱和度,其中甾体骨架4个环具有4个不饱和度,两个双键δC155.8、127.5,δC123.9、169.1及两个羰基δC186.4、169.7;共8个不饱和度,还有1个不饱和度可能是分子中存在另一个环。分析13C NMR与1H NMR图发现,与正常的甾醇骨架相比,该化合物缺少18位的甲基及22位的亚甲基信号,但多出1个缩醛碳δC93.6及缩醛氢δH5.69信号,推断此分子含有1个缩醛环,因此推测该化合物是一个具有五环半缩醛的甾体骨架。

图1 化合物的13C NMR 谱(CDCl3,125 MHz)Fig.1 13C NMR spectrum(CDCl3,125 MHz) of the compound
2.2 NMR 信号归属
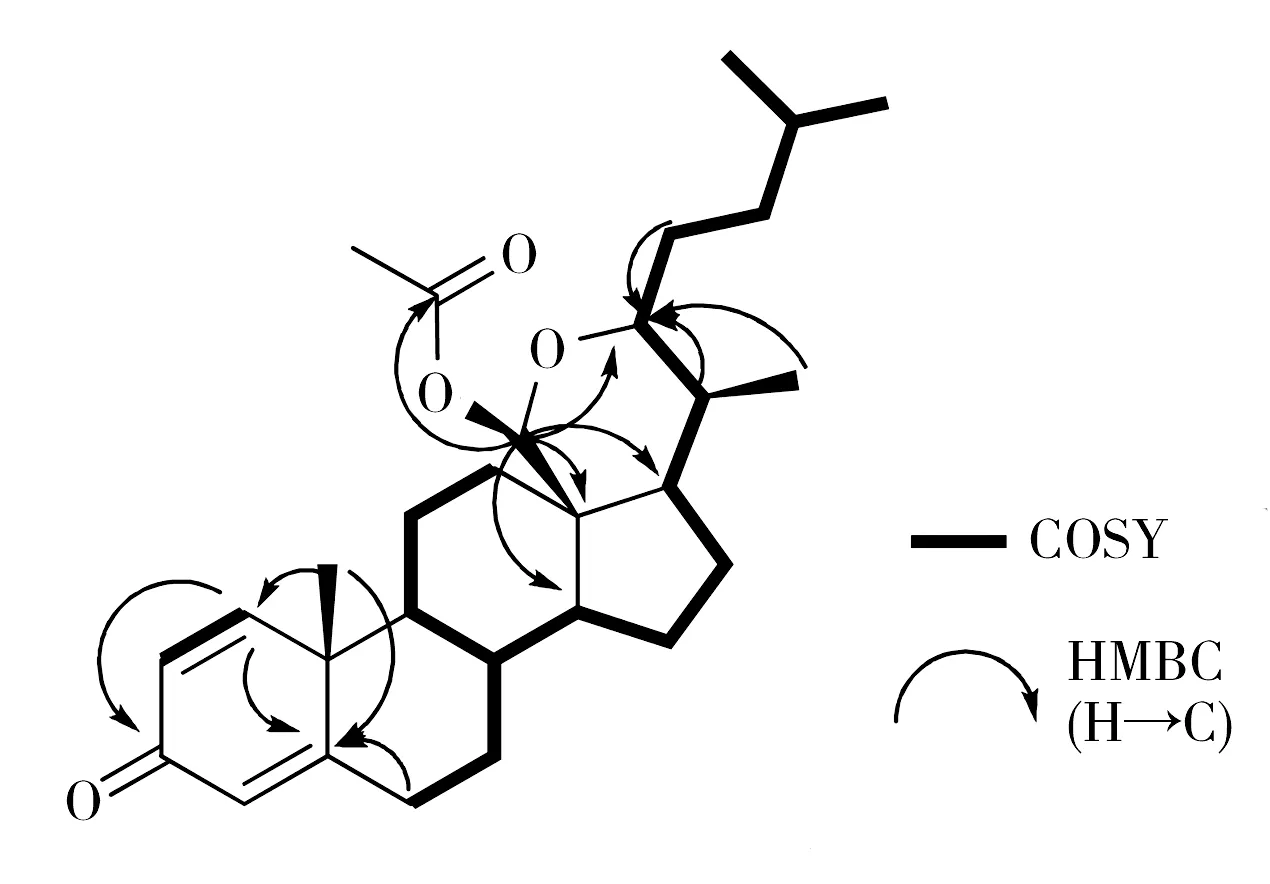
图2 化合物的主要1H-1H COSY 和 HMBC相关Fig.2 Key 1H-1H COSY and HMBC correlations of the compound
1H NMR谱 和COSY谱显示有3个ABX自旋体系的(三组)烯基氢信号存在, 化学位移分别为δH7.04(d,J=10.0 Hz)、6.22(dd,J=2.0,10.0 Hz) 和6.06(br. w),同时13C NMR 低场区有信号δC155.8、127.5、186.4、123.9和169.7存在,进一步表明分子中含有1,4-二烯-3-酮单元[13]。分析1H NMR谱(表1),提示分子中含有2个单峰甲基信号,化学位移分别为:δH1.22(s) 和2.18(s); 3个双峰甲基信号,化学位移分别为:δH0.79(d,J=7.0 Hz)、0.87(d,J=6.5 Hz) 和 0.88(d,J=6.5 Hz);同时还有1个具有三重峰连氧次甲基δH3.54(m) 和1个单峰连氧次甲基δH5.69(s)。分析该化合物的HMBC谱图,发现如下明显的相关关系: H-18(δH5.69) 与C-12(δC30.9)/C-13(δC45.4)/C-14 (δC54.3)/C-17(δC53.2)/C-28(δC169.4)(图2),提示C-18是1个缩醛碳原子,乙酰化发生在C-18位的羟基上。另外,1H-1H COSY 相关谱;以及HMBC 谱中C-22(δC78.2) 与 H-20(δH1.83,m)/H-21(δH0.79,d,J=7.0 Hz)/H-23(δH1.34,m)均有相关,提示C-22是1个连氧碳。进一步研究HMBC图谱发现,H-18(δH5.69) 与 C-22(δC78.2)明显相关,再结合化合物的分子式与不饱和度,推断该化合物是一个结构新颖的五环甾醇,第5个新环是C-18 和C-22 之间通过1个氧原子相连而形成的1个新的四氢吡喃环,据此建立了该化合物的平面结构[15]。

表1 化合物的1H NMR(500 MHz) 和 13C NMR(75 MHz) 数据(CDCl3溶剂)Table 1 1H NMR(500 MHz) and 13C NMR(75 MHz) data of compound in CDCl3
*HMBC correlations are from proton(s) stated to the indicated carbon

图3 化合物的主要NOESY 相关Fig.3 Key NOESY correlations of the compound

图4 化合物的实验和计算CD谱图Fig.4 Experimental and calculated CD spectra for the compound
2.3相对立体结构分析
通过NOESY 谱确定了化合物的相对立体构型(图3)。H-8(δH1.67,m) 与H-18(δH5.69,s)/H-19(δH1.22,s);以及H-14(δH1.14,m) 与H-17(δH1.64,m) 均有明显的NOE相关,表明A/B/C/D环之间均为反式骈合相连。H-18/H-21之间的NOE相关信号表明这些基团处于同一面上, H-18(δH6.27,s) 与H-22之间没有NOE 相关信号,所以推测该化合物的相对立体构型为8R*,9S*,10R*,13R*,14S*,17R*,18R*,20S*,22R*。
2.4 绝对立体结构的确证
分子的绝对构型用量子化学方法分析得到,通过比较模拟计算和实验得到的CD谱图来推测化合物的绝对构型,该方法已成功应用于有机化合物尤其是天然产物绝对构型的解析[16-17]。采用 TDDFT方法,在 B3LYP/6-31G(d) 水平上计算得到化合物的CD 谱图。计算结果表明,该化合物的计算CD 和实验CD曲线非常相似(图 4)。所以,化合物的绝对构型为8R,9S,10R,13R,14S,17R,18R,20S,22R。
3 结 论
利用相色谱技术首次从珊瑚Sinulariasp.中分离纯化得到五环半缩醛甾醇化合物,通过核磁共振谱与质谱分析、测试并计算其ECD确定此化合物为(8R,9S,10R,13R,14S,17R,18R,20S,22R)-胆甾-1,4-二烯-18-乙酰基-22-氧-3-酮-18,22-环缩醛。该化合物体外对人体宫颈癌细胞株(HeLa)具有较弱的抑制作用,通过进一步的结构修饰,可能为海洋新药研究提供先导化合物分子模型[13]。
[1] Pan Y C,Zeng L M.J.Instrum.Anal.(盘永才,曾陇梅.分析测试学报),2006,25(1):133-138.
[2] Liu H,Su J Y,Zeng L M.J.Instrum.Anal.(刘虹,苏镜娱,曾陇梅.分析测试学报),2004,23(3):13-17.
[3] Peng C H,Yin P H,Ou Y F,Xu S H.J.Instrum.Anal.(彭彩华,尹平河,欧云付,徐石海.分析测试学报),2010,29(3):302-305.
[4] Tsai T C,Chen H Y,Sheu J H,Chiang M Y,Wen Z H,Dai C F,Su J H.J.Agric.FoodChem.,2015,63(32):7211-7218.
[5] Tseng Y J,Yang Y C,Wang S K,Duh C Y.Mar.Drugs.,2014,12(6):3371-3380.
[6] Su C C,Wong B S,Chin C,Wu Y J,Su J H.Int.J.Mol.Sci.,2014,14(7): 4317-4325.
[7] Lei L F,Chen M F,Wang T,He X X,Liu B X,Deng Y,Chen X J,Li Y T,Guan S Y,Yao J H,Li W,Ye W C,Zhang D M,Zhang C X.Tetrahedron,2014,70(38): 6851-6858.
[8] Thao N P,Nam N H,Cuong N X,Quang T H,Tung P T,Dat L D,Chae D,Kim S,Koh Y S,Kiem P V.Bioorg.Med.Chem.Lett.,2013,23(1):228-231.
[9] Lillsunde K E,Festa C,Adel H,Marino S D,Lombrdi V,Tilvi S,Nawrot D A,Zampella A,Dsouza L,Dauria M V,Tammela P.Mar.Drugs,2014,12(7):4045- 4068.
[10] Chen K H,Dai C F,Hwang T L,Chen C Y,Li J J,Chen J J,Wu Y C,Sheu J H,Wang W H,Sung P J.Mar.Drugs,2014,12(1):385-393.
[11] Chen W T,Yao L G,Yao L G,Guo Y W.Steroids,2014,92(1):56-61.
[12] Yang B,Wei X Y,Huang J X,Lin X P,Liu J,Liao S R,Wang J F,Zhou X F,Wang L S,Liu Y H.Mar.Drugs,2014,12(7):5316-5327.
[13] Zhang J,Li L C,Wang K L,Liao X J,Deng Z,Xu S H.Bioorg.Med.Chem.Lett.,2013,23(5):1079-1082.
[14] Lai D W,Yu S J,van Ofwegen L,Totzke F,Proksch P,Lin W H.Bioorg.Med.Chem.Lett.,2011,19(9):6873-6880.
[15] Zhang J,Liao X J,Wang K L,Deng Z,Xu S H .Steroids,2013,78(2):396-400.
[16] Bringmann G,Bruhn T,Maksimenka K,Hemberger Y.Eur.J.Org.Chem.,2009,17(6):2717-2727.
[17] Stephens P J,Pan J J,Krohn K.J.Org.Chem.,2007,72(20):7641-7649.
Structural Analysis of a Pentacyclic Hemiacetal Steroid Isolated from Coral Sinularia sp.
WU Jia-cheng,LIN Jia-li,LIAO Gan-li,LIAO Xiao-jian,XU Shi-hai*
(College of Chemistry and Materials Science,Jinan University,Guangzhou 510632,China)
A pentacyclic hemiacetal steroid was isolated and purified by chromatography with silica gel,Sephadex LH-20 column as well as HPLC.Its plane structure was identified by nuclear magnetic resonance spectroscopy(NMR spectra)and mass spectrometry.By determining and comparing the calculated values of CD,it is determined that the structure of the compound is(8R,9S,10R,13R,14S,17R,18R,20S,22R)-cholesta-1,4-dien-18-al,22-hydroxy-3-oxo-,cyclic 18,22-(acetyl acetal).The compound was isolated fromSinulariasp.for the first time.
coral;pentacyclic hemiacetal steroid;structure elucidation
2017-05-22;
2017-07-25
国家自然科学基金(41376155,21672084);广东省自然科学基金(2016A030310095);广州市科技项目(201704030042);暨南大学科研培育与创新基金研究项目(21616113)
*
徐石海,博士,教授,研究方向:有机化学,Tel:020-85221346,E-mail: txush@jnu.edu.cn
10.3969/j.issn.1004-4957.2017.11.018
O656.4;O621.4
A
1004-4957(2017)11-1397-04
