营养缺乏和碱性环境对粪肠球菌侵入人工微管系统的影响
2017-11-29孙晓强王淑静罗春雄侯本祥
孙晓强 王淑静 罗春雄 侯本祥
营养缺乏和碱性环境对粪肠球菌侵入人工微管系统的影响
孙晓强 王淑静 罗春雄 侯本祥
目的研究不同环境因素对粪肠球菌侵入人工微管系统能力的影响和微流芯片的适用性。方法采用软光刻技术制作微流芯片,观察细菌在牛脑心浸出液(BHI)、PBS和pH 10的情况下在微流芯片中的生长情况,测定和比较细菌在相应微管内的最大侵入深度。结果粪肠球菌在营养缺乏和碱性环境下生长速度明显下降,侵入小管径微管的深度显著下降(Plt;0.01)。结论营养缺乏和碱性环境可显著降低粪肠球菌侵入微管系统的能力。微流芯片具有高通量、平行对比和可观察性好等特点,有望为今后相关研究提供标准化的实验平台。
牙本质小管; 粪肠球菌; 微流芯片; 持续性根尖周炎
粪肠球菌与根管治疗失败和持续性根尖周炎关系密切,在持续性根尖周炎患牙根管内粪肠球菌的检出率高达24%~77%[1-2],被认为是导致根管治疗失败和持续性根尖周炎的主要致病菌。研究显示粪肠球菌可侵入侧、副根管、根管峡部以及根管侧壁的牙本质小管内[3],很难通过目前的器械预备和化学预备方法完全清除。同时,粪肠球菌还具有对恶劣生存环境极强的适应性,可耐受营养缺乏[4]和碱性环境[5]而在根管中长期生存。目前对粪肠球菌在压力环境下对牙本质小管等根管微结构的侵入情况研究较少[6]。
本实验利用基于牙本质小管大小与结构制作的微流芯片[7],观察粪肠球菌在这2 种压力环境下对微管系统的侵入情况,探讨不同压力环境对粪肠球菌侵入微管能力的影响。
1 材料与方法
1.1 主要材料和仪器
E.faecalis标准菌株ATCC29212;聚二甲基硅氧烷 (polydimethylsiloxane、PDMS)前聚体(GE Toshiba日本);SU-8系列光胶及显影液(MicroChem,美国);牛脑心浸出液(BHI)(赛默飞世尔生物化学制品有限公司);1×PBS 、10×PBS(上海百赛生物技术有限公司);0.2 mol/L NaHCO3缓冲液、0.2 mol/L K2CO3缓冲液(分析纯,北京化学制剂厂); NIS软件(Nikon,版本3.10);尼康Ti-E全自动倒置荧光显微镜系统(尼康,日本)。
1.2 方法
1.2.1 不同环境培养基的配置 BHI培养基和1×PBS分别模拟营养丰富和营养缺乏状态[8];碱性环境由0.2 mol/L NaHCO3缓冲液和0.2 mol/L K2CO3缓冲液将BHI培养基调整为pH=10[9],消毒后4 ℃冰箱保存,3 d内使用。
1.2.2 细菌准备 将细菌置于37 ℃恒温箱中活化2 h,将细菌悬液加入不同条件培养基中,菌密度调整为OD600=0.1。
1.2.3 微流芯片的制作与准备 根据牙本质小管的特点和Sigusch等[10]的研究,采用标准的软光刻技术设计和制作微流芯片。主要结构包括中央孔(紫色)、缓冲区(桔红色)和不同管径和长度的微管系统(红色),1 块微流芯片由4 个相同的单位构成(图 1)[7],芯片预处理完成后,随机将其中4 个相同单位分为空白对照组、BHI组、营养缺乏组(PBS)和碱性环境组(pH=10)。

图 1 本实验中使用的微流芯片示意图
1.2.4 时序照片观察点和时间点的设定 将芯片置于时序显微镜下,BHI组、营养缺乏组(PBS)和碱性环境组(pH=10)分别随机选取每个直径单元各10 个作为观察单元。观察点设定完毕后自中央孔加入菌液进行时序观察。
1.2.5 观察各组细菌的生长情况并测定各组细菌在微管内最大平均侵入深度 使用Image J 软件测定72 h各组各管径20~30 个长度500 μm微管内细菌侵入最大深度,计算平均最大侵入深度,分析不同环境对细菌侵入深度的影响。
1.3 统计学分析
SPSS 18.0软件进行非参数检验。
2 结 果
2.1 细菌在BHI培养基环境对微管系统的侵入情况
平行空白对照组72 h微管系统内无细菌生长,培养液不浑浊。BHI组,细菌在腔室内生长迅速,并维持较高密度(图 2)。2 h细菌逐渐充满腔室并接近微管口,在2 μm和3 μm管径的微管中近腔室侧细菌排列较为密集,向末端逐渐变得稀疏,呈间断排列(图 3);在5 μm和10 μm管径的微管中排列密集。72 h不同管径500 μm长度微管内细菌平均最大侵入深度分别为(339.3±63.6)、(389.6±35.3)、(487.8±11.3)、(500.0±0.0) μm(表 1)。

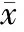
Tab 1 The depth of bacterial invasion in microtubes of different sizes at 72 h (μm, ±s)
注: ①与BHI组比较,Plt;0.01
2.2 营养缺乏环境对粪肠球菌在微管侵入的影响
在营养缺乏环境下,细菌在微流芯片内的生长繁殖明显减弱, 6~8 h逐渐由腔室接近微管系统(图 2)。细菌对小管径微管的侵入深度显著下降(表 1),72 h,腔室内充满细菌,但只有少量细菌进入微管系统。小管径各微管间细菌侵入情况差异较大,微管内细菌数量稀少,密集区域少见(图 3)。
2.3 碱性环境(pH=10)对粪肠球菌在微管侵入的影响
细菌在pH=10的环境下生长明显受到抑制,6~8 h开始侵入微管,细菌在腔室内表现出特殊的存在状态,多呈链状或团块状存在,微管内细菌数量较少(图 2~3),除10 μm管径微管外,细菌侵入微管深度显著下降(表 1)。

图 2 微管系统腔室内细菌在不同环境下的时序变化

图 3 72 h细菌在3 种环境下在管径2 μm微管内的侵入情况
Fig 3 Images of the bacterial invasion in 2 μm ×2 μm microtubes under different conditions at 72 h
3 讨 论
粪肠球菌导致持续性根尖周炎与其较强的环境适应能力密切相关。粪肠球菌在营养物质缺乏状态下可继续生存,研究[3]显示粪肠球菌可在根管治疗后营养物质缺乏的根管内生存12 个月之久。本实验中采用了George等[8]实验的方法,用1×PBS模拟营养物质缺乏的状态。氢氧化钙是目前根管治疗中的最为常用消毒药物[11],粪肠球菌对其产生的碱性环境有很强的耐受能力[12],可耐受的碱性极值达pH 11.1[5]。由于牙本质的缓冲作用,根管内氢氧化钙产生的碱性环境pH值通常不会高于10[13],因此本实验采用Appelbe等[9]的方法,使用2 种缓冲盐将BHI培养基的pH值调整为10,模拟氢氧化钙在根管内所产生的碱性环境。
此前研究[6,8]发现营养状态可显著影响粪肠球菌侵入牙本质小管的能力,本研究显示在营养缺乏状态下,细菌侵入微管的深度和数量均显著下降。与冉淑君等[14]的研究结果相似,在营养缺乏的环境下,粪肠球菌的生长速度明显减慢,表现为细菌充盈腔室所需的时间明显增加,密度明显下降。细菌生长速度下降可能是导致细菌侵入微管深度下降的原因之一。一方面由细菌密度不同产生的梯度所导致的扩散作用减小,另一方面细菌在微管内通过繁殖产生的主动侵入能力也下降。但本研究结果也显示,在24 h后,细菌在腔室内的密度逐渐增高,并没有发生可由此产生的向微管内明显的扩散,在一些微管内甚至没有细菌的存在。推测可能有以下几点原因:①管径因素,随着管径的缩小,扩散作用明显减弱,细菌不容易通过扩散进入小管径微管[7,10];②细菌在营养缺乏的状态下可能更容易形成生物膜,生物膜结构是细菌抵御外界不良环境的一种重要的方式。在Liu等[15]和刘红艳等[16]实验中就证实细菌在饥饿状态下可产生生物膜。生物膜的存在可能使处于游离状态的细菌减少,生物膜的形成还可能堵塞微管的入口,使后续的细菌难以进入微管系统;③从本实验的时序观察可以看到,在营养缺乏状态下,细菌即使进入腔室,但向微管内迁移的能力很弱。此前的研究[7]显示粪肠球菌可能通过随机运动侵入微管,外界环境的改变可能使细菌外在蛋白的表达、所带电荷等性状发生改变,随机运动的能力可能减弱,导致了细菌向微管内侵入的能力下降。
本研究显示在pH 10环境下,细菌不仅生长速度明显下降,还表现出特殊的状态,多呈链状或团块状存在,这种变化随着时间延长更加明显,与在BHI和PBS中的形态存在显著差异。Ran等[17]报道粪肠球菌在碱性环境下,细胞外形和胞质均会出现超微结构的改变,同时细菌的疏水性显著提高。研究[6,9]还发现细菌在碱性环境下包括调控细胞分裂的多种基因的表达受到影响。以上这些因素可能是导致粪肠球菌在碱性环境下表现出特殊形态的原因。
在pH 9、10的条件下,细菌对牙本质小管的侵入较正常可分别下降50%和80%以上[6]。本研究结果也显示,细菌在pH 10的碱性环境下对微管系统的侵入深度显著下降。Ran等[6]认为碱性环境下细菌侵入能力的下降不能简单归因于细菌生长速度的下降,而可能与细菌在此环境下表现出的疏水性增加有关。有研究还观察到粪肠球菌在碱性环境下更容易形成生物膜[5],如前所述生物膜的形成也可能会妨碍细菌侵入牙本质小管的深部。在本实验中观察到的细菌在碱性环境下的特殊存在方式也说明碱性环境造成细菌侵入能力下降可能是多方面因素的综合结果。
本研究结果表明粪肠球菌在营养缺乏和碱性环境下,对微管系统尤其是小管径微管的侵入深度和数量均显著下降。这一方面可能与在这2 种环境下细菌生长受到抑制有关,更有可能是细菌在压力环境下通过某些基因的调控来适应外界不良环境的表现。结果也表明该微流芯片具有制作精度高、高通量、平行对比和便于观察等特点,适于对细菌在微小空间内的生长做连续观察,可为今后相关研究提供标准化的研究平台。
[1] Fouad AF, Zerella J, Barry J, et al. Molecular detection ofEnterococcusspeciesin root canals of therapy-resistant endodontic infections[J]. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2005, 99(1):112-118.
[2] 张富华,张建凤,何爱民,等. 完善根管充填后治疗失败感染根管中粪肠球菌的活菌研究[J]. 实用口腔医学杂志, 2015, 31(3):365-368.
[3] Peters LB, Wesselink PR, Buijs JF, et al. Viable bacteria in root dentinal tubules of teeth with apical periodontitis[J]. J Endod, 2001, 27(2): 76-81.
[4] Sedgley CM, Lennan SL, Appelbe OK. Survival ofEnterococcusfaecalisin root canalsexvivo[J]. Int Endod J, 2005, 38(10):735-742.
[5] Distel JW, Hatton JF, Gillespie MJ. Biofilm formation in medicated root canals[J]. J Endod, 2002, 28(10):689-693.
[6] Ran S, Wang J, Jiang W,et al. Assessment of dentinal tubule invasion capacity ofEnterococcusfaecalisunder stress conditionsexvivo[J]. Int Endod J, 2015, 48(4):362-372.
[7] Sun X, Wang S, Yang Y, et al. Study of invasion and colonization ofE.faecalisin microtubes by a novel device[J]. Biomed Microdevices, 2016, 18(5): 82.
[8] George S, Kishen A, Song KP. The role of environmental changes on monospecies biofilm formation on root canal wall byEnterococcusfaecalis[J]. J Endod, 2005, 31(12):867-872.
[9] Appelbe OK, Sedgley CM. Effects of prolonged exposure to alkaline pH onEnterococcusfaecalissurvival and specific gene transcripts[J]. Oral Microbiol Immunol, 2007, 22(3): 169-174.
[10]Sigusch BW, Kranz S, Klein S, et al. Colonization ofEnterococcusfaecalisin a new SiO/SiO2-microtubeinvitromodel system as a function of tubule diameter[J]. Dent Mater, 2014,30(6):661-668.
[11]Siqueira JF Jr, Lopes HP. Mechanisms of antimicrobial activity of calcium hydroxide: A critical review[J]. Int Endod J, 1999, 32(5):361-369.
[12]van der Waal SV, van der Sluis LW, Özok AR, et al. The effects of hyperosmosis or high pH on a dual-species biofilm ofEnterococcusfaecalisandPseudomonasaeruginosa: Aninvitrostudy[J]. Int Endod J, 2011, 44(12):1110-1117.
[13]Haapasalo HK, Siren EK, Waltimo TM, et al. Inactivation of local root canal medicaments by dentine: Aninvitrostudy[J]. Int Endod J, 2000, 33(2):126-131.
[14]冉淑君,鄂佳,朱彩莲, 等. 不同理化条件对粪肠球菌生长周期及生物膜形成能力的影响[J].中华口腔医学杂志, 2013,48(9):529-534.
[15]Liu H,Wei X,Ling J,et al.Biofilm formation capability ofEnterococcusfacealiscells in starvation phase and its susceptibility to sodium hypochlorite[J].J Endod,2010, 36(4):630-635.
[16]刘红艳,韦曦,凌均棨. 饥饿状态粪肠球菌生物膜胞外多糖的合成能力[J].中华口腔医学研究杂志(电子版), 2012, 6(10):16-20.
[17]Ran S, He Z, Liang J. Survival ofEnterococcusfaecalisduring alkaline stress: Changes in morphology, ultrastructure, physiochemical properties of the cell wall and specific gene transcripts[J]. Arch Oral Biol, 2013, 58(11):1667-1676.
(收稿: 2016-08-18 修回: 2016-09-18)
TheeffectsofenvironmentalchangesonE.faecalisgrowthandpenetrationintomicrotubesinamicrofluidchip
SUNXiaoqiang1,WANGShujing2,LUOChunxiong2,HOUBenxiang1.
1.100050,DepartmentofEndodontics,SchoolofStomatologyCapitalMedicalUniversityBeijing,China; 2.StateKeyLaboratoryforArtificialMicrostructuresandMesoscopicPhysics,SchoolofPhysicsPekingUniversityBeijing
Objective: To evaluate the effects of different growth conditions onE.faecalisgrowth in the microfluid chip and the penetration ofE.faecalisinto microtubes.MethodsFour units on the chip were randomly selected as control, BHI, nutrient-Tdeprived(PBS) and pH 10 groups. The growth ofE.faecaliswas monitored by microscope for a period of 72 h after the suspension ofE.faecalishad been added into the chip.ResultsThe microscopic analysis showed a distinct variation in the growth rate and morphological feature under different experimental conditions. he depth of bacterial penetration was significantly greater in BHI group.ConclusionThis study demonstrated that environmental changes can significantly influence the growth and penetration ofE.faecalisinto the micro tubes.
Dentinaltubules;Enterococcusfaecalis;Microfluidics;Persistentapicalperiodontitis
国家自然科学基金(编号: 81170952, 11174012, 11434001); 北京市医院管理局临床医学发展专项经费资助(编号: XMLX201301)
100050, 首都医科大学附属北京口腔医院牙体牙髓科(孙晓强 侯本祥); 北京大学定量生物学中心,前沿交叉学科研究院(王淑静 罗春雄)
侯本祥 010-57099230 E-mail: houbenxiang@gmail.com
R780.2
A
10.3969/j.issn.1001-3733.2017.01.011
