含低聚半乳糖+低聚果糖配方奶对婴儿粪便性状及有益菌水平的影响
2017-11-29蒋永江柴灵莺汤庆娅
吴 江 蒋永江 柴灵莺 汤庆娅 蔡 威
1.上海交通大学医学院附属新华医院临床营养科 上海市儿科医学研究所 上海市小儿消化与营养重点实验室(上海 200092); 2.广西省柳州市妇幼保健院新生儿科(广西柳州 545001);3.浙江省杭州市贝因美母婴营养研究中心(浙江杭州 310053)
含低聚半乳糖+低聚果糖配方奶对婴儿粪便性状及有益菌水平的影响
吴 江1*蒋永江2*柴灵莺3汤庆娅1蔡 威1
1.上海交通大学医学院附属新华医院临床营养科 上海市儿科医学研究所 上海市小儿消化与营养重点实验室(上海 200092); 2.广西省柳州市妇幼保健院新生儿科(广西柳州 545001);3.浙江省杭州市贝因美母婴营养研究中心(浙江杭州 310053)
目的探讨添加1.34 g/L低聚半乳糖+低聚果糖(GOS+FOS)益生元组合的配方奶对健康足月婴儿大便性状及肠道有益菌水平的影响。方法纳入出生3周内的配方奶(FF组)喂养婴儿25例和母乳喂养(BF组)儿29例,FF组在中位日龄13 d(1~27 d)时全部使用GOS+FOS配方奶喂养。在两组婴儿6、12周龄时进行体格测量,采集粪便标本,同时记录其大便次数和性状。应用实时荧光定量PCR技术检测粪便中乳酸杆菌、双歧杆菌及其亚种水平。结果在6~12周龄的随访期内,FF组婴儿的体质量增加速率为(33.56 ± 7.03)g/d,BF组为(31.18 ± 6.91)g/d ,两组间差异无统计学意义(P>0.05)。6周龄时,FF组婴儿排便次数较少且粪便偏硬,12周龄时大便性状与BF组相似。FF组6周龄时粪便中双歧杆菌、长双歧杆菌和短双歧杆菌水平均低于BF组,差异有统计学意义(P<0.05);12周龄时上述有益菌含量均有增加,且与BF组差距缩小。结论添加低剂量GOS+FOS益生元的配方奶可为健康婴儿提供合理营养,有助于软化粪便并促进肠道双歧杆菌的生长。
益生元; 低聚半乳糖; 低聚果糖; 粪便性状; 肠道微生态; 婴儿
母乳是婴儿生长发育的最佳营养来源,还可以促进婴儿肠道菌群的定植和发展。母乳中含有丰富的低聚糖,成熟母乳中的含量为5~10 g/L,而初乳中的含量则高达10~20 g/L,是仅次于乳糖和脂肪的固体成分。部分低聚糖可在结肠中发酵,促进有益菌的生长[1,2]。以往数十年间,人们尝试在配方奶中添加益生元来模拟母乳的成分。低聚半乳糖(galactooligosaccharides,GOS)和低聚果糖(fructooligosaccharides,FOS)是婴儿配方奶中最常用的两种益生元[3]。GOS在母乳中存在,不被人体消化酶所消化且热稳定性良好,而FOS则天然存在于一些植物中,也可以菊粉为原料通过酸解或酶解来获取。单独或联合添加GOS和FOS的配方奶有助于软化婴儿粪便,并刺激肠道中双歧杆菌和乳杆菌等有益菌的增殖[4-8]。但上述研究结果并非完全一致,提示GOS和/或FOS对于婴儿肠道菌群的调节作用可能受到剂量和配方组合等多重因素的影响。本研究旨在探讨添加低剂量益生元组合GOS+FOS(1.34 g/L)的婴儿配方奶对健康足月儿生长发育、大便性状及粪便有益菌水平的影响,并与纯母乳喂养婴儿进行比较。
1 对象与方法
1.1 研究对象
本研究为前瞻性对照研究,研究方案通过上海儿童医学中心伦理委员会审批(SCMCIRB-K201305),并在Clinicaltrials.gov登记注册 (NCT02363582)。入组对象为2013年7月—2014年12月出生的健康足月婴儿。婴儿娩出后3周左右已经可以基本确定喂养方式是否为人工喂养,因此,将这一时间确定为入组年龄。纳入标准:①胎龄≥37周;②出生体质量≥2 500 g;③入组时为纯母乳喂养或纯人工喂养。排除标准:①患有先天异常、出生缺陷或代谢性疾病;②入组前患有感染性疾病;③入组前服用微生态制剂;④混合喂养。
婴儿分为2组:母乳喂养组(breast feeding,BF)指纯母乳喂养的婴儿;配方奶组(formula feeding,FF)指纯配方奶喂养的婴儿。所用奶粉为在牛乳基础上添加益生元组合GOS+FOS(含量分别为0.47 g/L和0.87 g/L)的一阶段婴儿配方奶(由杭州贝因美母婴营养品有限公司负责生产并经质检机构检验合格)。FF组的婴儿自入组后根据循序渐进的原则逐渐增加新奶粉的喂养比例,并在2周内全部转为含GOS+FOS的配方奶喂养。在6~12周龄的观察期内,入组婴儿以纯母乳或上述配方奶进行喂养,未服用益生菌或益生元制剂。所有入组婴儿的监护人均自愿参加研究并签署知情同意书。
1.2 方法
1.2.1 生长指标的测量及评价 分别在婴儿生后6周和12周时由专业医护人员进行体格检查,测量体质量和头围。测量时,将安静状态下的婴儿放置于婴儿秤(TANITA,BD-585)上读取数据,并减去婴儿所穿衣物和尿布的重量,即为体质量(精确到10 g)。头围则是用软尺测量经眉弓绕经枕骨粗隆1周的长度(精确至0.1 cm)。测量结果以世界卫生组织儿童生长量表为参考标准(http://www.who.int/childgrowth/software/en/),计算年龄别体质量Z评分(weightfor-age z-scores,WAZ)和年龄别头围Z评分(head circumference-for-age z-scores,HcAZ)。
1.2.2 喂养日记 家长在婴儿6周和12周龄时连续1周记录喂养日记,内容包括婴儿每日喂养频次、大便性状(包括大便次数、颜色和形状)及有无呕吐腹胀等。喂养日记由研究者统一提供,并当面告知填写方法。每2周进行电话随访,了解并记录婴儿的一般健康状况。
1.2.3 粪便标本的采集和分类 在婴儿6周龄和12周龄时分别采集粪便标本。婴儿排便后,用专用挖匙将2、3匙粪便放入含有DNA稳定剂的采集管内混合均匀,并于48 h内放入-80℃冰箱中保存。粪便的形状和颜色均以1~5分进行赋值[9,10]。①水样便:流动的/液体粪便,计1分;②松软便:半液体状/粪便在尿布上散开并混有水,计2分;③糊状软便:粪便在尿布上铺开,面糊状,计3分;④成形便:粪便在尿布上保持其形状但仍为潮湿的,计4分;⑤硬便:成型且很少有水分,计5分。粪便颜色的定义和赋值:①绿色,计1分;②黄绿色,计2分;③黄色,计3分;④黄褐色,计4分;⑤褐色,计5分。
1.2.4 粪便有益菌的定量PCR检测 将采集的粪便称重后用PSP® Spin Stool DNA Plus Kit(Stratec molecular GmbH)抽提样本DNA,操作依照试剂盒说明书进行。依据各细菌16SrRNA特异性基因序列并参照国外文献[11-13]设计合成特异性引物和探针(表1),并在BLAST基因库(www.ncbi.nlm.nih.gov/ BLAST)内比对引物和探针的特异性。乳酸杆菌和双歧杆菌定量测定采用SYBR green荧光染料法,反应条件:95 ℃2 min后,循环38次(95 ℃变性10 s,56 ℃退火15 s,72 ℃延伸 20 s)。长双歧杆菌、短双歧杆菌和青春双歧杆菌检测采用Taqman探针法,反应条件:95 ℃1 min,循环40次(95 ℃变性10 s,56℃退火15 s,72 ℃延伸15 s)。检测所用引物及探针由上海奇悟生物科技有限公司合成。各菌株标准品(购于中国科学院微生物研究所)提取DNA制备质粒后,按照浓度梯度稀释后制作PCR标准曲线。所有检测均设阴性对照,并做平行复孔,PCR反应在实时荧光定量PCR仪(Mastercycler ep realplex,Eppendorf,德国)上进行。

表1 PCR特异性引物及探针
1.3 统计学分析
各组数据采用SPSS 13.0软件进行统计分析。有关粪便性状的数据依据婴儿第6周和第12周的记录取平均值后进行计算。正态分布的计量资料以均数±标准差表示,组间比较采用两独立样本t检验。非正态分布的计量资料以中位数(四分位数间距)表示,组间比较采用Mann-WhitneyU检验。计数资料以百分比表示,组间比较采用χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 一般情况
分别有35名母乳喂养和30名人工喂养的婴儿纳入研究。BF组中有6名婴儿退出研究,原因包括:停止母乳喂养或添加配方奶(3例)、自行补充益生菌制剂(2例)、呼吸道感染(1例);FF组有5名退出研究,原因为:未进行排便状况记录(4例)和轮状病毒性腹泻(1例)。最终完成研究的婴儿包括BF组29名和FF组25名。FF组婴儿的入组中位日龄为3 d(1~18 d),并在13 d(1~27 d)时全部转为GOS+FOS配方奶喂养,其中有8名婴儿在出生后即使用研究奶粉喂养;BF组的入组中位日龄为18 d(9~22 d)。
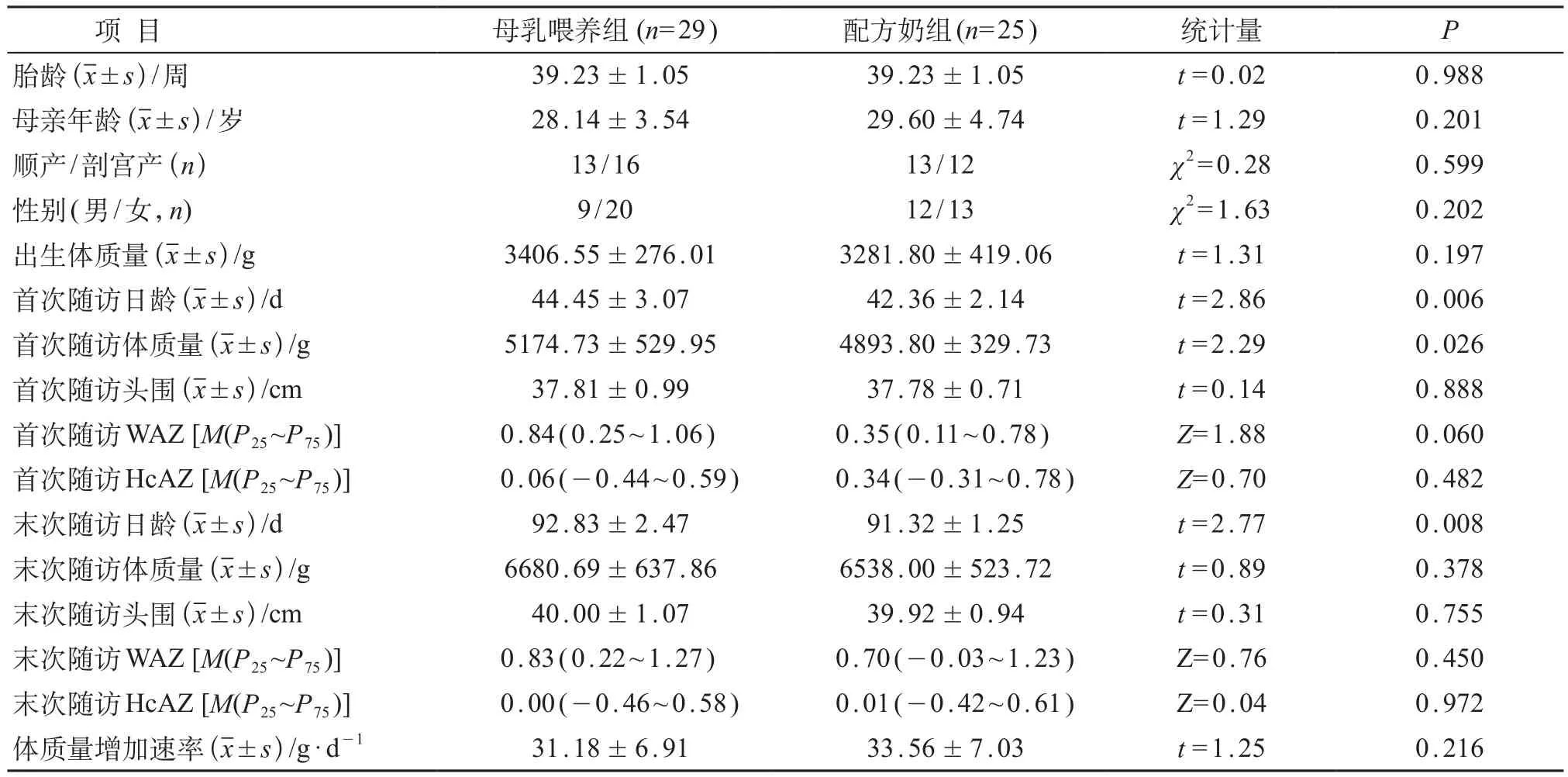
表2 婴儿基本情况及生长发育指标比较
2.2 基线数据和生长发育
两组婴儿在胎龄、母亲年龄、性别、娩出方式和出生体质量方面的差异均无统计学意义(P>0.05),见表2。首次随访时,FF组平均日龄为(42.36±2.14)d,略早于BF组的(44.45±3.07)d,差异有统计学意义(P<0.01);FF组体质量低于BF组,差异亦有统计学意义(P<0.05);与BF组相比,FF组WAZ值偏低,但两组差异无统计学意义(P=0.060)。两组在12周龄时无论体质量还是WAZ值的差异均无统计学意义(P>0.05)。两组的头围、HcAZ和6周内的体质量增加速率的差异均无统计学意义(P>0.05)。见表2。
2.3 大便性状
两组婴儿的大便性状比较见表3。6周龄时,FF组婴儿的大便次数明显少于BF组,差异有统计学意义(P<0.001)。BF组婴儿的大便形状以糊状软便为主,约20%为松软便,而FF组婴儿则以糊状软便和成形便最为常见。至12周龄时,两组的大便次数、颜色和形状比较差异均无统计学意义(P>0.05)。此外,FF组婴儿在转用研究用配方奶后均未发生腹胀、腹泻等反应。
2.4 婴儿粪便双歧杆菌和乳酸杆菌定量分析
因青春双歧杆菌仅在3例样本中检出,因此未进行统计分析。6周龄时,FF组婴儿粪便中双歧杆菌、长双歧杆菌和短双歧杆菌水平均低于BF组,差异有统计学意义(P<0.05)。直至12周龄时,FF组婴儿粪便中双歧杆菌和长双歧杆菌水平仍低于BF组,差异有统计学意义(P<0.05),但差距较6周龄时缩小。在12周龄实验结束时两组间短双歧杆菌水平差异无统计学意义(P>0.05)。无论在6周龄还是12周龄,粪便乳酸杆菌水平两组间差异均无统计学意义(P>0.05)。见表4。
在6周的观察期内,婴儿粪便中双歧杆菌和乳酸杆菌水平变化差值在FF组和BF组两组间的差异无统计学意义(P均>0.05)。12周龄时,FF组婴儿粪便中长双歧杆菌和短双歧杆菌水平较6周龄时显著增加,差值分别为1.24(0.23~3.71)和0.33(-0.45~2.16),BF组差值分别为0.26(-0.65~0.95)和-0.62(-1.35~0.19),两组间差异均有统计学意义(Z=1.99、2.63,P<0.05)。

表3 两组婴儿大便性状比较[M(P25~P75)]
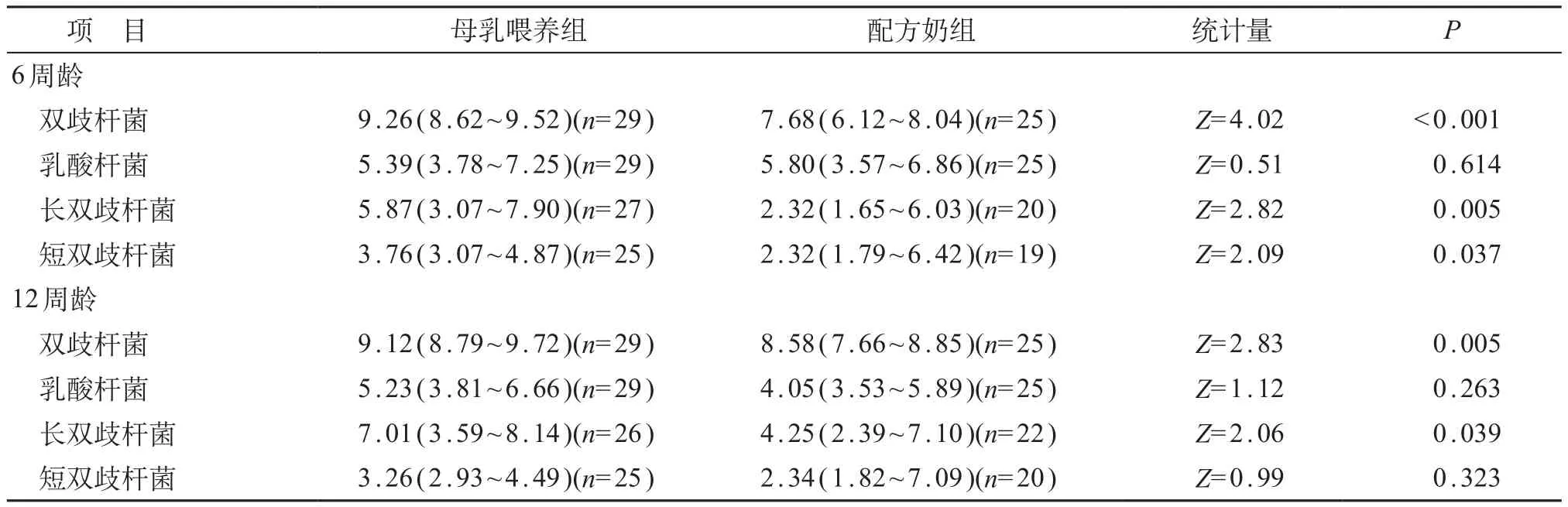
表4 粪便细菌定量分析[M(P25~P75)]
3 讨论
母乳是婴儿的最佳营养来源,其中丰富的低聚糖有利于促进肠道健康和免疫平衡。前期有研究探讨添加GOS+FOS组合对足月婴儿生长发育和肠道菌群的影响,所用配方中的GOS+FOS总量为4.0 g/L或8.0 g/L,两者比例为9:1[4,14-17]。本研究主要探讨添加低剂量GOS+FOS(总量为1.34 g/L,两者比例为1:1.85)的配方奶对健康婴儿生长发育、大便性状和粪便有益菌水平的影响。
首先,从生长指标来看,FF组与BF组在6周龄及12周龄时的WAZ、HcAZ值、观察期内的体质量增加速率均无统计学差别。许多研究显示,含益生元配方奶喂养的婴儿可获得与母乳喂养儿相同的生长表现[10,18]。Moro等[4]的研究发现含4.0 g/L或8.0 g/L的GOS+FOS配方奶喂养的婴儿两组间体格发育指标并无统计学差别,且与母乳喂养儿相似。尽管所使用的益生元配方不同,但本研究与Moro等[4]的结果一致。
其次,从粪便性状来看,FF组在6周龄时大便性状偏硬,但在12周龄时其粪便多为糊状软便,性状接近BF组。同时,FF组的排便次数在12周龄时也与BF组无统计学差异。多项研究显示,益生元有助于改善婴儿粪便性状,其机制可能与调节结肠内pH值和肠道菌群有关[4,19-22]。FF组粪便性状的变化提示GOS+FOS组合可能发挥了一定的改善作用。此外,FF组婴儿在转奶后均未发生不适反应,也显示对该配方良好的耐受性。
最后,从肠道有益菌的检测结果来看,FF组粪便双歧杆菌属及其亚种含量均显著低于BF组,但两组的差距在12周龄时明显缩小。已知多种因素可影响肠道菌群的建立和组成,如分娩方式、喂养方式、配方奶成分等[23-26]。本研究纳入的两组婴儿在娩出方式和出生体质量等指标方面均无统计学差异,提示基线具有可比性。体外实验发现,GOS等益生元可以促进婴儿粪便中的双歧杆菌和长双歧杆菌增殖[27],而含益生元配方奶喂养的婴儿与未添加组相比,其肠道菌群更加接近母乳喂养儿[4,5,28]。一项观察期为28天的研究显示,添加4.0 g/L或8.0 g/L GOS+FOS的配方奶均可促进婴儿肠道乳酸杆菌和双歧杆菌的生长,且对双歧杆菌的促生长作用呈现剂量-效应关系[4,21]。国内一项研究发现,婴儿在使用低剂量FOS(2.4 g/L)配方奶喂养3个月和6个月后,无论粪便性状还是粪便中乳酸杆菌和双歧杆菌水平都与母乳喂养儿相似[6,29]。在另一项观察期为1周的研究中,添加1.5 g/L或3.0 g/L FOS的配方奶虽可改善婴儿粪便性状但对肠道菌群的影响却并不明显[8]。上述研究结果提示,益生元的作用效果并非仅来自于其剂量,还受到成分和使用时间等的多重影响。值得注意的是,FF组在12周龄时长双歧杆菌和短双歧杆菌水平均较6周时显著增加,与母乳组的差异也明显缩小,提示配方奶中的低剂量益生元组合可能促进了双歧杆菌的增殖。此外,FF组婴儿自入组后才开始转用研究用奶粉,其累积使用时间尚不足12周。如果延长使用时间或调整益生元组合的剂量及比例,是否可以获得与母乳喂养儿更接近的喂养结果,仍有待更多的研究证实。
总而言之,添加低剂量GOS+FOS的配方奶可为健康婴儿提供适宜营养,支持其获得与纯母乳喂养婴儿相似的生长发育。喂养方式可影响婴儿的排便性状以及粪便中的双歧杆菌及其亚种含量,但上述差别随着婴儿日龄的增加逐渐缩小。这些改变可能与配方奶含有的益生元成分、比例和使用时间有关,但其具体机制以及更理想的配方仍有待后续进一步研究。
[1]Walker A.Breast milk as the gold standard for protective nutrients [J].J Pediatr,2010,156(2 Suppl): S3-S7.
[2]Erney RM,Malone WT,Skelding MB,et al.Variability of human milk neutral oligosaccharides in a diverse population[J].J Pediatr Gastroenterol Nutr,2000,30(2): 181-192.
[3]Vandenplas Y,De Greef E,Veereman G.Prebiotics in infant formula [J].Gut Microbes,2014,5(6): 681-687.
[4]Moro G,Minoli I,Mosca M,et al.Dosage-related bi fi dogenic effects of galacto- and fructooligosaccharides in formula-fed term infants [J].J Pediatr Gastroenterol Nutr,2002,34(3):291-295.
[5]Knol J,Scholtens P,Kafka C,et al.Colon microflora in infants fed formula with galacto- and fructo-oligosaccharides:more like breast-fed infants [J].J Pediatr Gastroenterol Nutr,2005,40(1): 36-42.
[6]Ben XM,Zhou XY,Zhao WH,et al.Supplementation of milk formula with galacto-oligosaccharides improves intestinal micro- fl ora and fermentation in term infants [J].Chin Med J(Engl),2004,117(6): 927-931.
[7]Xia Q,Williams T,Hustead D,et al.Quantitative analysis of intestinal bacterial populations from term infants fed formula supplemented with fructo-oligosaccharides [J].J Pediatr Gastroenterol Nutr,2012,55(3): 314-320.
[8]Euler AR,Mitchell DK,Kline R,et al.Prebiotic effect of fructo-oligosaccharide supplemented term infant formula at two concentrations compared with unsupplemented formula and human milk [J].J Pediatr Gastroenterol Nutr,2005,40(2): 157-164.
[9]Lloyd B,Halter RJ,Kuchan MJ,et al.Formula tolerance in postbreastfed and exclusively formula-fed infants [J].Pediatrics,1999,103(1): E7.
[10]Ziegler E,Vanderhoof JA,Petschow B,et al.Term infants fed formula supplemented with selected blends of prebiotics grow normally and have soft stools similar to those reported for breast-fed infants [J].J Pediatr Gastroenterol Nutr,2007,44(3): 359-364.
[11]Chen J,Cai W,Feng Y.Development of intestinal bifidobacteria and lactobacilli in breast-fed neonates [J].Clin Nutr,2007,26(5): 559-566.
[12]Livak KJ,Flood SJ,Marmaro J,et al.Oligonucleotides with fl uorescent dyes at opposite ends provide a quenched probe system useful for detecting PCR product and nucleic acid hybridization [J].PCRMethodsAppl,1995,4(6): 357-362.
[13]Haarman M,Knol J.Quantitative real-time PCR assays to identify and quantify fecalBifidobacteriumspecies in infants receiving a prebiotic infant formula [J].Appl Environ Microbiol,2005,71(5): 2318-2324.
[14]Mugambi MN,Musekiwa A,Lombard M,et al.Synbiotics,probiotics or prebiotics in infant formula for full term infants:a systematic review [J].Nutr J,2012,11: 81.
[15]Arslanoglu S,Moro GE,Schmitt J,et al.Early dietary intervention with a mixture of prebiotic oligosaccharides reduces the incidence of allergic manifestations and infections during the first two years of life [J].J Nutr,2008,138(6):1091-1095.
[16]Costalos C,Kapiki A,Apostolou M,et al.The effect of a prebiotic supplemented formula on growth and stool microbiology of term infants [J].Early Hum Dev,2008,84(1): 45-49.
[17]Bruzzese E,Volpicelli M,Squeglia V,et al.A formula containing galacto- and fructo-oligosaccharides prevents intestinal and extra-intestinal infections: an observational study [J].Clin Nutr,2009,28(2): 156-161.
[18]Ashley C,Johnston WH,Harris CL,et al.Growth and tolerance of infants fed formula supplemented with polydextrose (PDX) and/or galactooligosaccharides (GOS):double-blind,randomized,controlled trial [J].Nutr J,2012,11: 38.
[19]Agostoni C,Axelsson I,Goulet O,et al.Prebiotic oligosaccharides in dietetic products for infants: a commentary by the ESPGHAN Committee on Nutrition [J].J Pediatr Gastroenterol Nutr,2004,39(5): 465-473.
[20]Sherman PM,Cabana M,Gibson GR,et al.Potential roles and clinical utility of prebiotics in newborns,infants,and children: proceedings from a global prebiotic summit meeting,New York City,June 27-28,2008 [J].J Pediatr,2009,155(5): S61-S70.
[21]Moro GE,Mosca F,Miniello V,et al.Effects of a new mixture of prebiotics on faecal fl ora and stools in term infants[J].Acta Paediatr Suppl,2003,91(441): 77-79.
[22]Johnston WH,Ashley C,Yeiser M,et al.Growth and tolerance of formula with lactoferrin in infants through one year of age: double-blind,randomized,controlled trial [J].BMC Pediatr,2015,15: 173.
[23]Grönlund MM,Gueimonde M,Laitinen K,et al.Maternal breast-milk and intestinal bifidobacteria guide the compositional development of theBi fi dobacteriummicrobiota in infants at risk of allergic disease [J].Clin Exp Allergy,2007,37(12): 1764-1772.
[24]陆薇,张红波,黄娟,等.喂养方式对剖宫产婴儿大便性状及肠道菌群的影响 [J].临床儿科杂志,2011,29(5): 450-453.
[25]Fan W,Huo G,Li X,et al.Diversity of the intestinal microbiota in different patterns of feeding infants by Illumina high-throughput sequencing [J].World J Microbiol Biotechnol,2013,29(12): 2365-2372.
[26]Fan W,Huo G,Li X,et al.Impact of diet in shaping gut microbiota revealed by a comparative study in infants during the six months of life [J].J Microbiol Biotechnol,2014,24(2): 133-143.
[27]Stiverson J,Williams T,Chen J,et al.Prebiotic oligosaccharides: comparative evaluation using in vitro cultures of infants' fecal microbiomes [J].Appl Environ Microbiol,2014,80(23): 7388-7397.
[28]Vandenplas Y,Zakharova I,Dmitrieva Y.Oligosaccharides in infant formula: more evidence to validate the role of prebiotics [J].Br J Nutr,2015,113(9): 1339-1344.
[29]Ben XM,Li J,Feng ZT,et al.Low level of galactooligosaccharide in infant formula stimulates growth of intestinalBifidobacteriaandLactobacilli[J].World J Gastroenterol,2008,14(42): 6564-6568.
2017-05-31)
(本文编辑:蔡虹蔚)
Effects of a GOS+FOS supplemented formula on stool characteristics and fecal beneficial bacteria content in infants
WU Jiang1,JIANG Yongjiang2,CHAI Lingying3,TANG Qingya1,CAI Wei1(1.Department of Clinical Nutrition,Xinhua Hospital Af fi liated to Shanghai Jiaotong University School of Medicine,Shanghai Institute for Pediatric Research,Shanghai Key Laboratory of Pediatric Gastroenterology and Nutrition,Shanghai 200092,China; 2.Department of Neonatology,Maternal and Child Health Hospital of Liuzhou City,Liuzhou 545001 Guangxi,China; 3.Department of Maternal and Infant Nutrition Research,Beingmate Baby and Child Food Co.Ltd,Hangzhou 310053,Zhejiang,China)
ObjectiveTo investigate the impact of an infant formula supplemented with 1.34 g/L oligosaccharides mixture (galactooligosaccharides and fructooligosaccharides,GOS+FOS) on growth,stool characteristics and fecal bene fi cial bacteria content in healthy infants.Methods25 formula-fed (FF) infants and 29 breast-fed (BF) infants within 3 weeks after birth were included and followed up.FF infants were exclusively fed with GOS+FOS supplemented formula at the median age of 13d (1-27d).Body weight and head circumference at 6 and 12 weeks were measured.The frequency,consistency,and color of the infant’s stool,and occurrences of spit-up or vomiting during the study period were recorded daily by the parents.Stool samples were collected at 6 and 12 weeks of age,and then subjected to quantitative real-time polymerase chain reaction assays for the enumeration of lactobacillus,bi fi dobacteria,Bi fi dobacterium longum,Bi fi dobacterium breveandBi fi dobacterium adolescentis.ResultsNo difference in daily weight gain was detected between the two groups (33.56 ± 7.03g vs.31.18 ± 6.91g,P=0.22)during the observation phase from 6 to 12 weeks.FF infants had less frequent and fi rmer stools at 6 weeks than BF infants,and they both had similar stool frequency,color and consistency at the end of study.FF infants had less fecal Bi fi dobacterium,B.longum and B.breve at 6 weeks,but those differences became less signi fi cant at 12 weeks with more increase in fecal B.longum and B.breve levels in FF infants during the follow up.ConclusionsThe GOS+FOS supplemented formula provides adequate nutrition for growth,and promotes soft stools and intestinal bi fi dogenic effects in healthy infants.
prebiotics; galactooligosaccharides; fructooligosaccharides; stool characteristics; microbiota; infant
10.3969/j.issn.1000-3606.2017.11.007
蔡威 电子信箱:caiw204@sjtu.edu.cn
*共同第一作者
