漆酶与ABTS间的结合模式与作用机制研究
2017-11-29陶国翔李爱秀刘子泉
陶国翔,李爱秀*,张 敏,刘子泉
(1.武警后勤学院基础部药物设计实验室,天津300309;2.武警后勤学院科研部,天津300309;3.武警后勤学院附属医院 全军灾害应急救援医学重点实验室,天津300162)
漆酶与ABTS间的结合模式与作用机制研究
陶国翔1,李爱秀1*,张 敏2,刘子泉3
(1.武警后勤学院基础部药物设计实验室,天津300309;2.武警后勤学院科研部,天津300309;3.武警后勤学院附属医院 全军灾害应急救援医学重点实验室,天津300162)
选择常见的电子转移介质2,2′-连氮基-双(3-乙基-苯并二氢噻唑啉-6-磺酸)(ABTS)为研究对象,通过探究漆酶与ABTS之间的结合模式,在分子水平上揭示两者的相互作用机制,为发掘漆酶新介质、拓宽漆酶应用范围奠定理论基础。首先,基于分子对接建立变色栓菌漆酶-ABTS复合物模型;然后,与枯草芽孢杆菌漆酶-ABTS复合物晶体结构进行对比,综合两复合物结合特点,在分子水平上阐明漆酶与ABTS间的作用机制。结果表明,ABTS结构中的富电子基团深入活性位点,且靠近电子接收位点组氨酸;漆酶活性位点内多个中性氨基酸与ABTS发生疏水作用,稳定结合构象;最终在漆酶作用下ABTS生成阳离子中间体发挥介导作用。
漆酶;ABTS;漆酶-ABTS体系;分子对接;作用机制
漆酶(laccase,EC1.10.3.2)作为一种含铜氧化酶,主要存在于真菌、细菌、植物或昆虫的分泌物中[1-2],其中真菌漆酶由于稳定性强、产量大、氧化电势高等优势,其理化性质得到深入研究,目前已有100种真菌漆酶得到纯化,38个真菌漆酶晶体结构得到解析[3]。其中,变色栓菌漆酶是真菌漆酶中高产优良品种,常作为研究漆酶结构和功能的首选。在蛋白质数据库(PDB)中有关变色栓菌漆酶的晶体结构编号为1KYA和1GYC,其中1KYA为变色栓菌漆酶内嵌配体的晶体结构,有助于确定漆酶结合位点及底物活性构象,为研究漆酶-底物间的结合模式与作用机制提供重要参考。
漆酶通过所含铜离子与底物之间的电子传递实现了对酚类、芳香胺类等漆酶天然底物的催化氧化[4]。研究发现,在漆酶催化体系中加入一种小分子“介质”(mediator),两者共同构成“漆酶-介质体系(laccase mediator system,LMS)”[5],在LMS中,介质充当漆酶与底物之间电子传递的“电子梭”,减少漆酶与底物间空间阻碍,并间接提高漆酶氧化电势,从而提升电子传递效率,实现了漆酶对更多底物的催化氧化,拓宽了作用底物范围,同时提高了催化效率[6]。
高活性化合物2,2′-连氮基-双(3-乙基-苯并二氢噻唑啉-6-磺酸)(ABTS)是漆酶的特殊底物,也是使用最广泛的介质之一[7],这是由于ABTS在漆酶作用下的氧化产物较ABTS稳定性更强,可通过测定氧化产物的含量最终确定漆酶的活性[8]。作为介质,ABTS充当“电子梭”在漆酶和底物之间发挥电子传递作用,最终使底物降解。ABTS用于LMS的首次报道是漆酶-ABTS体系对纸浆中残余木质素的降解[5],该体系对木质素的高效降解实现了对这类可再生资源的高值化利用[9];工业中,漆酶-ABTS体系可高效降解废水中的含氮杂环化合物[10-11];农业中,漆酶-ABTS体系可对土壤、水体、大气中残留的有机磷酸酯农药进行降解[12]。漆酶-ABTS体系对多种底物的催化降解,在多个领域发挥着重要作用,但是ABTS具有一定毒性和刺激性,且合成成本较高,限制了它的进一步应用,对漆酶-ABTS体系的深入研究,揭示分子机制并发掘新介质,有助于克服其自身缺陷,进一步开发LMS的应用潜力。
目前,已有研究者提出在漆酶作用下ABTS电子转移的变化过程[13]:ABTS被氧化后分两步失去电子最终生成阳离子ABTS2+,在ABTS2+的介导下漆酶实现对底物的催化降解,见图1。但是,变色栓菌漆酶与ABTS分子间的结合模式及其相互作用机制尚不清楚。作者通过分子对接技术建立变色栓菌漆酶-ABTS复合物,并与已解析的枯草芽孢杆菌漆酶-ABTS晶体结构进行对比[14],验证变色栓菌漆酶-ABTS复合物的合理性并探究其分子作用机制,为漆酶结构改造、发现新介质等奠定理论基础。
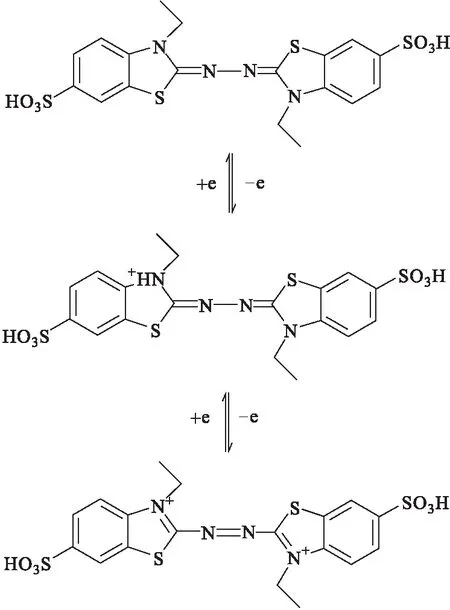
图1 ABTS电子转移机制示意图Fig.1 The schematic diagram of electron transfermechanism of ABTS
1 实验
1.1 技术平台
本研究所有计算在PC机上进行,利用分子模拟与分子设计软件包(molecula operating environment,MOE 2009)完成。
1.2 漆酶和介质结构
真菌漆酶结构来源于变色栓菌漆酶-底物复合物晶体结构(PDB编号:1KYA),将1KYA漆酶晶体结构导入MOE软件包,删除杂原子、溶剂分子、配体分子等,保留漆酶A链,在Amber99力场下,采用Protonate 3D模块对其加氢加电荷,作为漆酶初始构象[15]。细菌漆酶结构来源于枯草芽孢杆菌漆酶-ABTS复合物晶体结构(PDB编号:3ZDW)。
介质ABTS结构使用MOE-Build模块绘制,并在Conformation search模块下进行构象搜索,保留最低能量构象为对接初始构象。
1.3 研究方法
在MOE-Dock模块下进行分子对接,以变色栓菌漆酶配体为中心,配体5 Å范围内氨基酸构成的疏水区域为对接位点,设置力场为MMFF94x,放置函数为Triangle Mather,打分函数为London dG,优化函数为Forcefield,对接完成后,选取介质分子及对接位点氨基酸,在MMFF94x力场下进行能量优化[16]。
2 结果与讨论
2.1 漆酶与ABTS的结合模式与作用机制
漆酶与ABTS相互作用示意图见图2。
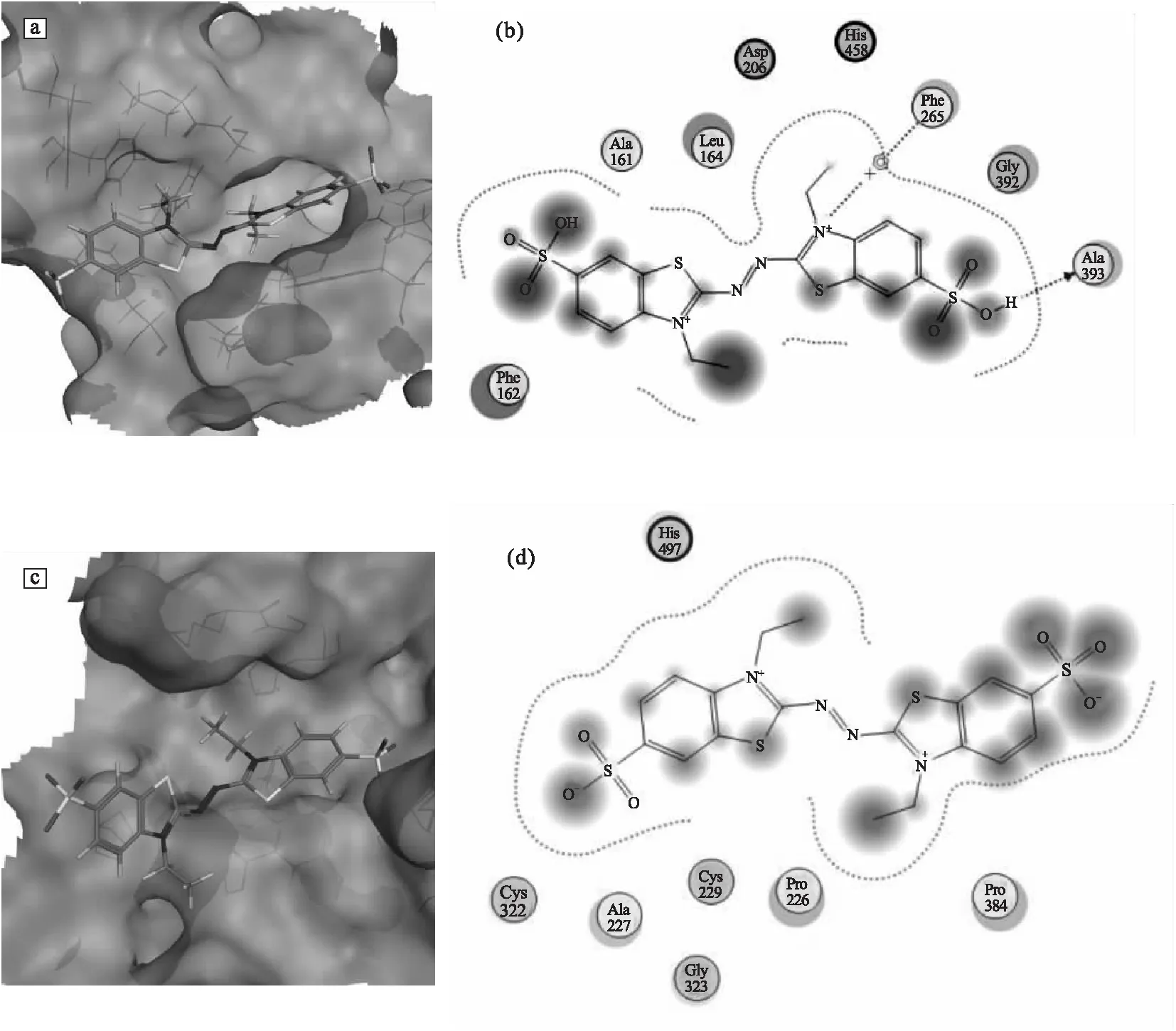
a.变色栓菌漆酶-ABTS的3D结合模式 b.变色栓菌漆酶-ABTS的2D相互作用 c.枯草芽孢杆菌漆酶-ABTS的3D结合模式 d.枯草芽孢杆菌漆酶-ABTS的2D相互作用图2 漆酶与ABTS相互作用示意图Fig.2 The schematic diagram of interaction between laccase and ABTS
从分子对接得到变色栓菌漆酶-ABTS的3D结合模式图(图2a)可知,ABTS结构中连氮基和与其相连的噻唑环深入到活性位点中,磺酸基暴露在活性位点外。从变色栓菌漆酶-ABTS的2D相互作用(图2b)进一步观察发现,ABTS失去电子后的ABTS2+与漆酶活性位点中的Ala161、Phe162、Leu164、Phe265、Gly392和Ala393产生疏水作用,并且介质中间体氮阳离子与Phe265产生π-阳离子相互作用。碱性氨基酸His458作为电子受体接收来自介质的电子,与酸性氨基酸Asp206共同维持体系pH值稳定。
来自细菌的枯草芽孢杆菌漆酶内嵌ABTS的复合物晶体结构已得到解析,晶体结构中漆酶与ABTS间的结合模式能较好地体现相互作用时的特点。利用MOE软件包图形显示功能得到枯草芽孢杆菌漆酶-ABTS的3D结合模式(图2c),该漆酶活性位点空腔浅而宽,ABTS结构中富含电子的连氮基和与其相连的噻唑环呈现“U”型形状深入活性位点内部,该结合模式利于ABTS与漆酶间的电子传递。从枯草芽孢杆菌漆酶-ABTS的2D相互作用(图2d)发现,漆酶活性位点内的中性氨基酸Pro226、Ala227、Cys229、Cys322、Gly323和Pro384与ABTS发生疏水作用。
通过对比两个复合物结合模式发现,ABTS结构中富含电子的连氮基和与其相连的噻唑环均深入到漆酶活性位点,这种结合模式有助于ABTS与漆酶发生电子传递,漆酶-ABTS的2D相互作用图证实了以上推断,ABTS在漆酶作用下发生电子传递后生成ABTS2+。漆酶-ABTS相互作用过程中,漆酶活性位点内的中性氨基酸和碱性氨基酸组氨酸在二者相互作用过程中发挥重要作用。
2.2 讨论
我们在前期研究另外一种机制的介质——氢转移介质时,已建立了得到验证的漆酶-介质对接模型[17]。本研究采取相同的对接参数得到变色栓菌漆酶-ABTS复合物。在该复合物中ABTS与漆酶结合稳定,且结合构象与复合物晶体结构中ABTS的结合构象相似;其中,漆酶-ABTS相互作用的氨基酸类型、数目、强度等与复合物晶体结构中漆酶-ABTS相互作用特点相似。可以看出,复合物在漆酶-ABTS结合稳定性、ABTS结合构象和氨基酸相互作用方面与复合物晶体结构均表现出相似的结合特点,也进一步说明所建立的变色栓菌漆酶-ABTS复合物模型是可靠的。
综合漆酶-ABTS复合物和复合物晶体结构3ZDW的结合模式分析发现,漆酶与ABTS相互作用时,ABTS结构中的连氮基和噻唑环靠近活性位点的电子受体组氨酸His458/His497,可顺利完成电子传递;活性位点的中性氨基酸与ABTS产生较强的疏水作用,稳定了ABTS与漆酶之间的结合构象,在中性氨基酸的疏水作用下,ABTS发生电子传递,生成阳离子中间体,该阳离子中间体在漆酶与底物之间发生电子传递起到介导催化反应的作用。
前期研究还发现,氢转移介质与漆酶产生作用的关键是酸性氨基酸Asp206与介质中的供氢基团之间的氢键作用[17],而本研究的电子转移介质ABTS并不与漆酶活性位点中的酸性氨基酸产生氢键作用,起主导作用的氨基酸为活性位点内的中性氨基酸和组氨酸。由此可见,介质在生成介质中间体过程中遵循不同反应机制的介质与漆酶发生相互作用时,起主导作用的氨基酸类型是不同的。
3 结论
通过分子对接得到变色栓菌漆酶-ABTS复合物模型,并与枯草芽孢杆菌漆酶-ABTS复合物晶体结构作对比,发现二者结合模式相似,从中总结出电子转移介质ABTS与漆酶之间的结合模式与作用机制,提出了不同介导机制的介质与漆酶反应时,起主导作用的氨基酸的差异。主要表现在,漆酶-ABTS相互作用时,富含电子的基团深入漆酶活性位点中,该基团接近电子接收位点组氨酸利于发生电子传递,ABTS与漆酶活性位点中的中性氨基酸发生疏水作用,维持了ABTS与漆酶相互作用时构象的稳定,这对于反应的发生起到关键作用。
[1] UPENDRA N,PRIYANKA S,VEDA P,et al.Structure-function relationship among bacterial,fungal and plant laccase[J].Journal of Molecular Catalysis B:Enzymatic,2011,68:117-128.
[2] 于孟兰,倪金凤.昆虫漆酶的研究进展[J].生物加工过程,2014,12(1):80-85.
[3] CLAUDIA M,EDWIN D,RAUL A,et al.Fungal laccase[J].Fungal Biology Reviews,2013,27:67-82.
[4] 罗爽,谢天,刘忠川,等.漆酶/介体系统研究进展[J].应用与环境生物学报,2015,21(6):987-995.
[5] BOURBONNAIS R,PAICE M G.Oxidation of non-phenolic substrates:an expanded role for laccase in lignin biodegradation[J].FEBS Letters,1990,267(1):99-102.
[6] 陶国翔,李爱秀,罗力,等.漆酶-介质体系中介质的研究进展及应用[J].解放军预防医学杂志,2017,35(1):65-68.
[7] GALLI C,MADZAK C,VADALA R,et al.Concerted electron/proton transfer mechanism in the oxidation of phenols by laccase[J].ChemBioChem,2013,14:2500-2505.
[8] 张鹏.以ABTS为底物测定漆酶活力的方法[J].印染助剂,2007,24(1):43-45.
[9] 邱卫华,陈洪章.木质素的结构、功能及高值化利用[J].纤维素科学与技术,2006,14(1):52-59.
[10] 王玲,陈旺生,鲍欣,等.共基质体系下漆酶介体系统降解氮杂环化合物的研究[J].环境污染与防治,2012,34(4):54-57.
[11] 詹琪,廖红福,张敏,等.漆酶催化复合染料酸性黑ATT脱色的研究[J].环境科学学报,2014,34(5):1236-1241.
[12] MARIE T L,CLAUDE J,MARIE T F,et al.Application of laccase-mediator system (LMS) for the degradation of organophosphorus compounds[J].Chemico-Biological Interaction,2010,187:393-396.
[13] TAKUMI S,YUMI S,HIROSHI K,et al.Comparison of a series of laccase mediators in the electro-oxidation reactions of non-phenolic lignin model compounds[J].Electrochimica Acta,2013,106:440-446.
[14] FRANCISCO J,DAVID M,MARTINS R,et al.Substrate and dioxygen binding to the endospore coat laccase fromBacillussubtilis[J].The Journal of Biological Chemistry,2004,279(22):23472-23476.
[15] 吴琼,康宏,王欢欢,等.AT1受体的中药活性成分筛选模型及其作用机理研究[J].化学学报,2012,70(6):796-802.
[16] 陶国翔,李爱秀,刘子泉,等.木质素降解产物用于漆酶-介质体系的结构理论研究[J].化学与生物工程,2017,34(4):28-33.
[17] 陶国翔,李爱秀,封加栋,等.基于分子对接技术研究漆酶与介质间的结合模式与相互作用机制[J].化学与生物工程,2016,33(12):42-47.
BindingModeandInteractionMechanismofLaccaseandABTS
TAO Guo-xiang1,LI Ai-xiu1*,ZHANG Min2,LIU Zi-quan3
(1.DrugDesignLaboratoryoftheBasicScienceDepartment,LogisticsUniversityofChinesePeople′sArmedPoliceForce,Tianjin300309,China;2.ScientificResearchDepartment,LogisticsUniversityofChinesePeople′sArmedPoliceForce,Tianjin300309,China;3.KeyLaboratoryofDisasterandEmergencyRescueMedicine,AffiliatedHospitalofLogisticsUniversityofChinesePeople′sArmedPoliceForce,Tianjin300162,China)
In order to find new mediators and provide a theoretical basis for further study on extending the application scope of laccase,we selected the electron transfer mediator—2,2′-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid)(ABTS) as an object to reveal the binding mode and interaction mechanism at the molecular level between laccase and ABTS.On the basis of molecular docking,we built a complex model ofTrametesversicolorlaccase-ABTS,and compared the crystal structure ofBacillussubtilislaccase-ABTS complex.Moreover,we explained the interaction mechanism of laccase and ABTS at the molecular level with the binding characteristics of two complexes.The results indicated that the rich electronics group in ABTS penetrated into the laccase active site,and approached the electron acceptor histidine.Many neutral amino acids interacted with ABTS by hydrophobic interaction at laccase active site,and stablilized the binding conformation.Finally,ABTS turned into cationic intermediate and played a mediated role under the action of laccase.
laccase;ABTS;laccase-ABTS system;molecular docking;interaction mechanism
武警后勤项目(WJHQ2012-14),武警后勤学院重点项目(WHZ201201),天津市卫生局科技基金项目(2015KZ123),武警后勤学院基础研究项目(WHJ2016025)
2017-06-30
陶国翔(1991-),男,河北南宫人,硕士研究生,研究方向:计算机辅助药物设计,E-mail:taoguoxiang91@126.com;通讯作者:李爱秀,教授,E-mail:liaixiu2006@126.com。
10.3969/j.issn.1672-5425.2017.11.006
陶国翔,李爱秀,张敏,等.漆酶与ABTS间的结合模式与作用机制研究[J].化学与生物工程,2017,34(11):23-26.
O641 Q814.9
A
1672-5425(2017)11-0023-04
