CdSe量子点的合成、功能化及生物应用
2017-11-29邓文清熊小莉
邓文清,代 蕊,江 雪,罗 虹,黄 科,熊小莉
(四川师范大学化学与材料科学学院,四川 成都 610066)
CdSe量子点的合成、功能化及生物应用
邓文清,代 蕊,江 雪,罗 虹,黄 科,熊小莉
(四川师范大学化学与材料科学学院,四川 成都 610066)
量子点是一种新型荧光纳米材料,具有独特而优良的荧光性质,近年来受到研究者的广泛关注。文章综述蛋白质、抗体、肽类以及DNA等对CdSe量子点(CdSe QDs)的表面功能化作用,以及CdSe QDs在生物传感分析中的重要研究进展。具体介绍CdSe量子点的多种合成方法(包括有机相合成、水相合成等),蛋白质、抗体、肽类、DNA利用共价键或静电作用对CdSe量子点修饰方法,以及其在生物医学标记与成像、生物传感、药物载送以及癌症治疗等领域的相关应用,最后针对现有研究的不足进行展望。希望通过对CdSe量子点全方位总结与概述,在一定程度上帮助科研工作者快速、准确了解其相关性质与研究进展。
量子点;合成;功能化;生物应用
0 引 言
量子点(QDs),是由几百到几千个原子组成的具有量子约束效应的发光半导体纳米晶体,其尺寸小于波尔半径时,会展现出显著的量子效应。作为一种新的荧光纳米材料,量子点具有许多独特的性质,如尺寸依赖效应、窄而对称的吸收峰、荧光寿命长以及量子产率高等[1-2],在生物学领域中应用广泛[3-4]。CdSe QDs是目前研究比较成熟的一类量子点,相较其他种类的量子点而言,具有显著的优势,如在同一波长光的照射下,随着自身粒径的不同,CdSe QDs的发射光谱在430~660nm范围内可调[5],CdSe QDs荧光量子产率高、易于检测、合成条件温和以及合成周期较短等。因此,CdSe量子点长期以来受到广泛的关注与研究。本文探讨了CdSe类QDs的制备及功能化方法,并对其在生物分析领域方面的应用进行了综述和展望。
1 CdSe QDs的合成方法
半导体量子点的形貌和结构对其固有的磁、电、光性质有很大的影响,不同合成方法制备的QDs的性质不同,其用途也不同;因此,量子点的合成一直以来受到科学家们的广泛关注。目前有机相合成和水相合成是两类主要的合成方法。
1.1 有机相合成
有机相合成QDs是最常用的方法之一,其发展主要包括了采用有机金属作为反应前驱体的有机金属法和无机金属作为反应前驱体的绿色化学法两个阶段。
有机金属法是指在200~400℃高温条件下将有机金属前驱体注入配体溶液中,前驱体在高温条件下迅速热解并成核,核继续生长形成量子点的一种方法[6-7]。反应中配体在QDs的表面形成疏水层,可以有效防止QDs发生聚集,因此有机金属法能够合成单分散并且具有高稳定性的QDs。采用此方法制备出的QDs有较好的荧光量子产率与光学性质。Bawendi等[8]采用有机合成方法制备了三辛基膦(TOP)/三辛基氧膦(TOPO)包裹的 CdSe QDs 量子点,合成的CdSe QDs具有较好的分散性和均匀的尺寸分布,但是荧光量子产率相对较低。后来研究发现,利用能带较大的ZnS包被在能带较小的CdSe表面能有效提高QDs的荧光量子产率,因此逐渐将提高QDs荧光量子产率的方法集中到形成CdSe/ZnS这样的核壳结构上。Hines等[9]在TOPO/TOP溶剂中合成了荧光量子产率高、稳定性强的CdSe/ZnS QDs。但是有机金属法也具有很多缺点,如使用的原料较贵且具有较大的毒性,合成过程较危险,易发生爆炸等,限制了此方法的进一步推广与运用。
后来研究者提出了绿色化学合成法[10],用稳定性高、毒性低且价格低廉的氧化镉为原料代替二甲基镉作为前驱体,与Se溶液混合反应,以此来制备性质优良的CdSe QDs。此方法虽然降低了反应成本,但是在反应过程中还是保留了毒性较强的有机膦溶剂的使用,因此还需寻找更绿色的合成方法。
1.2 水相合成法
水相法制备QDs通常选用水溶性的离子作阴离子前驱体,多官能团小分子作稳定剂,通过加热回流使QDs在水相中成核并生长熟化[11]。Chen等[12]利用L-半胱氨酸上的巯基和羧基,与纳米簇表面的Cd原子形成共价键,制得了粒径均一、具有较高荧光量子产率以及较好生物相容性的CdSe QDs。Wang等[13]在微波辐射的条件下,合成了柠檬酸稳定的CdSe纳米粒子,柠檬酸根离子为纳米粒子提供足够的静电稳定性,以避免纳米粒子发生聚集;因此该量子点在水溶液中有较好的单分散性。水相法制备QDs克服了有机合成的缺点,但是该法也存在结晶不完善、表面缺陷多、发光性能较差等问题,故水相合成法也需要进一步的改进。
2 CdSe QDs的表面功能化
尽管CdSe QDs具有许多独特和优异的物理化学性质与光学性质,但是它也存在一些局限,如生物兼容性低、水溶性较差以及毒性相对较大。为了克服这些缺点,需对量子点表面进行一定的包裹与修饰,近年来文献陆续报道了各种小分子(包括硫基、聚合物、DNA等修饰剂)包裹修饰的CdSe QDs。制备出的QDs拥有良好的生物相容性,广泛用于生物小分子的检测、疾病的诊断与治疗、生物传感等方面,在生物医学领域有着广阔的应用前景。
2.1 蛋白质包裹
蛋白质包裹的QDs在生物医学领域有很多重要的应用,因此将蛋白质作为合成QDs的常用包裹剂。通常可以通过静电吸引、共价键偶合等方式将蛋白质修饰到QDs表面,其中共价键结合是最常用的方式。共价键结合是利用蛋白质分子的官能团与量子点表面的官能团发生化学反应生成共价键的一种结合方式。由于蛋白质存在氨基与巯基,很容易与氨基、羧基修饰的QDs形成共价键相互偶合。使用新型蛋白(天然植物螯合肽)绑定在水溶性较差的CdSe/ZnS QDs上时,能够增加QDs的水溶性,并且被包裹的QDs呈现出很高的胶态稳定性,在水溶液中保持很高的量子产率,能够与不同的功能团进行生物偶联(如图1[14]所示)。
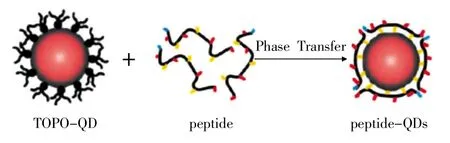
图1 量子点表面活性剂与γPC3肽交换原理图[14]
其结果表明,很多γ结构肽能够在有硫醇结构的QDs表面进行定向绑定,这些优化的QDs能够用于活细胞成像和斑马鱼体内成像及可视化传感。多价态蛋白质配体与QDs的自组装对于QDs的表面功能化已经成为了一种很重要的方法,并且在生物领域有着广泛的应用[15-16]。如图2所示,Xia等[17]基于荧光共振能量转移(FRET)的原理研究了CdSe/ZnS QDs与不同几何结构和构架的多价蛋白配体的组装,结果表明在有限的空间下多价蛋白与QDs的绑定序列能够紧密结合,以获得直接、稳定的蛋白质与QDs的复合物。这一结论对于指导QDs与多价配体的设计是非常有用的,该方法也成功用于生物分子体内成像。
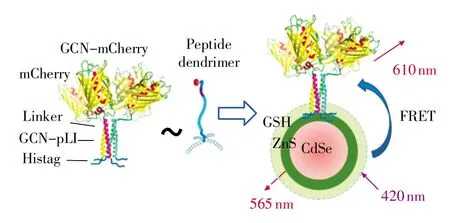
图2 GCN-mCherry与谷胱甘肽包裹的CdSe/ZnS量子点发生自组装导致荧光共振能量转移示意图[17]
蛋白质修饰QDs除应用于生物体内成像,也常用于离子的检测和小分子特异性结合。如用变性的牛血清白蛋白(dBSA)合成了dBSA包裹的CdSe量子点(dBSA-CdSe),dBSA上游离的半胱氨酸残基,能够有效的与金属离子螯合以及在形成稳定CdSe时起到表面钝化作用,当Cu2+出现时,与量子点相互响应,进而猝灭量子点的荧光。这种QDs能够高灵敏地检测Cu2+,对Cu2+的检出限达到5nmol/L[18](如图3所示)。
Snee等[19]用罗丹明哌嗪-赖氨酸-生物素(RBpip-Biotin)与CdSe/ZnS量子点进行偶联,再用凝血素修饰,生成由凝血素包裹的QDs,并以此建立了比率传感高灵敏检测蛋白质的方法,其检测限低至1 pmol/mL。Mattoussi等[20]则通过将辛硫酸包裹的CdSe/ZnS量子点与重组麦芽糖结合蛋白(MBP)进行偶联得到QD-MBP,这种蛋白包裹的QDs既保留了QDs的光学性质又保留了麦芽糖结合蛋白的生物活性。
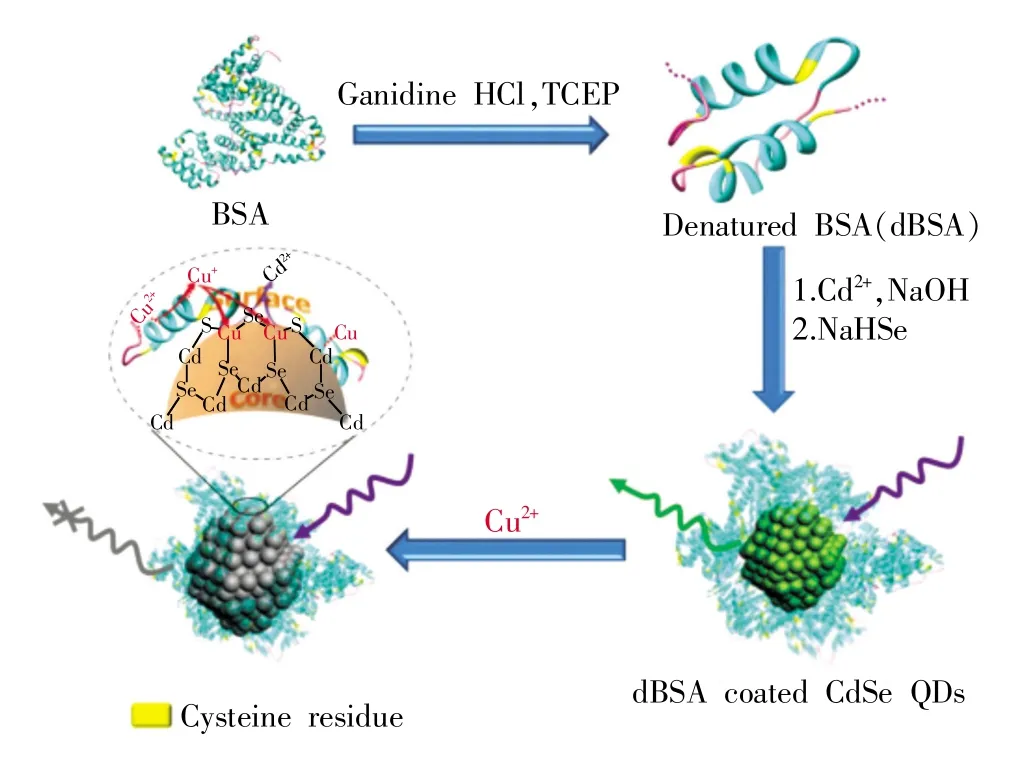
图3 dBSA包裹CdSe量子点的合成与荧光猝灭的原理图[18]
2.2 抗体的包裹
抗体是一种能特异性结合抗原的糖蛋白,将抗体连接在量子点上能够使QDs上的抗体与生物体内的抗原进行特异性结合,进而能够定性定量地检测生物体内的生物分子。当生物体内器官发生病变时,会导致此器官内的某些分子过度表达或降低表达;因此,抗体修饰的QDs能够在生物体内作为荧光传感检测肿瘤细胞。抗体与量子点的结合方法分为非共价结合和共价结合,非共价结合多采用生物素-亲和素连接方式。共价结合为抗体与量子点的表面功能基团通过1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)的活化作用相互反应生成共价键,最常用到的结合方式为氨基与羧基、氨基与巯基、醛基与酰肼的结合[21](如图4所示)。Pang等[22]合成羧基化的CdSe/ZnS量子点,用EDC和N-羟基琥珀亚酰胺(NHS)作为活化剂活化QDs表面的官能团,使其能快速与MC02抗体进行偶合,利用MC02抗体修饰的QDs能够灵敏地定量检测C反应蛋白,在缓冲液中对C反应蛋白的检出限为27.8 pmol/L,而在血清中检出限为34.8pmol/L,较高的灵敏度能够作为精确诊断细菌、病毒感染以及其他类型癌症的判断基础。CdSe/ZnS与免疫球蛋白(IgG)和链霉素连接用来标记活细胞表面的乳腺癌肿瘤标志物Her2,对细胞质中的肌动蛋白和微管纤维进行染色,并检测细胞核内的核抗原[23]。
2.3 肽类包裹

图4 量子点-抗体生物偶联的原理示意图[21]
肽类作为常见的生物分子也常常用来修饰QDs。肽类与量子点的结合常利用肽类表面的氨基和巯基,与量子点表面的氨基和羧基以共价键方式结合。Willner等[24]合成了谷胱甘肽(GSH)包裹的 CdSe/ZnS量子点,用于分析酪蛋白激酶(CK2)的光学性质和碱性磷酸酶(ALP)的水解活性。Dawson等[25]利用两性离子配体功能化CdSe/ZnS量子点与棕榈酸结合肽偶联,在小鸡胚胎第四天时注入小鸡胚胎脊髓用来传送以及追踪QDs的行动轨迹。类似的利用金属与六聚组氨酸肽相互作用进行自组装已经作为一个有效的、定点的方法来对CdSe/ZnS量子点与蛋白质进行表面修饰[26-27]。另外,利用生物仿生法合成小分子包裹QDs的方法相对简单,也得到了广泛推广。Chen等[28]利用生物仿生方法使用双功能肽合成了由肽链包裹的CdSe/ZnS核壳半导体晶体。这种方法对于核壳量子点的合成有非常重要的指导意义。通常,磷脂质也会被用来包裹QDs,Kim等[29]将CdSe/CdS/ZnS QDs与透明质酸(HA)合成了 HA-QD,结构稳定,尺寸可调并且可以应用于标记淋巴血管。
2.4 DNA包裹
DNA功能化的QDs在生物应用方面扮演着重要的角色,单链DNA能够识别互补的DNA/RNA通过碱基互补配对形成正常的螺旋结构,因此用DNA功能化的QDs能够检测病毒和细菌中的DNA片段[30]以及小RNA[31]。DNA也能够作为适配体,与目标分子有很高的亲和性。这些适配体功能化的量子点能够用来检测离子、蛋白,或用于疾病诊断[32-33]和细胞成像[34]。
DNA包裹QDs一般采用两种方法:1)利用生物素-链酶亲和素的化学反应方法,其原理是用链酶亲和素包裹的QDs在预先设计的DNA展现生物素分子的特定区域进行自组装,形成所需要的产物;2)DNA修饰的QDs与DNA携带互补序列的捕获链进行杂交[35]。DNA与QDs之间结合的方式有静电吸引以及共价键结合[36](如图5所示)。
Sharma等[37]基于DNA二维阵列合成链酶亲和素功能化CdSe量子点。Zhao等[38]则将寡核苷酸连接在3-巯基丙酸修饰的CdSe/ZnS量子点表面形成功能化的QD-DNA偶联物,用来检测乙型肝炎病毒的DNA和单碱基突变。
3 CdSe QDs在生物方面的应用
半导体QDs是一类重要的荧光标记物,他们拥有独特的光学性质并且能够与医学和成像技术相结合而用于分子和细胞成像,包括体内与体外成像、荧光寿命成像、靶向细胞成像、药物传送等方面。
3.1 生物医学标记与成像
通常,QDs进入细胞通过4种途径:1)通过内吞作用被细胞吸入;2)由受体调节与细胞膜相互作用并且内吞;3)物理处理促进细胞递送;4)组合方法[39]。探讨QDs进入细胞的途径有利于促进量子点在细胞生物学方面的应用,比如靶向细胞成像和生物进程的监测。Weiss等[40]用两种不同颜色的硅包裹的CdSe/ZnS量子点可以同时对小鼠纤维细胞实现双色成像。使用生物分子或小分子包裹的CdSe类QDs很多都能够进行生物成像。此外,Zhang等[41]用单域抗体(sdAbs)功能化 CdSe/ZnS量子点(sdAbs-CdSe/ZnS),根据抗原抗体特异性结合的原理,sdAbs-CdSe/ZnS能够特异性识别并标记表皮生长因子受体(EGFR),这就使QDs能够对EGFR表达异常的癌细胞进行生物成像。这些QDs能够在细胞环境中稳定存在,并且抗光漂白能力强。Mulder等[42]将疏水的CdSe量子点植入聚乙二醇脂质和顺磁性脂质制备了具有良好的光学性质与高弛豫效能的顺磁性量子点。当与精氨酸-甘氨酸-天冬氨酸共轭后,此磁性量子点能够用来对人脐静脉内皮细胞成像。
3.2 生物传感

图5 生物偶合方法的示意图
功能化的半导体QDs可以作为不同的生物传感器,其原理是QDs直接作为荧光标记靶向生物分子,QDs上的配体链识别目标分子,并且QDs的荧光信号的变化可以反应目标分子的数量。荧光信号的改变通常是由QDs与临近目标分子之间发生电荷转移或者电子转移造成的。由于QDs的荧光与其表面状态关系密切,因此当目标分子连接或者替换QDs表面的物质时会导致QDs的荧光增强或者猝灭。除了目标分子的连接或替换,还有一种方式也能引起QDs的荧光变化,即量子点与目标分子之间发生FRET[43]。通常发生FRET需要满足两个重要的条件:1)供体的发射光谱与受体的吸收光谱之间有重叠;2)供体与受体之间有适当的有效距离(1~10nm)。对QDs表面功能化可以使QDs作为能量供体或能量受体,当目标分子出现时就可能导致能量转移的发生或终止。图6总结了QDs作为发光生物传感器和能量转移传感器的典型的传感机制[44]。
为监测络氨酸酶的活性,Gill等[45]将CdSe/ZnS QDs与络氨酸甲脂和含有络氨酸残基的肽偶联,络氨酸酶通过氧气诱导络氨酸氧化形成邻-苯醌,从而猝灭QDs的荧光,因此通过QDs荧光的猝灭就能够监测络氨酸酶的活性。当邻-苯醌从QDs表面移除后又会使QDs的荧光恢复,因此加入有特异性凝血酶分裂位点的肽能够进一步监测凝血酶活性。Dubertret等[46]将CdSe/ZnS QDs包裹在磷脂嵌段共聚物胶囊中,得到尺寸均匀、形状规则、单分散的荧光QDs胶囊,用于体内和体外成像。当QDs与DNA进行偶联,可作为荧光探针与互补链进行特异性杂交。此外,将QDs胶囊注入非洲爪蟾胚胎时,可用于在胚胎形成过程中进行血统追踪实验。基于FRET原理,Algar等[47]用两个供体和一个受体形成的同轴FRET传感器用来检测胰蛋白酶的活性,且其检测限达到nMol水平。随后,他们还构建了一个同轴FRET的多功能传感器,能够用于同时检测蛋白酶的浓度与活性[48](如图 7 所示)。

图6 不同量子点作为传感器的传感机理[44]
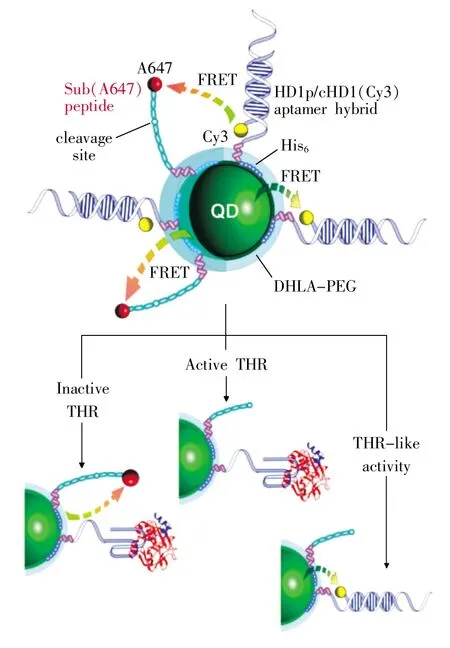
图7 量子点作为同轴荧光共振能量转移传感器同时检测凝血酶的浓度和凝血酶的活性的示意图[48]
Huang等[49]基于FRET原理利用巯基丁二酸(MSA)修饰的CdSe/ZnS QDs和葡萄糖氧化酶定性、定量检测葡萄糖。无葡萄糖存在时,由于葡萄糖氧化酶与QDs发生FRET,QDs的荧光明显增强,加入葡萄糖后,葡萄糖氧化酶与葡萄糖相互发生反应,阻碍了FRET的发生,故使得QDs的荧光发生降低甚至猝灭。此方法中葡萄糖的浓度在0.2~10mmol/L与2~30mmol/L的范围内与QDs的荧光强度呈较好的线性关系。用修饰后的QDs制备的传感器,能够对生物体内进行可视化检测,并且检出限低,反应灵敏,结果准确。
3.3 药物载送以及癌症治疗
量子点在肿瘤标志物的传感与成像的成功应用为早期临床诊断、高通量筛选和视觉手术指导的进一步应用提供了基础[50]。由于他们显著的高荧光性、大的比表面积以及各种共轭的柔性层,致使量子点在药物载送与释放中扮演多重角色。此外,量子点与高容量生物相容的纳米载体的结合能够有效提高其稳定性、生物相容性以及药物载送的能力。Minko等[51]构建量子点-黏蛋白和阿霉素(DOX)的共轭体系用于卵巢癌细胞中靶向药物治疗,量子点-黏蛋白与DOX的共轭体系的制备首先通过氨基修饰的黏蛋白与羧基修饰的量子点通过碳二酰胺反应结合;随后量子点与DOX通过形成酸不稳定腙键相互结合。量子点与DOX发生荧光共振能量转移,可以猝灭量子点的荧光。然而,癌组织的酸性溶酶体室和酸性微环境可能会瓦解QD-黏蛋白-DOX之间的腙键,导致DOX的释放进而使得量子点到DOX的荧光共振能量转移作用被终止,量子点荧光的恢复可以用来监测药物在癌细胞中的释放。Farokhzad等[52]展示了多功能的量子点-适配体的共轭体系同时用于癌症成像和靶向药物递送。量子点-适配体的共轭通过羧基修饰的量子点与氨基修饰的适配体反应生成,量子点的功能用于体内成像和药物载体。Park等[53]构建了量子点与免疫脂质体的共轭体系用于靶向肿瘤细胞成像与药物载送。免疫脂质体与量子点的复合物通过将抗人表皮生长因子单克隆抗体片段连接在脂质体上,随后与量子点相互结合。这些免疫脂质体-QD混合物能够有效地将抗癌药物DOX载送到人表皮生长因子过度表达的细胞,从而达到成像与药物治疗的目的。
4 结束语
CdSe QDs凭借自身突出的物理化学性能和独特的光学性质,使其在生物传感、疾病检测、小分子的检测、药物载送等方面有着非常广泛的应用,在生物传感分析与生物医学方面展示了举足轻重的作用。但是将CdSe QDs用于生物体内还是存在很多局限性:1)生物体与环境样本比较复杂,通常会严重干扰CdSe类QDs对生物分子的识别与标记而导致假阳性;2)CdSe类QDs作为传感器难以在复杂的生物体与环境中同时鉴定与检测多元生物分子;3)如何合成高通量和高水溶性的CdSe类QDs;4)如何降低CdSe类QDs在生物体中的毒性。随着科学家们的不断努力,相信CdSe QDs存在的局限都会被一一克服,并且能够在生物领域内发挥更大的作用。
[1]MEDINTZ I L, UYEDA H T, GOLDMAN E R, et al.Quantum dot bioconjugates for imaging,labelling and sensing[J].Nature Materials,2005(4):435-446.
[2]DUBERTRET B, SKOURIDES P, NORRIS D J, et al.In vivo imaging of quantum dots encapsulated in phospholipid micelles[J].Science,2002,298:1759-1762.
[3]LARSON D R,ZIPFEL W R,WILLIAMS R M,et al.Water-soluble quantum dots for multiphoton fluorescence imaging in vivo[J].Science,2003,300:1434-1436.
[4]ZHAO D, LI J, YANG T, et al.Turn off-on fluorescent sensor for platinum drugs-DNA interactions based on quantum dots[J].Biosenser Bioelectron,2014(52):29-35.
[5]MICHALET X, PINAUD F F, BENTOLILA L A, et al.Quantum dots for live cells, in vivo imaging, and diagnostics[J].Science,2005,307(5709):538-544.
[6]PENG Z A,PENG X.Mechanisms of the shape evolution ofCdSe nanocrystals[J].Journal of the American Chemical Society,2001,123:1389-1395.
[7]PENG Z A,PENG X.Nearly monodisperse and shapecontrolled CdSe nanocrystals via alternative routes:nucleation and growth[J].Journal of the American Chemical Society,2002,124:3343-3353.
[8]MURRAY C B, NORRIS D J, BAWENDI M G.Synthesis and characterization of nearly monodisperse CdE(E=S,Se,Te) semiconductor nanocrystallites[J].Journal ofthe American ChemicalSociety,1993,115:8706-8715.
[9]HINES M A,GUYOT-SIONNEST P.Synthesis and characterization of strongly luminescing ZnS-capped CdSe nanocrystals[J].Journal of Physical Chemistry,1996,100:468-471.
[10]LI J J, WANG Y A, GUO W, et al.Large-scale synthesis of nearly monodisperse CdSe/CdS core/shell nanocrystals using air-stable reagents via successive ion layer adsorption and reaction[J].Journal of the American Chemical Society,2003,125:12567.
[11]HAN H, SHENG Z, LIANG J.A novel method for the preparation of water-soluble and small-size CdSe quantum dots[J].Materials Letters,2006(60):3782-3785.
[12]CHEN J L, GAO Y C, XU Z B, et al.A novel fluorescent array for mercury (II) ion in aqueous solution with functionalized cadmium selenide nanoclusters[J].Analytica Chimica Acta,2006,577(1):77-84.
[13]WANG Y, TANG Z, CORREA-DUARTE M A, et al.Mechanism ofstrong luminescence photoactivation of citrate-stabilized water-soluble nanoparticles with CdSe cores[J].Journal of Physical Chemistry,2004,108(40):15461-15469.
[14]XU J M, RUCHALA P, EBENSTAIN Y, et al.Compact,bright biofunctional quantum dots with improved peptide coating[J].Journal of Physical Chemistry,2012,116(36): 11370-11378.
[15]DONG A, YE X, CHEN J, et al.A generalized ligand-exchange strategy enabling sequential surface functionalization of colloidal nanocrystals[J].Journal of the American Chemical Society,2011,133(4):998-1006.
[16]YOU C C, AGASTI S S, DE M, et al.Modulation of the catalytic behavior of α-chymotrypsin at monolayerprotected nanoparticle surfaces[J].Journal of the American Chemical Society,2006,128(45):14612-14618.
[17]LU Y, WANG J P, WANG J H, et al.Genetically encodable design of ligand bundling on the surface of nanoparticles[J].Langmuir,2012,28(39):13788-13792.
[18]BU X H,ZHOU Y M,HE M,et al.Bioinspired,direct synthesis of aqueous CdSe quantum dots for highsensitive copper(II) ion detection[J].Dalton Transactions,2013,42(43):15411-15420.
[19]TYRAKOWSKI C M,SNEE P T.Ratiometric CdSe/ZnS quantum dot protein sensor[J].Analytical Chemistry,2014,86(5):2380-2386.
[20]MATTOUSSI H,MAURO J M,GOLDMAN E R,et al.Self-assembly of CdSe-ZnS quantum dot bioconjugates using an engineered recombinant protein[J].Journal of the American Chemical Society,2000,122(49):12142-12150.
[21]XING Y, CHAUDRY Q, SHEN C, et al.Bioconjugated quantum dots for multiplexed and quantitative immunohistochemistry[J].Nature Protocols,2007,2(5):1152-1165.
[22]HU J, ZHANG Z L, WEN C Y, et al.Sensitive and quantitative detection of C-reaction protein based on immunofluorescent nanospheres coupled with lateral flow test strip[J].Analytical Chemistry,2016,88(12):6577-6584.
[23]WU X, LIU H, LIU J, et al.Immunofluorescent labeling of cancer marker Her2 and other cellular targets with semiconductor quantum dots[J].Nature Biotechnology,2003,21(1):41-46.
[24]FREEMAN R, FINDER T, WILLNER I, et al.Probing protein kinase (CK2) and alkaline phosphatase with CdSe/ZnS quantum dots[J].Nano Letters,2010,10(6):2192-2196.
[25]AGARWAL R, DOMOWICZ M S, SCHWARTZ N B,etal.Delivery and tracking of quantum dot peptide bioconjugates in an intact developing avian brain[J].ACS Chemical Neuroscience,2015,6(3):494-504.
[26]SAPSFORD K E, ALGAR W R, BERTI L, et al.Functionalizing nanoparticles with biological molecules:developing chemistries that facilitate nanotechnology[J].Chemical Reviews,2013,113(3):1904-2074.
[27]PRASUHN D E, DESCHAMPS J R, SUSUMU K, et al.Polyvalent display and packing of peptides and proteins on semiconductor quantum dots:predicted versus experimental results[J].Small,2010,6(4):555-564.
[28]SINGH S, BOZHILOV K, MULCHANDANI A, et al.Biologically programmed synthesis of core-shell CdSe/ZnS nanocrystals[J].Chemical Communications,2010,46(9):1473-1475.
[29]BHANG S H, WON N, LEE T J, et al.Hyaluronic acid-quantum dot conjugates for in vivo lymphatic vessel imaging[J].ACS Nano,2009,3(6):1389-1398.
[30]SAMANTA A, DENG Z, LIU Y, et al.A perspective on functionalizing colloidal quantum dots with DNA[J].Nano Research,2013,6(12):853-870.
[31]SU S, FAN J, XUE B, et al.DNA-conjugated quantum dot nanoprobe for high-sensitivity fluorescent detection of DNA and micro-RNA[J].ACS Applied Materialsamp;Interfaces,2014,6(2):1152-1157.
[32]BAGALKOT V, ZHANG L, LEVY-NISSENBAUM E,et al.Quantum dot-aptamer conjugates for synchronous cancer imaging, therapy, and sensing of drug delivery based on bi-fluorescence resonance energy transfer[J].Nano Letters,2007,7(10):3065-3070.
[33]LEVY M, CATER S F, ELLINGTON A D.Quantumdot aptamer beacons for the detection of proteins[J].Chem Bio Chem,2005,6(12):2163-2166.
[34]MA N,SARGENT E H,KELLEY S O.One-step DNA-programmed growth of luminescent and biofunctionalized nanocrystals[J].Nature Nanotechnology,2009(4):121-125.
[35]SAMANTA A, BANERJEE S, LIU Y.DNA nanotechnology for nanophotonic applications[J].Nanoscale,2015,7(6):2210-2220.
[36]ZHANG C L, DING C P, XIANG D S, et al.DNA functionalized fluorescent quantum dots for bioanalytical applications[J].Chinese Journal of Chemistry,2016,34(3):317-325.
[37]SHARMA J, KE Y, LIN C, et al.DNA tile directed self assembly of quantum dots into two dimensional nanopatterns[J].Angewandte Chemie,2008,47(28):5157-5159.
[38]WANG X, LOU X H, ZHAO J L, et al.QDs-DNA nanosensor for the detection of hepatitis B virus DNA and the single-base mutants[J].Biosensors and Bioelectronics,2010,25(8):1934-1940.
[39]BREGER J, DELEHANTY J B, MEDINTZ I L.Continuing progress toward controlled intracellular delivery ofsemiconductor quantum dots[J].Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology,2015,7(2): 131-151.
[40]BRUCHEZ M, MORONNE M, GIN P, et al.Semiconductor nanocrystals as fluorescent biological labels[J].Science,1998,281(5385):2013-2016.
[41]ZAMAN M B, BARAL T N, ZHANG J, et al.Singledomain antibody functionalized CdSe/ZnS quantum dots for cellular imaging of cancer cells[J].The Journal of Physical Chemistry,2008,113(2):496-499.
[42]MULDER W J M,KOOLE R,BRANDWIJK R J M G E,et al.Quantum dots with a paramagnetic coating as a bimodal molecular imaging probe[J].Nano Letters,2006,6(1):1-6.
[43]LIU H, XU S, HE Z, et al.Supersandwich cytosensor for selective and ultrasensitive detection of cancer cells using aptamer-DNA concatamer-quantum dots probes[J].Analytical Chemistry,2013,85(6):3385-3392.
[44]ZHOU J, YANG Y, ZHANG C Y.Toward biocompatible semiconductor quantum dots:from biosynthesis and bioconjugation to biomedical application[J].American Chemical Society,2015,115(21):11669-11717.
[45]GILL R, FREEMAN R, XU J P, et al.Probing biocatalytic transformations with CdSe/ZnS QDs[J].Journal of the American Chemical Society,2006,128 (48):15376-15377.
[46]DUBERTRET B, SKOURIDES P, NORRIS D J, et al.In vivo imaging of quantum dots encapsulated in phospholipid micelles[J].Science,2002,298(5599):1759-1762.
[47]KIM H,NG C Y W,ALGAR W R.Quantum dotbased multidonor concentric FRET system and its application to biosensing using an excitation ratio[J].Langmuir,2014,30(19):5676-5685.
[48]WU M, PETRYAYEVA E,ALGAR W R.Quantum dotbased concentricFRET configuration fortheparallel detection of protease activity and concentration[J].Analytical Chemistry,2014,86(22):11181-11188.
[49]HUANG C P,LIU S W,CHEN T M,et al.A new approach for quantitative determination of glucose by using CdSe/ZnS quantum dots[J].Sensors and Actuators B: Chemical,2008,130(1):338-342.
[50]SUNG H W,LIU Z.Advanced drug delivery systems for therapeutic applications[J].Advanced Healthcare Materials,2014,8(3):1130-1132.
[51]SAVLA R, TARATULA O, GARBUZENKO O, et al.Tumor targeted quantum dot-mucin 1 aptamer-doxorubicin conjugate for imaging and treatment of cancer[J].Jouynal of Controlled Release,2011,153(1):16-22.
[52]BAGALKOT V, ZHANG L, LEVY-NISSENBAUM E,et al.Quantum dot-aptamer conjugates for synchronous cancer Imaging, therapy, and sensing of drug delivery based on bi-fluorescence resonance energy transfer[J].Nano Letters,2007,7(10):3065-3070.
[53]WENG K C, NOBLE C O, PAPAHADJOPOULOS-STE RNBERG B,et al.Targeted tumor cell internalization and imaging of multifunctional quantum dot-conjugated immunoliposomes in vitro and in vivo[J].Nano Letters,2008,8(9): 2851-2857.
(编辑:莫婕)
Synthesis,functionalization and bio-applications of CdSe quantum dots
DENG Wenqing, DAI Rui, JIANG Xue, LUO Hong, HUANG Ke, XIONG Xiaoli
(College of Chemistry and Materials Science,Sichuan Normal University,Chengdu 610066,China)
Quantum dots, anew kind ofluminescentnanometermaterialwith uniqueand excellent fluorescent properties,have drawn much attention of researchers in recent years.In this article, the surface functionalization of proteins, antibodies, peptides and DNA on the CdSe quantum dots (CdSe QDs) and its important research progress in biosensor analysis have been reviewed in details.This article specifically introduced the various synthetic methods of CdSe QDs including organic phase synthesis, aqueous synthesis and so on, the modification of proteins,antibodies, peptides and DNA for CdSe QDs by covalent bond or electrostatic interactions, and its application in biological fields, such as biomedical labeling and imaging, biosensor, drug delivery and cancer treatment.Finally,a summary and expectation for the deficiency of related study of CdSe QDs have been made.It will be helpful for researchers to understand their related properties and research progress quickly and accurately to some extent based on all-around summary and overview for CdSe QDs.
quantum dots; synthesis; functional; bio-application
A
1674-5124(2017)11-0051-08
10.11857/j.issn.1674-5124.2017.11.011
2017-03-18;
2017-05-10
国家自然科学基金(21605108);四川师范大学实验室及设备管理处基金(ZZYQ2016-1)
邓文清(1992-),女,四川广安市人,硕士研究生,专业方向为光谱分析。
黄 科(1987-),男,四川成都市人,实验师,主要从事光谱分析研究。
