薯蓣皂素标准物质的研制
2017-11-29董跟来王鹤妍席兴军
兰 韬, 董跟来, 初 侨, 刘 文, 杨 丽, 王鹤妍, 王 尉, 席兴军
(1.中国标准化研究院,北京 100191;2.亚东信基(北京)农产品有限公司,北京 100125;3.北京市理化分析测试中心,北京 100089)
薯蓣皂素标准物质的研制
兰 韬1, 董跟来2, 初 侨1, 刘 文1, 杨 丽1, 王鹤妍1, 王 尉3, 席兴军1
(1.中国标准化研究院,北京 100191;2.亚东信基(北京)农产品有限公司,北京 100125;3.北京市理化分析测试中心,北京 100089)
按照JJF 1006——1994《一级标准物质技术规范》的要求,建立薯蓣皂素标准物质的研制方法。采用IR、UV、MS和NMR等方法对薯蓣皂素标准物质进行定性分析,以高效液相色谱方法进行均匀性和稳定性检验,通过8家实验室的联合定值,完成结果的数据分析。结果表明:该标准物质的均匀性和稳定性良好,定值结果为98.9%,置信度为95%的不确定度为0.2%。研制出的标准物质可用于薯蓣产品的检测和质量控制。
薯蓣皂素;标准物质;均匀性;稳定性;定值
0 引 言
盾叶薯蓣为我国特有的薯蓣科多年生草本植物[1]。薯蓣皂素(Diosgenin)是盾叶薯蓣的主要化学成分,在制药行业中应用较为广泛,是甾体激素类药物的重要原料来源,以薯蓣皂素为原料,通过衍生、合成等方法制得多种药物[2-3]。研究表明,薯蓣皂素具有抗过敏、抗炎[4-5]、抗肿瘤[6-8]等多种医学价值。提取薯蓣皂素的方法有酸水解法、预发酵法、流体萃取法、酶解法、微生物发酵法和色谱法等[9]。张裕卿等[10]运用直接酸水解法,通过优化酸水解时间和提取时间,最后干燥得薯蓣皂素,提取率为44.81%。张雯等[11]采用菌种黑曲霉,氮源为0.5%尿素,盾叶薯蓣发酵90h后,以氯仿为提取溶剂,回收率达到1.26%。毛楠等[12]通过发酵法提取薯蓣皂素,除去部分纤维后使用淀粉酶酶解,发酵后除去酒精并用硫酸水解提取薯蓣皂素,提取率可达2.09%。
文献报道薯蓣皂素的检测方法包括薄层色谱法、气相色谱法、高效液相色谱法[2]等,但这些方法均为相对法,需要薯蓣皂素标准物质作为对照才能准确定量。目前,国内未见薯蓣皂素国家二级标准物质研制的报道,薯蓣皂素标准物质的研制满足了相关产品的分析检测、质量控制的需求,保证了产品检测数据的准确性、可比性和溯源性[13]。本研究采用酸水解法、萃取、除色、减压浓缩制备薯蓣皂素,通过红外光谱(IR)、紫外-可见吸收光谱(UV-VIS)、质谱(MS)和核磁共振(NMR)等方法对其进行结构鉴定,并开展均匀性、稳定性检验和定值分析,最终得到纯度大于98.5%、扩展不确定度小于1.0%的薯蓣皂素标准物质。
1 材料与方法
1.1 材料与试剂
盾叶薯蓣(北京同仁堂(集团)有限责任公司);石油醚、盐酸均为分析纯(国药集团化学试剂有限公司);水为蒸馏水;甲醇为色谱纯(美国Fisher Scientific公司)。
1.2 仪器与设备
高效液相色谱系统配SPD-M20A检测器(日本岛津公司,LC-20A);紫外-可见分光光度计(美国瓦里安公司,Varian cary 100);傅里叶变换红外-近红外光谱仪(德国珀金埃尔默公司,Spectrum 400);高效液相色谱-质谱仪 (美国安捷伦公司,1100 Series LC/MSD Trap);超导脉冲傅里叶变换NMR仪(德国Bruker公司,AVANCE 600);真空冷冻干燥机(北京博医康实验仪器有限公司,FD-1-50)。
1.3 方法
1.3.1 薯蓣皂素的分离纯化
将盾叶薯蓣根茎洗净,干燥后粉碎,用少量去离子水浸泡干粉,于37℃恒温箱中发酵48h。然后用2mol/L盐酸水解6h,过滤,将滤饼烘干。采用石油醚作为提取溶剂,索氏提取4h。将得到的提取物活性炭脱色,并减压浓缩除去溶剂。最后,石油醚溶解样品,结晶。过滤后,甲醇复溶样品,重结晶,最终获得纯度大于98.5%的高纯度化合物。
制备好的薯蓣皂素单体置于洁净室内进行分装,用百万分之一天平称量,以每瓶5 mg的称样量将薯蓣皂素样品分装于2 mL的棕色样品瓶中。得到薯蓣皂素共180瓶,以1~180号计。将分装好的样品置于能够密封的塑料盒中,并置于4℃冰箱中长期保存。
1.3.2 定性分析
采用UV、IR、MS和NMR方法对薯蓣皂素的结构进行鉴定。UV的扫描范围是200~400nm;IR的扫描范围是400~4000cm-1;MS采用正离子模式,脱气溶剂为氮气;NMR测试溶剂为CDCl3。
1.3.3 均匀性检验
根据JJF 1343——2012《标准物质定值的通用原则及统计学原理》[14]的要求,对研制的样品进行均匀性检验。从标准物质的180个包装中随机抽取10个包装,每个包装取3个子样做瓶间和瓶内均匀性检验。每瓶最小取样量为1 mg,溶解于1 mL 85%色谱甲醇中。通过方差分析测试结果,判断标准物质的均匀性。
1.3.4 稳定性检验
标准物质的稳定性分为短期稳定性和长期稳定性。对薯蓣皂素标准物质短期稳定性进行考察,选取 25℃避光保存,分别 1,4,10 h,1,2,3,4,7d 进行检测,采用HPLC法检验,每次随机取3份样品,测定2次。
对薯蓣皂素标准物质长期稳定性进行考察,选取 4℃避光保存,分别在第 0,3,6,9,12 月进行稳定性检测,检验方法为HPLC法,每次随机取3份样品,测定2次。
1.3.5 定值
根据JJF 1006——1994《一级标准物质技术规范》的要求对研制的样品进行纯度定值。采用8个实验室协作的方式进行定值,从全部包装中随机抽取24瓶样品,每个定值单位送3瓶,每瓶测定2次。定值单位将样品配成一定浓度的溶液,采用峰面积归一化法进行纯度定值,经检验测得的数据符合正态分布后,计算平均值及标准偏差,估算不确定度。
1.3.6 不确定度评定
定值结果的不确定度包括样品的不均匀性引入的不确定度、不稳定性引入的不确定度、定值过程引入的不确定度。
2 结果与分析
2.1 纯度分析
HPLC条件:流动相为甲醇(A)-水(B),0~20min,85%A;流量:1.0 mL/min;柱温:30℃;运行时间:30min;ELSD条件如下:漂移管温度40℃,增益值6,载气压力350 kPa。色谱柱为Waters XTerra RP18(150mm×4.6mm,5 μm)柱,扣除溶剂峰,对色谱峰进行面积归一化定量,所得薯蓣皂素的纯度分析结果为99.64%,如图1所示。

图1 薯蓣皂素纯化前及纯化后HPLC色谱图
2.2 定性分析
经UV、IR、MS和NMR等方法进行鉴定,数据如下:UV:波长为 216nm,如图2 所示;IR:3514,3265,1 459,1 378,1 052,981,962,920,900,864 cm-1;MS:m/z415.320 3[M+H]+;氢谱、碳谱数据见表 1、表 2。综合文献数据与数据库对比,确定该化合物为薯蓣皂素。
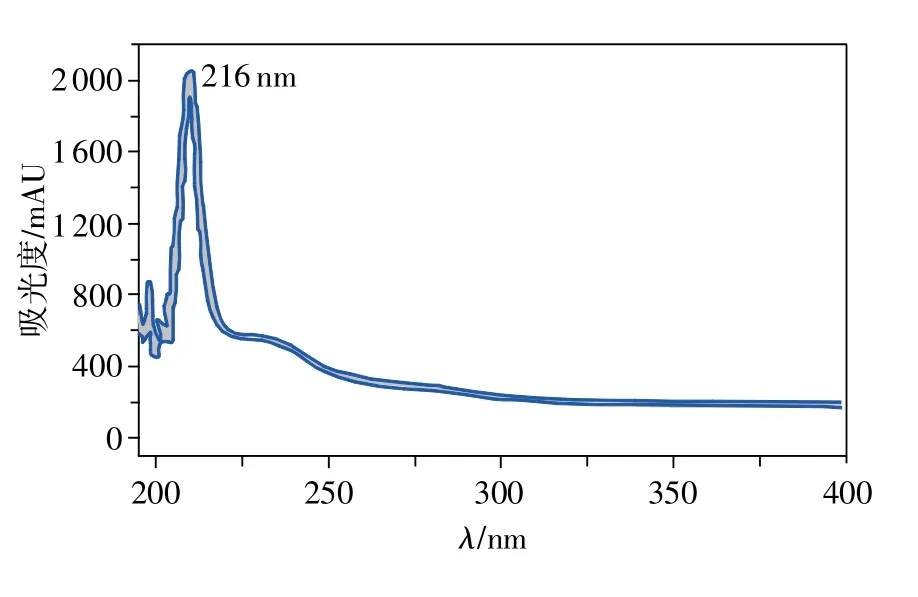
图2 薯蓣皂素紫外光谱图

表1 薯蓣皂素的核磁共振氢谱数据

表2 薯蓣皂素的核磁共振碳谱数据
2.3 均匀性检验
均匀性检验的测量数据、每瓶的平均值、方差见表3,均匀性研究的方差分析见表4。

表3 均匀性检验的数据
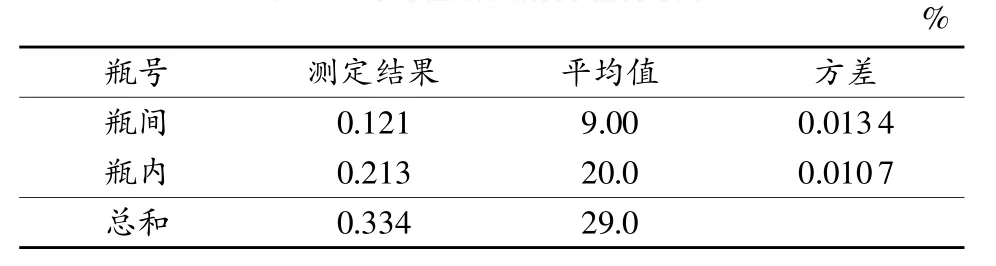
表4 均匀性研究的方差分析表
查F临界值表,得F0.05(9,20)=2.39,F=MS瓶间/MS瓶内=1.26<F0.05(9,20),说明薯蓣皂素样品符合正态分布,所以本标准物质是均匀的。
瓶间方差用下式计算:

瓶间标准偏差是该方差的平方根:

2.4 稳定性检验
薯蓣皂素标准物质短期稳定性检测的数据如图3所示,由图可知,在一周的时间内薯蓣皂素在25℃避光保存条件下具有较好的稳定性。

图3 短期稳定性检验结果
薯蓣皂素标准物质长期稳定性检测数据如表5所示,由表中数据可知,测得的平均值在测定时间内没有随时间的变化而明显的升高或下降,说明薯蓣皂素标准物质在1年内稳定。

表5 长期稳定性检验结果
采用直线作为经验模型,观察斜率值是否有显著变化,以此对标准物质的稳定性变化进行预测。斜率可用下式计算:


直线上点的标准偏差可由下式计算:

取其平方根s=0.043。
与斜率相关的不确定度用下式计算:

自由度为n-2和p=0.95(95%置信水平)的分布因子t=3.18, 由于|b|<t0.95,n-2·s(b1)=3.18×0.0045=0.014 3,故斜率是不显著的,因而未观测到该样品的不稳定性。t=12个月的长期稳定性的不确定度为u稳=sb1·t=0.0045×12=0.06%
2.5 定值结果
采用格拉布斯(Grubbs)检验法对采集的实验结果进行分析,定值结果如表6所示。

表6 纯度定值结果
总平均值:

由液相色谱定值引起的不确定度等于:
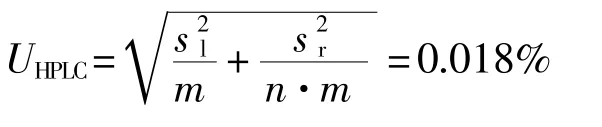
水分含量:根据卡尔费休法测定水分平均值为0.07%;元素含量:采用电感耦合等离子体发射光谱测定总元素平均值为0.06%,换算成碳酸盐的含量为0.14%,其中:
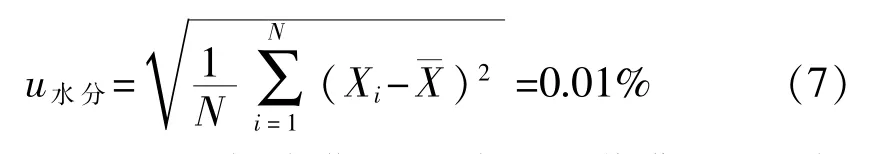
溶剂残留:根据中华人民共和国药典(2015年版)四部通则0861,采用气相色谱顶空进样法总溶剂残留测定平均值为0.12%(如表7所示),其中:

因此:


表7 水分、元素含量及溶剂残留汇总表
由于HPLC定值过程中没有包含水分、无机元素和溶剂残留。因此,最终定值方法为扣除响应的水分、灰分之后的结果。故薯蓣皂素标准物质纯度的标准值为(1-0.07%-0.14%-0.12%)×99.2%=98.9%。
2.6 不确定度的评定
薯蓣皂素标准物质不确定度计算公式为

故UCRM=0.08%。
扩展不确定度为

薯蓣皂素纯度标准物质纯度定值结果表达为98.9%±0.2%(k=2)。
3 结束语
本研究针对国内缺乏薯蓣皂素标准物质的状况,研制了薯蓣皂素标准物质,创建了该物质的分离纯化方法。通过定性分析和均匀性及稳定性检验,结果表明该物质的均匀性与稳定性均满足国家二级标准物质的要求,标准物质的标准值及其不确定度为98.9%±0.2%。研制的标准物质为薯蓣皂素产品及相关领域的成分分析、产品质量控制提供了技术支撑和量值溯源保证。
[1]李祥,马建中,田广文,等.薯蓣皂素分析方法综述[J].陕西科技大学学报,2009,27(5):163-168.
[2]汤兴利,徐增莱,夏冰,等.盾叶薯蓣皂素提取工艺及检测方法研究进展[J].中药材,2004,27(11):877-880.
[3]王博.具有抗肿瘤活性薯蓣皂素衍生物的合成及作用机制的研究[D].沈阳:沈阳药科大学,2012.
[4]李辉,倪晋仁.薯蓣皂甙元的研究进展[J].精细化工,2010,27(1):60-65.
[5]王天伦.黄姜的综合利用[D].湘潭:湖南科技大学,2015.
[6]张文秀.薯蓣皂苷元对人宫颈癌细胞增殖的影响[J].中国现代医生,2011,(26):5-7.
[7]LEE M S, YUET-WA J C, KONG S K, et al.Effects of polyphyllin D, a steroidal saponin in paris polyphylla,in growth inhibition of human breast cancer cells and in xenograft[J].Cancer Biologyamp;Therapy,2005,4(11):1248-1254.
[8]LEPAGE C,LIAGRE B M,PINON A.Cyclooxygenase-2 and 5-lipoxygenase pathwaysin diosgenin-induced apoptosis in HT-29 and HCT-116 colon cancer cells[J].International Journal of Oncology,2010,36(5):1183-1191.
[9]郭剑伟,苏丽娜,刘光明.薯蓣皂素提取工艺研究进展[J].中国药业,2011,20(18):13-16.
[10]张裕卿,王东青,李滨县,等.阶梯生物催化协同提取盾叶薯蓣中薯蓣皂苷元的研究[J].中草药,2006,37(5):688-691.
[11]张雯,李成涛,王少伟.生物法提取薯蓣皂素工艺研究[J].中国酿造,2008,194(17):54-55.
[12]毛楠,黄文,籍国东,等.分离-发酵法提取皂素清洁工艺研究[J].环境工程,2009(27):177-180.
[13]王尉,周晓晶,乐胜锋,等.白藜芦醇标准样品的研制[J].中国测试,2015,41(4):39-42.
[14]标准物质定值的通用原则及统计学原理:JJF 1343-2012[S].北京:中国质检出版社,2012.
[15]AGRAWAL P K, JAIN D C, AIN R K, et al.Carbon-13 NMR spectroscopy of steroidal sapogenins and steroidal saponins[J].Phytochemistry,1985,24(11):2479-2496.
(编辑:徐柳)
Preparation of Diosgenin certified reference materials
LAN Tao1, DONG Genlai2, CHU Qiao1, LIU Wen1, YANG Li1, WANG Heyan1, WANG Wei3, XI Xingjun1
(1.China National Institute of Standardization,Beijing 100191,China;2.Yadongxinji(Beijing) Agricultural Products Co.,Ltd.,Beijing 100125,China;3.Beijing Centre for Physical and Chemical Analysis,Beijing 100089,China)
The preparation method of Diosgenin reference materials was established according to thetechnicalnormofprimaryreferencematerial(JJF 1006-1994).Qualitative analysisof Diosgenin was carried out by UV, IR, MS and NMR spectrum and high-performance liquid chromatography was carried out for homogeneity and stability inspection.A cooperative certification was conducted with eight laboratories and the certification data were analyzed.The results showed that the homogeneity and stability of Diosgenin were excellent and the certified value was 98.9%with the expand uncertainty of 0.2%in confidence coefficient of 95%.The reference material of Diosgenin can be used for inspection and quality control of related products.
Diosgenin; reference material; homogeneity; stability; certification
A
1674-5124(2017)11-0042-05
10.11857/j.issn.1674-5124.2017.11.009
2017-03-18;
2017-05-10
中央基本科研业务费专项经费(562016Y-4687,562016Y-4492,562017Y-5284);质检公益性行业科研专项项目(201510048-4)
兰 韬(1984-),男,安徽马鞍山市人,助理研究员,博士,研究方向为农产品标准样品研制。
席兴军(1973-),男,广西横县人,副研究员,博士,主要从事农产品标准样品研究。
