电刺激对C2C12肌管自由基代谢及Nrf2/ARE信号通路的影响
2017-11-29董云峰赵秀峰徐晓阳
董云峰 赵秀峰 徐晓阳
1山西大同大学体育学院(山西大同 037009)
2泰山学院体育学院(山东泰安 271000)
3华南师范大学体育科学学院(广东广州 510006)
Nrf2/ARE信号通路是机体抗氧化系统中最重要的通路之一,它是指被活化的核因子E2相关因子2(nuclear factor E2 related factor2,Nrf2)与 Keap1(Kelchlike ECH-associated protein1,Keap1)解离,解离后从细胞质进入细胞核同时会与在核内的Nrf2蛋白结合,并且在生成异二聚体后再与抗氧化元件(antioxidant response element,ARE)序列结合进而启动相应基因的转录的整个表达路径[1]。有研究证明,激活后的Nrf2-ARE信号通路不但可以抑制Nrf2蛋白降解,使Nrf2蛋白处于比较稳定状态,而且还会使Nrf2蛋白的转录活性增强[2],这就形成了一种正反馈调节机制,这种机制的源头就是Nrf2的激活,对于加强其调节相关基因的转录活性有着重要作用。目前研究认为Nrf2/ARE通路在抵抗外来刺激以及抗氧化损伤方面起着重要作用[3,4],Nrf2缺失或激活发生障碍都会使机体在抗氧化损伤方面的作用大大减弱,所以Nrf2-ARE通路对于机体的作用不言而喻。
运动可导致骨骼肌细胞氧化应激程度提高,尤其是其线粒体的活性氧自由基(reactive oxygen species,ROS)产生会大大增加。虽然已经知道Nrf2/ARE是抗氧化应激的一个信号通路,而且已有研究表明线粒体ROS产生能够激活Nrf2系统,但是在具体的运动过程中产生的氧化应激与Nrf2信号通路关系如何尚不是很明确,需要进一步探讨。本研究利用培养的小鼠骨骼肌肌母细胞(C2C12)作为细胞模型,以电刺激引起其收缩,观察模拟运动对C2C12细胞肌管自由基及Nrf2信号通路的影响。
1 材料与方法
1.1 C2C12细胞的培养及分化
C2C12细胞(小鼠骨骼肌肌母细胞细胞株),购自南方医科大学解剖教研室。将液氮中保存的细胞进行复苏后,培养在含有10%胎牛血清的DMEM高糖培养基中,置于37℃、体积分数5%CO2培养箱中培养,当细胞生长密度达70%~80%时,用0.25%胰蛋白酶消化细胞,以2×105/mL密度种到6孔培养板中,待细胞单层覆盖培养板底面密度达95%左右时,换成分化培养液(高糖DMEM,2%马血清,质量分数1%青霉素/链霉素)开始进行分化培养,每天换液,并从加入分化培养基开始计算分化天数,分化6天后进行实验。
1.2 实验分组
C2C12细胞分化6天后分为对照组和电刺激组,对照组不进行电刺激,直接收样。电刺激组采用45 V、20 ms、5 Hz的刺激强度对肌管进行电刺激,根据刺激时间分为 30 min、45 min、60 min、75 min、90 min、120 min、和150 min七组,每组刺激后即刻收集细胞。
1.3 C2C12肌管培养液中乳酸脱氢酶(LDH)的测定
采用南京建成生物工程研究所提供的乳酸脱氢酶(lactate dehydrogenase,LDH)测定试剂盒测定细胞膜完整性,440 nm波长处测光密度值,通过公式计算各组LDH浓度。
1.4 C2C12肌管活性氧(ROS)含量测定
利用荧光探针二氯荧光素双醋酸盐(DCFH—DA)进行ROS检测。采用原位装载探针的方法,在37qc细胞培养箱内孵育20 min,然后电刺激和激光处理,用荧光分光光度计检测,激发波长488 nm,发射波长522 nm。试剂由江苏碧云天生物技术研究所提供。
1.5 C2C12肌管内谷胱甘肽过氧化物酶(GSH-Px)活性的测定
在荧光酶标仪波长为440 nm,温度为25℃下,利用总谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)的检测试剂盒检测体系中谷胱甘肽过氧化物酶 活 力 =[A340/min(sapmle)-A340/min(blank)]/0.00622。利用BCA蛋白浓度测定试剂盒,在荧光酶标仪波长为540~595 nm下进行检测,根据标准曲线计算出样品的蛋白浓度。计算公式:样品中谷胱甘肽过氧化物酶活力=检测体系中谷胱甘肽过氧化物酶活力×稀释倍数/样品中的蛋白浓度。试剂盒均由江苏碧云天生物技术研究所提供。
1.6 C2C12肌管Nrf2核蛋白含量的测定
收集细胞,离心提取蛋白。按照Nrf2核蛋白检测试剂盒说明书和检测目的条带大小来配制一定浓度的分离胶和5%浓缩胶。一抗:Nrf2(博士德),1∶400稀释,二抗:羊抗兔二抗(博士德)1∶200稀释,之后进行孵育,TBST洗涤膜。使用ECL试剂盒发光,显影,X线胶片压片曝光,扫描定量各条带的相对灰度值,β-actin为内参蛋白,目的蛋白相对含量=目的蛋白灰度值/βactin内参蛋白灰度值。试剂盒由南京建成生物技术有限公司提供。
1.7 数据统计处理
研究数据用SPSS17.0统计软件进行统计学处理,各数据以均值±标准差(±s)表示,并用单因素方差分析进行各组间的差异显著性检验。P<0.05为有显著性差异,P<0.01为有极显著性差异。
2 结果
2.1 不同电刺激时间引起C2C12培养液中LDH活性的变化
如表1所示,电刺激分化6天的C2C12肌管,电刺激各组溶液中的LDH活性较对照组有少量的增加,但它们之间并无显著性差异(P>0.05)。
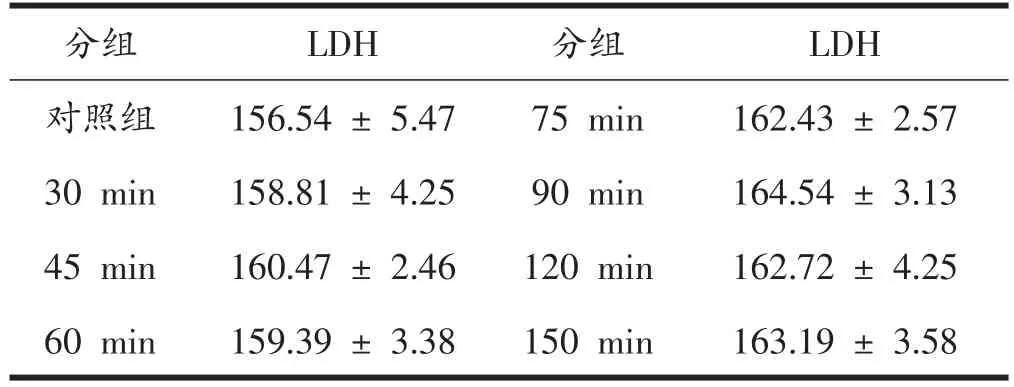
表1 不同电刺激时间C2C12肌管LDH活性(U/L)
2.2 不同电刺激时间引起C2C12肌管ROS含量的变化
由表2可见,电刺激分化6天的肌管,细胞内ROS生成增加,峰值分别出现在刺激60 min和120 min时;电刺激组除30 min、150 min组外,其他组与对照组相比,ROS含量都显著升高(P<0.05),其中60 min、120 min组与对照组相比有极显著性升高(P<0.01)。

表2 不同电刺激时间C2C12肌管ROS含量
2.3 不同电刺激时间引起C2C12肌管GSH-Px活性的变化
由表3可见,电刺激分化6天的C2C12肌管,细胞内GSH-Px活性变化呈增加趋势,与对照组相比,60 min、90 min、120 min组均有显著性升高(P<0.05),75 min、150 min组有极显著性升高(P<0.01)。150 min组与75 min组相比有显著性升高(P<0.05)。
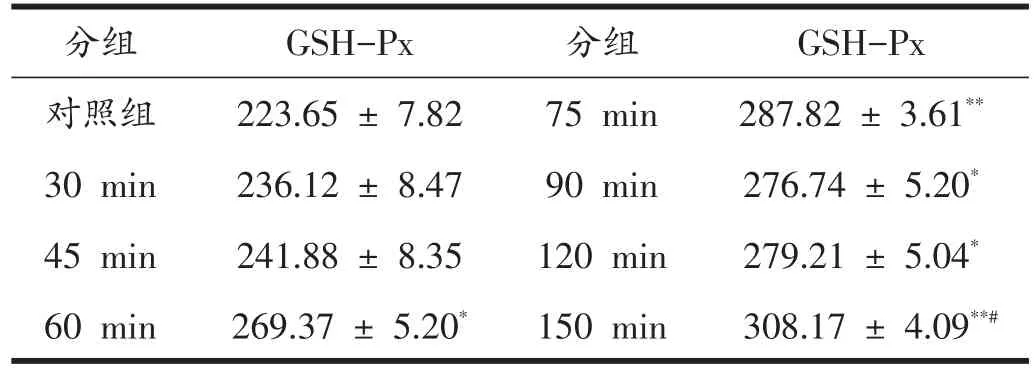
表3 不同电刺激时间C2C12肌管GSH-Px活性(mU/mg)
2.4 不同电刺激时间引起C2C12肌管Nrf2核蛋白含量的变化
由表4可见,电刺激分化6天的肌管,细胞内Nrf2核蛋白生成的变化成增加趋势,与对照组相比,60 min、90 min、120 min组有显著性升高(P<0.05),75 min、150 min组均有极显著性升高(P<0.01)。150 min与75 min组相比有显著性升高(P<0.05)。
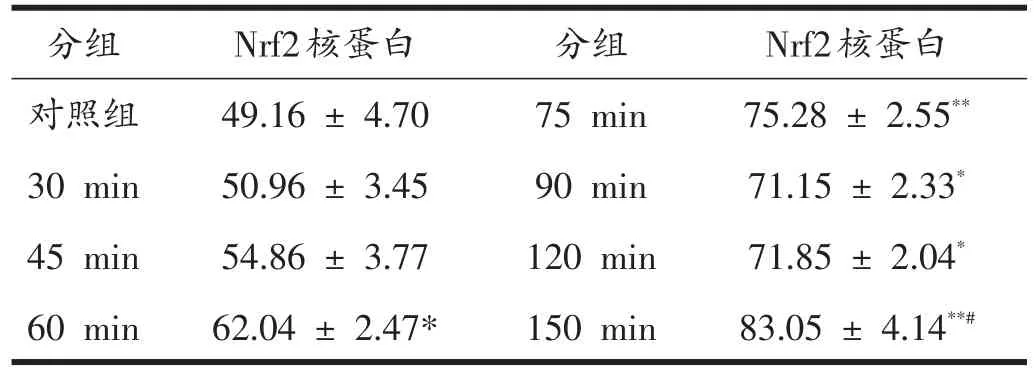
表4 不同电刺激时间C2C12肌管Nrf2核蛋白含量(灰度值)
3 讨论
3.1 C2C12肌管刺激强度及培养时间的确定
LDH是机体糖酵解供能系统的关键酶之一,可以催化丙酮酸加氢生成乳酸。在有氧条件下,LDH可以将乳酸转化成丙酮酸,再经三羧酸循环彻底氧化,释放能量供细胞代谢活动;而在无氧条件下,LDH催化丙酮酸还原成乳酸进而完成葡萄糖的无氧酵解过程,并且同时会释放少量ATP为机体提供能量。LDH在大部分组织中都会存在,其中以肝、骨骼肌、肾脏、心肌和胰腺中较多,而且组织中的LDH的活性一般比较高。当有细胞或者组织损伤时,该酶便会释放进而使其他血液或培养基中的LDH活性升高,所以电刺激后细胞培养液中LDH的活性强弱能反映细胞的损伤程度。
邱国荣[5]采用刺激强度为45 V、20 ms、5 Hz,刺激时间分别为45、60、75、90、120 min,刺激细胞后,经过蛋白总量的测定发现,分化前3天的肌管总蛋白增加明显,且分化第2天和第3天的肌管蛋白总量都比前一天有明显增加(P<0.05),从第3天到第6天肌管中总蛋白含量保持稳定,且比第1天有显著性增加。说明从第3天开始蛋白合成与分解达到平衡,蛋白总量开始保持稳定。此时肌管已有肌纤维的典型特征,与骨骼肌有相似的收缩功能,因此选择分化6天的肌管作为试验对象。本研究采用45 V、20 ms、5 Hz的强度电刺激C2C12肌管30、45、60、75、90、120、150 min,本研究中电刺激 30、45、60、75、90、120、150 min 培养液中LDH活性与对照组相比有稍微升高,但并无显著差异(P>0.05),说明本研究中使用电刺激的强度和时间并没有引起大量细胞的细胞膜破损,可以采用此电刺激强度和时间来进行实验。
3.2 不同电刺激时间对C2C12肌管ROS含量的影响
研究表明电刺激的频率与电刺激时间的长短对于ROS的产生有着很大影响。Leonardo R.Silveira等[22]研究发现,用不同的刺激强度刺激骨骼肌细胞,在高强度组,无论是细胞内还是细胞外,ROS与对照组相比都有明显升高,而在中等强度组,ROS与对照组相比则没有显著性变化,说明细胞状态在中等强度组相对稳定。Isabella Irrcher[6]等通过研究发现,电刺激频率增加后,细胞内线粒体活性会有显著性增加,同时自由基导致的过氧化氢的量也会显著性增加。McArdle A等[23]在研究ROS释放的时程规律时,用刺激强度为2 ms、1 Hz、30 V的电刺激,作用于分化6天的大鼠卫星细胞,发现电刺激15min时,体内的ROS便会快速升高。对于运动中线粒体自由基生成增多的原因,现在一般都认为是运动时氧化代谢较平时加快,进而促进了呼吸链产生更多的自由基。
本研究发现,除去30 min、150 min组,其余电刺激组的ROS量与对照组相比都有显著性增加(P<0.05),而且ROS的变化趋势成双峰曲线,这主要是由于运动引起的线粒体氧耗变化产生的氧化应激和细胞自身抗氧化系统之间的相互作用而产生的[7]。电刺激60 min时ROS到达一个峰值,说明此时骨骼肌运动氧耗增加,氧化应激水平比较高而体内自身的抗氧化系统却还没有充分调动起来,随着电刺激时间的延长,抗氧化系统也逐步地发挥作用,开始清除过多的ROS,到75 min时ROS生成量迅速降低;在刺激到120 min时又出现ROS峰值,这是由于机体抗氧化防御系统能力的提高跟不上自由基产生的增多,也就是说机体的抗氧化系统清除自由基的能力逐渐小于自由基生成的能力[8],所以使得ROS再次出现峰值。而在本研究中,继续延长肌管收缩时间到150 min时,ROS生成减少,是因为此时Nrf2信号系统被进一步激活,Nrf2核蛋白含量和GSH-Px活性都比较高,抗氧能力强,使ROS下降,也可能与此时细胞的收缩能力减弱有关。
3.3 不同电刺激时间对C2C12肌管GSH-Px活性的影响
研究表明GSH-Px不但是在自身免疫方面对机体有着重要的作用,而且它还可以充当免疫增强剂和抗氧化剂,此外它还可以控制自由基代谢增强[9]。相关研究表明,在剧烈的运动后由于自由基生成过多,会使得机体内部组织发生损伤,而运动训练对于提高GSH-Px的活性有很大帮助,所以通过训练来降低运动后的肌肉组织损伤是一个很好的选择,对机体而言也是非常有益的[10]。有实验通过比较急性剧烈运动和游泳训练,来检测这两种运动中骨骼肌和平滑肌的GSH-Px含量,结果发现游泳组GSH含量比剧烈运动组明显升高,机体的免疫力也上升了[11],而且体内的GSH-Px一般都是通过抑制脂质过氧化反应,进而提高机体的抗氧化能力[12,13]。
本研究发现,电刺激30 min到45 min时,肌管内的GSH-Px与对照组相比,虽有少量增加但并无显著性差异(P>0.05),可能是因为刚开始体内的抗氧化系统刚刚启动,GSH-Px没有被完全激活。GSH-Px的活性在60 min刺激时就开始有显著性增加,且一直呈升高趋势,到75 min时与对照组相比有极显著性升高(P<0.01)。表明此时电刺激引起C2C12收缩,细胞内的抗氧化机制被激活,Nrf2发生核转移,启动了调控GSHPx的基因,以消除产生过多的ROS。90 min和120 min时GSH-Px的活性略有下降的原因可能是此时自由基的生成能力还比较高,对GSH-Px的活性有一定的抑制作用。到了150 min时GSH-Px的活性与75 min相比有显著性升高,原因是此时Nrf2核蛋白含量比较高,那么受其调控的下游的GSH-Px基因会被大量的激活,从而使GSH-Px的活性升高,同时也与此时细胞内ROS量下降的变化相符。
3.4 不同电刺激时间对C2C12肌管Nrf2核蛋白含量的影响
Nrf2/ARE被激活后能够启动下游多种保护性基因的表达,所以对于它的研究向来都比较重要。到迄今为止,我们发现受Nrf2激活调控的基因有差不多200个左右,而且在不同条件下可以激活不同的激活物,这其中也跟激活方式有一定的关系[14]。Tan等研究发现无论肌细胞在体内还是体外,当其处于糖尿病环境下时,通过细胞外相关信号调节相应的激酶从而下调Nrf2的功能,使细胞出现氧化应激,从而诱导胰岛素抵抗,使患者心肌的葡萄糖利用率降低[15,16]。氧化应激被认为是好多疾病的发病机制,比如创伤性脑损伤、缺血性脑卒中等,有研究证实,当这些疾病发生时,Nrf2及其下游的相关抗氧化酶和解毒酶的活性与比正常时有显著性增加[17-19],这说明了Nrf2可能是相关脑损伤疾病的内在性机制。另外也有研究表明用H2O2刺激大鼠肝脏细胞前,再给予大鼠一定浓度的白藜芦醇培养一段时间,结果发现非治疗组中只有细胞质中有Nrf2的表达,而治疗组细胞质和细胞核中都有Nrf2的表达[20],说明治疗组中Nrf2发生了核转移。
电刺激30 min、45 min时,肌管内的Nrf2核蛋白含量与对照组相比,虽有少量增加但并无显著性差异(P>0.05),可能是因为ROS的堆积量还没达到可以激活Nrf2的水平。60 min时Nrf2核蛋白含量与对照组相比有显著增加(P<0.05),75 min达到一个峰值,与对照组比较有极显著升高(P<0.01),说明此时Nrf2信号系统已被激活,进而激活GSH-Px的活性,使它们发挥抗氧化作用,使ROS下降。150 min时与75 min相比Nrf2核蛋白含量有显著性升高(P<0.05),其原因可能是由于长时间的刺激,使细胞本身的收缩能力减弱,那么其产生的ROS的能力也会受到影响,同时氧化应激也会减弱,那么抗氧化系统在与氧化应激相互制约当中,抗氧化系统会占据上风,使得Nrf2系统被进一步的激活,Nrf2核蛋白含量则会相应的增加,同时也与此时细胞内ROS量的下降变化相符。
3.5 在不同电刺激时间下,C2C12肌管内GSH-Px和Nrf2核蛋白含量的对比研究
随着电刺激时间的增加,C2C12肌管内GSH-Px活性和Nrf2核蛋白含量的变化趋势基本一致,从0 min到75 min时间段内呈上升趋势并达到一个高峰,而此时75 min组的ROS刚刚处于最低谷,这是因为电刺激产生的ROS会使正常情况下和Nrf2在细胞质中结合在一起的Keap1发生了构象变化,进而导致Nrf2与Keap1的解离,使得Nrf2进入细胞核,并在核内与Maf蛋白结合生成异源二聚体同时与ARE结合,进而启动其下游相关抗氧化酶基因的转录与表达,如超氧化物歧化酶(Superoxide Dismutase,SOD)、醌氧化还原酶 1(quinine oxidoreductase1,NQO1)、血红素加氧酶1(hemeoxygenase1,HO-1)、和谷胱甘肽过氧化物酶(GSH-Px)等[21]。75 min到150 min时间段内GSH-Px活性和Nrf2核蛋白含量同时有一个小幅度降低,紧接着又呈升高趋势,这可能是因为此时的ROS又继续升高,使得体内的氧化系统相对于抗氧化系统略占优势。不过随着时间的增加,我们看到150 min时Nrf2核蛋白继续升高,这一优势逐渐被消除,这可能是此时Nrf2下游其他抗氧化酶基因陆续被激活的原因,如SOD、NQO1和HO-1等。
4 结论
在45V、20 ms、5 Hz的强度下,电刺激C2C12肌管会使肌管发生氧化应激,结合ROS产生量随电刺激时间的变化规律,发现ROS只有达到一定的量才能激活Nrf2信号系统,同时启动相关基因,使GSH-Px发挥抗氧化作用,而且随着刺激时间的增加,肌管内抗氧化能力略有降低,随后则继续保持着其较高的活性。这对于我们以后在运动训练过程中合理安排训练时间、休息时间、提高机体抗氧化能力和防止氧化应激方面有着一定参考意义。
