长筒花试管开花诱导影响因素
2017-11-28吕侃俐姜琳李青
吕侃俐 姜琳 李青
(北京林业大学,北京,100083)
长筒花试管开花诱导影响因素
吕侃俐 姜琳 李青
(北京林业大学,北京,100083)
以苦苣苔科忌寒苣苔属长筒花(Achimenes‘Kim blue’)试管苗为试验材料,探究了植物生长调节剂种类及质量浓度、无机盐质量分数、不同碳源和琼脂质量浓度对其试管开花诱导的影响。结果表明:花芽诱导培养基中不宜添加细胞分裂素,添加适宜质量浓度生长素NAA与IBA即能诱导开花;增大培养基中P、K元素质量分数有利于花芽诱导;适宜的开花诱导培养基为 MS(KNO3+KH2PO4)+NAA0.1 mg·L-1+IBA0.1 mg·L-1+PP3330.05 mg·L-1,添加蔗糖40 g·L-1+琼脂4 g·L-1。
长筒花;试管开花;花芽诱导;正常开放
长筒花(Achimenesspp.),苦苣苔科忌寒苣苔属,多年生草本,日中性植物[1]。长筒花花色多样,筒状花型俏皮可爱,是目前欧美地区最流行的窗台盆花和吊篮花卉之一[2],但在国内市场仍较为少见,仅局限于家庭园艺爱好者间交流种植,有极大的推广空间。目前,关于长筒花试管开花的相关研究暂未见报道,本试验欲通过探究长筒花试管开花诱导的各影响因素,建立高效的试管开花诱导体系,为长筒花在大陆市场的推广以及研究长筒花花芽分化、开花机理提供组织培养技术依据和基础。
1 材料与方法
以当年生长筒花紫色品种‘kim blue’(Achimenes‘Kim blue’)叶片为外植体,诱导不定芽继代1次培养得到的长势健壮、高约4cm的无菌试管苗为试验材料(图1)。
不同生长素对长筒花试管花芽诱导的影响:设置不同质量浓度生长素NAA、IBA(0.1、0.3、0.5 mg·L-1),以及两种生长素的前2个水平两两组合配比进行花芽诱导试验,接种后持续观察长势及花芽诱导情况。

图1 经壮苗培养的长筒花试管苗
无机盐质量分数对长筒花试管花芽诱导的影响:在培养基中添加IBA0.1 mg·L-1+NAA0.1 mg·L-1,改变MS基本培养基中大量元素质量分数,共设置6个组合,即1/2MS、MS-1/2N(50% KNO3+50% NH4NO3)、MS+P(200% KH2PO4)、MS+P+K(200% KNO3+200%KH2PO4)、MS+N+P+K(200% KNO3+200% KH2PO4+200% NH4NO3)、MS(CK),培养70 d后统计花芽诱导率。
蔗糖对长筒花试管花芽诱导的影响:在培养基中分别添加不同质量浓度的蔗糖(30、40、50、60 g·L-1),培养70 d后统计试管内花芽诱导率。
琼脂对长筒花试管花芽正常开放的影响:在培养基中分别添加不同质量浓度的琼脂(2、4、8 g·L-1),以6 g·L-1为对照,培养70 d后统计试管内花芽诱导率。
无机盐、蔗糖、琼脂不同配比对长筒花试管花芽正常开放的影响:筛选上述试验中试管花芽诱导率较高、开放较好的处理组,设置无机盐(MS、MS+P、MS+P+K、MS-1/2N)、蔗糖(35、40、45、50 g·L-1)、琼脂(2、3、4、5 g·L-1),进行3因素4水平正交试验。培养70 d后统计花芽诱导率和花朵正常开放率。
多效唑(PP333)对长筒花试管花芽诱导的影响:在培养基中分别添加不同质量浓度的PP333(0.05、0.10、0.20、0.40、0.80 mg·L-1)进行单因素试验,以不添加PP333的处理为对照(CK),培养70 d后统计试管内花芽诱导率。
培养条件:无特殊说明时以MS为基本培养基,添加蔗糖30 g·L-1、琼脂6 g·L-1,pH值6.0。每个处理接种12株试管苗,重复3次。培养温度为(23±2)℃,光照强度2 500~3 000 lx,光照时间14 h·d-1。
数据统计:花芽诱导率=(形成花芽的植株/接种植株总数)×100%;花芽开放率=(花芽正常开放的植株数/形成花芽的植株总数)×100%;使用SPSS20.0软件对数据进行方差分析,用Ducan氏新复极差法进行多重比较,检验各影响因素的差异显著性(P≤0.05)。
2 结果与分析
2.1 不同生长素对长筒花试管花芽诱导的影响
在培养基中单独添加生长素NAA、IBA,或将两种生长素组合使用,对长筒花试管苗进行花芽诱导培养。经持续观察,培养65d后首先在8号处理(MS+NAA0.1 mg·L-1+IBA0.3 mg·L-1)中出现花芽并逐渐伸长(图2),花芽着生在植株上部的叶腋处。试验结果具体见表1。

(a)花芽出现 (b)花芽伸长

图2 花芽生长过程
注:表中诱导率数据为平均值±标准差;同列不同字母表示差异显著(Plt;0.05)。
由表1可知,单独添加1种生长素的处理组花芽诱导效果较差,花芽诱导率最高仅为5.56%,且质量浓度较大的单一生长素处理组(NAA0.3、0.5 mg·L-1,IBA0.5 mg·L-1)花芽诱导率均为0。同时添加两种生长素的处理组花芽诱导效果较好,7号处理(MS+NAA0.1 mg·L-1+IBA0.1 mg·L-1)中花芽诱导率达到最高值(29.63%),显著高于其他处理组。各处理组植株生长情况均较好,生根较多,植株健壮,叶片平展,仅在3号处理(MS+NAA0.5 mg·L-1)、9号处理(MS+NAA0.3 mg·L-1+IBA0.1 mg·L-1)和10号处理(MS+NAA0.3 mg·L-1+IBA0.3 mg·L-1)中部分植株出现叶片反卷现象。因此,在MS培养基中添加NAA0.1 mg·L-1+IBA0.1 mg·L-1有利于花芽诱导,但此条件下花芽诱导率较低,还需继续探究其他影响因子以提高诱导率。
2.2 无机盐质量分数对长筒花试管花芽诱导的影响
以MS+NAA0.1 mg·L-1+IBA0.1 mg·L-1为基础,改变基本培养基中无机盐质量分数,以不改变大量元素质量分数的处理为对照(CK)。试验结果显示,无机盐质量分数对花芽诱导率和花芽诱导数均有显著影响(表2)。

表2 不同无机盐质量分数对长筒花花芽诱导的影响
注:表中数据为平均值±标准差;同列不同字母表示差异显著(Plt;0.05)。
在花芽诱导率方面,2号处理(KNO3、NH4NO3质量分数减半)中花芽诱导率最高,达到37.96%,3号处理(KH2PO4质量分数加倍)次之,花芽诱导率为37.04%,两者间差异不显著,均显著高于对照组。在花芽诱导数方面,4号处理中花芽诱导数最多,为2.62个,显著高于对照组及2个无机盐减少的处理组。结合生长状况,1、2、6号处理组中诱导出的花芽较小,并在后期生长伸长开放过程中,大部分花芽出现花芽枯萎、开花中断、无法正常开展等情况(图3a);试管苗于接种后55 d在4号处理中最先出现花芽,比对照组提前10 d左右,说明适当增大无机盐质量分数能有效提前花期、促进开花,且诱导的花芽相对较为饱满,大部分能够正常开放。综上,在MS基础上增大P、K元素质量分数,或增大P元素质量分数能有效提高花芽诱导率和花芽数量,并使花芽生长较好。
2.3 蔗糖质量浓度对长筒花试管花芽诱导的影响
在MS+IBA0.1 mg·L-1+NAA0.1 mg·L-1培养基中分别添加不同质量浓度的蔗糖,对花芽诱导率和花芽诱导数进行方差分析和多重比较(表3)。
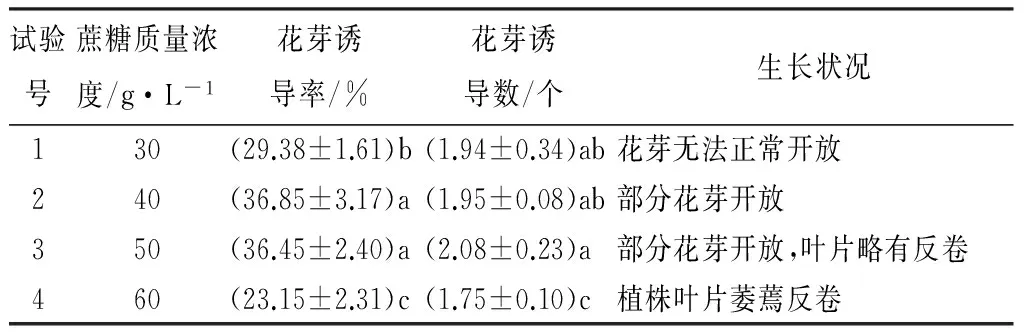
表3 不同蔗糖质量浓度对长筒花花芽诱导的影响
注:表中数据为平均值±标准差;同列不同字母表示差异显著(Plt;0.05)。
由表3可知,花芽诱导率随蔗糖质量浓度先增大后减小,在40 g·L-1时达到最高值,为36.85%;花芽诱导数在蔗糖质量浓度50 g·L-1时达到最大值,为2.08个,但与蔗糖质量浓度30~40 g·L-1处理差异不显著。结合植株生长状况,当蔗糖质量浓度为30~40 g·L-1时,植株长势良好,但经30 g·L-1处理诱导的花芽大部分较小,且无法正常开放;而高质量浓度水平处理组中形成的花芽开放率有所提高。综合各指标初步得出,以添加蔗糖40 g·L-1为宜。
2.4琼脂质量浓度对长筒花试管花芽正常开放的影响
琼脂质量浓度直接反映培养基的水分含量,水分含量直接影响花的早期发育。为探究上述试验中出现的花朵无法正常开放是否与培养基中水分含量有关,在MS+IBA0.1 mg·L-1+NAA0.1 mg·L-1培养基中分别添加不同质量浓度的琼脂,试验结果见表4。

表4 不同琼脂质量浓度对长筒花花芽诱导的影响
注:表中花朵开放率数据为平均值±标准差;同列不同字母表示差异显著(Plt;0.05)。
花朵开放率随琼脂质量浓度增大逐渐下降,在琼脂质量浓度为2 g·L-1时最高,为55.39%,其次是当琼脂质量浓度为4 g·L-1时,为55.33%,两者之间无显著差异,均显著高于对照组及琼脂质量浓度为8 g·L-1处理组,说明低质量浓度的琼脂对于花芽正常开放效果显著(图3b)。此外,琼脂质量浓度8 g·L-1处理组中植株长势较差,叶片皱缩,茎秆变为褐色,生长变慢,同时产生大量气生根;而琼脂质量浓度为2 g·L-1时培养基难以凝固,呈较稀的接近液态的半固态,长筒花试管苗自身难以在培养基中固定直立,需倚靠容器壁,观赏效果较差。因此,以添加琼脂质量浓度4 g·L-1为宜。

(a)花朵开放中断 (b)花朵开放正常
图3花朵开放状态
2.5不同质量分数无机盐,不同质量浓度蔗糖、琼脂配比对长筒花试管花芽正常开放的影响
在MS+IBA0.1 mg·L-1+NAA0.1 mg·L-1基础上,综合上述试验中试管花芽诱导率较高、花朵开放较好的处理组的影响因子浓度水平情况,分别筛选出4个水平的无机盐、蔗糖、琼脂,进行3因素4水平正交试验。具体试验结果见表5。

表5 不同质量分数无机盐,不同质量浓度蔗糖、琼脂配比对长筒花花芽诱导的影响
注:表中开放率数据为平均值±标准差;同列不同字母表示差异显著(Plt;0.05)。
由表5可知,各处理间花朵开放情况和植株长势各不相同。花朵开放率在10号处理中达到最高值(95.69%),其次为11号处理,为94.44%。进一步对花芽诱导率和花朵开放率进行极差分析,结果见表6。由表6可知,3个因子对长筒花花朵开放率的影响由大到小依次为无机盐、琼脂、蔗糖。无机盐的极差值最大,说明无机盐质量分数在3个因子中对于长筒花的花朵正常开放起主导作用。从均值看,花芽开放率随无机盐质量分数增大而逐渐升高,在第3水平达到最高值74.76%;而第4水平则为最低值,仅为12.16%,且极显著低于其他水平,说明该水平无机盐严重阻碍长筒花花朵开放。琼脂对于花朵开放也起到关键作用。当排除无机盐第4水平对于花朵开放的抑制作用时,无机盐极差值为32.77,低于琼脂的极差值45.89,即当无机盐对花朵开放不存在抑制作用时琼脂质量浓度对于花朵开放率起主导作用。从均值看,‘Kim blue’在琼脂为第3水平(4 g·L-1)时花朵开放率最高,为61.87%。为提高花朵开放率,理论最适宜的培养基成分为MS(KNO3+KH2PO4)+NAA0.1 mg·L-1+IBA0.1 mg·L-1+蔗糖45 g·L-1+琼脂4 g·L-1,与实际试验结果得出的最佳处理基本一致。

表6 极差分析结果
2.6多效唑(PP333)对长筒花试管花芽诱导的影响
在上述结果基础上,添加不同质量浓度的PP333,以不添加多效唑的处理为对照,试验结果见表7。

表7 不同质量浓度PP333对长筒花花芽诱导的影响
注:表中诱导率数据为平均值±标准差;同列不同字母表示差异显著(Plt;0.05)。

图4 逆境下枝端形成小鳞茎
由表7可知,花芽诱导率随PP333质量浓度增大而降低,当质量浓度为0.05 mg·L-1时即达到最高值(69.81%),显著高于对照组及其他处理组。而当质量浓度增至0.10 mg·L-1和0.20 mg·L-1时即有显著下降,但仍显著高于对照组。结合植株生长状态,PP333质量浓度较低时植株长势良好,当质量浓度≥0.40 mg·L-1时长势变弱,枝端形成小鳞茎(图4),停止生长。因此,以添加PP3330.05 mg·L-1为宜。
3 结论与讨论
组织培养的环境与自然环境中的栽培条件有所区别,试管苗只有在适宜的培养基中达到一定的生长状态才能进行花芽分化进而开花。
研究者对于生长素在花芽诱导中作用的结论各不一致,部分研究者认为添加生长素尤其是NAA对花芽诱导起抑制作用[3-4],但也有研究表明:单独添加NAA即可诱导试管苗开花[5]。本研究设置了单独使用NAA、IBA以及两种生长素共同使用等多个处理组,结果显示,单独添加NAA、IBA时花芽诱导效果较低,以组合使用效果较好,适宜的质量浓度组合为NAA0.1 mg·L-1+IBA0.1 mg·L-1。
盆栽花卉在常规生产栽培过程中,常在花前对植物增施复合肥进行追肥,从而达到促花、提高着花率的目的。本试验中,通过改变MS培养基中KNO3、KH2PO4、NH4NO3用量,共设置5个处理组,与不改变用量的处理组作对照。试验结果显示,‘Kim blue’在N质量分数减半(即KNO3、NH4NO3质量分数减半)处理中花芽诱导率最高,其后依次为KH2PO4加倍和KNO3、KH2PO4加倍的处理组。
PP333在常规栽培中常用于调整盆栽花卉的株形、矮化木本观赏植物[6-9],还有将其与矮壮素搭配使用以获得最佳观赏效果[10]。在试管开花研究中,PP333对多种植物都起到了促进开花的作用[11-15]。本研究结果显示,添加PP333能显著提高花芽诱导率及促进提前开花。
在已有的试管开花研究报道中常见诱导出花芽但花芽畸形或无法正常开放的现象[13,16-18]。培养基中的任何成分不适宜均可能导致花朵无法正常开放,例如,金钗石斛随PP333质量浓度增大花芽诱导率显著提高,但高质量浓度下诱导的花芽较小且畸形[19];MS培养基中氮磷比例也会影响花芽正常开放率[18]。培养环境以及植株自身生长状态也会影响花朵开放,如2年生花卉中国石竹在未经低温处理前即使诱导形成花芽也无法正常开放[13]。在本研究中,通过观察和比较各试验组的花朵开放情况,发现当不改变或减小MS基本培养基中无机盐质量分数、蔗糖质量浓度为30g·L-1、琼脂质量浓度≥6g·L-1时大部分诱导形成的花芽无法正常开放。进一步对无机盐质量分数、蔗糖及琼脂质量浓度3个因素设置水平梯度进行正交试验,极差分析结果显示,3个因子对长筒花花朵开放率的影响由大到小依次为无机盐、琼脂、蔗糖,其中无机盐质量分数减小时严重阻碍长筒花花朵开放,而当无机盐不起阻碍作用(质量分数不变或增大)时降低琼脂质量浓度能显著提高花朵开放率。三者共同作用最佳组合为MS(KNO3+KH2PO4)+蔗糖45g·L-1+琼脂3~4g·L-1。
[1] VLAHOS J C. Growth and development inAchimenescultivars[D]. Holland: Vakgroep Tuinbouwplantenteelt,1991.
[2] MILLER C, BRIDGEN M.Achimenesmakes a comeback[J]. Gpn Greenhouse Product News,2011,21(6):30.
[3] LIN C C, LIN C S, CHANG W C. In vitro flowering ofBambusaedulisand subsequent plantlet survival[J]. Plant Cell, Tissue and Organ Culture,2003,72(1):71-78.
[4] 邵宏波,初立业.离体植物花芽和花器官的发育研究进展[J].广西植物,1993,13(3):275-288.
[5] 张英.龙葵再生体系建立及试管开花研究[D].牡丹江:牡丹江师范学院,2016.
[6] 罗远华,叶秀仙,黄敏玲,等.多效唑对小苍兰株型、开花及仔球繁育的影响[J].江西农业学报,2011,23(2):43-45.
[7] 杨爽,苏智先.多效唑对中国水仙开花和生长的影响[J].安徽农业科学,2006,34(7):1345-1346.
[8] 胡存彪,陈云飞,刘圣会,等.多效唑和赤霉素对结球白菜抽薹开花的调控[J].山地农业生物学报,2016,35(2):73-75.
[9] 徐洪辉,陈晓德,谢世友,等.叶面喷施多效唑对醉蝶花的生长和开花的影响[J].北方园艺,2010,9(11):79-82.
[10] 曹春燕.多效唑与矮壮素对盆栽一品红观赏品质的影响[J].中国园艺文摘,2014(7):9-11.
[11] 郜旭芳.勋章菊的组培快繁及试管开花研究[D].洛阳:河南科技大学,2012.
[12] 姜顺日.孔雀草试管开花及蛋白质组学研究[D].福州:福建农林大学,2011.
[13] 邢琳.石竹、月季、春石斛试管开花组培技术研究[D].北京:北京林业大学,2010.
[14] 孙婵娟.万寿菊的快速繁殖及试管开花研究[D].重庆:西南大学,2009.
[15] QI Q, XING F W, XIAO Y P, et al. Somatic embryogenesis and in vitro flowering inSaposhnikoviadivaricata.[J]. Journal of Plant Growth Regulation,2009,28(1):81-86.
[16] 王光远,许智宏,蔡德发,等.铁皮石斛的离体开花[J].中国科学C辑:生命科学,1997,27(3):229-234.
[17] 董璐.三种草本花卉试管开花组织培养技术研究[D].北京:北京林业大学,2015.
[18] 洪怡,王爱华,陈之林.铁皮石斛试管诱导开花[J].园艺学报,2014,41(S):2757.
[19] 王再花.金钗石斛和细茎石斛试管开花研究[D].广州:华南师范大学,2005.
InfluenceFactorsofinvitroFloweringInductionofAchimenesspp.//
Lü Kanli, Jiang Lin, Li Qing
(Beijing Forestry University, Beijing 100083, P. R. China)//
Achimenesspp.;invitroflowering; Flower bud induction; Flower open normally
吕侃俐,女,1992年8月生,北京林业大学园林学院,硕士研究生。E-mail:lvkanli@126.com。
李青,北京林业大学园林学院,副教授。E-mail:wliqing06@sina.com。
2017年6月8日。
责任编辑:任 俐。
S682.2+9;Q943.1
Journal of Northeast Forestry University,2017,45(11):49-53,71.
With aseptic plantlets ofAchimenes‘Kim blue’, we studied the effects of plant growth regulators, different concentration of mineral and agar and carbohydrate sources oninvitroflowering induction. The suitable combination of NAA and IBA could induce flower bud, while cytokin had a negative effect on flower bud induction. Increased concentration of phosphorus and potassium element in the medium was beneficial to flower bud induction. Suitable medium for inducinginvitroflowering was MS(KNO3+KH2PO4)+NAA0.1 mg·L-1+IBA0.1 mg·L-1+PP3330.05 mg·L-1, adding 40 g·L-1sucrose +4 g·L-1agar.
