慢性鼻-鼻窦炎钩突病理学改变与手术预后及CT诊断价值的相关性分析
2017-11-28肖惠雯徐唱方一张凌浩武鹏骆雅梅李慧媚杜瀚廖志苏
肖惠雯 徐唱 方一 张凌浩 武鹏 骆雅梅 李慧媚 杜瀚 廖志苏
·临床研究·
慢性鼻-鼻窦炎钩突病理学改变与手术预后及CT诊断价值的相关性分析
肖惠雯 徐唱 方一 张凌浩 武鹏 骆雅梅 李慧媚 杜瀚 廖志苏
目的研究慢性鼻-鼻窦炎(CRS)患者钩突黏膜、骨质病理改变程度与患者主客观评分的相关性,并评估CT影像诊断价值。方法107例慢性鼻-鼻窦炎患者,男性63例、女性44例;年龄22~59岁。取患者病变侧的钩突黏膜及骨质,行苏木素-伊红(HE)染色。依据黏膜间质炎性细胞的数目及Biedlingmaier分级方法分析黏膜、骨质病理改变程度,并研究二者的相关性。同时使用相关性分析研究钩突黏膜、骨质病理改变程度与视觉模拟评分(VAS)、鼻腔-鼻窦结局测试22条(SNOT-22条)、Lund-Kennedy评分的关系,以及钩突骨质病理分级与CT值、Lund-Mackay CT评分的关系。结果CRS钩突黏膜炎性细胞浸润严重程度与钩突骨质病理分级存在明显的相关性。黏膜、骨质病理分级与VAS评分、SNOT-22评分、Lund-Kennedy评分呈正相关。钩突骨质病理分级与CT值、Lund-Mackay CT评分呈显著相关性。结论慢性鼻-鼻窦炎患者存在钩突黏膜、骨质的病理学改变,后者在一定程度上反映了疾病的严重程度及预后,同时CT测量在一定程度上可以客观评价骨质病理改变程度,为预后评价提供依据。(中国眼耳鼻喉科杂志,2017,17:403-407)
慢性鼻-鼻窦炎;钩突;病理改变;CT值;预后
慢性鼻-鼻窦炎(chronic rhinosinusitis, CRS)是耳鼻咽喉科常见疾病之一,其发病机制仍不明确[1]。目前认为, CRS是由多种因素独立或相互作用而导致的鼻-鼻窦慢性炎症过程[2-3], 难以用单一病因去解释其复杂的病理和临床表现[4]。虽然有关CRS 的指南性文件均认为“CRS 是鼻-鼻窦黏膜的慢性炎症”,但是鼻窦黏膜依附于黏膜下的骨质,失去黏膜下骨质的黏膜则不能存活[5-6];同样,黏膜的慢性病变也可影响其依附的骨质。在临床上CRS患者的CT影像学经常发现骨质的改变[7]。因此,对 CRS 发病机制的病理学研究应该包括鼻窦黏膜和黏膜下骨质2方面。现阶段对二者病理改变的相关性尚未得出肯定性的结论。本文通过对鼻窦钩突黏膜与骨质进行病理学研究来探讨二者病变的相关性, 并分析其病理分级与疾病严重程度、CT值的相关性,为临床治疗策略提供重要依据。
1 资料与方法
1.1 病例选择 选取2014年11月~2015年10月于我科住院并符合CRS诊断标准(昆明,2012年)[8]的107例CRS患者(男性63例、女性44例)进行研究,年龄22~59岁,平均49岁。其中单侧病变62例、双侧病变45例。所有患者皆为初次手术,且窦口鼻窦复合体均有炎症累积,均无哮喘、过敏性疾病,无高血压、糖尿病等严重内科疾病,以及代谢性骨病、恶性肿瘤、真菌性鼻窦炎,排除骨纤维异常增殖及骨化纤维瘤等可以引起鼻窦骨质变化的非 CRS 患者。另外取9例因单纯上颌窦囊肿及鼻中隔偏曲行矫正手术患者切取的钩突骨质及黏膜作为对照组。男性5例、女性4例;年龄20~45岁,平均39岁。患者无明显鼻部炎症症状,CT检查无明显鼻窦炎表现。本文中试验组及对照组患者的入组及标本收集已通过本院伦理委员会的会议讨论,并已签署患者知情同意书。
1.2 标本制作及观察 术中取完整钩突,即带有黏膜及骨质的标本。双侧取病变较重侧的钩突。分离钩突黏膜及骨质,黏膜标本经甲醛固定、脱水,石蜡包埋,切片,苏木素-伊红(hematoxylin-eosin,HE)染色、固定。根据参照文献[9]的分类方法,根据光镜下观察计数鼻窦黏膜间质炎性细胞的数目进行病理评分。①无明显炎症:黏膜间质无炎细胞浸润(评分0分);②轻度炎症:黏膜间质内炎细胞很少(评分1分);③中度炎症:黏膜间质内有较多的炎细胞(评分2分);④显著/严重炎症:黏膜间质内有大量炎细胞浸润(评分3分)。骨质标本经甲醛固定。5%硝酸脱钙,流水冲洗,脱水,石蜡包埋,切片,HE染色、固定。根据Biedlingmaier分级[10],将钩突病理学改变按严重程度分为Ⅰ~Ⅵ级。Ⅰ级: 正常, 无骨膜增厚, 无骨质破坏; Ⅱ级: 骨膜增厚; Ⅲ级: 骨膜增厚,有成骨-破骨活动,伴骨吸收和(或)重塑形成的较宽类骨线; Ⅵ级:明
显的骨髓炎,伴白细胞浸润,骨破坏。试验采取双盲原则。以上分级由2名经验丰富、不知患者病情的病理医师共同完成。
1.3 主观及客观评分标准 对所有研究者于手术前1~2 d行客观Lund-Mackay CT 评分(Lund-Mackay score, LMS)[11]。术后第1个月每周复查1次,此后根据术腔恢复情况确定复查时间。6个月后行鼻内镜随访并录像,完成主观视觉模拟评分(visual analogue scale, VAS)[12]、鼻腔-鼻窦结局测试22条(sino-nasal outcome test,SNOT-22)评分[13]及客观Lund-Kennedy内镜评分 (Lund-Kennedy score, LKS)[14],其中VAS在向患者讲明评分标准后由患者本人填写,LMS、LKS 由2名耳鼻咽喉科专业医师填写后取平均值。
1.4 CT值的测量 CT设备为美国GE公司VCT型64层螺旋CT机。扫描参数:管电压120 kV,管电流 200 mA·S,矩阵512×512。扫描范围: 硬腭至额窦顶部平面,层厚2 mm,层距2~5 mm。采用骨窗,窗宽2 000 Hu,窗位150~200 Hu,不需要增强扫描。水平位扫描后,重建冠状位和矢状位。在鼻道窦口复合体层面[15],对钩突进行CT值的测算,单位采用Hu,随机测算3次求平均值。
1.5 统计学处理 用SPSS 21.0统计软件对数据进行分析,计量资料组间均数的比较采用t检验;计数资料采用率进行描述,采用χ2检验进行组间比较,以Plt;0.05为差异有统计学意义。使用Spearman相关性分析研究其与钩突黏膜及骨质病理改变的关系;用同样的统计学方法分析骨质病理改变与黏膜病理改变的相关性,以及CT值与病变程度和钩突骨质病理改变的关系。
2 结果
2.1 钩突黏膜形态改变及炎症评分 观察107例CRS患者钩突黏膜HE染色切片光镜下改变,根据光镜下观察计数鼻窦黏膜间质炎性细胞的数目进行病理评分。对照组黏膜表面平整光滑,基底膜无增厚,间质未见明显水肿,炎症细胞浸润少,腺体未见明显增生。实验组钩突黏膜杯状细胞增多,基底膜增厚,间质水肿,并可见炎症细胞浸润,主要为小淋巴细胞、浆细胞,黏液及浆液腺体增生。
CRS患者钩突黏膜炎症评分为1.860±0.995,对照组为0.670±0.500,二者间差异有统计学意义(P=0.001)(表1)。
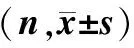
表1 2组钩突黏膜炎症评分
注:慢性鼻窦炎组黏膜炎症程度评分显著高于对照组,a示P=0.001
2.2 钩突骨质形态改变及病理分级 观察107例CRS患者钩突骨质HE染色切片光镜下改变,根据Biedlingmaier分级将钩突病理学改变按严重程度分级。对照组骨膜厚度较薄,无明显骨质破坏;实验组钩突骨膜增厚,有骨破坏,伴骨吸收及白细胞浸润(图1)。
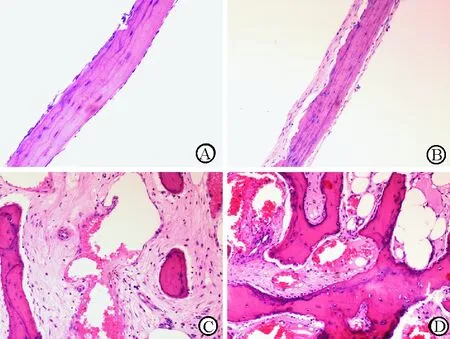
图1. A. 正常钩突骨质,无骨吸收,无骨形成(HE染色 ×100);B. 钩突骨质增厚(HE染色 ×200);C. 骨质破坏,骨纤维化(HE染色 ×200);D. 骨纤维化,骨破坏,大量白细胞浸润(HE染色 ×200)
CRS患者钩突骨质病理评分为2.440±0.871,对照组为1.330±0.500,二者间差异有统计学意义(P=0.001)(表2)。
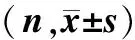
表2 2组钩突骨质病理评分
注:慢性鼻窦炎组骨质病理等级评分显著高于对照组,a示P=0.001
2.3 钩突黏膜炎症评分与骨质病理分级的相关性 为了评估CRS钩突标本的黏膜炎症程度与骨质病理改变的关系,本研究采用Spearman相关性分析。实验结果显示,CRS患者钩突的黏膜炎症浸润评分与骨质病理评分具有中度相关性,即随着钩突黏膜炎性细胞浸润严重程度增加,其钩突骨质病理分级加重(r=0.615,Plt;0.01)(表3)。
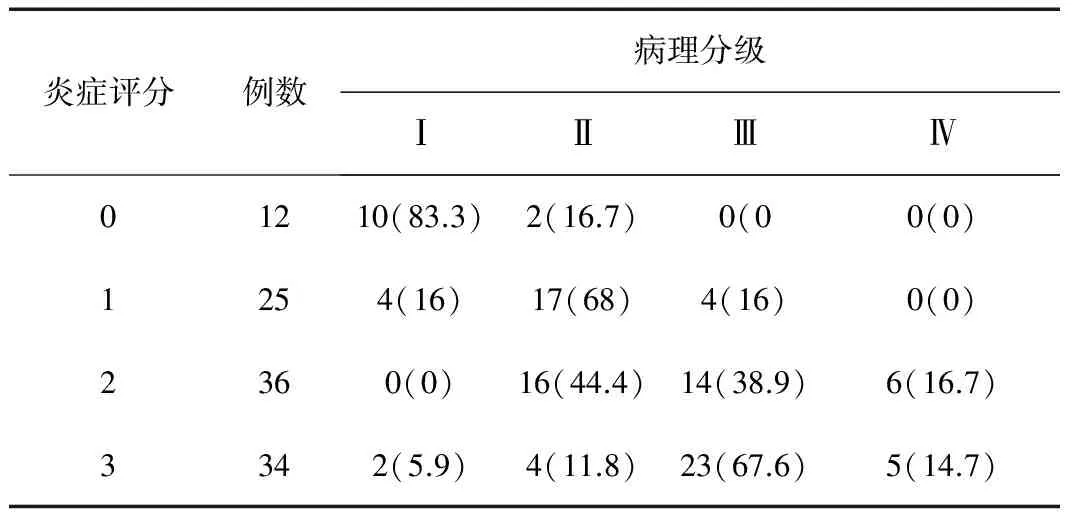
表3 钩突黏膜病理改变严重程度与骨质病理分级的相关性分析[n(%)]
2.4 钩突黏膜炎症评分与预后的关系 分析术后6个月患者VAS、SNOT-22条、LKS在不同钩突黏膜炎症评分之间具有明显的差异性(P值分别为0.009 1、0.001 0、0.001 3,P值均lt;0.01)(表4)。Spearman相关性分析显示,黏膜炎症评分分别与VAS(r=0.608,Plt;0.01)、SNOT-22条(r=0.543,Plt;0.01)、LKS(r=0.577,Plt;0.01)具有中度相关性。
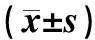
表4 钩突黏膜炎症评分与主、客观评分的相关性分析
2.5 钩突骨质病理分级与预后的关系 术后6个月患者VAS、SNOT-22条、LKS在不同钩突骨质病理分级之间差异具有统计学意义(P值分别为0.001 2、0.001 5、0.002 1,P值均lt;0.01)(表5)。Spearman相关性分析显示,骨质病理分级分别与VAS(r=0.641,Plt;0.01)、SNOT-22条(r=0.729,Plt;0.01)具有中度相关性,与LKS(r=0.921,Plt;0.01)具有高度相关性。
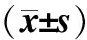
表5 钩突骨质病理分级与主、客观评分的相关性分析
2.6 钩突骨质病理分级与CT值、LMS相关性 对107例CRS患者于手术前1~2 d行钩突CT测量及LMS。有骨质病变的CT表现为骨质增厚,骨密度不均匀, CT值增高;或有骨质吸收破坏现象。方差分析显示,钩突骨质病理的不同分级之间,CT值及LMS差异有统计学意义(P=0.008 2,Plt;0.01)。Spearman相关性分析发现,钩突骨质的CT值随钩突骨质病理等级的增高明显增高,二者呈正相关(r=0.794,Plt;0.01)(表6)。
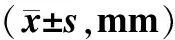
表6 钩突骨质病理分级与CT值及LMS评分的相关性分析
3 讨论
CRS 发病的始动因素目前并不清楚,而且有可能多种因素参与了疾病的初始阶段,但所有的 CRS 均表现为鼻腔外侧壁黏膜过度、持续性炎症反应,往往伴有骨质改变[16-18]。有研究[19]表明,慢性鼻窦炎骨质的病变会加重其表面黏膜炎症反应。Cho等[20]通过对患者CT影像学表现的骨质变化和病变黏膜标准病理评分行相关性分析,发现二者呈正相关,即黏膜评分越高,骨质评分也越高。因此,对CRS发病机制的病理学研究应该包括鼻窦黏膜和黏膜下骨质2方面。钩突属于窦口鼻道复合体的一部分,位于鼻腔外侧壁,与筛窦、上颌窦相毗邻。慢性鼻-鼻窦炎普遍波及钩突,同时,钩突切除术是鼻内镜下开放上颌窦、筛窦的必经步骤,取材方便、定位准确。因此,本实验中选取钩突骨质、黏膜为实验标本。基于以上研究基础,本实验中将所取钩突骨质、黏膜行HE染色,分别将骨质依据Biedlingmaier分级及黏膜依据间质炎性细胞的数目进行病理评分,通过Spearman相关性分析得出二者具有显著相关性,即随着钩突黏膜炎性细胞浸润严重程度增加,其钩突骨质病理分级加重。
Ponikau等[21]证实, CRS黏膜的病理改变类似于哮喘气管黏膜的重塑改变,鼻黏膜也发生炎性细胞浸润、杯状细胞和腺体增生、基质胶原纤维沉积、基底膜增厚。鼻黏膜病理变化表现为慢性炎症过程,其导致的直接后果是炎性细胞浸润,感染机会增加。最终导致炎症慢性化,治疗难度增加,故早期干预极为重要。 鼻-鼻窦炎不论是变应性还是感染性,其基本病理学改变是炎症反应,也是黏膜重塑的特征性变化之一。本实验通过方差分析及Spearman相关性分析,研究CRS患者钩突黏膜炎症评分与手术预后间的相关性。实验证明不同等级黏膜炎症评分的主、客观评分之间存在差异性,同时,黏膜炎症水平与代表预后的主、客观评分之间呈正相关,即黏膜炎症水平从一定程度上反映了患者的预后。术后病变黏膜改变是否可逆还存在争议[22]。只有少数学者[23-24]通过电子显微镜观察证明术前或术后黏膜发生了不可逆性变化,因此在常规的功能性鼻窦内镜手术(FESS)中,患者的预后仅仅通过更大范围病变黏膜切除就能够逆转吗?这一问题还有待于进一步研究。
Kennedy等[25]在观察鼻内镜术后创面愈合过程中发现,虽然病变区域的黏膜已经切除,但是在该部位仍然出现局限区域的复发;然而若同时切除病变黏膜下的骨质,病变会自然消退或消失。因此提出黏膜下的骨质无论是否存在严重感染迹象,骨质活力减弱在疾病的慢性演变过程中具有重要作用。Bhandarkar等[26]对190例CRS患者研究后发现,有骨炎与无骨炎的患者在LMS、LKS以及生活质量评分方面差异均有统计学意义。本实验中通过对CRS钩突骨质的组织学观察发现,CRS患者中普遍存在骨质病理改变,表现为骨膜增厚,成骨-破骨活动,甚至伴白细胞浸润的明显骨髓炎、骨破坏。通过方差分析及Spearman相关性分析发现,实验中证明不同骨质病理分级的主、客观评分之间存在显著差异;同时,骨质病理分级与代表预后的主、客观评分之间呈正相关,即骨质炎症水平从一定程度上反映了患者的预后。
本实验中通过计算LMS及测量患者术前CT检查中钩突骨质的CT值,并将其与钩突骨质病理分级做相关性检测,得出随着病变骨质CT值的增加,钩突骨质病理分级增加,二者表现出明显的相关性。说明CT值的变化可以在一定程度上反映出鼻窦炎病程中骨质炎症的程度,这与一些近期研究[27-29]结果相一致。尽管组织病理学是诊断骨炎的最准确方法,但是术前很难获取患者组织材料,这就导致对骨质病变程度难以确定。目前鼻窦CT在鼻窦炎的诊断中具有重要的作用,通过 CT 检查可以比较清晰地发现鼻窦炎患者是否存在慢性骨炎;因此,通过术前完善CT检查来预测骨质病变严重程度,有益于临床手术分析和预后评估。
综上所述,CRS患者钩突的黏膜、骨质存在一定程度的病理改变,病理改变能在一定程度上反映疾病的严重程度,并能预测患者的预后与转归。同时,CT值可以很好地代表CRS患者病变骨质的病理改变程度,CT值增加代表骨质炎性改变等级增加。通过CT值术前可以判定病变骨质的严重程度及范围,进而指导手术的计划和实施以及对预后效果的判断,从而制订更加合理和有效的治疗策略。
[1] Meltzer EO, Hamilos DL, Hadley JA, et al. Rhinosinusitis: establishing definitions for clinical research and patient care[J]. Otolaryngol Head Neck Surg, 2004, 131(6 Suppl):S1-S62.
[2] Rosati MG, Peters AT. Relationships among allergic rhinitis, asthma, and chronic rhinosinusitis[J]. Am J Rhinol Allergy, 2016,30(1):44-47.
[3] Feng CH, Miller MD, Simon RA. The united allergic airway: connections between allergic rhinitis, asthma, and chronic sinusitis[J]. Am J Rhinol Allergy, 2012, 26(3):187-190.
[4] 程雷,李华斌.慢性鼻-鼻窦炎的定义及其分类和治疗[J].中华耳鼻咽喉头颈外科杂志,2005,40(10):733-746.
[5] Bhandarkar ND, Sautter NB, Kennedy DW, et al. Osteitis in chronic rhinosinusitis: a review of the literature[J]. Int Forum Allergy Rhinol, 2013,3(5):355-363.
[6] Huang CC, Wang CH, Fu CH, et al.Association between cigarette smoking and interleukin-17A expression in nasal tissues of patients with chronic rhinosinusitis and asthma[J]. Medicine (Baltimore), 2016, 95(47):e5432.
[7] 成雷,黄振校,黄谦,等.影响慢性鼻-鼻窦炎骨炎的相关因素临床分析[J]. 中华耳鼻咽喉头颈外科杂志,2014,49(3):205-209.
[8] 中华耳鼻喉头颈外科杂志编辑委员会鼻科组,中华医学会耳鼻咽喉头颈外科学分会鼻科学组.慢性鼻-鼻窦炎诊断和治疗指南(2012,昆明)[J].中华耳鼻咽喉头颈外科杂志,2013,48(2):92-94.
[9] van Nostrand AW, Goodma WS. Pathologic aspects of mucosal lesions of the maxillarysinus[J]. Otolaryngol Clin North Am, 1976,9(1):21-34.
[10] Biedlingmaier JF, Whelan P, Zoarski G, et al.Histopathology and CT analysis of partially resected middle turbinates [J]. Laryngoscope,1996, 106( 1pt1): 102-104.
[11] Lund VJ,Mackay IS. Staging in rhinosinusitus [J]. Rhinology,1993,31(4): 83-184.
[12] Wabnitz DA, Nair S, Wormald PJ. Correlation between preoperative symptom scores, quality-of-life questionnaires, and staging with computed tomography in patients with chronic rhinosinusitis[J]. Am J Rhinol,2005,19(1):91-96.
[13] Buckland JR, Thomas S, Harries PG. Can the Sino-nasal Outcome Test (SNOT-22) be used as a reliable outcome measure for successful septal surgery?[J]. Clin Otolaryngol, 2003, 28(1):43-47.
[14] Lund VJ, Kennedy DW. Quantification for staging sinusitis. The Staging and Therapy Group[J]. Ann Otol Rhinol Laryngol Suppl, 1995, 167:17-21.
[15] 谷京城, 李玉霞, 孙旭云,等. 慢性鼻及鼻窦炎中筛骨病理学分析和CT的诊断价值[J]. 中国耳鼻咽喉头颈外科, 2010, 17(9):477-479.
[16] Liu Z,Lu X,Zhang XH,et al. Clara cell 10-kDa protein expression in chronic rhinosinusitis and its cytokine-driven regulation in sinonasal mucosa[J]. Allergy,2009,64(1):149-157.
[17] Zhao YC, Wormald PJ. Biofilm and osteitis in refractory chronic rhinosinusitis[J]. Otolaryngol Clin North Am, 2017, 50(1):49.
[18] Günel C, Bleier BS, Bozkurt G, et al. Microarray analysis of the genes associated with osteitis in chronic rhinosinusitis[J]. Laryngoscope, 2017,127(3):E85-E90.
[19] Giacchi RJ, Lebowitz RA, Yee HT, et al. Histopathologic evaluation of the ethmoid bone in chronic sinusitis[J]. Am J Rhinol, 2001, 15(3):193-197.
[20] Cho SH, Min HJ, Hong XH, et al. CT analysis and histopathology of bone remodeling in patients with chronic rhinosinusitis[J]. Otolaryngol Head Neck Surg, 2006, 135(3):404-408.
[21] Ponikau JU, Sherris DA, Kephart GM, et al. Features of airway remodeling and eosinophilic inflammation in chronic rhinosinusitis: is the histopathology similar to asthma?[J]. J Allergy Clin Immunol,2003,112(5):877-882.
[22] Kennedy DW, Zinreich SJ, Rosenbaum AE, et al. Functional endoscopic sinus surgery: theory and diagnostic evaluation[J]. Arch of Otolaryngol, 1985, 111(9):576.
[23] Thiele A, Holzhausen HJ, Riederer A, et al. Mucosal remodeling in chronic rhinosinusitis without nasal polyposis—an ultrastructural evaluation[J]. Laryngorhinootologie, 2010, 89(6):352-357.
[24] Toskala E, Rautiainen M. Electron microscopy assessment of the recovery of sinus mucosa after sinus surgery[J]. Acta Otolaryngol, 2003, 123(8):954-959.
[25] Kennedy DW,Bolger WE,Zinreich SJ, et al. Diseases of sinusitis:diagnosis and management[M].B.C.Decker,2001:197-200.
[26] Bhandarkar ND, Mace JC, Smith TL. The impact of osteitis on disease severity measures and quality of life outcomes in chronic rhinosinusitis[J]. Inter Forum Allergy Rhinol, 2011, 1(5):372-378.
[27] 董怿, 周兵, 牛延涛,等. 兔鼻窦炎模型骨质重塑CT评估[J]. 中华耳鼻咽喉头颈外科杂志, 2011, 46(10):848-853.
[28] 林枫, 周兵, 成雷,等. 整体骨炎评分与慢性鼻-鼻窦炎预后的相关性分析[J]. 中国耳鼻咽喉颅底外科杂志, 2015, 21(1):8-13.
[29] 成雷, 黄振校, 周兵,等. 整体骨炎评分系统在慢性鼻-鼻窦炎中的临床应用及骨炎评估的意义[J]. 中华耳鼻咽喉头颈外科杂志, 2013, 48(2):119-122.
2016-12-15)
(本文编辑 杨美琴)
试题3.答案:C。 眼弓形虫病(ocular toxoplasmosis)病灶往往为视网膜及脉络膜同时受累。
试题4.答案:C。 真菌性眼内炎往往表现为视网膜下黄白色病灶,最先受累的是脉络膜。
试题5.答案:C。 先天性视乳头小凹多单眼发病
试题6.答案:D。眼白化病及眼皮肤白化病患者黄斑发育不良,缺乏典型的黄斑中心凹形态。
CorrelationsbetweenpathologiccharacteristicsofuncinateprocessandsurgicaloutcomesanddiagnosticvalueofCTinpatientswithchronicrhinosinusitis
XIAOHui-wen,XUChang,FANGYi,ZHANGLing-hao,WUPeng,LUOYa-mei,LIHui-mei,DUHan,LIAOZhi-su.
DepartmentofOtorhinolaryngology,theFirstAffiliatedHospitalofWenzhouMedicalUniversity,Wenzhou325000,China
LIAO Zhi-su, Email: liaozhisu111@163.com
ObjectiveTo investigate the correlation between the pathologic characteristics of uncinate process mucosa and bone and the subjective/objective scores in patients with chronic rhinosinusitis (CRS), and to assess the diagnostic value of CT.MethodsOne hundred and seven patients with CRS (63 males and 44 females) participated in the study. They were aged between 22 and 59 years. The mucosae and bones of uncinate process were collected during operations. Hematoxylin-eosin (HE) staining was used for observing the pathological change. The number of inflammatory cells in mucosal interstitial was used to observe the pathological grade of mucosa, and Biedlingmaier criterion was used for determining the pathological grade of bone. The correlations between the pathological grade of uncinate process’s mucosae and bones were analyzed. Meanwhile, the correlation between the pathological grade of the mucosae and bones, scores of visual analogue scale (VAS), sino-nasal outcome test (SNOT-22), and Lund-Kennedy were investigated through correlation analysis. In the end, the correlations between pathologic changes of the bones and CT values, scores of Lund-Mackay CT were analyzed.ResultsThe severity of inflammatory cell infiltration in mucosal interstitial of the patients with CRS was positively correlated with the pathologic changes of bone in CRS. Pathologic changes of mucosa and bone of uncinate process in CRS were positively correlated with scores of VAS, SNOT-22 and Lund-Kennedy. Positive correlations between the pathological grades of uncinate process bone and CT values, scores of Lund-Mackay CT were observed.ConclusionsAt a certain extent, the pathologic changes of uncinate process mucosa and bone present in patients with CRS might reflect the severity and prognosis of CRS. Furthermore, CT values of the uncinate process bone in CRS can be used to evaluate objectively the pathological degree of the uncinate process bone and the prognosis of CRS. (Chin J Ophthalmol and Otorhinolaryngol,2017,17:403-407)
Chronic rhinosinusitis; Uncinate process; Pathologic change; CT value; Prognosis
温州医科大学附属第一医院耳鼻咽喉科 温州 325000
廖志苏(Email: liaozhisu111@163.com)
10.14166/j.issn.1671-2420.2017.06.006
