人血红蛋白凝集活性的研究
2017-11-27刘尚杰陆国永章跃陵
刘尚杰,郑 洲,陆国永,乔 杰,章跃陵
(汕头大学理学院生物学系,广东省海洋生物技术重点实验室,广东 汕头 515063)
人血红蛋白凝集活性的研究
刘尚杰,郑 洲,陆国永,乔 杰,章跃陵
(汕头大学理学院生物学系,广东省海洋生物技术重点实验室,广东 汕头 515063)
目前研究证实,人血红蛋白不仅具有输氧功能,而且具有酚氧化酶活性、抑菌活性等非特异性免疫学活性.本课题运用生物信息学技术对人血红蛋白与凝集素进行同源性分析,结果显示人血红蛋白α、β亚基与人、牛、大鼠、家鼠、非洲爪蟾、斑马鱼凝集素均存在同源区域,同源性大小为20%~46.7%.进而采用玻片凝集法与糖抑制实验探索人血红蛋白的凝集活性,结果表明人血红蛋白对副溶血弧菌等6种细菌均存在明显的凝集活性,其凝集比活为3.9~15.6 mg/L,且α-D-葡萄糖、麦芽糖、α-D-乳糖、D-半乳糖、D-山梨糖、D-木糖和N-乙酰神经氨酸可以部分或全部抑制人血红蛋白的细菌凝集活性.由此说明,人血红蛋白确实具有凝集活性,所获研究结果为进一步探索人血红蛋白的免疫学活性及其作用机理奠定了良好的基础.
血红蛋白;凝集素;凝集活性;糖抑制
0 引言
血红蛋白(hemoglobin,Hb)是脊椎动物和部分无脊椎动物中的一种含铁呼吸蛋白[1-4],其由血红素(heme)与珠蛋白(globin)结合而成,其中血红素分子是一个具有卟啉结构的小分子,珠蛋白由二条α链(141个氨基酸)和二条β肽链(146个氨基酸)组成,分子量为68 000 Da,呈四面体、紧密的球状结构.目前研究发现,其除具有运输氧气的功能外,还具有稳定血压、运输硫化物、调节酸碱平衡等多种生物学功能[5-8].有趣的是,最近人们证实血红蛋白还具有酚氧化酶活性、抑菌活性等多种免疫学活性[4,6-8].尤其值得一提的是,本课题组最近研究发现存在于甲壳动物中的呼吸蛋白——血蓝蛋白具有凝集活性[9].由此提示,人红细胞可能同样具有凝集活性.为此,积极探索人血红蛋白的细菌凝集活性,对丰富人血红蛋白非特异性免疫学活性及其作用机制具有重要意义.
1 材料与方法
1.1 实验材料
健康人血由志愿者提供;副溶血弧菌(Vibrio parahaemolyticus)、溶藻酸弧菌(Vibrio alginolyticus)、河弧菌(Vibrio fluvialis)、金黄色葡萄球菌(Stphylococcus aureus)、大肠杆菌(Escherichia coli K12)、乙型链球菌(beta streptococcus)为本实验室保存菌种.
葡聚糖凝胶Sephadex G-100为Pharmacia公司产品,β-巯基乙醇(β-mercaptoethanol)、丙烯酰胺(Acrylamide)、双丙烯酰胺(Bis-acrylamide)、三羟甲基氨基甲烷(Tris)、十二烷基磺酸钠(SDS)、考马斯亮蓝G-250(Coomassie brilliant blue G-250)、氯化钙(CaCl2)、α-D-葡萄糖、D-半乳糖、D-木糖、D-山梨糖、蔗糖、麦芽糖、α-D-乳糖、甘露醇和N-乙酰神经氨酸等试剂购于上海Sangon生物工程有限公司,无水乙醇、甲醇、冰乙酸、浓硫酸等试剂购于汕头西陇化工有限公司.
1.2 实验方法
1.2.1 人血红蛋白与凝集素的同源性分析
人血红蛋白与凝集素蛋白质序列搜索依据NCBI服务器Search the conserved domain database(rpsblast)(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi),选择protein blast中的blastp(protein-protein BLAST)(http//blast.ncbi.nlm.nih.gov/)服务器进行.
1.2.2 人血红蛋白的纯化
按臧家涛、周勃等[10-11]报道的方法进行,简要流程如下:取新鲜血液,2 000 r/min离心10 min,去上清,红细胞用预冷生理盐水洗涤3遍,除去血浆、白细胞和血小板.将洗涤后红细胞加2倍体积纯水,置4℃冰箱过夜,使其自然溶胀破碎.将低渗溶胀破碎的红细胞溶液于4℃,12 000 r/min离心30 min,取上清.继而取上清2 mL,加入Sephadex G-100分子筛层析柱,20 mmol/L pH 7.5磷酸盐缓冲液洗脱,流速2.4 mL/min,用自动部分收集器按每管1.5 mL收集,Bradford法测定蛋白浓度,-20℃保存备用.
1.2.3 SDS-PAGE电泳
取适量纯化人血红蛋白与2×SDS凝胶加样缓冲液等体积混合,采用5%浓缩胶、15%分离胶按常规方法进行SDS-PAGE电泳、固定、染色与拍照.
1.2.4 细菌悬液的制备
按章跃陵等报道的方法进行[9],分别用肉汤培养基或LB培养基培养副溶血弧菌、溶藻酸弧菌、河弧菌、乙型链球菌、金黄色葡萄球菌和大肠杆菌K12,取其培养物室温12 000 r/min离心1 min,生理盐水洗涤3次,用TBS-Ca2+(50 mmol/L Tris.HCl,0.75% NaCl,50 mmol/L CaCl2,pH 7.2)制备细菌悬液(1×108CFU/mL).
1.2.5 凝集实验
按章跃陵等所报道的玻片凝集法进行[9],实验分为对照组和实验组2组,其中,对照组以TBS-Ca2+代替人血红蛋白,实验组用TBS-Ca2+将血红蛋白进行2倍梯度稀释.各取10 μL滴加在洁净的载玻片上,并分别在其上滴加等量待测细菌悬液,轻轻摇动1 min,置37℃30 min,显微镜观察细菌凝集状态并拍照.以各样品发生凝集反应的最高稀释度为凝集效价,样品蛋白含量与凝集效价的比值为凝集比活(mg/L).
1.2.6 糖抑制实验
按章跃陵等报道的方法进行[9],分别选取9种糖(α-D-葡萄糖、D-半乳糖、D-木糖、D-山梨糖、蔗糖、麦芽糖、α-D-乳糖、甘露醇和N-乙酰神经氨酸)依次配成4种浓度梯度的溶液(25 mmol/L、50 mmol/L、100 mmol/L、200 mmol/L).取人血红蛋白和糖溶液各10 μL于载玻片上轻轻震荡混匀1 min,加入待测细菌悬液并混匀,置37℃30 min,显微镜下观察结果.
2 结果与分析
2.1 人血红蛋白与凝集素同源性分析
为了探索人血红蛋白是否具有凝集活性,采用NCBI数据库BLAST软件Standard protein-protein Blast和DNAstar软件,对人血红蛋白进行蛋白质序列的比对和同源性分析.结果发现,人血红蛋白α、β亚基分别与人、牛、大鼠、家鼠、非洲爪蟾和斑马鱼等6种凝集素存在保守同源区域,同源性大小为20%~46.7%(图1).由此提示,人血红蛋白可能同样具有凝集活性.
2.2 人血红蛋白的纯化与鉴定
由图2可知,Sephadex G-100纯化人血红蛋白,SDS-PAGE表现为分子质量约为14.4 kDa的2条带,与既往报道人血红蛋白β、α亚基分子量大小相符.推测该两条带应为人血红蛋白的β、α亚基,说明所纯化蛋白确实为人血红蛋白.

图1 人血红蛋白与凝集素的氨基酸序列保守区域比较和同源性分析

图2 Sephadex G-100纯化的人血红蛋白SDS-PAGE分析
2.3 人血红蛋白细菌凝集活性分析
选取副溶血弧菌等6种细菌探索人血红蛋白的细菌凝集活性,结果如表1和图3、4所示,人血红蛋白与6种细菌均能发生凝集反应,其凝集比活为3.9~15.6 mg·L-1,其中对大肠杆菌K12和金黄色葡萄球菌的凝集活性最强,对河弧菌和溶藻酸弧菌的凝集活性最弱,前者是后者的4倍.
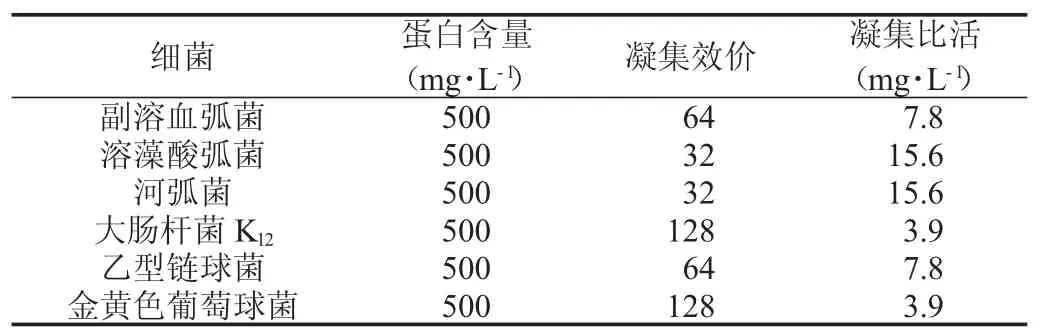
表1 人血红蛋白凝集活性分析(37℃)

图3 人血红蛋白(0.5 mg/mL)对金黄色葡萄球菌凝集反应图(400×)

图4 1:64人血红蛋白(0.5 mg/mL)对不同细菌凝集反应图(400×)
2.4 人血红蛋白凝集活性糖抑制分析
选取9种糖考察人血红蛋白细菌凝集活性的影响因素,结果如表2和图5所示,α-D-葡萄糖、麦芽糖、α-D-乳糖、D-半乳糖、D-山梨糖、D-木糖和N-乙酰神经氨酸可以部分或全部抑制人血红蛋白的细菌凝集活性,而其它糖对人血红蛋白细菌凝集活性无明显影响.其中,200 mmol·L-1α-D-葡萄糖可部分抑制人血红蛋白对溶藻酸弧菌和金黄色葡萄球菌的凝集反应,200 mmol·L-1麦芽糖和α-D-乳糖可部分抑制人血红蛋白对溶藻酸弧菌、大肠杆菌K12和金黄色葡萄球菌的凝集反应,200 mmol·L-1D-木糖可部分抑制人血红蛋白对溶藻酸弧菌的凝集反应,D-半乳糖和D-山梨糖可部分抑制人血红蛋白对大肠杆菌的凝集反应,而200 mmol·L-1N-乙酰神经氨酸可以全部抑制人血红蛋白对6种细菌的凝集反应,其中对金黄色葡萄球菌和大肠杆菌K12的抑制作用最强,其最低抑制浓度低至50 mmol·L-1.

表2 糖对人血红蛋白的细菌凝集活性抑制分析
3 讨论
近年来国内外研究表明,血红蛋白及其降解片段在免疫反应中具有多种免疫学活性[12-13].新加坡学者Jiang等[2]研究发现,人血红蛋白在病原体蛋白酶刺激下可通过释放出活性氧而杀灭微生物,提示血红蛋白具有抑菌活性.德国学者Liepke等[6]证实,人血红蛋白水解片段同样具有抑菌活性,其不仅能有效抑制革兰氏阴、阳性菌及酵母的生长,而且还可以降低内毒素活性.中国学者Hu等[4]报道,牛血红蛋白降解肽段,对大肠埃希菌、金黄色葡萄球菌和白色念珠菌也具有抑菌活性.但血红蛋白是否还具有其它免疫学活性如凝集活性等国内外尚未报道,故积极对其进行研究具有重要意义.
凝集素是一类能选择性识别糖并与之非共价可逆结合的多功能免疫分子,具有识别大多数细菌、真菌和病毒的功能,在天然免疫中发挥重要作用[14-16].本研究利用生物信息学技术发现人血红蛋白与人、牛、大鼠、家鼠、非洲爪蟾和斑马鱼等6种凝集素存在同源区域,提示人血红蛋白可能同样具有凝集活性.在此基础之上,本研究进一步运用玻片凝集法分别探索人血红蛋白对溶藻酸弧菌等6种细菌的凝集活性.发现人血红蛋白对6种菌均表现出较强的凝集活性、且其凝集活性可被N-乙酰神经氨酸等糖所抑制.由此说明,人血红蛋白确实具有凝集活性.不过,与一般凝集素相比,其凝集活性大概低2~3个数量级[17-18],其在人血清中含量上的丰富(110-160 mg·L-)1也许可以弥补其凝集活性上的不足,这一发现为进一步探索血红蛋白的抗菌机理奠定了重要基础.
一般认为,动物呼吸蛋白可分为3大类:血红蛋白(hemoglobin)、血蓝蛋白(hemocyanin)和蚯蚓血红蛋白(hemerythreins)[1].近年来研究证实,呼吸蛋白除参与呼吸作用外,还具有稳压、抗菌等多种生物学功能[2,19],引起学者们的高度关注.有意思的是,包括本实室在内的前期研究发现血蓝蛋白还具有凝集[9,20]、溶血[21]、抗肿瘤[22-23]和抗病毒[24]等多种免疫学活性.而本研究在此研究基础之上,发现血红蛋白同样具有凝集活性.由此提示,血红蛋白有可能与血蓝蛋白相似同样具备其它免疫学活性,3种呼吸蛋白也有可能由同一起源蛋白进化而来.至于其确实情况,还有待于进一步研究和探索.相信随着对3种呼吸蛋白免疫学功能及其分子基础研究的深入,其确实情况必将彻底阐明.

图5 100 mmol·L-1N-乙酰神经氨酸抑制人血红蛋白(1:16)对大肠杆菌和溶藻酸弧菌凝集反应(400×)
[1]COATES C J,DECKER H.Immunological properties of oxygen-transport proteins:hemoglobin,hemocyanin and hemerythrin[J].Cell Mol Life Sci,2017,74(2):293-317.
[2]JIANG N,TAN N S,HO B,et al.Respiratory protein-generated reactive oxygen species as an antimicrobial strategy[J].Nat Immunol,2007,8(10):1114-1122.
[3]LEE SK,DING J L.A perspective on the role ofextracellularhemoglobin on the innate immune system[J]. DNA Cell Biol,2013,32(2):36-40.
[4]HU J H,XU M L,HANG B L,et al.Isolation and characterization of an antimicrobial peptide from bovine hemoglobin a-subunit[J].World J Microb Biot,2011,27(4):767-771.
[5]ARYA S,SETHI D,SINGH S,et al.Truncated hemoglobin,HbN,is post-translationally modified in Mycobacteriumtuberculosisand modulateshost-pathogen interactionsduringintracellularinfection[J].J Biol Chem,2013,288(41):29987-29999.
[6]LIEPKE C,BAXMANN S,HEINE C,et al.Human hemoglobin derived peptides exhibit antimicrobial activity:a class of host defense peptides[J].J Chromatogr B,2003,791(1/2):345-356.
[7]DU R,WINARSIH I,HO B,et al.Lipid-free apolipoprotein A-I exerts an antioxidative role against cell-free hemoglobin[J].Am J Clin Exp Immunol,2012,1(1):33-48.
[8]BAHLN,DUR,WINARSIHI,et al.Delineationoflipopolysaccharide(LPS)-binding sites on hemoglobin:from in silico predictions to biophysical characterization[J].J Biol Chem,286(43):37793-37803.
[9]ZHANG Y L,PENG B,LI H,et al.C-terminal domain of hemocyanin,a major antimicrobial protein from Litopenaeus vannamei:structural homologywith immunoglobulins and molecular diversity[J].Front Immunol,2017,8:611.
[10]臧家涛,刘建仓,徐竞,等.一种安全高效的血红蛋白纯化方法[J].中国生物工程杂志,2011,31(11):69-74.
[11]周勃,边六交.从猪血中分离纯化高纯度的猪血红蛋白[J].色谱,2008,26(3):384-387.
[12]CATIAU L,TRAISNEL J,DELVAL-DUBOIS V,et al.Minimal antimicrobial peptidic sequence from hemoglobin alpha-chain:KYR[J].Peptides,2011,32(4):633-638.
[13]DU R,HO B,DING J L.Rapid reprogramming of haemoglobin structure-function exposes multiple dual-antimicrobial potencies[J].EMBO J,2010,29(3):632-642.
[14]VOJDANI A.Lectins,agglutinins,and their roles in autoimmune reactivities[J].Altern Ther Health Med,2015,1(Suppl 1):46-51.
[15]DAMBUZAIM,BROWNGD.C-typelectinsinimmunity:recent developments[J].Curr Opin Immunol,2015,32(32):21-27.
[16]DRICKAMER K,TAYLOR M E.Recent insights into structures and functions of C-type lectins in the immune system[J].Curr Opin Struct Biol,2015,34:26-34.
[17]SUDHAKAR G R,VINCENT S G.Purification and characterization of a novel C-type hemolytic lectin forclotlysisfrom the fresh water clam Villorita cyprinoides:a possible natural thrombolytic agent against myocardial infarction[J].Fish Shellfish Immunol,2014,36(2):367-373.
[18]SAVAN R,ENDO M,SAKAI M.Characterization of a new C-type lectin from common carp Cyprinus carpio[J].Mol Immunol,2004,41(9):891-899.
[19]ZHANG D L,GUAN R Z,HUANG W S,et al.Isolation and characterization of antibacterial peptide derived from hemoglobin alpha in the liver of Japanese eel,Anguilla japonica[J].Fish ShellfishImmunol,2013,35(3):625-631.
[20]YAN F,ZHANG Y L,JIANG R P,et al.Identification and agglutination properties of hemocyanin from the mud crab(Scylla serrata)[J].Fish Shellfish Immunol,2011,30(1):354-360.
[21]ZHANG Y L,YAN F,HU Z,et al.Hemocyanin from shrimp Litopenaeus vannamei shows hemolytic activity[J].Fish Shellfish Immunol,2009,27(2):330-335.
[22]ZHENG L Y,ZHAO X L,ZHANG P,et al.Hemocyanin from ShrimpLitopenaeus vannameihas antiproliferative effect against HeLa cellin vitro[J].Plos One,2016,11:e0151801.
[23]LIU S J,ZHENG L Y,AWEYA J J,et al.Litopenaeus vannameihemocyanin exhibits antitumor activity in S180 mouse modelin vivo[J].Plos One,2017,12(8):e0183783.
[24]NESTEROVA N V,ZAGORODNYA SD,MOSHTANSKA V,et al.Antiviral activity of hemocyanin isolated from marine snailRapana venosa[J].Antivir Res,2011,90(2):A38.
Investigation of Agglutinative Activity of Human Hemoglobin
LIUShangjie,ZHENGZhou,LUOGuoyong,QIAO Jie,ZHANG Yueling
(Department of Biology,College of Science,Shantou University,Shantou 515063,Guangdong,China)
Hemoglobin is an important oxygen carrier in erythrocytes.However,recent reports have demonstrated that human hemoglobin has some nonspecific immunological functions including phenoloxidase and antimicrobial activity.In the present study,the homology between human hemoglobin and agglutinin was analyzed by bioinformatics.The results showed that the α and β chains of human hemoglobin possessed 20%~46.7%homology with lectin fromHomo sapiens,Bos taurus,Rattus norvegicus,Mus musculus,Xenopus(Silurana)tropicalisandDanio rerio.When sixbacteria includingVibrio parahaemolyticus,Vibrio alginolyticus,Vibrio fluvialis,Stphylococcus aureus,Escherichia coli K12andbeta streptococcuswere reacted with human hemoglobin,the results showed that human hemoglobin could aggregate with all these bacteria,with agglutinative activities in the range 3.9~15.6 mg/L.Moreover,saccharide effect on human hemoglobin was further analyzed using nine saccharides including α-D-glucofuranose, Maltose,α-D-lactose,D-galactose,D-sorbin,D-xylose and N-acetylneuraminic acid.The results indicated that the agglutinative activity of human hemoglobin could be partly or completely inhibited by these monosaccharides or oligosaccharides.Taken together,these results suggested that human hemoglobin could also act as an agglutinin in nonspecific immune response,hence, these results will lay the foundation to further explore the immunological functions of human hemoglobin and its mechanism.
hemoglobin;agglutinin;agglutinative activity;saccharide inhibition
1001-4217(2017)04-0003-07
Q71
A
2017-10-29
刘尚杰(1984—),男,博士生,主要从事生物化学与分子生物学研究.E-mail:15sjliu1@stu.edu.cn
章跃陵(1971—),男,教授,博士生导师.E-mail:zhangyl@stu.edu.cn
国家自然科学基金项目(31672689),广东省自然科学基金重点项目(2017A030311032),广东省高等学校重大科研项目培育计划类项目(2014GKXM043)
