苜蓿DUS测试标准品种SSR分子标记指纹图谱的构建
2017-11-24闵学阳刘文献张正社韦兴燚齐晓张义刘志鹏王彦荣
闵学阳,刘文献*,张正社,韦兴燚,齐晓,张义,刘志鹏,王彦荣*
(1.草地农业生态系统国家重点实验室,农业部草牧业创新重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020;2.全国畜牧总站,全国草品种审定委员会办公室,北京 100125;3.全国畜牧总站,北京100193)
苜蓿DUS测试标准品种SSR分子标记指纹图谱的构建
闵学阳1,刘文献1*,张正社1,韦兴燚1,齐晓2,张义3,刘志鹏1,王彦荣1*
(1.草地农业生态系统国家重点实验室,农业部草牧业创新重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020;2.全国畜牧总站,全国草品种审定委员会办公室,北京 100125;3.全国畜牧总站,北京100193)
苜蓿在育种过程中,由于其异花授粉特性和骨干亲本的集中使用,导致品种间的遗传差异日益缩小,品种之间通过形态学鉴定愈加困难。通过构建苜蓿DUS测试标准品种DNA指纹图谱数据库,可以实现苜蓿品种的快速、准确鉴定。本研究利用筛选得到的10个SSR标记对33个苜蓿DUS测试标准品种进行指纹图谱构建和遗传多样性分析。结果表明,10对SSR引物共扩增出69个等位基因,平均每个标记可产生6.9个等位基因;多态性比率(PPB)从25%到90%不等,平均值为56.7%;各SSR标记的多态信息含量(PIC)范围为0.56~0.87,平均值为0.75。利用不同引物间的组合能有效区分33个苜蓿 DUS标准品种,并为每份标准品种建立了唯一标识的指纹代码,为苜蓿品种的审定和保护以及遗传背景分析提供了技术依据。
苜蓿; SSR标记; 指纹图谱; 标准品种; DUS 测试
在过去的几十年中,随着植物育种和种子贸易的发展,植物新品种已成为现代农业建设的重要支撑和掌握农业发展主动权的关键,因此对植物新品种进行保护就显得尤为重要。植物特异性、一致性和稳定性(distinctness, uniformity and stability, DUS)测试作为植物新品种保护的技术基础,授权的科学依据和判断品种真实性的技术手段,其重要性日益突出[1]。DUS测试技术体系包括以植物农艺学形态特征测试为主导的传统测试技术和对基因型测试的分子辅助技术两部分。传统的DUS测试虽然具有简单直观、经济方便等优点,但其测试周期长,受环境条件影响大,稳定性差,需要大面积的土地和专业的技术人才。同时随着骨干亲本的集中使用,相近品种之间的形态学差异缩小,在实际操作过程中较难执行,进而阻碍了新品种授权的有效性和权威性[2-3]。
近年来,以PCR 技术为基础的分子标记技术已经被广泛用于植物品种鉴定和指纹图谱构建[4-5]。与形态性状不同,分子标记因具有多态性高、测试周期短、不受环境影响、易于自动化等优势,可以在DNA水平上揭示品种间基因型的差异,为种质资源鉴定提供了一种直接、可靠和高效的途径[6-7]。其中,SSR(simple sequence repeat)标记在DNA指纹鉴定上具有信息含量高、标记数量丰富、多态信息含量高、简单快速、重复性好及共显性遗传的独特优越性,已成为当前多种农作物标准品种指纹图谱构建及DUS 测试的首选标记[6]。作为植物新品种 DUS快速测试的核心技术之一,SSR标记分别对水稻(Oryzasativa)[8]、玉米(Zeamays)[9]、多花黑麦草(Loliummultiflorum)[10]和柱花草(Stylosanthesspp.)[11]等物种进行了研究,并成功将这项技术运用于植物标准品种指纹图谱构建和新品种DUS测试中。
苜蓿(Medicagosativa)作为最重要和广泛种植的豆科饲料作物,具有较高的营养品质和经济价值。除此之外,其在饲草生产、生态治理和绿肥种植中都是首选物种[12-13]。栽培苜蓿为异花授粉的同源四倍体(2n=4x=32),主要靠种子繁殖后代。由于其为四倍体遗传,具有多个等位基因和显著的近交繁殖抑制特性[14-15]。因此,采用多态性共显性标记,例如SSR分子标记,可从分子水平区分和鉴定杂合和纯合基因座,从而辅助选择和提高苜蓿品种开发的效率。
在农业部农业技术试验示范(国家草品种区域试验)项目的资助下,本团队经过近3年的测试分析及品种评价,验证和完善了48个苜蓿品种的19个基本性状田间测试技术,筛选出的33个苜蓿标准品种列入中华人民共和国农业部《植物新品种特异性、一致性和稳定性测试指南 紫花苜蓿和杂花苜蓿》(NY/T2747-2015)农业行业标准文本[16],不仅填补了我国苜蓿DUS测试技术体系的空白,也进一步促进了我国苜蓿新品种的审定和保护。为了从分子水平研究苜蓿品种间基因型的差异,本研究采用基于苜蓿开发的引物组合,对DUS测试指南中规定的33个苜蓿标准品种构建标准品种指纹图谱,并在此基础上对品种间的遗传相似性进行分析,从分子水平上为苜蓿品种的鉴定和保护提供更加准确、公正和客观的判定依据。
1 材料与方法
1.1试验材料
试验于2016年9-12月进行。本研究所用的33个苜蓿品种由国内和国外两部分构成,19份国外品种由美国农业部提供,14份国内品种由农业部全国畜牧总站和国家草种质资源库提供,均为苜蓿DUS测试的标准品种(表1)。以上测试材料均种植在兰州大学临泽试验站。
1.2基因组DNA的提取
对每个苜蓿品种,采用30个单株的新鲜叶片混合取样[17]。利用CTAB法提取苜蓿基因组总DNA[18],以1% 琼脂糖凝胶电泳检测质量,并用Nanodrop分光光度计和1%琼脂糖凝胶电泳测DNA浓度和质量(OD260/OD280≈1.8)。将DNA样品稀释成25 ng/μL的工作液并置于4 ℃保存备用。

表1 苜蓿品种鉴定试验材料Table 1 Alfalfa varieties in the experiment
1.3PCR 扩增与检测
本研究所用的SSR引物分别选自在苜蓿中具有通用性、多态性高、重复性好的MtTFSSR[18],MsSSR[19]及MTRmiRSSR分子标记。引物由上海生工生物工程技术服务有限公司合成(表2)。PCR反应体系为10 μL,在PTC-200热循环仪上进行:模板DNA 1 μL,2×Taq PCR MasterMix 5 μL,正反向引物各1 μL,ddH2O 2 μL。PCR 扩增程序为:94 ℃变性30 s;60~56 ℃ 退火30 s,72 ℃延伸30 s,共5个循环;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,共30个循环;72 ℃延伸7 min;于4 ℃保存。PCR扩增产物用6%变性聚丙烯酰胺凝胶进行检测。样品点样量为2 μL,200 V电压下电泳110 min,凝胶用AgNO3溶液染色,照相保存。
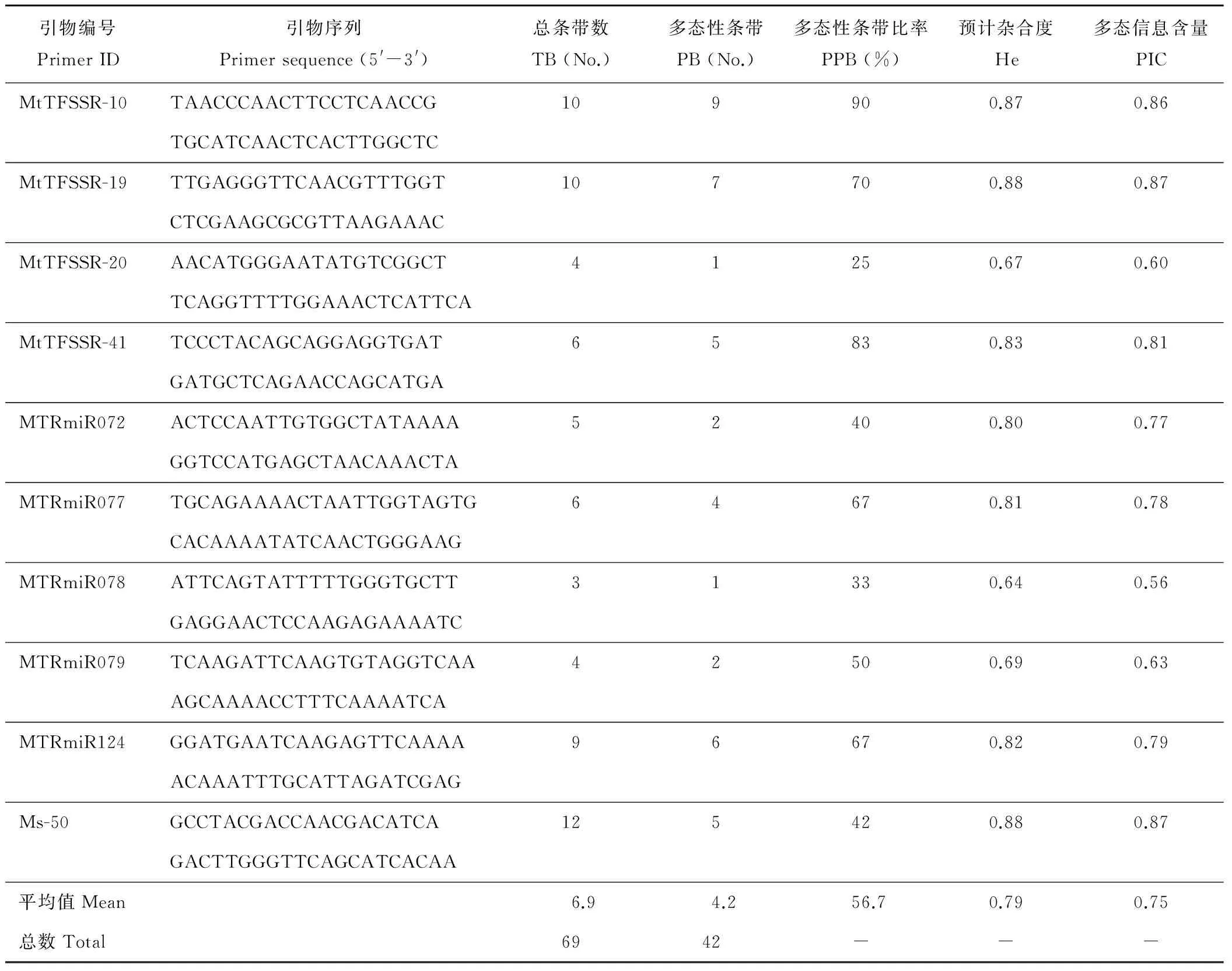
表2 10对SSR引物信息Table 2 Information on SSR markers used in the study
TB: Total bands; PB: Polymorphic bands; PPB: Percentage of polymorphic bands; He: Expected heterozygosity; PIC: Polymorphic information content.
1.4数据分析
通过人工比对和软件校正,对SSR 标记扩增产物进行统计。按照扩增条带的分子量从大到小编号读取,相同迁移位置有带的记为1,无带的记为0, 建立“0,1”矩阵。根据“0,1”矩阵,统计SSR标记扩增产物的总条带数(total bands, TB)、多态性条带数(polymorphic bands, PB)、多态性条带比率(percentage of polymorphic bands, PPB)、预计杂合度(expected heterozygosity, He)和多态信息量(polymorphic information content, PIC)[20]。
2 结果与分析
2.1SSR产物多态性分析
本研究采用本课题组开发的具有较高遗传多样性的10 对核心SSR引物,对33个苜蓿品种进行了遗传多样性分析(表2),这些引物均可扩增出多态性高且清晰的条带。每对引物多态性条带数量(PB)从1(MtTFSSR-20和MTRmiR078)到9(MtTFSSR-10)不等,平均值为 4.2;10对SSR引物的多态性比率(PPB)从25%(MtTFSSR-20)到90%(MtTFSSR-10)不等,平均值为56.7%;多态信息含量(PIC)范围为 0.56(MTRmiR078)~0.87(MtTFSSR-19, Ms-50),平均值为0.75,这表明本研究中的33个标准品种具有丰富的遗传多样性;每个标记预计杂合度(He)范围为0.64(MTRmiR078)~0.88(MtTFSSR-19, Ms-50)。基于以上结果, MtTFSSR-10的PB和PPB均为最大值,MtTFSSR-19和Ms-50的PIC和He均为最大值,因此,MtTFSSR-10、MtTFSSR-19和Ms-50这3对引物在苜蓿遗传多样性分析及品种鉴定中具有更大的潜力。
2.2SSR引物鉴定苜蓿品种效率分析
在筛选出的10对核心SSR多态性引物中,每个多态性引物分别能扩增出1~9 条多态性条带,不同引物能够区分的苜蓿品种数不同,其范围在1~7之间(表3)。例如,引物MtTFSSR-10能扩增出10条多态性条带,可以一次性区分7个品种;而引物MtTFSSR-20扩增出4条多态性条带,仅能鉴定出Ranger一个品种。但不同引物的组合可以大大提高对不同品种的鉴别能力。例如,MtTFSSR-10引物能鉴别7个品种,与引物MtTFSSR-19组合后可鉴别品种的数量增加到16个;引物MtTFSSR-19能鉴别3个品种,与引物MtTFSSR-41组合后能鉴别的品种数增至12个。采用以上10对SSR引物对33个品种进行分析,14个品种具有特征谱带(表3),即仅用1个特征引物即可将该品种与其他品种区分开。例如,MtTFSSR-10和MtTFSSR-19均在中兰1号上具有特征谱带;MTRmiR079在Abi 700中具有特征谱带(图1)。因此在对品种鉴定时可优先采用相应特征引物快速鉴定。

表3 14个苜蓿品种的5对特征引物列表Table 3 Five primer pairs with specific bands for 14 alfalfa varieties

图 1 部分SSR引物在编号为1~33的苜蓿品种中的扩增结果Fig.1 SSR amplification results of alfalfa varieties coded from 1 to 33 with part of primers A: MtTFSSR-10; B: MtTFSSR-19; C: MTRmiR077;M:DNA marker.
2.3苜蓿标准品种指纹图谱的构建
33个标准品种的SSR引物扩增条带, 详见表4。 在扩增结果中, 有条带记为“1”,无带记为“0”。10对引物组合在一起即为苜蓿的DNA指纹图谱,如用所有10对SSR引物,扩增Abi 700,得到的图谱分别为1111111111、1100001110、 0111、 111111、 11111、 111111、 011、 1110、 000111011和100111101011, 将其组合到一起为1111111111-1100001110-0111-111111-11111-111111-011-1110-000111011-100111101011(表4)。 将10对SSR引物的扩增结果组合在一起,可得到由79个“0” 和“1” 组成的数字图谱。这些组合的数字图谱构成了33个苜蓿品种的组合指纹图谱数据库。当33条字符串形成能够唯一标识一份品种的字符串时,即表明这10个SSR标记能将33份材料全部区分开,即每一条字符串可以作为每一份品种的分子身份证号码。

表4 33个苜蓿品种的DNA指纹图谱Table 4 DNA fingerprint of the 33 alfalfa varieties
A: MtTFSSR-10;B: MtTFSSR-19;C: MtTFSSR-20;D: MtTFSSR-41;E: MTRmiR072;F: MTRmiR077;G: MTRmiR078;H: MTRmiR079;I: MTRmiR124;J: Ms-50.

图2 SSR引物扩增结果相关性分析Fig.2 The correlation analyze based on the SSR productions
利用10对核心引物在33个苜蓿品种的电泳带型对引物间扩增结果的相关性进行分析。相关性分析结果如图2所示。10对引物间,MTRmiR079与MtTFSSR-20之间相关性最强,相关系数达到0.94,两者之间扩增带型差异最小;而Ms-50与MtTFSSR-20之间相关性最差, 相关系数为-0.09,他们之间的扩增带型差异最大。因此,根据引物间扩增结果的相关性高低,可以进一步辅助在进行品种鉴定时进行引物间的优化组合,即利用相关性较差的引物组合可以更加利于进行品种间的鉴定。同时,进一步利用10对引物在不同品种中的扩增产物所对应的分子量大小对每个品种的DNA指纹图谱进行作图,从而可以更直观地对不同品种间的差异进行比较(图3)。
3 讨论
随着我国畜牧业的发展,牧草种子的市场需求量日趋增大,新的牧草品种急剧增加。因此,如何快速、准确地检测品种纯度与真实性的工作也变得越来越重要。传统的形态学鉴定法具有耗时长、受环境限制、需要大量的土地面积等缺点[4]。随着以PCR 技术为基础的分子标记技术的不断发展与完善,解决了传统的形态学鉴定法、同工酶蛋白和电泳鉴定中存在的多个问题。目前,该技术已被成功地运用于水稻、玉米和多花黑麦草等植物的品种鉴定中。同时,大量研究表明SSR标记由于具有高分辨力特性及共显性的遗传方式,使其成为指纹构建和品种鉴定的理想标记技术[6,8,21]。
苜蓿品种大多为通过表型轮回选择或大量自然选择培育的综合品种(群体),有多个亲本参与杂交,这就造成部分育成品种间或多或少有着亲缘关系。品种的遗传多样性分析重在揭示品种间的亲缘关系及遗传基础,在研究中只要品种间一个 DNA 位点(片段)的基因型(带型)不同, 便视为不同品种,筛选核心引物的重要指标之一是可以利用DNA带型区分更多的品种。品种指纹图谱作为植物品种特异性检测的分子标记,不仅需要区别尽可能多的品种,还应能从众多品种中筛查出相似度高的品种。苜蓿指纹图谱则是通过统计多态性条带信息构建的,而不同苜蓿品种的遗传多样性正是通过多态性位点差异体现的。本研究把10对SSR引物的扩增结果组合在一起就可以将33个苜蓿品种完全区分开,即每个苜蓿品种都有能够唯一标识的一份品种字符串。苜蓿SSR指纹图谱的构建不仅可以为SSR标记技术在苜蓿DUS测试中应用奠定基础,而且在育种策略调整和选配优良杂交组合培育新品种等方面具有现实意义。
本研究中所选用10对引物中,有5对引物具有特征条带,可以直接对14个苜蓿品种进行鉴定。因此,若想获得其他品种的特异性谱带,还需要扩大引物的筛选范围。同时,随着参试品种数量的增加,一些特征谱带可能会失去其特异性,只能对特定的材料有效。研究表明,通过不同引物的有限组合能够提高引物的鉴别效率。如张玉翠等[22]通过5对引物的有效组合,即可将32个棉花(Gossypiumhirsutum)品种完全区分开。罗永聪等[10]利用12对引物的组合提高了引物在多花黑麦草品种间的鉴别能力,例如,01-01B引物可以鉴别12个品种,但是与引物12-10F组合后即能鉴别全部供试的21个品种。本研究结果也证实了这一结论,如引物MtTFSSR-10能鉴别6个品种,引物MtTFSSR-19能鉴别3个品种,但是将这两个引物组合就可以鉴别14(42%)个品种,表明本研究筛选的10对SSR引物具有多态性高和稳定性强的特点,可作为一套鉴定苜蓿品种的核心引物。
值得注意的是,本研究中所用的大部分品种来源于国外,由于某些原因难以获得其育种系谱关系,加之苜蓿为典型的异花授粉植物,具有复杂的品种遗传基础,增大了研究品种间遗传相似性关系的难度。因此,对于异花授粉的植物,在构建指纹图谱及遗传关系分析时应该特别注意系谱关系的收集,以便于后续的分析,进而建立更为完善的指纹图谱数据库。
4 结论
本研究以10对核心引物构建了33个用于苜蓿DUS测试的品种的DNA指纹图谱,可以从分子水平快速准确鉴别和了解苜蓿品种的遗传多样性,能够在品种鉴定和知识产权保护等方面发挥积极作用,为合理利用苜蓿种质资源和选配优良杂交组合培育新品种提供理论依据。
References:
[1] UPOV. Document TG/1/3 General Introduction to the Examination of Distinctness, Uniformity and Stability and the Development of Harmonized Descriptions New Varieties of Plants[EB/OL]. (2002-04-19)[2016-12-19]. http:// www.Upov.int/en/publications/tg-rom/tg001/tg_1_3. Pdf.
[2] Kwon Y S, Lee J M, Yi G B,etal. Use of SSR markers to complement tests of distinctiveness, uniformity, and stability (DUS) of pepper (CapsicumannuumL.) varieties. Molecules Cells, 2005, 19(3): 428-435.
[3] Chen H R, Gu X J. Introduction to protection of new varieties of watermelon. China Watermelon and Melon, 2002, 4: 21.
陈海荣, 顾晓君. 浅谈西瓜新品种的保护. 中国西瓜甜瓜, 2002, 4: 21.
[4] Wang F G, Tian H L, Zhao J R,etal. Development and characterization of a core set of SSR markers for fingerprinting analysis of Chinese maize varieties. Maydica, 2011, 56(1): 1-11.
[5] Chen Y N, Dai X G, Hou J,etal. DNA fingerprinting of oil camellia cultivars with SSR markers. Tree Genetics amp; Genomes, 2016, 12(1): 1-8.
[6] Teng H T, Lü B, Zhao J R,etal. DNA fingerprint profile involved in plant variety protection practice. Biotechnology Bulletin, 2009, (1): 1-6.
滕海涛, 吕波, 赵久然, 等. 利用DNA指纹图谱辅助植物新品种保护的可能性. 生物技术通报, 2009, (1): 1-6.
[7] Singh A, Sengar R. DNA fingerprinting based decoding of indica rice (OryzasativaL) via molecular marker (SSR, ISSR, amp; RAPD) in aerobic condition. Advances in Crop Science and Technology, 2015, 3: 167.
[8] Shahin K B, Kabirnattaj S, Nematzadeh G A,etal. Fingerprinting and genetic diversity evaluation of rice cultivars using inter simple sequence repeat marker. Journal of Plant Molecular Breeding, 2015, 3(1): 81-91.
[9] Setimela P S, Warburton M L, Erasmus T. DNA fingerprinting of open-pollinated maize seed lots to establish genetic purity using simple sequence repeat markers. South African Journal of Plant and Soil, 2016, 33(2): 141-148.
[10] Luo Y C, Ma X, Zhang X Q. DNA fingerprinting of annual ryegrass (LoliummultiflorumLam.) varieties using SSR makers. Journal of Agricultural Biotechnology, 2013, 21(7): 799-810.
罗永聪, 马啸, 张新全. 利用SSR技术构建多花黑麦草品种指纹图谱. 农业生物技术学报, 2013, 21(7): 799-810.
[11] Ding X P, Zhang L, Luo X Y,etal. Construction of DNA fingerprinting ofStylosanthesstandard cultivars for DUS testing. Pratacultural Science, 2015, 32(15): 2047-2056.
丁西朋, 张龙, 罗小燕, 等. 柱花草DUS测试标准品种DNA指纹图谱构建. 草业科学, 2015, 32(15): 2047-2056.
[12] Sun Q Z, Yu Z, Xu C C. Urgency of further development alfalfa industry in China. Pratacultural Science, 2012, 29(2): 314-319.
孙启忠, 玉柱, 徐春城. 我国紫花苜蓿产业亟待振兴. 草业科学, 2012, 29(2): 314-319.
[13] Sanz-Sáez, Erice G, Aguirreolea J,etal. Alfalfa forage digestibility, quality and yield under future climate change scenarios vary withSinorhizobiummelilotistrain. Journal of Plant Physiology, 2012, 169(8): 782-788.
[14] Wang Z, Yu G, Shi B,etal. Development and characterization of simple sequence repeat (SSR) markers based on RNA-sequencing ofMedicagosativaand in silico mapping onto theM.truncatulagenome. Plos One, 2014, 9(3): e92029.
[15] Stanford E H. Tetrasomic inheritance in alfalfa. Agronomy Journal, 1951, 43(5): 222-225.
[16] The Ministry of Agriculture of the People’s Republic of China. Guidelines for the Conduct of Tests for Distinctness, Uniformity and Stability Lucerne: NY/T2747-201[S]. Beijing: Standards Press of China, 2015.
中华人民共和国农业部. 植物新品种特异性、一致性和稳定性测试指南 紫花苜蓿和杂花苜蓿: NY/T2747-201[S]. 北京: 中国标准出版社, 2015.
[17] Herrmann D, Flajoulot S, Julier B,etal. Sample size for diversity studies in tetraploid alfalfa (Medicagosativa) based on codominantly coded SSR markers. Euphytica, 2010, 171: 441-446.
[18] Liu W X, Jia X T, Liu Z M,etal. Development and characterization of transcription factor gene-derived microsatellite (TFGM) markers inMedicagotruncatulaand their transferability in leguminous and non-leguminous species. Molecules, 2015, 20(5): 8759-8771.
[19] Liu Z P, Chen T L, Ma L C,etal. Global transcriptome sequencing using the Illumina platform and the development of EST-SSR markers in autotetraploid alfalfa. PLoS One, 2013, 8(12): e83549.
[20] Nei M. Analysis of gene diversity in subdivided populations. Proceedings of the National Academy of Sciences of the United States of America, 1973, 70: 3321-3323.
[21] Santhy V, Mohapatra T, Dadlani M,etal. DNA markers for testing distinctness of rice (OryzasativaL.) varieties. Plant Varieties amp; Seeds, 2000, 13(3): 141-148.
[22] Zhang Y C, Yang W H, Kuang M,etal. Construction of DNA fingerprinting and analysis of genetic diversity with SSR markers for 32 leading cotton cultivars. Cotton Science, 2012, 24(2): 120-126.
张玉翠, 杨伟华, 匡猛, 等. 32个棉花主栽品种DNA指纹图谱构建及遗传多样性分析. 棉花学报, 2012, 24(2): 120-126.
ConstructionofSSRmarkerfingerprintdatabaseofstandardalfalfavarietiesutilizingDUStests
MIN Xue-Yang1, LIU Wen-Xian1*, ZHANG Zheng-She1, WEI Xing-Yi1, QI Xiao2, ZHANG Yi3, LIU Zhi-Peng1, WANG Yan-Rong1*
1.State Key Laboratory of Grassland Argo-ecosystems, Key Laboratory of Grassland Livestock Industry Innovation, Ministry of Agriculture, College of Pastoral Agriculture Science and Technology, Lanzhou University, Lanzhou 730020, China; 2.National Animal Husbandry Service, Office of the Chinese Herbage Cultivar Registration Board, Beijing 100125, China; 3.National Animal Husbandry Service, Beijing 100193, China
Due to cross-pollinating characteristic and the excessive use of backbone materials during the alfalfa breeding, the genetic diversity of alfalfa varieties is declining, and the discrimination of different varieties through phenotypical characteristics is becoming more difficult. The construction of a DNA fingerprint database of standard alfalfa varieties through the distinctness, uniformity and stability (DUS) test can facilitate the identification of alfalfa varieties. In this study we analyzed the genetic diversity among 33 standard alfalfa varieties with a DUS test and the DNA fingerprint of each variety was constructed based on 10 SSR markers. The results showed that a total of 69 alleles were generated from the 10 SSR markers, with an average of 6.9 alleles per marker; the polymorphic ratio varied from 25% to 90%, with an average of 56.7%. The polymorphic information content per SSR marker varied from 0.56~0.87, with an average of 0.75. The 33 varieties could be clearly distinguished by the 10 SSR markers. The DNA fingerprint of each variety was established providing a technical basis for the validation and conservation of alfalfa varieties and genetic background analysis.
alfalfa; SSR markers; DNA fingerprinting; example varieties; DUS testing
10.11686/cyxb2017038http//cyxb.lzu.edu.cn
闵学阳, 刘文献, 张正社, 韦兴燚, 齐晓, 张义, 刘志鹏, 王彦荣. 苜蓿DUS测试标准品种SSR分子标记指纹图谱的构建. 草业学报, 2017, 26(11): 47-56.
MIN Xue-Yang, LIU Wen-Xian, ZHANG Zheng-She, WEI Xing-Yi, QI Xiao, ZHANG Yi, LIU Zhi-Peng, WANG Yan-Rong. Construction of SSR marker fingerprint database of standard alfalfa varieties utilizing DUS tests. Acta Prataculturae Sinica, 2017, 26(11): 47-56.
2017-02-14;改回日期:2017-04-10
国家自然科学基金项目(31502000),教育部创新团队(IRT_17R50),高等学校学科创新引智计划(B12002),国家草品种区域试验项目(21301060001)和兰州大学中央高校基本科研业务费专项资金(lzujbky-2016-8)资助。
闵学阳(1991-),男,甘肃张掖人,在读硕士。E-mail: minxy15@lzu.edu.cn
*通信作者Corresponding author. E-mail: liuwx@lzu.edu.cn, yrwang@lzu.edu.cn
