牛传染性鼻气管炎病毒LAMP方法的建立及与PCR方法的对比研究
2017-11-24郭利李家伟姚庆李建友程世鹏
郭利,李家伟,姚庆,李建友,程世鹏
(1.中国农业科学院特产研究所特种动物分子生物学重点实验室,农业部经济动物疫病重点实验室,长春 130112;2.安图县畜牧兽医总站,安图 133600;3.龙井市畜牧业管理局,龙井 133400)
牛传染性鼻气管炎病毒LAMP方法的建立及与PCR方法的对比研究
郭利1,李家伟2,姚庆3,李建友1,程世鹏1
(1.中国农业科学院特产研究所特种动物分子生物学重点实验室,农业部经济动物疫病重点实验室,长春 130112;2.安图县畜牧兽医总站,安图 133600;3.龙井市畜牧业管理局,龙井 133400)
本研究利用环介导等温扩增(LAMP)技术建立了可视化牛传染性鼻气管炎病毒(BoHV-1)LAMP检测方法,并与普通PCR方法进行对比研究。试验结果证明,LAMP具有良好的敏感性、特异性,可检测到2.23×103拷贝/µL的BoHV-1基因含量,其临床样品的阳性检出率高于普通PCR。
牛传染性鼻气管炎病毒;LAMP;PCR
传染性鼻气管炎(Infectious Bovine Rhinotracheitis,IBR)又名牛疱疹病毒Ⅰ型(Bovine herpesvirus type1 infections,BoHV-1)感染症,是由牛传染性鼻气管炎病毒引起的牛的一种急性接触性传染病,临床表现形式多样,以呼吸道为主[1],为B类疫病[2]。病牛和带毒动物是主要传染源,隐性感染的种公牛精液带毒。病牛愈后可带毒6~12个月,甚至长达19个月。病毒主要存在于鼻、眼、阴道分泌物和排泄物[3]。急性BoHV-1呼吸道感染还可继发其他细菌性或病毒性感染,造成牛呼吸道疾病综合征(BRDC)[4]。目前,IBR已在世界范围内流行,可结合流行病学做出初步诊断,实验室诊断包括病毒分离鉴定和血清学试验。
IBR是牛场临床常见的多发病,可给养牛业造成极大的损失。BoHV-1为双股DNA病毒,但其病毒基因平均GC含量高于75%[5],这一基因组的特殊性限制了BoHV-1的病原学快速检测方法的建立。环介导等温扩增(loop-mediated isothermal amplification,LAMP)是一种新型的核酸等温扩增技术[6],是近年来发展起来的一项疾病快速临床诊断方法,具有条件简单、操作方便等十分突出的优点。本研究针对BoHV-1病毒gE基因,建立了BoHV-1的LAMP快速检测方法,产物通过目视检测基于钙黄绿素显色的荧光和琼脂糖凝胶电泳,亦可根据反应液浊度来直接判断反应结果,可视化程度高。同时,采用该方法检测临床样品与普通PCR进行对比分析,以期为疫病的预后筛查和治疗检测提供一种简单快速的试验手段。
1 材料与方法
1.1 毒株和细胞
BoHV-1、BPIV3、BVDV和BRSV病毒及标准阳性质粒、MDBK细胞均由中国农业科学院特产研究所分子生物学重点实验室保存。
1.2 仪器与试剂
水浴锅:杭州博日科技有限公司;分光光度计:Eppendorf;PCR 扩增仪:美国Bio-Rad公司;凝胶成像系统:美国Bio-Rad公司;琼脂糖购自Promega公司;胎牛血清购自Hyclone公司。DNA、RNA提取试剂盒购自AXYGEN公司;钙黄绿素(FD) 购自日本荣研化学株式会社公司;Bst DNA、LATaq聚合酶购自宝生物科技有限公司;引物由长春库美生物有限公司合成。
1.3 试验设计
1.3.1 病毒增殖及DNA提取
将MDBK细胞用含8%胎牛血清的DMEM培养液培养和传代,待细胞长成单层后,用于BoHV-1病毒接种。取-70℃保存的牛传染性鼻气管炎病毒接种单层MDBK细胞进行培养(MOI 0.01),72h后,-20℃反复冻融3次,收获病毒。病毒DNA的提取按试剂盒操作说明进行。
1.3.2 LAMP反应引物的设计与筛选
从NCBI数据库中获得牛传染性鼻气管炎病毒保守序列gE(GenBank∶ L27212.1)的序列,利用软件Primer design V4设计LAMP反应所需的4组引物(内引物FIP和BIP、外引物F3和B3),引物序列见表1。将4组引物分别用于LAMP反应,选取最佳扩增引物。

表1 引物序列
反应混合物总体系25μL,分别加入4组引物:引物F3 0.5μL,引物B3 0.5μL,引物FIP 4μL,引物BIP 4μL,Bst DNA酶0.5μL,2×buffer13μL,模板2μL,钙黄绿素0.5μL。反应温度设置为65℃,反应时间为50min,以双蒸水为阴性对照。利用钙黄绿素观察荧光和琼脂糖凝胶电泳的反应结果选择最优引物组。试验设阴性和阳性对照。
1.3.3 特异性试验
对筛选出来的最佳引物组进行特异性试验,分别以阴性对照双蒸水,以牛呼吸道相关病毒BoHV-1病毒DNA和BPIV3、BRSV 、BVDV三种病毒阳性质粒为模板,通过琼脂糖凝胶电泳和钙黄绿素来检测引物特异性,待检测样本中含有BoHV-1基因序列时,就可以发生LAMP反应,产生大量焦磷酸镁白色沉淀,与钙黄绿素结合显示黄绿色荧光,而阴性样品不发生扩增呈橙色,琼脂糖凝胶电泳可见特异扩增条带。
1.3.4 敏感性试验
按试剂盒说明操作提取BoHV-1总DNA,根据定量进行10倍梯度稀释至终浓度为10-6倍。25μL体系反应混合物在63℃反应50min后进行LAMP敏感性检测(反应条件同上),并与PCR方法检测灵敏性进行对比,PCR反应总体系25μL,各组分的体积分别为:引物P1 0.5μL,引物P2 0.5μL,LATaq酶0.5μL,10×buffer 2.5μL(高GC),dNTP 2μL,模板1μL,去离子水补至25μL。反应条件:94℃ 5min;94℃ 30s,57℃15s,72℃ 1min,30个循环,72℃总延伸5min。
1.3.5 临床样品检测
采用建立的IBR LAMP检测方法对来自吉林、内蒙古、黑龙江和山东等地区发病牛场的10份临床DNA样品进行检测。LAMP反应条件、普通PCR反应条件同上。
2 结果与分析
2.1 最佳引物筛选结果
根据BoHV-1gE特异性保守序列设计了4组LAMP引物,依照LAMP试剂盒优化条件,分别加入4组不同引物,在63℃反应50min。由图1、图2可以看出,引物组2、3、4反应结束后无扩增,引物组1呈阳性扩增,阴性对照成立。选择引物组1为BoHV-1-LAMP方法扩增引物。
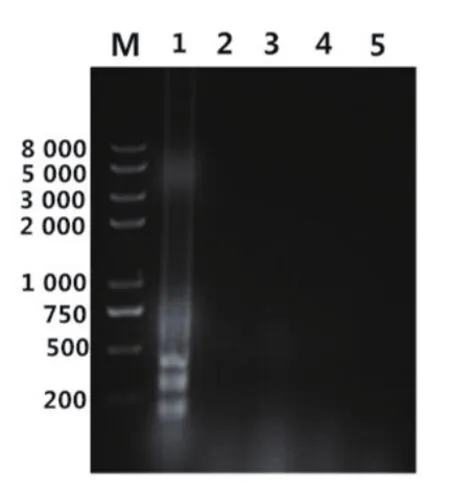
图1 4组引物的扩增结果

图2 4组引物的扩增荧光变化结果
2.2 特异性试验结果
分别以阴性对照双蒸水,以牛呼吸道相关病毒BoHV-1、BPIV3、BRSV和BVDV的DNA为模板,通过琼脂糖凝胶电泳和钙黄绿素来检测引物特异性。琼脂糖凝胶电泳结果显示。BoHV-1模板反应管可见特异扩增条带,其他三组未见LAMP反应扩增条带,且阴性对照结果成立,表示该引物对BoHV-1具有良好的特异性(图3)。LAMP结果显示,BoHV-1基因反应管为阳性,出现黄绿色荧光;BPIV3、BRSV和BVDV样品为阴性,无黄绿色荧光,没有产生沉淀(图4)。

图3 LAMP方法特异性试验

图4 LAMP方法特异性试验荧光变化
2.3 敏感性试验结果
将BoHV-1病毒的细胞培养物提取其总DNA,定量为5.58×108个拷贝/μL,10倍系列稀释至10-6,25μL 反应体系中BoHV-1含量为2.23×106拷贝/μL~2.23×101拷贝/μL,用LAMP方法和PCR进行检测并设阴性对照。结果显示,LAMP扩增在病毒模板稀释到10-5即BoHV-1基因组含量为2.23×103个拷贝时仍可被检测到(图5),阳性样品显示黄绿色荧光(图6);PCR方法检测2.23×103个拷贝数时呈弱阳性(图7)。

图5 LAMP敏感性试验结果

图6 LAMP敏感度试验荧光变化结果

图7 普通PCR敏感度试验结果
2.4 临床样品检测结果
收集到来自安徽、内蒙古、吉林、黑龙江、山东、辽宁等部分地区发病牛场的临床样品10份,其中鼻拭子4份,血样3份,粪拭子3份。采用建立的LAMP方法对10份样品进行检测。结果显示,在10份临床样品中,LAMP方法检出阳性样品6份,琼脂糖凝胶电泳均可见特异条带(图8),对应阳性样品可见黄绿色荧光,阴性对照成立(图9)。PCR方法检出BoHV-1阳性样品3份,阴性对照成立(图10)。结果表明,PCR检出的阳性样品3、5和6对应LAMP检测均为阳性,LAMP阳性检测结果与PCR方法阳性检测符合率为100%,且LAMP阳性检出率高于普通PCR。
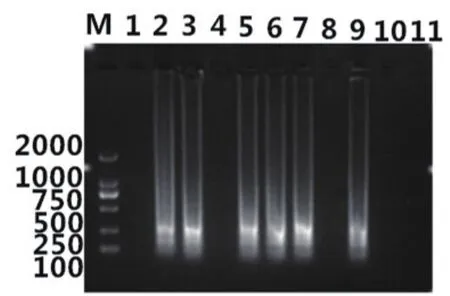
图8 临床样品LAMP检测结果
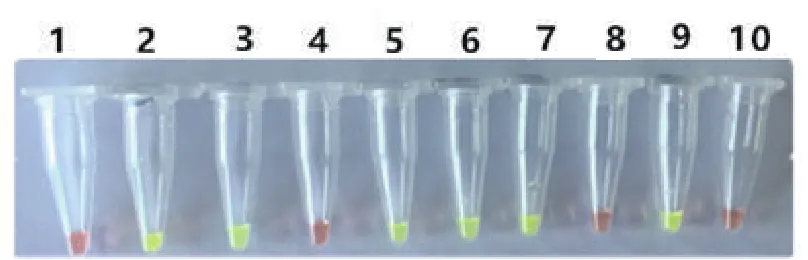
图9 临床样品LAMP荧光变化检测结果

图10 临床样品PCR检测结果
3 讨论
IBR是由BoHV-1病毒引起的牛常见传染病[7],各种年龄的牛都易感染,病毒隐藏在三叉神经内,形成隐性感染,适当条件下重新发病,病畜是主要传染源。本病呈全球性分布,各养牛业发达国家均有流行。BoHV-1为DNA病毒,属疱疹病毒科,感染后一般发生病毒潜伏而长期带毒,适当应激条件下重新发病,使疾病在牛群中广泛流行[8]。通常情况下,鉴定血清学中阳性动物是检查动物感染状态非常有用而且理想的指标,抗体阳性动物可认为是病毒携带动物和潜在的排毒者。国内目前大型养牛场有使用IBR疫苗的,或者幼畜通过吸食初乳获得母源抗体,所以依靠血清抗体对疫病筛查需结合具体情况进行分析,最后的临床诊断仍是对病原的监测。
本研究室对国内部分省市的BoHV-1血清流行病学调查显示,仅个别地区未见有血清抗体阳性,绝大部分省区均有IBR的流行,某些地区BoHV-1血清抗体阳性率可达100%,说明BoHV-1病毒在中国流行广泛。BoHV-1临床样本检测方法主要包括Real Time-PCR技术、PCR技术、ELISA及中和试验[9,10]等,但上述方法都局限在实验室条件下进行。皇甫和平等[11]建立了IBRLAMP检测方法,特异性好,灵敏性可检测到1.68×104拷贝/μL。LAMP对引物要求高,且反应时间不宜过长,时间越久假阳性结果越明显。提高反应的灵敏性和特异性对疾病的快速诊断是至关重要的环节。本研究建立的牛传染性鼻气管炎病毒(BoHV-1)的LAMP快速检测方法,经对引物反复筛选和反应条件的优化,1h之内完成检测,普通水浴后可根据溶液颜色变化肉眼观察判定结果,具有良好的特异性和敏感性。临床样品检测时,LAMP阳性检测率高于普通PCR方法,且与PCR方法阳性检测符合率为100%。
LAMP法操作流程简便,针对DNA病毒样品易于处理,为BoHV-1的临床检测提供了一种简单快速的试验手段,更适合IBR的诊断和临床现场快速检测,可对疫病的防控起到临床科学的指导作用。
[1]Pritchard GC, Banks M, Vernon RE. Subclinical breakdown with infectious bovine rhinotracheitis virus infection in dairy herd of high health status[J]. Vet Rec, 2003, 153:113-117.
[2]Pritchard GC, Banks M, Vernon RE. Subclinical breakdown with infectious bovine rhinotracheitis virus infection in dairy herd of high health status[J]. Vet Rec, 2003, 153:113-117.
[3]Griffin D, Chengappa MM, Kuszak J, et al. Bacterial pathogens of the bovine respiratory disease complex[J]. Vet Clin North Am Food AnimPract, 2010,26:381-394.
[4]Baker JC.Bovine viral diarrhea virus: Rosskopf, M., Staub, E.,Ackermann, M., 1994. Comparison of two ELISA systems for the detection of antibodies against IBR/IPVand against enzootic bovine leukemia virus. Schweiz. Arch.Tierheilk. 136,58-67.
[5]Borsberry S. Challenges of BoHV-1 eradication in 'closed' cattle herds[J]. Vet Rec,2012,170:652.
[6]NotomtTH, Okayama H, Masubuchi T,et al. Amino, and T.Hase.Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Res, 2000, 28:E63.
[7]Tomita N,Mori Y,Kanda H,et al.Loop-mediated isothermal amplification (LAMP) of gene sequences and simple visual detection of products[J]. Nat. Protoc, 2008,3:877-882.
[8]Wyler, R., Engels, M., Schwyzer, M., 1989. Infectious bovinerhinotracheitis/vulvovaginitis. In: Wittmann, G. (Ed.),HerpesvirusDiseases of Cattle, Horses and Pigs. Kluwer Academic Publishers, Boston, Dordrecht, London, pp. 1-72.
[9]陈茹,毕英佐,曹永长,等. 牛传染性鼻气管炎病毒 LUX 新型荧光 PCR 检测方法的建立[J]. 中国预防兽医学报,2007,29(4):303-308.
[10] Yason C.V, Harris L.M., Kibenge F.S.Establishment of conditions for the detection of bovine herpesvirus-1 polymerase chain reaction using primers in the thymidine kinase region[J].Canadian Journal of Veterinary Research, 1995, 59(2):94-101.
[11]皇甫和平,石冬梅,许文博,等. 牛 传 染 性 鼻 气 管 炎 病 毒 g E 基因LAMP 检 测 方 法 的 建 立[J]. 中国兽医杂志,2016,52(6):14-16.
Establishment of LAMP Method for Bovine Hypersvirus Type 1 and Comparison with PCR
GUO Li1, LI Jia-wei2, YAO Qing3, LI Jian-you1, CHENG Shi-peng1
(1.The Key Laboratory for Molecular Biology of Special Economic Animals, Institute of Special Economic Animal and Plant Sciences , Chinese Academy of Agricultural Sciences, Key Laboratory of Special Animal Epidemic Disease, Ministry of Agriculture, Changchun 130112; 2.Animal Husbandry and Veterinary Station of Antu, Antu 133600; 3.Bureau of Animal Husbandry of Longjing, Longjing 133400)
This study using loop mediated isothermal amplification (LAMP) technology to establish the infectious bovine rhinotracheitis virus (BoHV-1) LAMP detection method, and compares with the ordinary PCR method. The results show that the LAMP is more sensitivity and specificity than the ordinary PCR method. The LAMP method can be detected 2.23×103copies /µL. The detection of clinical samples were compared with normal PCR results showed that clinical samples positive rate was higher than that of ordinary PCR.
Infectious bovine rhinotracheitis virus; Loop-mediated isothermal amplification; PCR
S858.23
A
1004-4264(2017)11-0025-04
10.19305/j.cnki.11-3009/s.2017.11.007
2017-03-11
牛传染性鼻气管炎活疫苗(LNM株)产业化关键技术研究与应用(20150307024NY);国家重点研发计划:畜禽重大疫病防控与高效安全养殖综合技术研发(2016YFD0500907);规模化牛场牛病毒性腹泻净化体系建立及推广应用(20170309002NY)。
郭利(1977-),女,吉林长春人,副研究员,主要从事动物病毒和生物制品的研究。
