硒生物营养强化小麦在发芽过程中的生理特征研究
2017-11-23马丽佳张泽洲袁林喜尹雪斌
马丽佳, 张泽洲,2, 袁林喜*, 尹雪斌
1.江苏省硒生物工程技术研究中心, 江苏 苏州 215123; 2.中国地质大学(武汉), 生物地质与环境地质国家重点实验室, 武汉 430074; 3.中国科学技术大学苏州研究院, 江苏 苏州 215123
硒生物营养强化小麦在发芽过程中的生理特征研究
马丽佳1, 张泽洲1,2, 袁林喜1*, 尹雪斌3*
1.江苏省硒生物工程技术研究中心, 江苏 苏州 215123; 2.中国地质大学(武汉), 生物地质与环境地质国家重点实验室, 武汉 430074; 3.中国科学技术大学苏州研究院, 江苏 苏州 215123
选取硒生物营养强化种植获得的小麦品种扬麦16的低硒组A(硒含量5.245 μg/g)、高硒组B(硒含量47.850 μg/g)和非强化组CK(硒含量0.039 μg/g)为研究对象,通过监测发芽过程中的发芽参数(芽长、根长、发芽率)、芽体的总硒和硒形态、酶[淀粉酶(AMS)、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)]活力、总抗氧化能力(T-AOC)以及过氧化氢(H2O2)、丙二醛(MDA)含量的变化,探讨硒生物营养强化转化的内源硒对小麦发芽过程生理行为的影响。结果显示,内源硒对麦芽的根长、芽长没有明显影响,但适宜浓度的内源硒有助于提高小麦的发芽率。高硒小麦籽粒可以通过发芽过程将部分内源硒代蛋氨酸(SeMet)转化为硒代胱氨酸(SeCys2)。内源硒有助于增强α-淀粉酶、抗氧化酶(GSH-Px和SOD)的活力,同时,可提高麦芽的总抗氧化能力(T-AOC)、降低麦芽体内H2O2和MDA的积累。
硒生物营养强化;小麦;发芽;谷胱甘肽过氧化物酶;总抗氧化能力
尽管尚不能确定硒是否为植物的必需营养元素[1],但可以明确的是,硒有助于促进植物的生长、提高其抗氧化能力[2,3]、抵制由内部因素(如光合作用和呼吸作用中产生的氧自由基)和外部胁迫(如干旱、冻伤)对植物引起的氧化损伤[2]。此外,研究显示,在低温条件下,经2 mg/L Na2SeO3溶液浸润后的苦瓜种子能够提高发芽率并降低自身的氧化损伤[4];在花生的发芽过程中适宜浓度的Na2SeO3溶液(3~6 mg/L)有助于芽体中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)基因的表达及酶活性的提高,而高浓度的Na2SeO3溶液(12~24 mg/L)会显著抑制下胚轴和主根的伸长以及阻碍侧根的生长[5];适宜浓度的硒溶液(15~60 μmol/L)可作为大米种子的引发剂,有助于提高其发芽率和幼苗生长活力,而高浓度的硒溶液(90~105 μmol/L)则易对幼苗产生毒害作用[6]。研究表明,硒能够提高小麦籽粒在干旱胁迫条件下的抵抗力[7,8],有助于减少在低温胁迫下小麦发芽过程中氧自由基和脂质过氧化物的产生,并提高麦芽的生物量[9];适量硒的添加有助于促进小麦籽粒的生长,减少在UV-B光线照射下引起的氧化损伤[10]。
但是,现有的研究集中在外源硒施用对作物种子发芽过程的影响,并未对经硒生物营养强化所获得的富硒(或硒含量较高)种子的发芽过程中的生理特征变化开展研究。目前,在中国、芬兰、印度、英国,通过土壤、叶面施加硒肥等硒生物营养强化途径能够显著提高作物籽粒中的硒含量[11~14]。其中,小麦是人体摄入硒的主要来源之一[15~18],硒生物营养强化后的小麦籽粒不仅具有较高的硒含量,而且可以将外源无机硒转化为硒代蛋氨酸(SeMet)[19]。
因此,本研究以硒生物营养强化的小麦籽粒为研究对象,探讨内源硒对籽粒发芽参数和生理特征的影响,以期为合理利用和开发硒生物营养强化谷物提供参考。
1 材料和方法
1.1材料
1.1.1试验试剂 Se(IV)标准溶液(GSB 04-1751-2004,由国家有色金属及电子材料分析测试中心提供);蛋白酶K、蛋白酶XIV、纤维素酶、硒代胱氨酸(SeCys2)、硒甲基硒代半胱氨酸(SeMeCys)、硒代蛋氨酸(SeMet)标准物质均购自德国Sigma公司;α-淀粉酶(AMS)、过氧化氢(H2O2)、丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)、总抗氧化能力(T-AOC)试剂盒均购自南京建成生物工程研究所;其他化学试剂均为分析纯。
1.1.2试验材料 小麦品种为扬麦16(由江苏里下河地区农科所培育和提供),通过向土壤中施加专用硒肥(由天然高硒矿物活化制成,由苏州硒谷科技有限公司提供)获得了硒生物营养强化小麦低硒组A(硒含量5.245 μg/g)、高硒组B(硒含量47.850 μg/g)以及同一品种的非强化小麦对照组CK(硒含量0.039 μg/g)。
1.2试验方法
1.2.1发芽处理与发芽参数 挑选饱满、均一的小麦籽粒,置于5% NaClO溶液中浸泡5 min后立即用超纯水(18.2 MΩcm)冲洗10次,然后在250 mL超纯水中浸泡24 h(25℃)后放在发芽盘中,每个发芽盘中放500粒小麦,每组设置4个平行。将发芽盘放置在恒温恒湿培养箱中,避光,温度20℃,湿度90%,定期补给发芽所需的水分。分别在发芽的第0天(24 h浸泡后)、第2天、第4天、第6天观察后采取整株小麦芽样品,样品一部分于-20℃冷藏,用于酶活性及抗氧化性质的研究,另一部分于50℃烘干后粉碎,用于测定麦芽总硒含量及硒形态。此外,选取在发芽第4天检测发芽率(以100粒计),以及根长、芽长(以20粒计)。
1.2.2总硒含量与硒形态测定 样品干燥粉碎后过100目筛,准确称取0.5~1.0 g样品加入10 mL混酸(80%浓硝酸+20%高氯酸)中,热消解后加入5 mL盐酸、18.2 MΩcm超纯水定容至25 mL,硼氢化钾溶液作还原剂、5%盐酸溶液为载流,采用氢化物发生-原子荧光光谱法(北京吉天—9230)测定总硒含量[20]。
准确称取0.2 g经干燥粉碎过100目筛的样品,加入5 mL Tris-HCl,超声波提取30 min,加入纤维素酶50 mg、蛋白酶K 0.4 mL、蛋白酶XIV 0.4 mL,气浴恒温振荡器(50℃,250 r/min)中震荡48 h,低温高速离心机(1 000 r/min,4℃)离心30 min,收集上清液过0.22 μm水系膜,采用形态预处理-原子荧光联用仪测量SeCys2、SeMeCys、SeMet、Se(IV)的含量(北京吉天AFS-9230-SPA-10-LC-20AB)[21,22],其中SeCys2、SeMeCys、SeMet、Se(IV)的测试标样相对误差(RSD)分别为5%、6%、10%和5%。
1.2.3AMS、GSH-Px、SOD、T-AOC、H2O2、MDA的测定 称取0.5 g冷藏麦芽样品加入4.5 mL 0.86%生理盐水中,在冰水浴下制备组织匀浆,低温高速离心(1 000 r/min,4℃)30 min,过0.22 μm水系膜,收集匀浆上清液。采用南京建成生物工程研究所提供的试剂盒测定麦芽上清液[5],调节分光光度计(UV-2450 岛津)波长到660 nm、412 nm、550 nm、520 nm、405 nm和532 nm处分别测定样品吸光度,依照试剂盒说明书分别计算淀粉酶(AMS)、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)的活性、总抗氧化能力(T-AOC)以及过氧化氢(H2O2)、丙二醛(MDA)的含量。
1.2.4数据分析 采用SPSS 19单因素方差分析法(ANOVA)、Duncan法进行均数的多重比较(P<0.05)。
2 结果与分析
2.1硒生物营养强化小麦的发芽参数、总硒与硒形态特征
在发芽的第4天对发芽参数进行统计(表1),结果显示硒生物营养强化小麦低硒组A和高硒组B的根长、芽长与对照组并没有显著性差异(P>0.05)。低硒组A的发芽率(77.33%±4.73%)显著高于对照组CK(68.67%±1.53%)(P<0.05),但高硒组B的发芽率(70.67%±4.93%)与对照组相比并没有显著差异(P>0.05)。
低硒组A和高硒组B的小麦籽粒在发芽的第6天,全株芽体(包括芽、根和籽粒)中总硒含量相比未发芽籽粒分别增加了29.0%和36.8%(表2),这可能是由于发芽过程中籽粒的部分营养物质消耗而引起质量损失导致的。发芽过程中,硒在低硒组A中以硒代蛋氨酸(SeMet)的形式存在,占总硒的比例达到53%~69%;而在高硒组B中以硒代蛋氨酸(SeMet)和硒代胱氨酸(SeCys2)的形式存在,占总硒的比例达到40%~54%。尽管在不同发芽时期中硒的形态特征并未发生明显变化,但硒代氨基酸在总硒中的占比随发芽过程的进行而逐步降低。
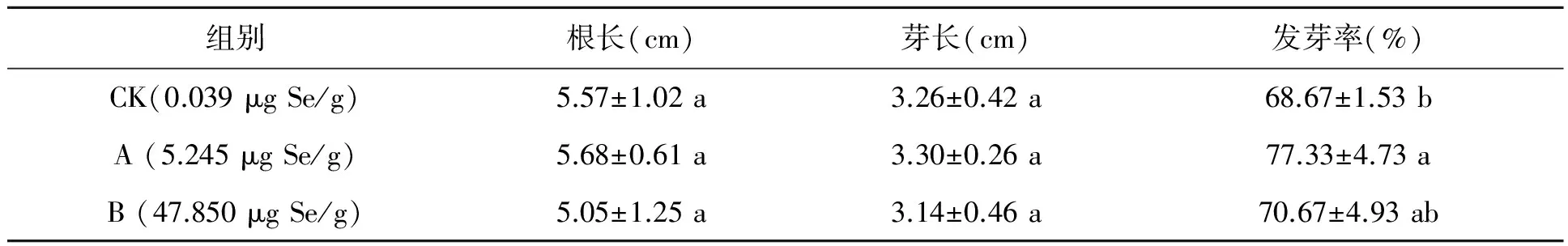
表1 发芽第4天麦芽根长、芽长及籽粒发芽率(Duncan test,P<0.05)Table 1 Root length, sprout length and germination rate on the fourth day during wheat germination (Duncan test,P<0.05).
注:同列数据不同字母表示差异显著(P<0.05)。
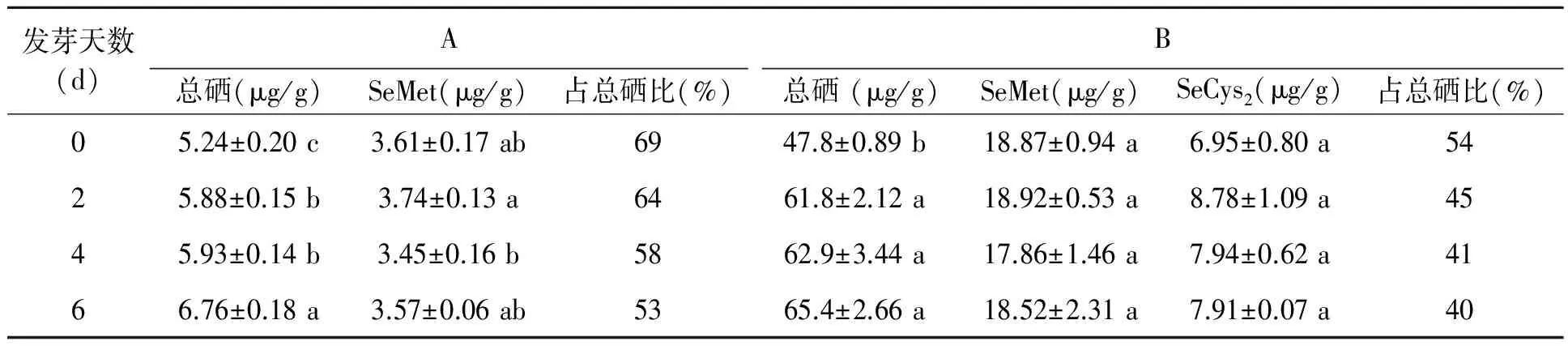
表2 不同发芽时期的全株芽体中总硒与硒形态特征Table 2 Total Se contents and Se-containing amino acids contents in germinated wheats during different times.
注:对照组CK的硒代氨基酸含量较低,未达到仪器检出限;同列数据不同字母表示差异显著(P<0.05)。
2.2硒生物营养强化小麦的发芽生理指标特征
不同发芽时期(第0天、第2天、第4天、第6天)中小麦的AMS、GSH-Px和SOD的变化情况如图1所示。总体而言,发芽过程中淀粉酶的活力越来越强,在发芽的第6天,对照组CK、低硒组A、高硒组B的淀粉酶活力比第0天时分别增长了128%、178%和120%。从发芽第2天开始,籽粒硒含量越高,淀粉酶活力越强(CK:13.57 U/mg,A:18.35 U/mg,B:23.46 U/mg,P<0.05);尽管在发芽第6天,高硒组B的淀粉酶活性(27.93 U/mg)有所下降,但仍显著高于对照组CK(23.73 U/mg)(图1A)。
GSH-Px酶活力在发芽过程中均呈明显上升趋势,第6天时的GSH-Px酶活力较第0天分别提高了24.37倍(CK)、11.23倍(A)、7.71倍(B),分别达到130.66 U/mg、174.19 U/mg和154.32 U/mg。但是,GSH-PX酶活力最高值出现在高硒组B的第4天,达到229.47 U/mg,随后呈下降趋势,到第6天下降至154.32 U/mg,而低硒组A和对照组CK依然呈上升趋势(图1B)。

图1 发芽过程中AMS、GSH-Px、SOD变化特征(Duncan test,P<0.05)Fig.1 AMS, GSH-Px and SOD changes during wheat germination (Duncan test,P<0.05).
与之相反的是SOD酶活力整体呈现下降趋势(图1C):在第0天,低硒组A小麦SOD酶活力为692.62 U/mg,明显高于对照组CK(595.70 U/mg)和高硒组B(573.65 U/mg);在第2~4天,低硒组A的SOD酶活力下降到537.55 U/mg,几乎与高硒组B为同一水平(529.30 U/mg),但二者均显著高于对照组CK(446.59 U/mg)(P<0.05);到第6天,三者SOD酶活力达到相同水平。
生物体内的各种抗氧化大分子、抗氧化小分子和抗氧化酶的总体水平体现了该体系内的总抗氧化能力(T-AOC)。在发芽第0天,低硒组A、高硒组B的T-AOC明显高于对照组CK(CK:2.12 U/mg,A:2.63 U/mg,B:2.43 U/mg,P<0.05)。在发芽第2、4、6天,3组小麦的T-AOC均呈增长趋势,高硒组B的T-AOC分别是对照组CK的1.81倍、1.76倍和1.23倍(P<0.05),但低硒组A的T-AOC在发芽第2、4天与对照组CK相比无明显差异(图2A),在第6天时,低晒组A的T-AOC低于对照组。
发芽第0天,3组小麦籽粒中的H2O2含量未表现出明显差异(P>0.05);第2天,低硒组A、高硒组B的H2O2含量明显低于对照组CK(CK:21.15 mmol/g,A:17.33 mmol/g,B:5.95 mmol/g;P<0.05);第4天,对照组CK、低硒组A和高硒组B的H2O2含量分别较第2天增长了1.23倍、1.48倍和4.55倍,且处于同一水平;第6天,对照组CK继续升高了6%,而低硒组A和高硒组B较第4天分别降低了36.8%和54.5%(图2B)。
高硒组B在未发芽阶段的MDA含量(0.59 μmol/g)显著低于对照组CK(0.81 μmol/g),低硒组A的MDA含量(0.71 μmol/g)与对照组CK相比没有明显差异;第4天,3组MDA含量分别较第2天上升了49%、195%和78%,低硒组A和高硒组B的MDA含量上升幅度较大;第6天,对照组CK和低硒组A的MDA含量继续分别上升了114%、4%,而高硒组B的MDA含量则降低了6%,且低硒组A和高硒组B的MDA含量在第6天明显低于对照组(P< 0.05)(图2C)。
3 讨论
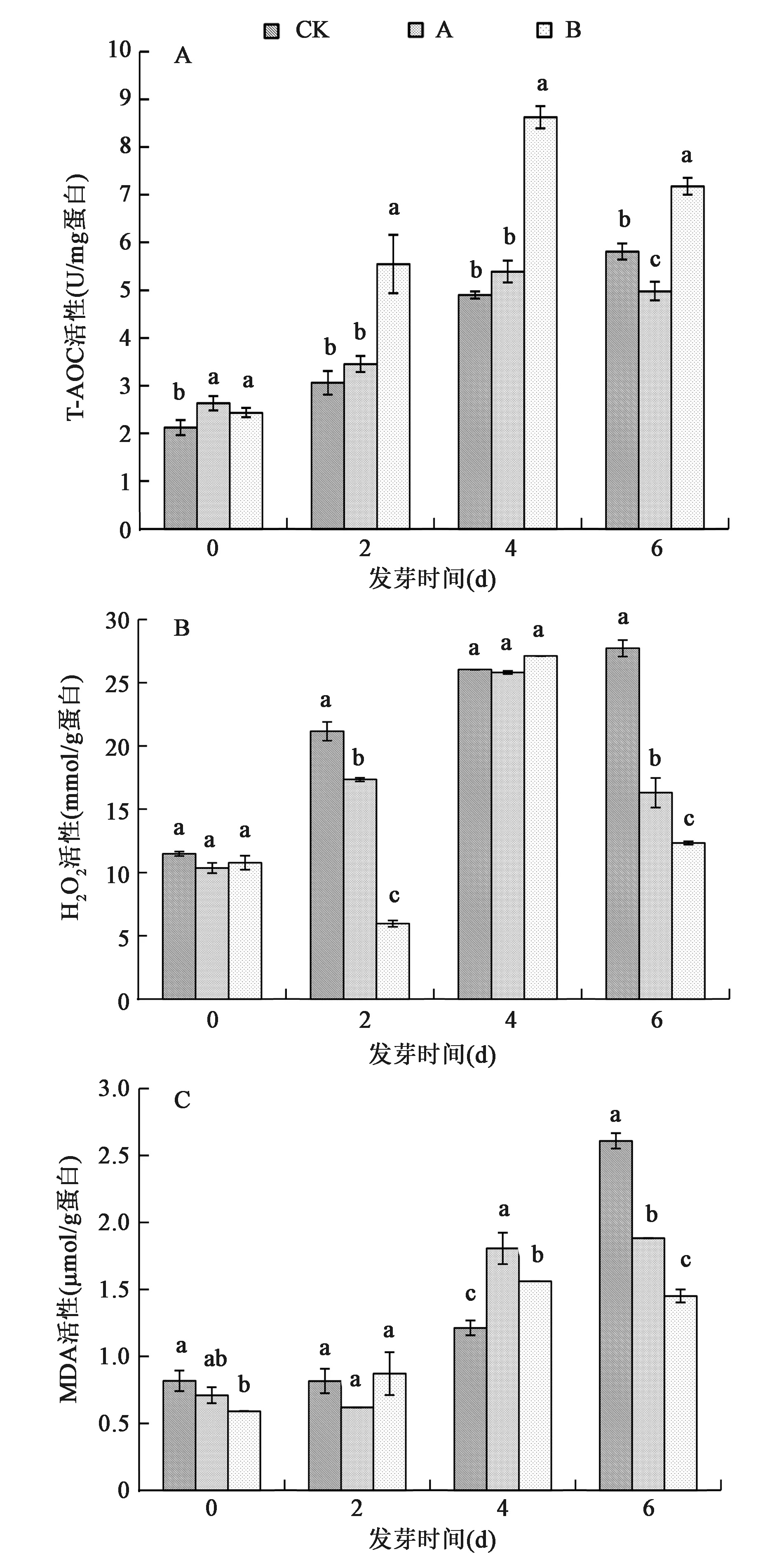
图2 发芽过程中T-AOC、H2O2、MDA变化特征(Duncan test,P<0.05)Fig.2 T-AOC, H2O2 and MDA changes during wheat germination (Duncan test, P<0.05).注:同一图中同一发芽时间的不同处理中的不同字母表示差异显著(P<0.05)。A.T-AOC; B.H2O2; C.MDA。
总体而言,对照组CK、低硒组A和高硒组B的整体发芽率在70%~80%之间,发芽率并不高,这可能与新收获小麦籽粒存在休眠期有关[23];但是,低硒组A(硒含量5.245 μg/g)的发芽率显著高于其余两组,这表明小麦籽粒中适宜浓度的硒可能有助于提高小麦的发芽率。此外,低硒组A中的硒形态主要是硒代蛋氨酸(SeMet),而高硒组B中的硒形态主要是硒代蛋氨酸(SeMet)和硒代胱氨酸(SeCys2),较为复杂,而且在发芽过程中低硒组A中的硒形态和占比基本维持不变,但高硒组B中的硒代氨基酸比例出现明显下降,很可能是由于SeCys2在发芽过程中代谢转化为甲基化物(如:硒甲基硒代半胱氨酸SeMeCys)挥发而导致的[24]。
有研究显示硒的存在能够提高淀粉的代谢活力、维持细胞膜的稳定性[6]和细胞的完整性[25],对小麦的发芽过程具有积极作用[26]。硒能够对植物的抗氧化酶系统产生影响,外源硒的添加能够增强GSH-Px酶活力、降低脂质过氧化物的含量[27~29],同时也能够提高SOD酶的活力[5,30]以清除超氧自由基。本研究中低硒组A和高硒组B的GSH-Px、SOD活力显著高于对照组CK,从而导致其在清除发芽过程中产生的H2O2和O2-的能力显著优于对照组。但是,在本研究过程中发现硒含量越高,其GSH-Px活力越强,且发芽过程中GSH-Px活力整体呈上升趋势,而SOD酶活力却整体呈下降趋势,这与Wang等[5]的研究结果不同,可能是因为Wang等的研究是通过添加外源无机硒(Na2SeO3)来研究花生的发芽过程,与本研究中的经过硒生物营养强化转化的内源硒在作物发芽过程中的代谢方式不同所导致的。同时,本研究中较高活力的GSH-Px酶的表达可以有效的清除H2O2和脂质过氧化物,减少O2-的产生,从而可能降低了对SOD的需求[31]。总体而言,发芽后期(第4~6天)麦芽体内的H2O2和MDA含量与未发芽籽粒相比均有明显增加,表明发芽过程中产生了大量活性氧,会对蛋白质等生物大分子以及细胞结构产生氧化损伤[32, 33]。但本研究中的小麦发芽的第2天和第6天,麦芽体内H2O2含量与硒含量呈负相关,且在发芽第6天时MDA含量与H2O2变化一致,这表明经过生物营养强化后在籽粒中存在的内源硒能够有效调节发芽过程中的生长状态并降低由硒引起的氧化胁迫[5]。
综上所述,硒生物营养强化小麦在发芽过程中籽粒中适宜浓度的内源硒有助于提高小麦发芽率、增强α-淀粉酶的活力、通过影响酶(GSH-Px、SOD)和非酶系统提高机体的总抗氧化能力(T-AOC)、降低发芽过程中的H2O2和MDA的积累。但是,硒生物营养强化籽粒中的内源有机硒是如何在发芽过程中从籽粒向不同组织部位转移和转化的,以及如何通过发芽工艺开发硒生物营养强化小麦制品等工作尚需进一步探究。
[1] Terry N, Zayed A M, de Souza M P,etal.. Selenium in higher plants[J]. Annu. Rev. Plant Phys.,2000,51(1):401-432.
[2] Hartikainen H. Biogeochemistry of selenium and its impact on food chain quality and human health[J]. J. Trace Elem. Med. Biol., 2005,18(4):309-318.
[3] El-Ramady H, Abdalla N, Alshaal T,etal.. Selenium and its role in higher plants[A].In: Pollutants in Buildings, Water and Living Organisms[M]. Berlin: Springer, 2015,235-296.
[4] Chen C C, Sung J M. Priming bitter gourd seeds with selenium solution enhances germinability and antioxidative responses under sub-optimal temperature[J]. Physiol. Plantarum., 2001,111(1):9-16.
[5] Wang G, Zhang H, Lai F,etal.. Germinating peanut (ArachishypogaeaL.) seedlings attenuated selenite-induced toxicity by activating the antioxidant enzymes and mediating the ascorbate-glutathione cycle[J]. J. Agric. Food Chem., 2016,64(6):1298-1308.
[6] Khaliq A, Aslam F, Matloob A,etal.. Seed priming with selenium: Consequences for emergence, seedling growth, and biochemical attributes of rice[J]. Biol. Trace Elem. Res., 2015,166(2):236-244.
[7] Nawaz F, Ashraf M Y, Ahmad R,etal.. Selenium (Se) seed priming induced growth and biochemical changes in wheat under water deficit conditions[J]. Biol. Trace Elem. Res., 2013,151(2):284-293.
[8] Nawaz F, Ashraf M Y, Ahmad R,etal.. Selenium (Se) regulates seedling growth in wheat under drought stress[J]. Adv. Chem. Ser.,2014 (3): 670-675.
[9] Chu J, Yao X, Zhang Z. Responses of wheat seedlings to exogenous selenium supply under cold stress[J]. Biol. Trace Elem. Res., 2010,136(3):355-363.
[10] Yao X, Chu J, Ba C. Antioxidant responses of wheat seedlings to exogenous selenium supply under enhanced ultraviolet-B[J]. Biol. Trace Elem. Res., 2010,136(1):96-105.
[11] Boldrin P F, Faquin V, Ramos S J,etal.. Soil and foliar application of selenium in rice biofortification[J]. J. Food Compos. Anal., 2013,31(2):238-244.
[12] Broadley M R, White P J, Bryson R J,etal.. Biofortification of UK food crops with selenium[J]. Proc. Nutr. Soc., 2006,65(2):169-181.
[13] Hawkesford M J, Zhao F. Strategies for increasing the selenium content of wheat[J]. J. Cereal Sci., 2007,46(3):282-292.
[15] Combs G F. Selenium in global food systems[J]. Brit. J. Nutr., 2001,85(5):517-547.
[16] Lyons G, Stangoulis J, Graham R. High-selenium wheat: Biofortification for better health[J]. Nutr. Res. Rev., 2003, 16(1): 45-60.
[17] Lyons G, Ortiz-Monasterio I, Stangoulis J,etal.. Selenium concentration in wheat grain: Is there sufficient genotypic variation to use in breeding [J]. Plant Soil,2005,269(1-2):369-380.
[18] Lyons G H, Lewis J, Lorimer M F,etal.. High-selenium wheat: Agronomic biofortification strategies to improve human nutrition[J]. J. Food Agric. Environ., 2004,22(1):171-178.
[19] Cubadda F, Aureli F, Ciardullo S,etal.. Changes in selenium speciation associated with increasing tissue concentrations of selenium in wheat grain[J]. J. Agric. Food Chem., 2010,58(4):2295-2301.
[20] Gao J, Liu Y, Huang Y,etal.. Daily selenium intake in a moderate selenium deficiency area of Suzhou, China[J]. Food Chem., 2011,126(3):1088-1093.
[21] Yuan L X, Zhu Y Y, Lin Z Q,etal.. A novel selenocystine-accumulating plant in selenium-mine drainage area in Enshi, China[J]. PLoS ONE, 2013,8:e656156.
[22] Mazej D, Falnoga I, Veber M,etal.. Determination of selenium species in plant leaves by HPLC-UV-HG-AFS[J]. Talanta, 2006, 68 (3): 558-568.
[23] Kashiwakura Y, Kobayashi D, Jikumaru Y,etal.. Highly sprouting-tolerant wheat grain exhibits extreme dormancy and cold imbibition-resistant accumulation of abscisic acid[J]. Plant Cell Physiol., 2016,57(4):715-732.
[24] Pilon-Smits E A, Quinn C F. Selenium metabolism in plants[A].In:Cell Biology of Metals and Nutrients[M]. Berlin: Springer, 2010,225-241.
[25] Feng R, Wei C, Tu S. The roles of selenium in protecting plants against abiotic stresses[J]. Environ. Exp. Bot., 2013,87:58-68.
[26] Akladious S A. Influence of different soaking times with selenium on growth, metabolic activities of wheat seedlings under low temperature stress[J]. Afr. J. Biotechnol., 2012,11(82):14792-14804.
[27] Cartes P, Gianfreda L, Mora M L. Uptake of selenium and its antioxidant activity in ryegrass when applied as selenate and selenite forms[J]. Plant Soil, 2005,276(1-2):359-367.
[28] Djanaguiraman M, Devi D D, Shanker A K,etal.. Seleninm-an antioxidative protectant in soybean during senescence[J]. Plant Soil,2005,272(1-2):77-86.
[29] Xue T, Hartikainen H, Piironen V. Antioxidative and growth-promoting effect of selenium on senescing lettuce[J]. Plant Soil, 2001,237(1):55-61.
[30] Seppänen M, Turakainen M, Hartikainen H. Selenium effects on oxidative stress in potato[J]. Plant Sci., 2003,165(2):311-319.
[31] Hartikainen H, Xue T, Piironen V. Selenium as an anti-oxidant and pro-oxidant in ryegrass[J]. Plant Soil, 2000,43(225):193-200.
[32] Fu J, Huang B. Involvement of antioxidants and lipid peroxidation in the adaptation of two cool-season grasses to localized drought stress[J]. Environ. Exp. Bot.,2001,45(2):105-114.
[33] Ríos J J, Blasco B, Cervilla L M,etal.. Production and detoxification of H2O2in lettuce plants exposed to selenium[J]. Ann. Appl. Biol., 2009,154(1):107-116.
StudyonPhysiologicalCharacterizationofSelenium-biofortifiedWheatDuringGermination
MA Lijia1, ZHANG Zezhou1,2, YUAN Linxi1*, YIN Xuebin3*
1.JiangsuBio-engineeringResearchCentreofSelenium,JiangsuSuzhou215123,China; 2.StateKeyLaboratoryofBiogeologyandEnvironmentalGeology,ChinaUniversityofGeosciences,Wuhan430074,China; 3.SuzhouInstituteforAdvancedStudies,UniversityofScienceandTechnologyofChina,JiangsuSuzhou215123,China
The selenium (Se)-biofortified wheat cultivar, Yangmai 16, with low-Se level A (5.245 μg Se/g), high-Se level B (47.850 μg Se/g) and control group CK (0.039 μg Se/g) were selected to germinate, and the germination parameters (root length, sprout length and germination rate), the total Se contents and Se species, and the physiological metabolism activities (AMS, GSH-Px, SOD, T-AOC, H2O2, MDA) were monitored during the different germination phases. The results revealed that there were no differences on root length and sprout length among the three groups, but increased germination rates could be observed with moderate Se contents in wheats. SeMet could be transformed into SeCys2in high-Se level B during germination. Moreover, the biofortified Se in group A and B could obviously improve the activities of AMS, GSH-Px and SOD, increase the capacity of T-AOC, and reduce the accumulation of H2O2and MDA.
selenium biofortification; wheat; germination; GSH-Px; T-AOC
2017-07-30;接受日期2017-08-22
国家自然科学基金项目(31400091)资助。
马丽佳,硕士,研究方向为硒生物营养强化。E-mail:malijia@163.com。*通信作者:袁林喜,研究员,博士,研究方向为生物营养强化与应用。E-mail: yuanlinxi001@gmail.com;尹雪斌,副教授,博士,研究方向为功能农业研究与开发。E-mail: xbyin@ustc.edu.cn
10.19586/j.2095-2341.2017.0096
