恩替卡韦治疗慢性乙型肝炎纤维化的有效性和安全性观察
2017-11-23张晓艳张海涛杨立新孟娟龚春燕
张晓艳,张海涛,杨立新,孟娟,龚春燕
(1.唐山市传染病医院肝病科,河北 唐山 063020;2.唐山市第二医院医保科,河北 唐山 063000;3.唐山市铁路中心医院内科,河北 唐山 063003)
·临床经验·
恩替卡韦治疗慢性乙型肝炎纤维化的有效性和安全性观察
张晓艳1,张海涛1,杨立新1,孟娟2,龚春燕3
(1.唐山市传染病医院肝病科,河北 唐山 063020;2.唐山市第二医院医保科,河北 唐山 063000;3.唐山市铁路中心医院内科,河北 唐山 063003)
目的 分析恩替卡韦治疗慢性乙型肝炎(CHB)对患者细胞因子和肝纤维化的影响,探究恩替卡韦对CHB的治疗价值。方法 选取我院2013年2月至2015年10月诊治的180例CHB患者根据抗病毒治疗方案分为恩替卡韦组(使用恩替卡韦,n=90)和对照组(使用聚乙二醇干扰素,n=90),检测用药前后两组患者血清细胞因子、肝纤维化、病毒动力学以及药物不良反应情况,对比两种药物的治疗价值。结果 ①用药后12周恩替卡韦组IL-4(55.34±8.87)pg/mL、IL-6(30.91±8.03)pg/mL、TNF-α(39.93±5.81)pg/mL、TGF-β(11.42±3.05)pg/mL、hs-CRP(10.76±4.01)pg/mL、HA(142.79±28.64)ng/mL、LN(172.85±30.26)ng/mL、ⅣC(269.67±48.15)ng/mL、PCⅢ (166.77±40.46)ng/mL明显低于对照组,差异均有统计学意义(P<0.05);用药后24周、恩替卡韦组IL-4(41.63±7.19)pg/mL、IL-6(22.57±7.21)pg/mL、TNF-α(36.54±5.63)pg/mL、TGF-β(9.25±2.61)pg/mL、hs-CRP(7.19±3.67)pg/mL、HA(130.16±24.08)ng/mL、LN(144.64±28.72)ng/mL、ⅣC(218.67±34.85)ng/mL、PCⅢ(140.54±31.52)ng/mL明显低于对照组,差异均有统计学意义(P<0.05);用药后48周恩替卡韦组IL-4(35.37±6.24)pg/mL、IL-6(19.63±6.65)pg/mL、TNF-α(29.67±4.85)pg/mL、TGF-β(7.44±2.16)pg/mL、hs-CRP(6.14±3.15)pg/mL、HA(95.37±16.69)ng/mL、LN(130.14±23.26)ng/mL、ⅣC(164.28±32.06)ng/mL、PCⅢ (130.98±26.84)ng/mL明显低于对照组,差异均有统计学意义(P<0.05);②用药后24周,恩替卡韦组病毒学应答率(88.89%)、完全应答率(88.89%)明显高于对照组,差异均有统计学意义(P<0.05),用药后48周,恩替卡韦组病毒学应答率(92.22%)、完全应答率(94.44%)明显高于对照组,差异均有统计学意义(P<0.05);③恩替卡韦组不良反应率(14.44%)显著低于对照组(28.89%),组间差异具有统计学意义(P<0.05)。结论 恩替卡韦治疗CHB能够明显降低血清炎性因子表达水平,改善肝纤维化和病毒应答情况,且药物副作用少,建议临床加以重视。
慢性乙型肝炎;恩替卡韦;炎症因子;肝纤维化;病毒应答
乙型肝炎病毒(hepatitis B virus,HBV)感染是导致慢性乙型肝炎(chronic hepatits B,CHB)的主要原因[1-4],CHB的发生机理为HBV诱导的免疫损伤,其具有传染性。HBV能够对机体免疫功能造成攻击,最终的结局是发生肝硬化、肝癌等严重威胁生命安全的疾病,因此,积极防治CHB极为重要。抗病毒治疗能够通过阻断病毒复制过程而清除HBV,并减轻HBV诱导的炎症反应,是可以延缓或部分逆转肝纤维化的发生的,因此,合理选择抗病毒方案对治疗效果极为重要。恩替卡韦作为CHB治疗新药,已经被证实对CHB具有确切疗效[5-7]。本文从细胞学、病毒动力学层次上观察恩替卡韦对CHB患者的干预效果,旨在探究恩替卡韦治疗CHB的可能机制,现总结如下:
1 资料与方法
1.1 一般资料
1.1.1 资料来源 本组病例全部来自于河北省唐山市传染病医院,为我院于2013年2月至2015年10月间遵守规范治疗的初治CHB患者180例,根据抗病毒治疗方案分为恩替卡韦组(使用恩替卡韦,n=90)和对照组(使用聚乙二醇干扰素,n=90)。
1.1.2 入选标准 ①经过乙肝五项等全面检查,证实达到《慢性乙型肝炎防治指南》(由中华医学会研究并制定)中CHB诊断条件[8],明确诊断为CHB,且HBV无耐药位点变异;②患者年龄在18~60岁之间;③肝脏组织学评分不低于S2;④Fibro Scan测定相应肝脏硬度值不低于7.2 kPa;⑤肝组织出现明显肝纤维化改变,肝纤维化指标高出正常范围;⑥能够配合治疗和随访,用药规范且随访资料完整;⑦患者具有正常智力和理解能力,知情同意自愿参加。
1.1.3 排除标准 ①合并肝衰竭、意识不清等重症疾病者;②其他类型肝炎;③存在肝硬化、心脏病、恶性肿瘤、肾功能损伤等其他病种;④6个月内进行过肝炎相关治疗,或使用过抗病毒类、影响免疫功能的药物;⑤存在相关药物禁忌;⑥妊娠、高龄、哺乳等特殊群体。
1.2 治疗方法 患者在入院后均接受西医常规护肝、抗病毒治疗;对照组同时用干扰素(Schweiz Roche Pharma Ltd,国药准字 J20120075,生产批号120821、150122)治疗,给药方法和剂量为:每次皮下注射180 μg,每周1次,连用48周;恩替卡韦组同时用恩替卡韦(南京正大天晴制药有限公司,国药准字H20120038,生产批号1210223、1502142),给药方法和剂量为:每次口服0.5 mg,1次/d,连用48周。
1.3 观察指标 在用药前后不同时间监测血清细胞因子、肝纤维化指标以及病毒动力学指标,同时准确记录用药期间药物相关不良反应。
1.3.1 血清细胞因子监测 在用药前、用药后12周、24周以及48周时分别抽取外周血,对血清白细胞介素-4(Interleukin-4,IL-4)、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、转化生长因子-β(transforming growth factor-β,TGF-β)以ELISA法进行定量分析,对超敏C反应蛋白(high sensitive C reactive protein,hs-CRP)以透射比浊法进行定量分析,实验所有试剂盒均由深圳匹基生物工程公司提供。
1.3.2 肝纤维化指标检测 在用药前、用药后12周、24周、48周时采集外周静脉采血,以放射免疫法检测透明质酸(hyaluronic acid,HA)、层黏蛋白(laminin,LN)、Ⅳ型胶原(Type IV collagen,ⅣC)、Ⅲ型前胶原肽(type III collagen peptide,PCⅢ)等肝纤维化评价指标,实验试剂盒由上海恒远公司提供。
1.3.3 病毒动力学评价 在用药前、用药后24周和48周时利用PCR仪器分别对HBVDNA进行定量分析,参照文献报道,根据HBVDNA变化进行病毒动力应答情况评价,其中完全应答指HBV DNA低于1 000 co/mL,且肝功能正常;病毒学应答值HBV DNA减少幅度在10 000 co/mL以上[9]。
1.4 统计学方法 实验结果以双录入成立电子集且核查准确后,以SPSS.17.0程序作为统计分析工具,计量资料组间对比采用独立t检验,组内重复测量对比采用重复测量方差分析,组间计数资料采用χ2检验;P<0.05为差异具有统计学意义。
2 结 果
2.1 两组患者一般资料比较 经过对患者年龄和性别、病程、基线HBVDNA等基线相关情况进行分析,结果发现,两组基线资料差异无统计学意义(P>0.05),见表1。
表1 两组患者一般资料比较(-±s)
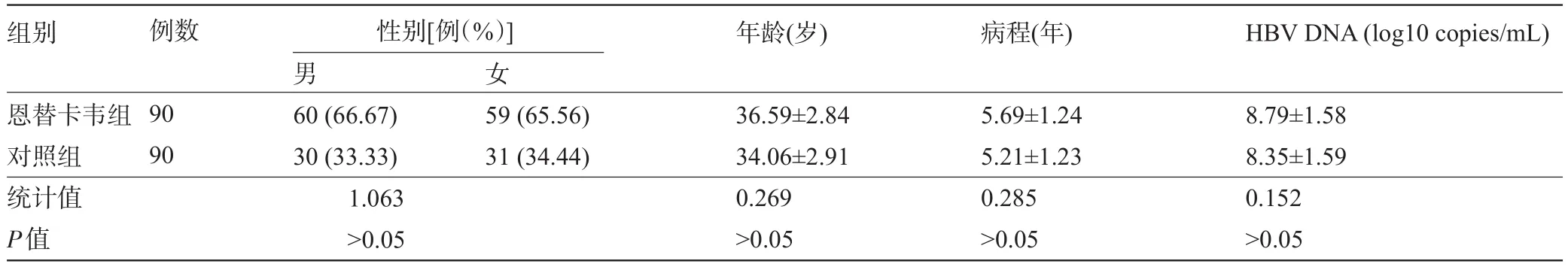
表1 两组患者一般资料比较(-±s)
组别 例数 性别[例(%)]男女年龄(岁)病程(年)HBV DNA(log10 copies/mL)恩替卡韦组对照组统计值P值90 90 60(66.67)30(33.33)59(65.56)31(34.44)1.063>0.05 36.59±2.84 34.06±2.91 0.269>0.05 5.69±1.24 5.21±1.23 0.285>0.05 8.79±1.58 8.35±1.59 0.152>0.05
2.2 两组患者血清细胞因子动态监测结果比较 用药前,两组血清IL-4、IL-6、TNF-α、TGF-β以及hs-CRP均为显著高表达,组间差异无统计学意义(P>0.05),与用药前比较,在用药后两组患者的血清IL-4、IL-6、TNF-α、TGF-β以及hs-CRP明显下降,差异均有统计学意义(P<0.05),且随着治疗时间的延长,IL-4、IL-6、TNF-α、TGF-β以及hs-CRP不断向正常范围下降,其中在治疗后相同检测点,恩替卡韦组下降效果明显优于对照组差异均有统计学意义(P<0.05),见表2。
2.3 两组患者肝纤维化指标动态监测结果比较 用药前,所有患者的肝纤维化指标均为高表达差异均有统计学意义(P>0.05),用药后,两组肝纤维化指标表达水平显著降低差异均有统计学意义(P>0.05),且随着用药时间的推移,肝纤维化指标不断趋于好转,而且在治疗后相同时间,恩替卡韦组纤维化四项指标的改善效果优于对照组差异均有统计学意义(P<0.05),见表3。
2.4 两组患者病毒动力学比较 在治疗后,各组中大部分患者出现病毒应答,在治疗后相同检测点,恩替卡韦组病毒应答结果明显高于对照组差异均有统计学意义(P<0.05),见表4。
2.5 两组患者药物副反应比较 恩替卡韦组和对照组全部出现了药物不良反应,两组均以流感样综合征、消化系统反应、皮肤反应等为主要副反应,恩替卡韦组中并发症出现了13例(14.44%),对照组中并发症出现了26例(28.89%),组间差异具有统计学意义(χ2=10.263,P<0.05)。
表2 两组患者间血清细胞因子动态监测结果比较(±s)
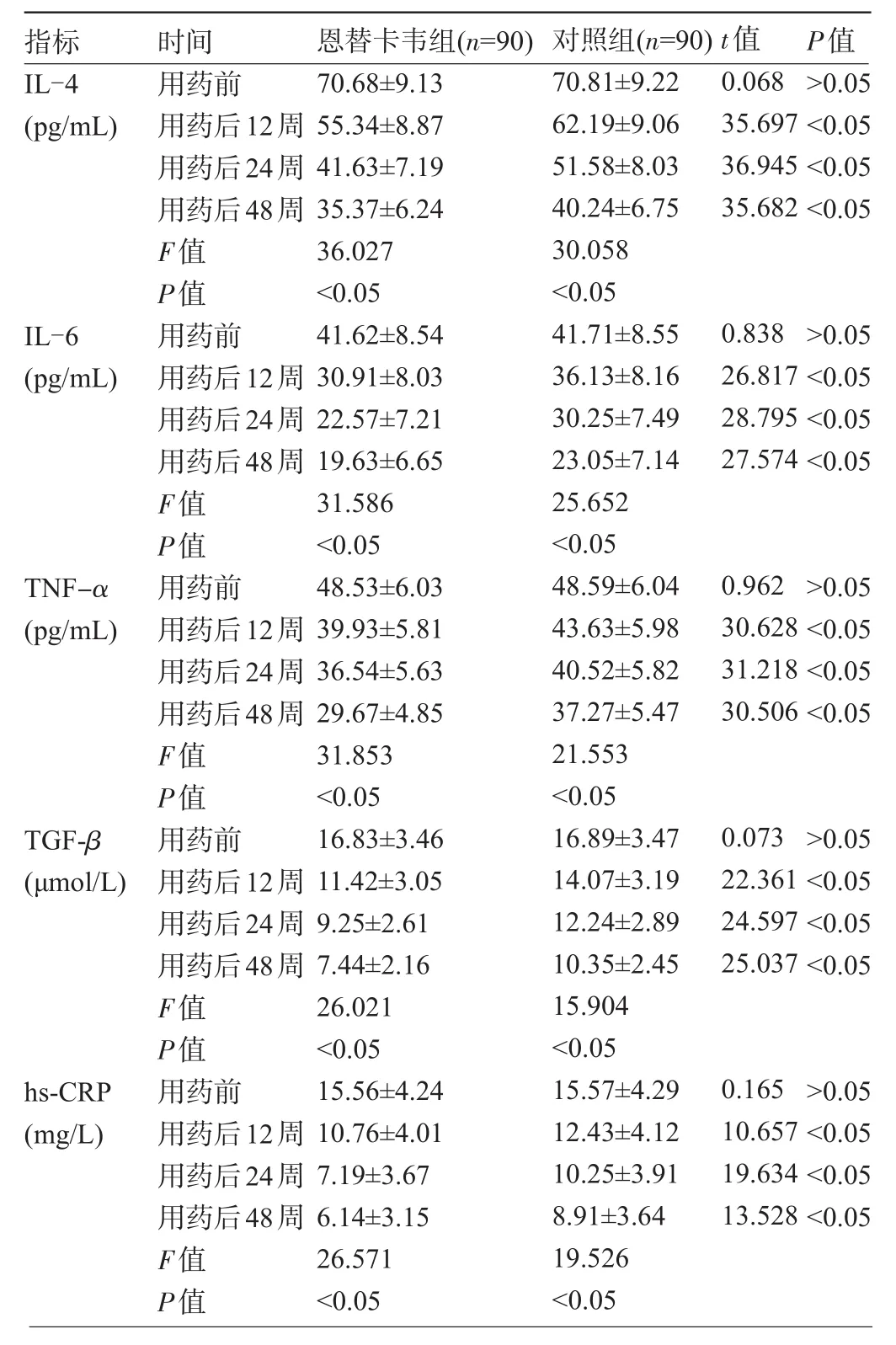
表2 两组患者间血清细胞因子动态监测结果比较(±s)
指标 时间 恩替卡韦组(n=90)对照组(n=90)t值P值IL-4(pg/mL)IL-6(pg/mL)TNF-α(pg/mL)TGF-β(μmol/L)hs-CRP(mg/L)用药前用药后12周用药后24周用药后48周F值P值用药前用药后12周用药后24周用药后48周F值P值用药前用药后12周用药后24周用药后48周F值P值用药前用药后12周用药后24周用药后48周F值P值用药前用药后12周用药后24周用药后48周F值P值70.68±9.13 55.34±8.87 41.63±7.19 35.37±6.24 36.027<0.05 41.62±8.54 30.91±8.03 22.57±7.21 19.63±6.65 31.586<0.05 48.53±6.03 39.93±5.81 36.54±5.63 29.67±4.85 31.853<0.05 16.83±3.46 11.42±3.05 9.25±2.61 7.44±2.16 26.021<0.05 15.56±4.24 10.76±4.01 7.19±3.67 6.14±3.15 26.571<0.05 70.81±9.22 62.19±9.06 51.58±8.03 40.24±6.75 30.058<0.05 41.71±8.55 36.13±8.16 30.25±7.49 23.05±7.14 25.652<0.05 48.59±6.04 43.63±5.98 40.52±5.82 37.27±5.47 21.553<0.05 16.89±3.47 14.07±3.19 12.24±2.89 10.35±2.45 15.904<0.05 15.57±4.29 12.43±4.12 10.25±3.91 8.91±3.64 19.526<0.05 0.068 35.697 36.945 35.682 0.838 26.817 28.795 27.574 0.962 30.628 31.218 30.506 0.073 22.361 24.597 25.037 0.165 10.657 19.634 13.528>0.05<0.05<0.05<0.05>0.05<0.05<0.05<0.05>0.05<0.05<0.05<0.05>0.05<0.05<0.05<0.05>0.05<0.05<0.05<0.05
表3 两组患者间肝纤维化指标动态监测结果比较(±s)

表3 两组患者间肝纤维化指标动态监测结果比较(±s)
指标HA(ng/mL)LN(ng/mL)ⅣC(ng/mL)PCⅢ(ng/mL)时间用药前用药后12周用药后24周用药后48周F值P值用药前用药后12周用药后24周用药后48周F值P值用药前用药后12周用药后24周用药后48周F值P值用药前用药后12周用药后24周用药后48周F值P值恩替卡韦组(n=90)199.53±35.72 142.79±28.64 130.16±24.08 95.37±16.69 22.597<0.05 255.62±36.94 172.85±30.26 144.64±28.72 130.14±23.26 25.492<0.05 345.65±51.78 269.67±48.15 218.67±34.85 164.28±32.06 23.594<0.05 276.78±54.18 166.77±40.46 140.54±31.52 130.98±26.84 21.564<0.05对照组(n=90)199.61±36.81 172.81±29.83 148.62±25.92 126.47±20.84 29.468<0.05 254.76±36.78 211.87±30.48 175.47±29.17 165.83±26.43 31.845<0.05 346.81±51.82 307.67±48.95 261.37±41.53 211.13±39.01 26.958<0.05 276.26±54.21 214.81±45.67 184.67±35.98 169.78±30.61 29.335<0.05 t值15.975 16.454 21.891 17.598 16.592 18.924 14.569 13.591 12.892 23.841 31.598 42.978 31.598 24.824 26.569 17.564 P值>0.05<0.05<0.05<0.05>0.05<0.05<0.05<0.05>0.05<0.05<0.05<0.05>0.05<0.05<0.05<0.05
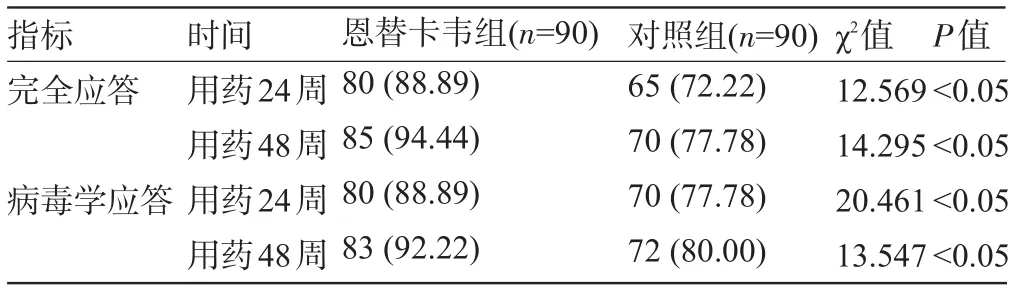
表4 两组间病毒动力学变化[例(%)]
3 讨 论
我国属于病毒性肝炎易感国家之一,据中国卫生部统计,我国的病毒性肝炎发病总人数已经超过130万,其作为甲乙类法定传染病发病榜的首位病种,死亡率也处于较高水平。近年来,有研究发现不仅病毒复制能够导致CHB疾病进展,而且炎症反应在CHB病变过程中具有重要影响[10-11]。炎症反应引发体内炎症因子呈瀑布样释放,降低机体免疫耐受能力和清除病毒的能力,是肝炎持续恶化的关键性因素。因此,抑制炎症反应被认为对CHB恢复具有促进作用。在本实验中,在治疗前,两组患者的血清炎性因子表达显著高于正常,也证明了目前多数CHB患者多存在着明显的炎症反应。
CHB疾病进展最重要、危害性最大的就是肝纤维化,由于HBV复制不间断进行,且不具有自控性。因此,该病毒能够导致大量正常肝细胞遭受侵袭而使肝脏病变程度不断加重。本研究中,治疗前两组患者肝纤维化指标明显异常,也证明了CHB患者多存在着肝纤维化病理改变,因此,在抗病毒治疗的同时,逆转肝纤维化、减轻炎症对于CHB预后极为重要。
恩替卡韦作为现已批准上市的核苷类似物类生物制剂,能够通过阻断病毒启动、转录过程而阻断病毒复制,从而不断清除HBV、发挥抗CHB效应,而且由于其具有高度耐药性屏障,多数CHB患者对恩替卡韦具有较高的敏感性。目前国外研究均发现恩替卡韦能够改善CHB的预后,可将其作为CHB首选治疗药物[12-15]。但是目前国内关于CHB血清炎性因子、肝纤维化、病毒动力学的研究并不多见,基于此,本文通过对比干扰素、恩替卡韦对于CHB患者血清炎性因子、肝纤维化、病毒动力学作用成果进行对比,旨在为临床防治CHB作出贡献。本研究结果发现,与传统干扰素治疗比较,恩替卡韦组的IL-4、IL-6、TNF-α、TGF-β、hs-CRP、HA、LN、ⅣC、PCⅢ改善效果更为显著,而且恩替卡韦组病毒学应答、完全应答情况显著高于对照组,药物不良反应明显低于对照组,说明虽然恩替卡韦与干扰素均能够产生抑制炎症效应、拮抗肝纤维化、病毒免疫应答的效果,但是恩替卡韦的作用效果明显更胜一筹,且其药物安全性更为可靠,考虑上述结果与恩替卡韦特殊的生物学效应有关。而干扰素虽然能够拮抗乙肝病毒,但是其不良反应,对机体副作用较大。除此之外,本实验发现,乙肝患者用药48周的效果明显优于用药12周和24周时,说明CHB作为慢性疾病,其治疗疗程较长,为了保障临床疗效,建议疗程不低于48周。由于实验中诸多条件限制,未能对高龄患者疗效进行分析,且未涉及免疫功能、肝功能指标检测,仍有不完全之处。
综上所述,恩替卡韦能够有效提升应答效果,对于CHB具有良好治疗作用,考虑作用途径可能与调节炎症因子表达、调节病毒动力、逆转肝纤维化有关。
[1]Martin P,Lau TY,Nguyen MH,et al.A treatment algorithm for the management of chronic hepatitis B virus infection in the United States:2015 Update[J].Clin Gastroenterol Hepatol,2015,13(12):2071-2087.
[2]Shin SH,Kim SU,Park JY,et al.Liver stiffness-based model for prediction of hepatocellular carcinoma in chronic hepatitis B virus infection:comparison with histological fibrosis[J].Liver Int,2014,35(3):1054-1062.
[3]周红萍,严俊,陈晓瑾,等.慢性乙型肝炎患者恩替卡韦治疗的临床疗效观察[J].中华医院感染学杂志,2014,24(17):4237-4239.
[4]张中琴,顾亭亭.拉米夫定与恩替卡韦治疗HBeAg阴性的慢性B型病毒性肝炎[J].现代消化及介入诊疗,2013,18(4):245-247.
[5]Papatheodoridis GV,Manolakopoulos S,Touloumi G,et al.Hepatocellular carcinoma risk in HBeAg-negative chronic hepatitis B patients with or without cirrhosis treated with entecavir:HepNet.Greece cohort[J].J Viral Hepat,2014,22(2):120-127.
[6]Arends P,Sonneveld MJ,Zoutendijk R,et al.Entecavir treatment does not eliminate the risk of hepatocellular carcinoma in chronic hepatitis B:limited role for risk scores in Caucasians[J].Gut,2015,64(8):1289-95.
[7]杨年欢,袁国盛,周宇辰,等.恩替卡韦联合复方鳖甲软肝片治疗慢性乙型肝炎肝纤维化96周的临床疗效[J].南方医科大学学报,2016,36(6):775-779.
[8]中华医学会肝病学分会.慢性乙型肝炎防治指南(2015更新版)[S].中华传染病杂志,2015,33(11):641-662.
[9]官亮,邓欢,龚辉,等.恩替卡韦联合胸腺法新对HBeAg阴性慢性乙型肝炎患者病毒动力学的影响[J].中国老年学杂志,2014,34(23):6791-6792.
[10]程海军,成军,王兰舟,等.恩替卡韦治疗慢性乙型肝炎患者血清IL-4和IL-10水平变化[J].中西医结合肝病杂志,2014,24(2):114-115.
[11]艾买提江·司马义,买木热·肉孜.恩替卡韦对慢性乙型肝炎患者细胞因子和肝纤维化指标的影响[J].基层医学论坛,2013,17(23):3049-3050.
[12]张瑞凤,姚云洁,游忠岚,等.复方鳖甲软肝片联合恩替卡韦治疗慢性乙型肝炎肝纤维化的观察[J].第三军医大学学报,2014,36(18):1961-1963.
[13]Hou JL,Jia JD,Wei L,et al.Efficacy and safety of entecavir treatment in a heterogeneous CHB population from a‘real-world'clinical practice setting in China[J].J Viral Hepat,2013,20(11):811-820.
[14]Lee SW,Kwon JH,Kim YW,et al.FRI-145-delayed serologic response in multi-drug resistant CHB patients with tenofovir and eEntecavir combination therapy in real clinical practice[J].J Hepat,2016,64(2):S602-S603.
[15]Kang SH,Yim HJ,Kim HR,et al.Comparison of lamivudine plus adefovir therapy versus entecavir with or without adefovir therapy for adefovir-resistant chronic hepatitis B[J].J Clin Gastroenterol,2014,48(10):889-895.
R512.6+2
B
1003—6350(2017)21—3540—04
10.3969/j.issn.1003-6350.2017.21.031
河北省唐山市科技计划项目(编号:2014B156)
张海涛。E-mail:zouxiaocq@163.com
2017-03-04)
