反离子对部分电荷中和的聚乙烯亚胺接枝介质的蛋白质色谱行为的影响
2017-11-22翟秋红余林玲孙彦
翟秋红,余林玲,孙彦
(天津大学化工学院系统生物工程教育部重点实验室,天津 300072)
反离子对部分电荷中和的聚乙烯亚胺接枝介质的蛋白质色谱行为的影响
翟秋红,余林玲,孙彦
(天津大学化工学院系统生物工程教育部重点实验室,天津 300072)
前期研究表明部分电荷中和的聚乙烯亚胺接枝琼脂糖介质FF-PEI-R440具有较高静态吸附容量和快速传质速率。本文选取硫氰酸根离子、氯离子、磷酸氢根离子以及硫酸根离子这4种反离子,在离子强度为0.03、0.06 mol·L-1下,研究其对FF-PEI-R440吸附与洗脱行为的影响。结果表明:在两种离子强度下,饱和吸附容量的增加顺序均为在低离子强度下,除SCN-外,反离子种类对传质速率和动态结合容量没有显著影响;在高离子强度下,传质速率的增加顺序为而动态结合容量的增加顺序与饱和吸附容量序列一致;两种离子强度下 Cl-均保持最高的动态结合容量;反离子种类对蛋白质洗脱行为没有显著影响。上述结果说明反离子主要影响FF-PEI-R440的吸附性能,而不影响洗脱,且流动相中选择Cl-为反离子最利于FF-PEI-R440的实际柱色谱操作。
离子交换色谱;聚合物接枝;反离子;吸附平衡;动力学;动态结合容量;线性梯度洗脱
引 言
离子交换色谱(IEC)因其具有处理量大、分辨率高、对生物活性物质友好等优势,已被广泛应用于蛋白类药物的分离纯化[1-3]。为了提升IEC介质的吸附性能,研究者开发了聚合物接枝介质,它具有较高吸附容量和快速传质的优势[4-6]。
本课题组在前期工作中设计合成了一系列不同离子交换容量(IC,即接枝密度)的聚乙烯亚胺(PEI)接枝琼脂糖介质,并系统研究了其对牛血清蛋白(BSA)和γ-球蛋白的吸附行为[7-9],结果表明当介质的IC达到临界离子交换容量(cIC)时(分别为约 600 mmol·L-1和约 460 mmol·L-1),其对蛋白质的静态吸附容量和传质速率都出现大幅度提升。这是由于当 IC>cIC时,吸附位点拓展为三维空间有利于蛋白质吸附,从而增大了静态吸附容量;链间距缩短,灵活的相邻链可以通过摆动而接触,吸附在PEI链上的蛋白可以在介质孔入口和孔内部化学势梯度以及由吸附相蛋白介导的相邻柔性链之间相互作用的推动下从一条链传递到相邻的另一条链上,即在吸附相发生“链传递”作用,促进孔内传质[10-11]。另外,在较宽的盐浓度范围内,该介质仍能保持较好的吸附性能。
为了进一步研究接枝链电荷密度对传质速率的影响,本课题组利用乙酸钠修饰PEI接枝琼脂糖介质FF-PEI-L740(IC>cIC),通过部分中和PEI接枝链的正电荷,形成一系列具有不同接枝链电荷密度的介质[12]。研究发现,当接枝链的电荷密度降低到一定值时,即 FF-PEI-R440(R440,即介质经中和修饰后剩余的离子交换容量为440 mmol·L-1),介质吸附容量基本不变但吸附速率可提升3倍(表1)。这是源于接枝链的电荷密度降低后,蛋白分子与离子交换基团之间的结合强度减弱,促使“链传递”更容易发生[12]。此外,FF-PEI-R440在 0~50 mmol·L-1的盐浓度范围内仍具有较高的吸附容量和传质速率,且在30~150 cm·h-1的流速条件下保持较高的动态吸附容量。同时,由于该介质对离子强度较敏感,蛋白质可在较低离子强度下实现洗脱,其生物活性不易被破坏。因此,FF-PEI-R440是一种兼具优良吸附和洗脱性能的色谱介质,可应用于高流速下蛋白的快速吸附与洗脱,从而有利于保持蛋白分子活性。

表1 3种吸附剂在20 mmol·L-1 Tris-HCl,pH 8.0缓冲液中对BSA的吸附与传质参数Table 1 Langmuir parameters and effective diffusivities of BSA adsorption on different resins at 20 mmol·L-1 Tris-HCl,pH 8.0[12,17]
由于离子交换作用的实质即为反离子与蛋白质竞争结合于介质表面的离子交换配基,因而反离子的性质必然会影响蛋白质在离子交换色谱介质上的吸附与洗脱行为[13-15]。本课题组已研究了反离子对 PEI接枝介质 FF-PEI-L680(IC>cIC,L680,即接枝链电荷密度高的介质的离子交换容量)吸附与洗脱行为的影响,结果表明,与介质亲和性强的反离子由于更易于将蛋白质置换,因此会促进蛋白质在链间的传质(即发生“链传递”作用),加快传质并有利于蛋白洗脱[16]。FF-PEI-R440与FF-PEI-L680相比,前者接枝链中的部分氨基参与反应,接枝链的电荷密度降低到一定程度[17],配基结构和电荷分布差异如图1所示,蛋白与离子交换基团间的结合强度减弱,同时接枝链间作用也发生改变,因而反离子对“链传递”作用的影响可能不同,其对吸附与洗脱行为的影响需要进一步研究。
以FF-PEI-R440为研究对象,选取4种具有不同尺寸、带电量和水化能力的反离子:硫氰酸根、氯离子、磷酸氢根和硫酸根,以牛血清蛋白为模型蛋白,系统研究反离子对吸附平衡、吸附动力学、动态结合容量和线性梯度洗脱的影响,并与FF-PEI-L680做比较,以期揭示反离子在IEC过程中的作用并优化FF-PEI-R440的吸附与洗脱条件。
1 材料和方法
1.1 实验材料

图1 不同介质的配基结构和电荷分布差异Fig.1 Scheme of ligand chemistry and charge distribution of different resins
牛血清白蛋白(BSA,Mw66.4 kD, 96%)购置于Sigma-Aldrich(St. Louis, USA),根据其消光系数EmM(280 nm) =45.5[18]计算浓度。FF-PEI-R440来源于本课题组前期工作(对FF-PEI-L740减电荷修饰)[12],其吸附参数见表1。另外,由于FF-PEI-R440的出发介质FF-PEI-L740与FF-PEI-L680吸附性能相似(表1)[10,17],两者在本文被视为同种介质,用于与 FF-PEI-R440比较。氯化钠(NaCl)、硫酸钠(Na2SO4)、硫氰酸钠(NaSCN)、二甲基亚砜(DMSO)购置于天津市江天化工科技开发公司。磷酸二氢钠(NaH2PO4)、磷酸氢二钠(Na2HPO4)、三羟甲基氨基甲烷(Tris)购置于上海生工生物工程有限公司。试剂均为分析纯,且直接使用未经进一步提纯。由于25℃时磷酸的三级解离常数分别为2.16、7.21和12.32[19],在pH为8的添加磷酸盐的缓冲液中主要阴离子为HPO42-,因此本文以HPO4
2-代表磷酸盐缓冲液中反离子,不考虑H2PO4-。4 种反离子的性质参见表2[16,20]。

表2 反离子的基本性质Table 2 Properties of counterions used in this work[16,20]
针对反离子影响的研究均在相同离子强度(0.03或0.06 mol·L-1)下进行,离子强度(I)通过式(1)计算

式中,ci为缓冲液中某离子的摩尔浓度,mol·L-1;Zi为该离子的电荷数;ITris-HCl为 20 mmol·L-1Tris-HCl,pH 8.0 缓冲液的离子强度,0.01 mol·L-1。即所有平衡缓冲液均以 20 mmol·L-1Tris-HCl,pH 8.0为基础,加入不同种类的钠盐而制得。利用电导率检测器测得的不同反离子缓冲液的电导率如表3所示。

表3 不同反离子缓冲液的电导率Table 3 Conductivity of buffer with different counterions
1.2 吸附等温线
吸附等温线通过间歇摇瓶法测定[7]:将用平衡缓冲液预平衡后的介质置于25 ml锥形瓶中,加入5 ml用同样缓冲液配制的BSA溶液(浓度为0.1~5 mg·ml-1)。将其置于 25℃水浴,在 170 r·min-1振荡24 h,取出后4000 r·min-1离心5 min,测定上清中的蛋白浓度。根据物料衡算计算介质吸附密度。利用Langmuir方程拟合吸附等温线

式中,qm为饱和吸附容量,mg·ml-1;Kd为解离常数,mg·ml-1;q为平衡时固相蛋白浓度(介质吸附密度),mg·ml-1;c为平衡时液相蛋白浓度,mg·ml-1。
1.3 吸附动力学
吸附动力学通过间歇搅拌法测定[7]:将100 ml以平衡缓冲液配制的1 mg·ml-1BSA溶液置于100 ml三口圆底烧瓶中,25℃,280 r·min-1搅拌。蛋白质溶液以20 ml·min-1的流速通过孔径为2 μm的不锈钢滤头注入紫外(UV)检测器并返回三口烧瓶,以实时检测蛋白溶液浓度。将一定量用平衡缓冲液预平衡介质加入三口烧瓶,并开始计时,获得液相蛋白质的浓度随时间变化的曲线。利用有效孔扩散模型分析吸附动力学数据[21],利用Matlab求解得到蛋白质在介质中的有效孔扩散系数(De)。
1.4 动态结合容量
动态结合容量的测定采用迎头分析法[17]:用重力沉降法将脱气介质注入 TricornTM(50×5 mm,I.D.)色谱柱,在ÄKTA purifierTM10色谱系统中经1.5 ml·min-1(450 cm·h-1)的流速形成固定的床层。床层体积为1.04 ml±0.03 ml。平衡色谱柱15个柱体积(CV),待 UV信号稳定后调零,上样蛋白(2 mg·ml-1)至 50%穿透。最终以 10%穿透计算蛋白质的动态吸附容量(DBC)
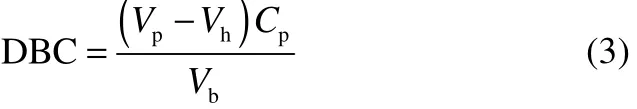
式中,Vp为达到10%穿透的上样体积,ml;Vh为系统死体积,ml;Vb为填充柱体积,ml;Cp为上样蛋白浓度,mg·ml-1。流速恒定为 0.5 ml·min-1。
1.5 线性梯度洗脱
利用Liu等[16]所用方法进行线性梯度洗脱,即平衡15CV后,上样2.5 ml蛋白(2 mg·ml-1),再清洗 2CV,然后以线性梯度从I0(0.03或 0.06 mol·L-1)经 10CV 至最终离子强度(IF=1.01 mol·L-1),再清洗 2CV,最后用 0.5 mol·L-1NaOH再生,流速恒定为0.5 ml·min-1。并根据洗脱峰和再生峰面积计算得出蛋白的回收率[22]。
2 结果与讨论
2.1 吸附平衡
不同反离子存在下,BSA在FF-PEI-R440上的吸附等温线结果如图2所示,通过Langmuir 吸附平衡方程拟合出的吸附容量和解离常数见表4。
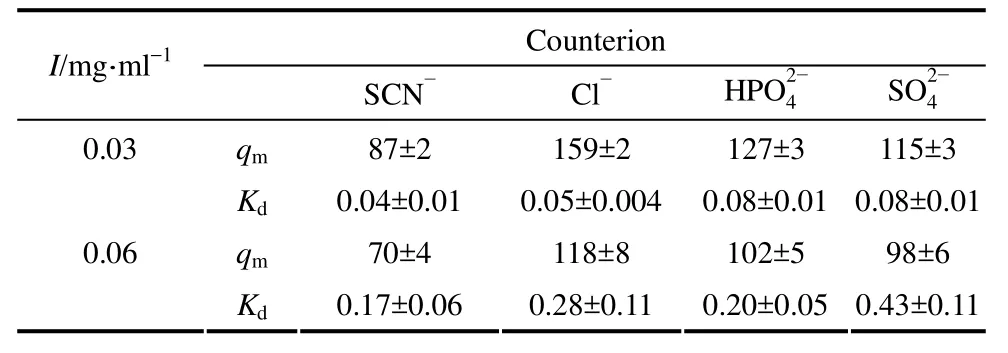
从图2和表4可以看出,对于每种反离子而言,当离子强度增大时,由于蛋白质与离子交换基团之间的静电作用被屏蔽,FF-PEI-R440对BSA的饱和吸附容量均降低。同时,反离子对饱和吸附容量有明显的影响(变化幅度可达183%),且在低离子强度和高离子强度下呈现相同的序列,即qm由小到大的顺序为SCN- 图2 BSA在FF-PEI-R440上的吸附等温线Fig.2 Adsorption isotherms of BSA on FF-PEI-R440 in 20 mmol·L-1 Tris-HCl, pH 8.0 with different counterions 表4 BSA在FF-PEI-R440上的吸附平衡参数Table 4 Equilibrium parameters, qm and Kd (both in mg·ml-1), for BSA adsorption on FF-PEI-R440 in 20 mmol·L-1 Tris-HCl with different counterions/mol·L-1 2- 然而,SCN-存在时,两者的趋势却相反,即此时FF-PEI-R440的吸附容量最小,而FF-PEI-L680的吸附量最大。这可能是因为FF-PEI-R440在制备过程中,PEI链内的伯、仲胺的活性比较强,大部分参与乙酸钠的中和反应而失去电荷[24-25],离子交换基团多为剩余的叔胺基。而文献报道离子交换基团相比,后者与单一离子的静电相互作用以及氢键结合力较弱,离子诱导极化和伦敦色散作用较强,因而更容易结合较大的离子[14]。由于SCN-离子半径较大极性强,水化能力差[26],所以亲和力强,蛋白质的吸附容量较低。离子交换基团为叔胺基的介质DEAE Sepharose FF也出现了类似的现象(由小到大的顺序为即SCN-存在时的吸附容量最低[16]。 综上所述,反离子显著影响 FF-PEI-R440对BSA的静态吸附行为,Cl-存在下吸附容量最高,SCN-存在时的吸附容量最低。 不同反离子存在下,FF-PEI-R440对BSA的吸附动力学曲线如图3所示。利用孔扩散模型拟合得到的有效扩散系数(De)与BSA在自由溶液中扩散系数(D0=6.0×10-11m·s-2)的比值(De/D0),如图4所示。 由图4可以看出,无论在低离子强度或高离子强度下,SCN-存在下的De/D0值都明显低于其他3种反离子,其主要原因是 SCN-存在下的吸附容量最低,即可通过链传递作用传递的蛋白量最少(吸附相蛋白量少),“链传递”作用(一种特殊的表面扩散过程)对孔内传质的贡献最低,故而De/D0值最小。 图3 BSA在FF-PEI-R440上吸附动力学曲线Fig.3 Uptake curves for 1 mg·ml-1 BSA on FF-PEI-R440 in 20 mmol·L-1 Tris-HCl, pH 8.0 with different counterions 上述反离子对FF-PEI-R440传质速率的影响结果与在 FF-PEI-L680得到的结果不同,在后者中De/D0值由小到大的顺序为即与介质具有较高亲和性的反离子会促进“链传递”作用发生、加快传质[16,29]。造成这一差异的原因可能是FF-PEI-R440电荷密度低于 FF-PEI-L680,耐盐性也较差[12],即前者的静电相互作用更易被屏蔽,在反离子存在时,反离子-蛋白-介质间的作用均较弱,差别不明显,所以反离子更大程度上是通过对蛋白吸附容量,而不是主要通过其与介质间的亲和强弱对“链传递”作用造成影响。 综上所述,反离子显著影响 FF-PEI-R440对BSA的传递速率,SCN-存在时传质速率最低。 在不同反离子存在下,FF-PEI-R440对BSA的动态结合容量如图5所示。 图5 BSA在FF-PEI-R440柱上的动态结合容量Fig.5 DBC values of BSA on FF-PEI-R440 column at I=0.03 mol·L-1 and I=0.06 mol·L-1 in 20 mmol·L-1 Tris-HCl, pH 8.0 with different counterions 众所周知,DBC由吸附平衡与传质速率共同决定,且饱和结合容量是在相同缓冲液条件下 DBC能达到的理论最高值[30]。因而对于每种反离子而言,当离子强度增大时,qm和De/D0值均降低(表4和图4),FF-PEI-R440对BSA的DBC值也均降低(图5);且无论在低离子强度或高离子强度下,由于SCN-存在下的qm和De/D0值均明显低于其他3种反离子,其DBC值也为最低。 由图5可以看出,低离子强度时(I=0.03 mol·L-1),除 SCN-外,和Cl-3种反离子存在下的 DBC 十分接近(100 mg·ml-1±8 mg·ml-1),这与2.3节中De/D0值随反离子的变化趋势相同。这是由于此时离子强度低,FF-PEI-R440的饱和吸附容量均较高,DBC主要由传质速率决定。这与在FF-PEI-L680观察得到的结果相同[16]。 而在高离子强度时(I=0.06 mol·L-1),DBC值由小到大的顺序为与 2.2节中qm的增加顺序相同。这是由于此时离子强度高,饱和吸附容量均有较大幅度降低,静态吸附容量成为限制DBC的主要因素,因而DBC值的增加顺序与qm的顺序相同。 综上所述,反离子显著影响 FF-PEI-R440对BSA的柱上吸附行为,SCN-存在时动态结合容量最低,Cl-存在时动态结合容量最高(可达 106 mg·ml-1)。对于离子交换色谱而言,在上柱操作中,高流速下具有较高的动态结合容量对蛋白的分离纯化才有实际应用意义[31],所以在使用 FF-PEI-R440介质的色谱过程中可以选择 Cl-作为反离子进行吸附操作。 不同反离子存在下,BSA在FF-PEI-R440的线性洗脱色谱图如图6所示,从图中可以看出4种反离子条件的下洗脱均获得了单峰(由于SCN-对280 nm紫外有吸收,所以随着盐浓度增大,基线逐渐偏高,并非拖尾),计算得到的洗脱收率见表5。由表5可知,4种反离子在两种离子强度下对BSA的洗脱收率均达到了95.6%±0.7%,即4种反离子均对BSA实现了良好的洗脱。 由图6可以看出,无论在低离子强度或高离子强度下,4种反离子的种类对FF-PEI-R440的洗脱顺序没有显著差别。这与在FF-PEI-L680上结果不同,即与介质亲和力较强的反离子会竞争蛋白吸附位点而优先将蛋白洗脱下来[16]。这一差异也主要是因为两种介质的电荷密度不同造成的,表面电荷密度低的FF-PEI-R440介质在较低的离子强度下就可以将蛋白质洗脱下来[12],蛋白质洗脱对离子强度更敏感,而反离子对洗脱的影响较小。 表5 不同反离子条件下蛋白的洗脱回收率Table 5 Recoveries of BSA with different counterions on FF-PEI-R440 图6 BSA在FF-PEI-R440上的梯度洗脱色谱图Fig.6 Linear gradient elution chromatograms of BSA with different counterions on FF-PEI-R440 综上所述,反离子对BSA在FF-PEI-R440柱上洗脱行为没有显著影响,且均能实现良好洗脱。所以,在使用FF-PEI-R440介质进行实际柱色谱操作中,吸附过程中可以选择 Cl-作为反离子,而洗脱过程则无须更换反离子。 通过研究反离子对部分电荷中和且具有较高传质速率的PEI接枝琼脂糖介质FF-PEI-R440上蛋白吸附与洗脱行为的影响,并与其出发介质FF-PEI-L680比较,结果表明:无论低离子强度或高离子强度下,BSA在FF-PEI-R440上的静态吸附容量对反离子的种类比较敏感,qm的增加顺序均为在低离子强度下,除SCN-外,反离子对传质速率和动态结合容量没有显著影响;在高离子强度下,传质速率的增加顺序为动态结合容量的增加顺序为;而4种反离子对蛋白质的洗脱顺序没有显著影响。该结果与反离子对FF-PEI-L680介质的影响不同,主要是由于离子交换基团化学特性和基团密度均不同造成的。在实际柱色谱操作中,使用FF-PEI-R440时流动相宜选择Cl-作为反离子以获得较高的动态结合容量,而对FF-PEI-L680,则需选择上述研究结果将有助于为PEI接枝的琼脂糖介质的柱色谱操作选择合适的反离子以提升对蛋白的吸附和洗脱效果,提高操作效率。 符 号 说 明 Cp——上样蛋白浓度,mg·ml-1 c——蛋白质溶液浓度,mg·ml-1 c0——蛋白质溶液初始浓度,mg·ml-1 DBC——动态结合容量,mg·ml-1 De——介质内蛋白质有效扩散系数 D0——溶液中蛋白质扩散系数 IC——离子交换容量,mmol·L-1 Kd——解离常数,mg·ml-1 Mw——分子量 m——色谱介质湿重,g q——蛋白质吸附密度,mg·ml-1 qm——蛋白质饱和吸附容量,mg·ml-1 Vb——填充柱体积,ml Vh——系统死体积,ml Vp——达到10%穿透蛋白的上样体积,ml [1] RICCARDI E, WANG J C, LIAPIS A I. Modeling the construction of polymeric adsorbent media: effects of counter-ions on ligand immobilization and pore structure[J]. Journal of Chemical Physics,2014, 140(8): 3073-3083. [2] YU L L, ZHANG L, SUN Y. Protein behavior at surfaces: orientation,conformational transitions and transport[J]. Journal of Chromatography A, 2015, 1382: 118-134. [3] LENHOFF A M. Protein adsorption and transport in polymer-functionalized ion-exchangers[J]. Journal of Chromatography A, 2011, 1218(49): 8748-8759. [4] BASCONI J E, CARTA G, SHIRTS M R. Multiscale modeling of protein adsorption and transport in macroporous and polymer-grafted ion exchangers[J]. AIChE Journal, 2014, 60(11): 3888-3901. [5] TAO Y Y, CHEN N Y, CARTA G,et al. Modeling multicomponent adsorption of monoclonal antibody charge variants in cation exchange columns[J]. AIChE Journal, 2012, 58(8): 2503-2511. [6] 余林玲, 孙彦. 接枝聚合物配基的蛋白质吸附层析[J]. 化工学报,2016, 67(1): 140-151.YU L L, SUN Y. Adsorptive protein chromatography with grafted polymeric ligands[J]. CIESC Journal, 2016, 67(1): 140-151. [7] YU L L, TAO S P, DONG X Y,et al. Protein adsorption to poly(ethylenimine)-modified Sepharose FF (Ⅰ): A critical ionic capacity for drastically enhanced capacity and uptake kinetics[J].Journal of Chromatography A, 2013, 1305(1): 76-84. [8] HONG Y, LIU N, WEI W,et al. Protein adsorption to poly(ethylenimine)-modified Sepharose FF (Ⅲ): Comparison between different proteins[J]. Journal of Chromatography A, 2014,1342(4): 30-36. [9] YU L L, SUN Y. Protein adsorption to poly(ethylenimine)-modified Sepharose FF (Ⅱ): Effect of ionic strength[J]. Journal of Chromatography A, 2013, 1305(1): 85-93. [10] TAO Y, PEREZ-ALMODOVAR E X, CARTA G,et al. Adsorption kinetics of deamidated antibody variants on macroporous and dextran-grafted cation exchangers (Ⅲ): Microscopic studies[J].Journal of Chromatography A, 2011, 1218(44): 8027-8035. [11] PEREZ-ALMODOVAR E X, WU Y G, CARTA G. Multicomponent adsorption of monoclonal antibodies on macroporous and polymer grafted cation exchangers[J]. Journal of Chromatography A, 2012,1264(22): 48-56. [12] ZHAO Y Y, DONG X Y, YU L L,et al. Protein adsorption to poly(ethylenimine)-modified Sepharose FF (Ⅵ): Partial charge neutralization drastically increases uptake rate[J]. Journal of Chromatography A, 2015, 1427: 102-110. [13] STÅHLBERG J. Retention models for ions in chromatography 1[J].Journal of Chromatography A, 1999, 855(1): 3-55. [14] FRITZ J S. Factors affecting selectivity in ion chromatography[J].Journal of Chromatography A, 2005, 1085(1): 8-17. [15] TUGCU N, SONG M, BRENEMAN C M,et al. Prediction of the effect of mobile-phase salt type on protein retention and selectivity in anion exchange systems[J]. Analytical Chemistry, 2003, 75(14):3563-3572. [16] LIU N, YU L L, SUN Y. Protein adsorption to poly(ethylenimine)-modified Sepharose FF (Ⅴ): Complicated effects of counterions[J]. Journal of Chromatography A, 2015, 1404: 44-50. [17] LIU N, WANG Z Y, LIU X G,et al. Characterization of novel mixed-mode protein adsorbents fabricated from benzoyl-modified polyethyleneimine-grafted Sepharose[J]. Journal of Chromatography A, 2014, 1372: 157-165. [18] YONG J L, NOTIDES A C, TSAY Y G,et al. Coumestrol,NBD-norhexestrol, and dansyl-norhexestrol, fluorescent probes of estrogen-binding proteins[J]. Biochemistry, 1977, 16(13): 2896-2901. [19] ŚMIECHOWSKI M. Theoretical calculation of pKas of phosphoric(Ⅴ) acid in the polarisable continuum and cluster-continuum models[J]. Journal of Molecular Structure, 2009, s924/925/926: 170-174. [20] MARCUS Y. Thermodynamics of solvation of ions (Ⅴ): Gibbs free energy of hydration at 298. 15 K[J]. Journal of the Chemical Society Faraday Transactions, 1991, 87(18): 2995-2999. [21] CARTA G, UBIERA A R, PABST T M. Protein mass transfer kinetics in ion exchange media: measurements and interpretations[J].Chemical Engineering & Technology, 2005, 28(11): 1252-1264. [22] LI M, LI Y Y, YU L L,et al. Characterization of poly (allylamine) as a polymeric ligand for ion-exchange protein chromatography[J].Journal of Chromatography A, 2017, 1486: 103-109. [23] ANGELO J M, CVETKOVIC A, GANTIER R,et al.Characterization of cross-linked cellulosic ion-exchange adsorbents(Ⅰ): Structural properties[J]. Journal of Chromatography A, 2013,1319(18): 46-56. [24] TIONG W H C, DAMODARAN G, NAIK H,et al. Enhancing amine terminals in an amine-deprived collagen matrix[J]. Langmuir, 2008,24(20): 11752-11761. [25] MADISON S A, CARNALI J O. pH Optimization of amidationviacarbodiimides[J]. Industrial & Engineering Chemistry Research, 2013,52(38): 13547-13555. [26] CACACE M G, LANDAU E M, RAMSDEN J J. The Hofmeister series: salt and solvent effects on interfacial phenomena[J]. Quarterly Reviews of Biophysics, 1997, 30(3): 241-277. [27] PEREZ-ALMODOVAR E X, GLATZ B, CARTA G. Counterion effects on protein adsorption equilibrium and kinetics in polymer-grafted cation exchangers[J]. Journal of Chromatography A,2012, 1253(1253): 83-93. [28] STONE M C, TAO Y, CARTA G. Protein adsorption and transport in agarose and dextran-grafted agarose media for ion exchange chromatography: effect of ionic strength and protein characteristics[J].Journal of Chromatography A, 2009, 1216(20): 4465-4474. [29] HU X, DO D D, YU Q. Effects of supporting and buffer electrolytes (NaCl, CH3COOH and NH4OH) on the diffusion of BSA in porous media[J]. Chemical Engineering Science, 1992,47(1): 151-164. [30] MÜLLER E. Properties and characterization of high capacity resins for biochromatography[J]. Chemical Engineering & Technology,2005, 28(11): 1295-1305. [31] FRANKE A, FORRER N, BUTTÉ A,et al. Role of the ligand density in cation exchange materials for the purification of proteins[J].Journal of Chromatography A, 2010, 1217(15): 2216-2225. date:2017-04-10. YU Linling, yulinling@tju.edu.cn supported by the National Natural Science Foundation of China (21406160, 21236005, 21621004). Effect of counterions on protein adsorption to partial neutralization poly(ethylenimine)-grafted Sepharose FF ZHAI Qiuhong, YU Linling, SUN Yan The partially neutralized poly(ethylenimine)-grafted Sepharose FF, FF-PEI-R440, exhibited higher protein capacity and faster uptake rate than its starting resin FF-PEI-L740. In this work, the influence of counterions on protein adsorption onto and elution from the FF-PEI-R440 resin was investigated with sodium salts of SCN-, Cl-,at ionic strengths of 0.03 mol·L-1and 0.06 mol·L-1. It was found that the static adsorption equilibrium of FF-PEI-R440 was significantly influenced by the counterions, and the adsorption capacity increased in the order ofat the two ionic strengths. At the low ionic strength,the counterions had no significant effect on the uptake rate and dynamic binding capacity except for SCN-. At high ionic strength, the uptake rate increased in the order ofDynamic binding capacity increased in the order ofthe same of the order of adsorption capacity. The dynamic binding capacity kept the highest values when Cl-existed at the two ionic strengths. Protein elution was little affected by counterions. The results indicated that the adsorption performance of FF-PEI-R440 was affected by counterions and the Cl-was the most favorable couterion for column operation. ion exchange chromatography; polymer grafting; counterion; adsorption equilibrium; kinetics;dynamic binding capacity; linear gradient elution TQ 033 A 0438—1157(2017)11—4178—08 10.11949/j.issn.0438-1157.20170360 2017-04-10收到初稿,2017-07-11收到修改稿。 联系人:余林玲。 翟秋红(1991—),女,硕士研究生。 国家自然科学基金项目(21406160,21236005,21621004)。
2.2 吸附动力学

2.3 动态结合容量

2.4 线性梯度洗脱


3 结 论
(Department of Biochemical Engineering and Key Laboratory of Systems Bioengineering of Ministry of Education,School of Chemical Engineering and Technology,Tianjin University,Tianjin300072,China)
