右美托咪定对结肠癌根治术患者围术期应激反应及细胞免疫功能的影响①
2017-11-22周志鹏蔡仁贤
周志鹏 宋 歌 王 航 蔡仁贤
(儋州市人民医院麻醉科,儋州 571700)
右美托咪定对结肠癌根治术患者围术期应激反应及细胞免疫功能的影响①
周志鹏 宋 歌 王 航 蔡仁贤
(儋州市人民医院麻醉科,儋州 571700)
目的探讨右美托咪定对结肠癌根治术患者围术期应激反应及细胞免疫功能的影响。方法择期行结肠癌根治术患者96例,采用数字表法随机均分为右美托咪定组(D组)和对照组(C组)。D组气管插管后静脉泵注右美托咪定0.6 μg/kg,随后以0.3 μg/(kg·h)的速率静脉输注至术毕,C组给予等容量和速率的0.9%生理盐水。分别于麻醉诱导前10 min(T0)、术毕即刻(T1)、术后24 h(T2)和术后72 h(T3)采集患者静脉血,采用流式细胞仪检测T淋巴细胞亚群(CD3+、CD4+、CD8+、CD4+/CD8+)及NK细胞的百分比,并测定去甲肾上腺素(NE)、肾上腺素(E)、皮质醇(Cor)、IL-6、IL-10及TNF-α水平。记录患者T0、插管即刻(Ta)、T1、拔管即刻(Tb)的SBP、DBP、MAP及术后不良反应发生情况。结果Ta、T1、Tb时C组SBP、DBP及MAP明显高于T0时和D组(P<0.05)。T1、T2时两组CD3+、CD4+、CD8+及CD4+/CD8明显低于T0时(P<0.05),且T1、T2、T3时C组CD3+、CD4+、CD8+及CD4+/CD8明显低于D组(P<0.05)。T1、T2时C组NK细胞明显低于T0时和D组(P<0.05)。T1、T2时两组IL-6、IL-10及TNF-α水平明显高于T0时(P<0.05),且C组明显高于D组(P<0.05);T3时C组IL-6及IL-10水平明显高于T0时和D组(P<0.05)。T1、T2时两组NE、E及Cor水平明显高于T0时(P<0.05),且C组明显高于D组(P<0.05)。T3时C组NE、E及Cor水平明显高于T0时和D组(P<0.05)。D组发生不良反应的比例明显低于C组(χ2=4.800,P=0.028)。结论右美托咪定可抑制结肠癌根治术患者围术期的应激反应,降低对免疫功能的影响。
右美托咪定;结肠癌;应激反应;免疫功能
结肠癌是临床上常见的消化道恶性肿瘤,其发病率较高,预后较差,严重威胁患者的生命健康[1]。结肠癌患者大多选择手术治疗,而手术创伤、麻醉及术后疼痛可抑制机体细胞免疫功能,导致癌细胞的扩散,进而影响患者的康复。右美托咪定(Dexmedetomidine,Dex)是高选择性α2肾上腺素能受体激动药,有较强的镇静、镇痛、抗焦虑及抑制交感神经活性等药理特性[2]。近期的研究表明,Dex可以减少乳腺癌及肺癌患者的应激反应,减轻术后免疫功能的抑制状态[3,4]。然而,Dex对结肠癌根治术患者围术期应激反应及免疫功能的影响,目前尚无定论。本研究拟通过观察Dex对结肠癌根治术患者围术期外周血T淋巴细胞亚群、炎症因子及应激激素水平的影响,为临床应用提供参考。
1 资料与方法
1.1资料 选取2015年1月至2016年12月儋州市人民医院收治的择期行结肠癌根治术患者96例,其中男65例,女31例,体质量指数(BMI)20~26 kg/m2,年龄35~68岁,平均年龄为(51.6±8.4)岁。纳入标准:(1)经病理确诊为结肠癌并适合手术治疗者;(2)术后病理分期按国际抗肿瘤联盟标准分为Ⅱ~Ⅲ期者;(3)符合美国麻醉医师协会(ASA)I~Ⅱ级者。排除标准:(1)严重心、肝、肾及内分泌疾病或免疫性疾病者;(2)术前接受过化疗或放疗者;(3)伴有精神疾病和严重药物过敏者。采用数字表法随机均分为右美托咪定组(D组)和对照组(C组),每组各48例。本研究获得医院伦理委员会批准,并与患者或家属签署知情同意书。
1.2方法
1.2.1麻醉方法 所有患者进入手术室后监测无创血压、心电图、心率和脉搏血氧饱和度。采用静脉注射咪达唑仑0.08 mg/kg、舒芬太尼3 μg/kg、丙泊酚1 mg/kg 和顺式阿曲库铵0.15 mg/kg行麻醉诱导,术中均以TCI异丙酚,血浆靶浓度2~3 μg/ml,TCI瑞芬太尼,血浆靶浓度2~3 ng/ml维持麻醉,吸入1.0%~3.0%七氟醚,间断静脉注射顺式阿曲库铵0.1 mg/kg维持肌松。D组气管插管后静脉泵注右美托咪定(江苏恒瑞医药有限公司,批号:1050423)负荷量0.6 μg/kg,随后以0.3 μg/(kg·h)的速率静脉输注至术毕,C组给予等容量和速率的0.9%生理盐水。手术结束后送入麻醉恢复室,行自控静脉镇痛(PCIA),PCIA量0.5 ml,时间为15 min。
1.2.2观察指标 所有患者分别于麻醉诱导前10 min(T0)、术毕即刻(T1)、术后24 h(T2)和术后72 h(T3)采集外周静脉血标本5 ml,离心分离血浆,保存于-80℃冰箱待测。荧光法测定血浆去甲肾上腺素(NE)及肾上腺素(E),放射免疫法测定血清皮质醇(Cor),酶联免疫法测定IL-6、IL-10及TNF-α,采用FACS Caliber型流式细胞仪检测T淋巴细胞亚群(CD3+、CD4+、CD8+、CD4+/CD8+)及自然杀伤(NK)细胞的百分比。记录患者T0、插管即刻(Ta)、T1、拔管即刻(Tb)的收缩压(SBP)、舒张压(DBP)、平均动脉压(MAP),术后不良反应发生情况。

2 结果
2.1两组患者一般情况和术中情况比较 两组患者性别、年龄、BMI、ASA分级、TNM分期、液体输注量、失血量及手术时间等情况比较,差异均无统计学意义(P>0.05),见表1。
2.2两组患者不同时点血流动力学指标的比较 Ta、T1、Tb时C组SBP、DBP及MAP明显高于T0时,差异有统计学意义(P<0.05),而Ta、T1、Tb时D组SBP、DBP及MAP与T0时比较,差异无统计学意义(P>0.05)。Ta、T1、Tb时C组SBP、DBP及MAP明显高于D组,差异有统计学意义(P<0.05),见表2。
2.3两组患者不同时点T淋巴细胞亚群和NK细胞比较 与T0时比较,T1、T2时两组CD3+、CD4+、CD8+及CD4+/CD8明显下降(P<0.05),且C组明显低于D组(P<0.05)。T3时C组CD3+、CD4+、CD8+及CD4+/CD8明显低于T0时和D组,差异有统计学意义(P<0.05)。T1、T2时C组NK细胞明显低于T0时和D组,差异有统计学意义(P<0.05),见表3。
2.4两组患者不同时点IL-6、IL-10及TNF-α水平比较 与T0时比较,T1、T2时两组IL-6、IL-10及TNF-α水平明显升高(P<0.05),且C组明显高于D组(P<0.05)。T3时C组IL-6及IL-10水平明显高于T0时和D组,差异有统计学意义(P<0.05),见表4。
2.5两组患者不同时点NE、E及Cor水平比较 与T0时比较,T1、T2时两组NE、E及Cor水平明显升高(P<0.05),且C组明显高于D组(P<0.05)。T3时C组NE、E及Cor水平明显高于T0时和D组,差异有统计学意义(P<0.05),见表5。
2.6两组患者术后不良反应发生情况比较 D组发生不良反应有4例,占8.3%(4/48);C组发生不良反应有12例,占25.0%(12/48)。D组术后发生不良反应的比例明显低于C组,差异有统计学意义(χ2=4.800,P=0.028),见表6。
表1两组患者一般情况和术中情况比较
Tab.1Generalsituationandintraoperativeconditionoftwogroupswerecompared

GroupsnMale[n(%)]Age(years,x±s)BMI(kg/m2,x±s)ASAⅡgrade[n(%)]TNMⅢphase[n(%)]Liquidinfusionvolume(ml,x±s)Bloodloss(ml,x±s)Operationtime(min,x±s)Cgroup4832(66.7)52.4±8.721.6±3.433(68.8)21(43.8)1705.8±326.4126.8±35.3194.7±44.8Dgroup4833(68.8)50.8±8.322.5±3.835(72.9)23(47.9)1792.6±385.7132.6±38.4187.5±40.6χ2/tvalue0.0481.2160.8750.2020.1681.5280.9070.783Pvalue0.8270.2470.3820.6530.6820.1630.3750.424
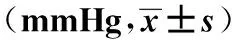
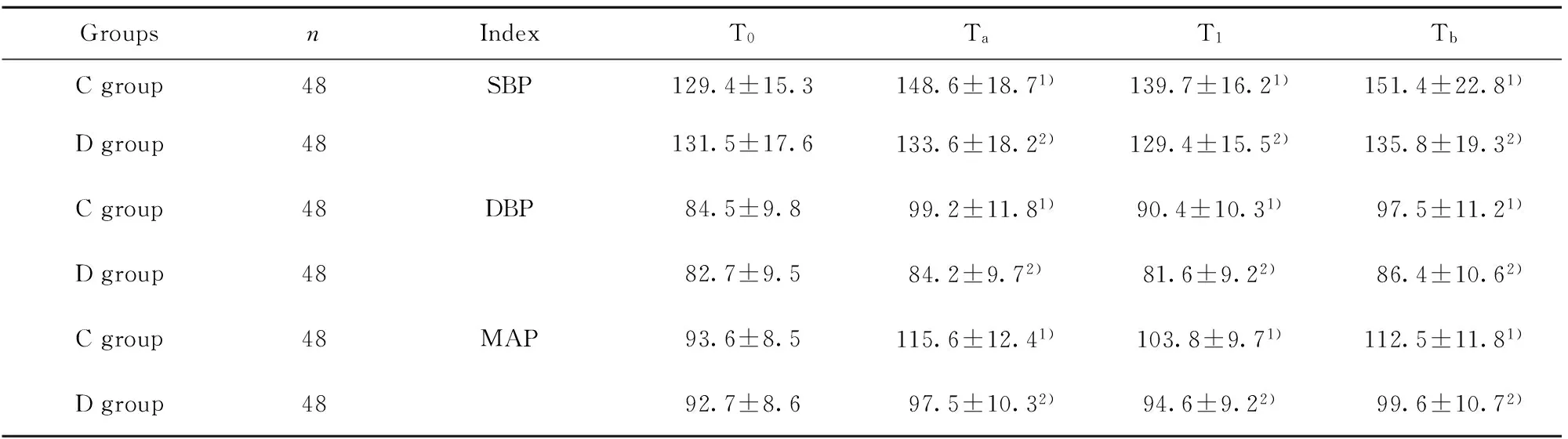
GroupsnIndexT0TaT1TbCgroup48SBP129.4±15.3148.6±18.71)139.7±16.21)151.4±22.81)Dgroup48131.5±17.6133.6±18.22)129.4±15.52)135.8±19.32)Cgroup48DBP84.5±9.899.2±11.81)90.4±10.31)97.5±11.21)Dgroup4882.7±9.584.2±9.72)81.6±9.22)86.4±10.62)Cgroup48MAP93.6±8.5115.6±12.41)103.8±9.71)112.5±11.81)Dgroup4892.7±8.697.5±10.32)94.6±9.22)99.6±10.72)
Note:Vs T0time points of the same group,1)P<0.05;vs the C group at the same time point,2)P<0.05.
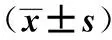
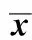
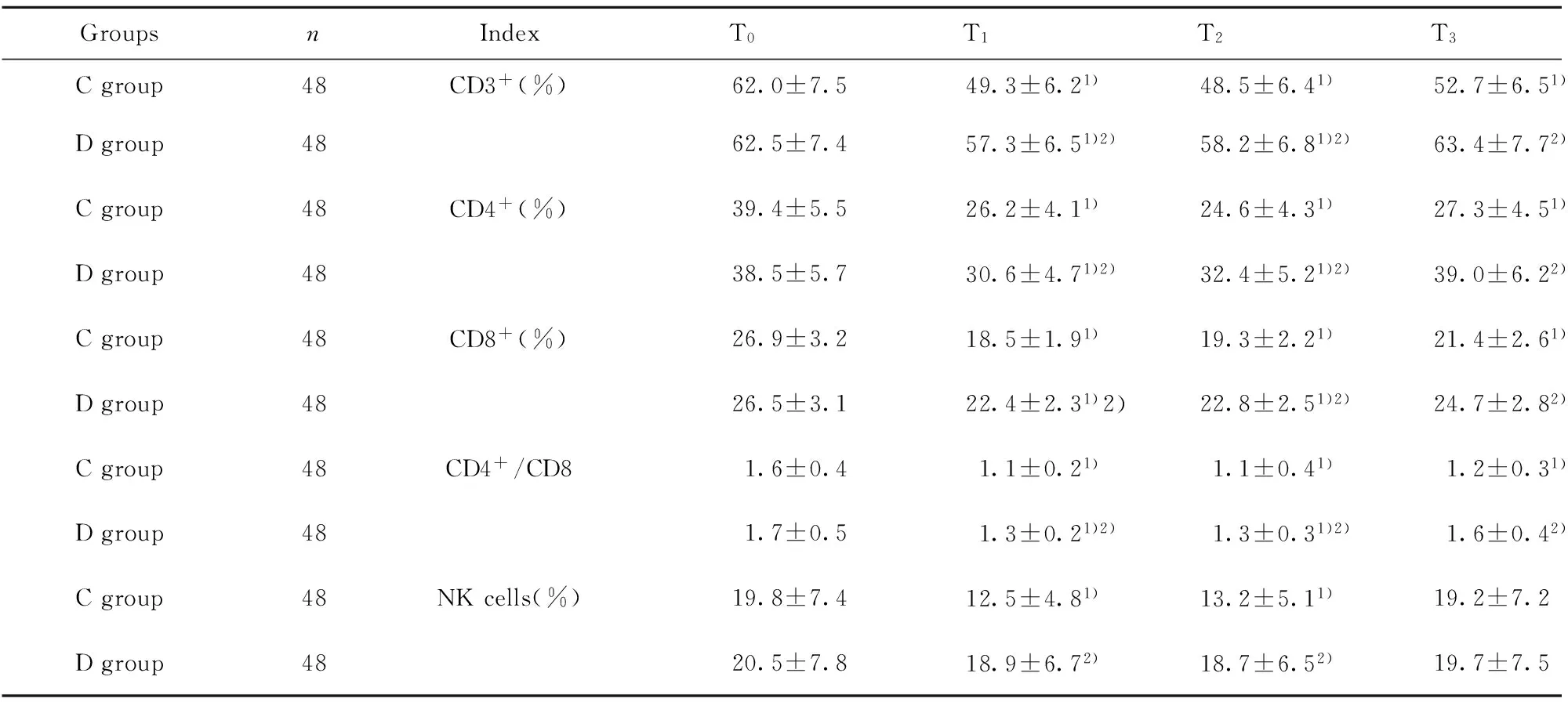
GroupsnIndexT0T1T2T3Cgroup48CD3+(%)62.0±7.549.3±6.21)48.5±6.41)52.7±6.51)Dgroup4862.5±7.457.3±6.51)2)58.2±6.81)2)63.4±7.72)Cgroup48CD4+(%)39.4±5.526.2±4.11)24.6±4.31)27.3±4.51)Dgroup4838.5±5.730.6±4.71)2)32.4±5.21)2)39.0±6.22)Cgroup48CD8+(%)26.9±3.218.5±1.91)19.3±2.21)21.4±2.61)Dgroup4826.5±3.122.4±2.31)2)22.8±2.51)2)24.7±2.82)Cgroup48CD4+/CD81.6±0.41.1±0.21)1.1±0.41)1.2±0.31)Dgroup481.7±0.51.3±0.21)2)1.3±0.31)2)1.6±0.42)Cgroup48NKcells(%)19.8±7.412.5±4.81)13.2±5.11)19.2±7.2Dgroup4820.5±7.818.9±6.72)18.7±6.52)19.7±7.5
Note:Vs T0time points of the same group,1)P<0.05;vs the C group at the same time point,2)P<0.05.

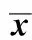

GroupsnIndex T0 T1 T2T3Cgroup48IL-652.7±8.367.3±10.51)73.8±11.21)58.6±9.41)Dgroup4853.8±8.660.8±9.31)2)64.7±10.21)2)50.7±8.52)Cgroup48IL-1032.4±6.843.8±8.31)49.5±8.31)38.7±7.51)Dgroup4833.7±6.541.6±8.21)2)43.4±8.21)2)32.5±7.41)2)Cgroup48TNF-α3.6±0.46.3±0.81)7.2±0.91)3.8±0.5Dgroup483.5±0.54.9±0.61)2)5.3±0.71)2)3.4±0.3
Note:Vs T0time points of the same group,1)P<0.05;vs the C group at the same time point,2)P<0.05.
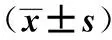
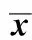
GroupsnIndexT0T1T2T3Cgroup48NE(pg/ml)356.3±54.8426.5±64.71)435.1±68.21)387.2±56.41)Dgroup48354.2±53.7385.4±57.31)2)402.6±60.41)2)359.3±54.72)Cgroup48E(pg/ml)17.2±3.825.4±4.31)28.3±4.61)23.8±4.21)Dgroup4816.4±3.621.6±4.11)2)22.4±3.71)2)16.2±3.52)Cgroup48Cor(ng/ml)210.5±34.6275.3±52.71)328.4±61.51)311.5±59.41)Dgroup48208.4±35.2239.6±43.81)2)284.6±55.71)2)272.4±53.81)2)
Note:Vs T0time points of the same group,1)P<0.05;vs the C group at the same time point,2)P<0.05.
表6两组患者术后不良反应发生情况比较[n(%)]
Tab.6Postoperativeadversereactionsoftwogroupswerecompared[n(%)]

GroupsnNauseaandvomitingBradycardiaSleepinessVertigoRespiratorydepressionRestlessCgroup484(8.3)1(2.1)2(4.2)2(4.2)1(2.1)2(4.2)Dgroup482(4.2)1(2.1)0(0)1(2.1)0(0)0(0)
3 讨论
近年来,结肠癌的发病率有上升趋势,其发病年龄也倾向年轻化,给家庭及社会带来沉重的负担。有研究认为,结肠癌的发生发展与机体免疫功能的改变有关,当宿主免疫功能低下或受抑制时,其发病风险增加[5]。围术期的许多因素可影响结肠癌根治术患者的免疫功能,其中手术创伤、麻醉药物及应激反应是影响术后免疫功能的主要因素[6],而免疫功能的抑制对患者的预后造成严重的影响。
Dex是一种高选择性α2肾上腺素能受体激动药,能有效地控制围术期的应激反应和维持围术期血流动力学的稳定,且有利于患者的术后恢复[7]。本研究显示,Ta、T1、Tb时C组SBP、DBP及MAP明显高于D组,且T1、T2、T3时C组NE、E及Cor水平明显高于D组。这说明D组患者的血流动力学变化趋于稳定,同时术后的应激反应激素水平明显低于C组。由此可见Dex能维持结肠癌根治术患者围术期血流动力学的稳定,并减少手术创伤所引起的应激反应。D组发生不良反应的比例明显低于C组,说明Dex作为辅助用药,能明显减少术后不良反应的发生。Panchgar等[8]研究也表明,全身麻醉期间静脉泵注Dex能减少患者围术期的应激反应、不抑制呼吸且能维持患者的血流动力学稳定。
T细胞是主要的效应细胞,具有发挥细胞免疫及免疫调节的作用,参与术后感染、肿瘤转移及扩散。T淋巴细胞亚群之间的平衡是维持免疫调节的重要环节,其中CD3+代表细胞免疫的总体水平,CD4+是辅助其他细胞参与免疫应答,CD8+对免疫应答有负性调节功能,CD4+/CD8+比值降低提示机体免疫功能减低。本研究中,T1、T2时两组CD3+、CD4+、CD8+及CD4+/CD8较T0时明显下降,且C组明显低于D组;T3时C组CD3+、CD4+、CD8+及CD4+/CD8明显低于T0时和D组。这说明患者术后存在一定的免疫抑制,D组下降的幅度较C组小,T3时D组指标恢复至术前水平,C组仍明显低于T0时。由此可见,Dex能减轻患者术后的免疫抑制,使患者的免疫功能恢复得更快。梁桦等[9]研究也认为,Dex可改善结肠癌根治术患者围术期细胞免疫功能,降低肿瘤细胞微转移的机率。NK细胞在机体抗肿瘤免疫中发挥重要作用,可直接杀伤机体内的肿瘤细胞,其活性降低表明机体免疫功能受抑制。本研究中T1、T2时C组NK细胞明显低于T0时和D组,说明右美托咪定对免疫保护的作用更强,与既往研究结果相似[10]。其作用机制可能是Dex主要作用于蓝斑核,高选择性地激活了肾上腺素能α2受体,调控儿茶酚胺等的释放,同时对中枢的去甲肾上腺素的释放与合成产生抑制,降低交感中枢张力,使机体自主神经系统和下丘脑-垂体-肾上腺轴的活化程度降低,从而降低了患者的应激反应。Wang等[11]研究也表明,Dex可抑制胃癌根治术患者围术期的T淋巴细胞亚群和NK细胞数降低,改善患者的免疫状态。
IL-6是机体应激反应中重要的炎症因子,可刺激肾上腺激素的分泌和调节免疫应答,在机体的抗感染免疫反应中起重要作用[12,13]。IL-10是一种多功能的抗炎性因子,具有发挥下调炎症反应及拮抗炎性介质的作用,其水平的降低可减轻患者的免疫抑制[14]。TNF-α能杀伤和抑制肿瘤细胞,促进细胞增殖和分化,是重要的炎症因子[15]。有研究表明,围术期间持续使用Dex可改善患者的炎症反应和免疫反应[16]。本研究中,T1、T2时两组IL-6、IL-10及TNF-α水平较T0时明显升高,且C组明显高于D组;T3时C组IL-6及IL-10水平明显高于T0时和D组。这说明患者术后存在一定的炎症反应,D组炎症反应的程度较C组小,T3时D组炎症指标恢复至术前水平,C组仍明显高于T0时。由此可见,Dex能抑制患者围术期的炎症反应,减轻炎症反应对心、肾和脑等重要器官的损害。Yeh等[17]研究也显示,Dex可以减轻患者围术期的应激反应及炎症反应,降低TNF-α水平。另有研究表明,围术期间持续使用Dex可有效降低手术患者TNF-α、IL-6等炎症因子的表达,抑制围术期炎症反应,减轻炎症反应对中枢神经系统的损害[18]。此外,D组术后发生不良反应的比例明显低于C组,提示使用右美托咪定可以降低患者不良反应的发生率。
综上所述,一定剂量的右美托咪定可以降低结肠癌根治术患者围术期的炎症和应激反应,改善患者术后T淋巴细胞和NK细胞的免疫功能,且不增加不良反应,从而更有利于患者术后的康复。
[1] Siegel RL,Miller KD,Fedewa SA,etal.Colorectal cancer statistics,2017[J].CA Cancer J Clin,2017,67(3):177-193.
[2] Funai Y,Pickering AE,Uta D,etal.Systemic dexmedetomidine augments inhibitory synaptic transmission in the superficial dorsal horn through activation of descending noradrenergic control:an in vivo patch-clamp analysis of analgesic mechanisms[J].Pain,2014,155(3):617-628.
[3] Jain G,Bansal P,Ahmad B,etal.Effect of the perioperative infusion of dexmedetomidine on chronic pain after breast surgery[J].Indian J Palliat Care,2012,18(1):45-51.
[4] Lee SH,Kim N,Lee CY,etal.Effects of dexmedetomidine on oxygenation and lung mechanics in patients with moderate chronic obstructive pulmonary disease undergoing lung cancer surgery:A randomised double-blinded trial[J].Eur J Anaesthesiol,2016,33(4):275-282.
[5] Sundström P,Stenstad H,Langenes V,etal.Regulatory T cells from colon cancer patients inhibit effector T-cell migration through an adenosine-dependent mechanism[J].Cancer Immunol Res,2016,4(3):183-193.
[6] Plummer JM,Williams N,Leake PA,etal.Surgical quality in colorectal cancer[J].Ann Med Surg(Lond),2015,5(12):52-56.
[7] Bilgi KV,Vasudevan A,Bidkar PU.Comparison of dexmedetomidine with fentanyl for maintenance of intraoperative hemodynamics in hypertensive patients undergoing major surgery:A randomized controlled trial[J].Anesth Essays Res,2016,10(2):332-337.
[8] Panchgar V,Shetti AN,Sunitha HB,etal.The effectiveness of intravenous dexmedetomidine on perioperative hemodynamics,analgesic requirement,and side effects profile in patients undergoing laparoscopic surgery under general anesthesia[J].Anesth Essays Res,2017,11(1):72-77.
[9] 梁 桦,刘洪珍,王汉兵,等.右美托咪定对结肠癌根治术病人围术期细胞免疫功能和血循环微转移的影响[J].中华麻醉学杂志,2012,32(10):1165-1168.
[10] Yang XH,Bai Q,Lv MM,etal.Effect of dexmedetomidine on immune function of patients undergoing radical mastectomy:double blind and placebo control study[J].Eur Rev Med Pharmacol Sci,2017,21(5):1112-1116.
[11] Wang Y,Xu X,Liu H,etal.Effects of dexmedetomidine on patients undergoing radical gastrectomy[J].J Surg Res,2015,194(1):147-153.
[12] Farghaly HS,Mahmoud AM,Abdel-Sater KA.Effect of dexmedetomidine and cold stress in a rat model of neuropathic pain:Role of interleukin-6 and tumor necrosis factor-α[J].Eur J Pharmacol,2016,776(4):139-145.
[13] Yun SH,Park JC,Kim SR,etal.Effects of dexmedetomidine on serum interleukin-6,hemodynamic stability,and postoperative pain relief in elderly patients under spinal anesthesia[J].Acta Med Okayama,2016,70(1):37-43.
[14] Kang SH,Kim YS,Hong TH,etal.Effects of dexmedetomidine on inflammatory responses in patients undergoing laparoscopic cholecystectomy[J].Acta Anaesthesiol Scand,2013,57(4):480-487.
[15] Zhang X,Wang J,Qian W,etal.Dexmedetomidine inhibits tumor necrosis factor-alpha and interleukin 6 in lipopolysaccharide-stimulated astrocytes by suppression of c-Jun N-terminal kinases[J].Inflammation,2014,37(3):942-949.
[16] Li Y,He R,Chen S,etal.Effect of dexmedetomidine on early postoperative cognitive dysfunction and peri-operative inflamm-ation in elderly patients undergoing laparoscopic cholecystectomy[J].Exp Ther Med,2015,10(5):1635-1642.
[17] Yeh YC,Sun WZ,Ko WJ,etal.Dexmedetomidine prevents alterations of intestinal microcirculation that are induced by surgical stress and pain in a novel rat model[J].Anesth Analg,2012,115(1):46-53.
[18] Bekker A,Haile M,Kline R,etal.The effect of intraoperative infusion of dexmedetomidine on the quality of recovery after major spinal surgery[J].J Neurosurg Anesthesiol,2013,25(1):16-24.
[收稿2017-07-04 修回2017-07-27]
(编辑 许四平 刘格格)
Effectofdexmedetomidineonstressresponseandcellularimmunefunctioninpatientsundergoingradicalresectionofcoloncancer
ZHOUZhi-Peng,SONGGe,WANGHang,CAIRen-Xian.
DepartmentofAnesthesiology,DanzhouCityPeople′sHospital,Danzhou571700,China
Objective:To investigate the effect of dexmedetomidine on stress response and cellular immune function in patients undergoing radical resection of colon cancer during perioperative period.Methods96 cases of colon cancer undergoing radical resection were randomly divided into dexmedetomidine group(group D)and control group(group C).The group D was intubated with intravenous infusion of dexmedetomidine 0.6 μg/kg,followed by intravenous infusion of 0.3 μg/(kg·h) at the end of the surgery,and the group C was given 0.9% saline at equal volume and rate.The venous blood of patients was collected before anesthesia induction,10 min(T0),immediate postoperative(T1),postoperative 24 h(T2)and postoperative 72 h(T3).Flow cytometry were used to detect T lymphocyte subsets(CD3+,CD4+,CD8+,CD4+/CD8+)and the percentage of NK cells,and determination of norepinephrine(NE),epinephrine(E),cortisol(Cor),IL-6,IL-10 and TNF-α levels.Records of patients with T0,immediate intubation(Ta),T1,immediate extubation(Tb)of SBP,DBP,MAP,and postoperative adverse reactions were recorded.ResultsThe SBP,DBP and MAP of group C at Ta,T1,Tbwere significantly higher than that of T0and group D(P<0.05).Compared to those at T0,the levels of CD3+,CD4+,CD8+and CD4+/CD8 at T1and T2were significantly lower in both groups(P<0.05),and the levels of group C at T1,T2,T3were significantly lower than those in group D(P<0.05).The NK cells of group C at T1,T2were significantly lower than that of T0and group D(P<0.05).Compared to those at T0,the levels of IL-6,IL-10 and TNF-α at T1and T2were significantly higher in both groups(P<0.05),and the levels in group C were significantly higher than those in group D(P<0.05).The IL-6 and IL-10 of group C at T3were significantly higher than that of T0and group D(P<0.05).Compared to those at T0,the levels of NE,E and Cor at T1and T2were significantly higher in both groups(P<0.05),and the levels in group C were significantly higher than those in group D(P<0.05).The NE,E and Cor of group C at T3were significantly higher than that of T0and group D(P<0.05).The proportion of adverse reactions in group D was significantly lower than that in group C(χ2=4.800,P=0.028).ConclusionDexmedetomidine can inhibit the perioperative stress response and reduce the impact on immune function in patients undergoing radical resection of colon cancer.
Dexmedetomidine;Colon cancer;Stress response;Immune function
10.3969/j.issn.1000-484X.2017.11.020
①本文受海南省医学科研基金资助(15812560)。
R614.2
A
1000-484X(2017)11-1694-05
周志鹏(1982年-),男,主治医师,主要从事临床麻醉学研究,E-mail:tianerlong1982@163.com。