EP2A体外可促进人CD34+细胞归巢而不能促进其增殖*
2017-11-22刘芳洁汪亚群陈惠珍赖淑萍许多荣
刘芳洁, 汪亚群, 唐 晶, 陈惠珍, 赖淑萍, 苏 畅, 李 娟, 许多荣
(中山大学附属第一医院血液科, 广东 广州 510080)
EP2A体外可促进人CD34+细胞归巢而不能促进其增殖*
刘芳洁, 汪亚群, 唐 晶, 陈惠珍, 赖淑萍, 苏 畅, 李 娟, 许多荣△
(中山大学附属第一医院血液科, 广东 广州 510080)
目的探讨前列腺素E2受体2激动剂(EP2A)在体外对人CD34+细胞的归巢与增殖作用。方法收集健康供者经粒细胞集落刺激因子动员后的外周血,免疫磁珠法分选出人CD34+细胞;同时收集健康供者动员前骨髓液,分离单个核细胞,并行骨髓间充质干细胞(BMMSC)培养。人CD34+细胞和BMMSC经前列腺素E2(阳性对照)、DMSO(阴性对照)、EP2A和EP2A+前列腺素E2受体2拮抗剂(EP2AA)处理后,对人CD34+细胞用CCK-8法检测细胞活力,集落形成实验检测集落形成数目,流式细胞术检测G2/M期细胞比例,Western blot检测细胞中survivin、β-catenin及CXC趋化因子受体4(CXCR4)的蛋白表达;ELISA法检测BMMSC中基质细胞衍生因子1α(SDF-1α)的含量。结果EP2A组与阴性对照组相比,人CD34+细胞在细胞活力、集落形成数目、G2/M期比例及survivin和β-catenin蛋白表达方面均无明显差别。但EP2A组人CD34+细胞CXCR4及BMMSC SDF-1α的表达均明显高于阴性对照组。结论EP2A体外可促进人CD34+细胞归巢但不能促进其增殖。
前列腺素E2; 前列腺素E2受体2激动剂; 细胞增殖; 归巢
异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,Allo-HSCT)是目前能够治愈恶性血液病的一种重要手段,促使造血干细胞(hematopoietic stem cell,HSC)增殖和归巢是使得HSC植入成功的关键[1]。目前关于促进HSC归巢的机制已经研究得比较透彻,相关研究明确指出促进HSC归巢的关键在于CXC趋化因子受体4(CXC chemokine receptor 4,CXCR4)/基质细胞衍生因子1α(stromal cell-derived factor-1α,SDF-1α)信号轴[2-4]。Goichberg 等[5]报道前列腺素E2(prostaglandin E2,PGE2)可以通过上调小鼠HSC表面的CXCR4表达,增加其对SDF-1α的趋化作用,进而达到促进HSC归巢的作用,而对于促进HSC增殖的具体机制尚未完全明了。本课题组前期研究已经证实,PGE2可促进人CD34+细胞体外增殖和归巢,这一点同早期国外的研究保持一致[6];同时也证实了人CD34+细胞均能表达PGE2的4个特异性受体,即PGE2受体1~4(prostaglandin E2receptors 1~4, EP1~EP4),但以EP2和EP4受体为主。本课题组还发现,EP1和EP3受体在人CD34+细胞中不起作用,主要是通过EP2和EP4受体发挥作用。PGE2受体2激动剂(EP2agonist, EP2A)是否能通过活化EP2受体同时发挥促进人CD34+细胞归巢与增殖的作用仍需进一步探讨。本研究旨在探讨EP2A是否能同时促进人CD34+细胞体外归巢和增殖,从而为研发促进HSC成功植入的药物提供理论依据。
材 料 和 方 法
1试剂
经健康供者同意,收集本院2015年8月~2016年8月期间健康供者经粒细胞集落刺激因子动员后的外周血采集产物及动员前骨髓液;PGE2和PGE2受体2拮抗剂(EP2antagonist, EP2AA)购于Cayman;EP2A由Ono Pharmaceutical Co. Ltd馈赠;人淋巴细胞分离液(Ficoll-Paque)购于MP Biomedicals;无血清培养基StemSpan TM SFEM购于Stem Cell Technologies;CD34+免疫磁珠试剂盒购于MiltenyiBiotec;甲基纤维素购于Sigma;重组人干细胞因子(recombinant human stem cell factor, rhSCF)、rhFlt3、rhTPO和rhIL-3购于Peprotech;CCK-8试剂盒购于日本同仁公司;DMEM/F12培养基购于Thermo Fisher;抗survivin和β-catenin抗体购于CST;抗CXCR4抗体购于Santa-cruze;SDF-1α ELISA试剂盒购于R&D。
2主要方法
2.1人CD34+细胞磁珠分选及流式鉴定 具体见参考文献[7]。
2.2骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMMSC)培养和鉴定 用人淋巴细胞分离液分离骨髓单个核细胞,用DMEM/F12+10% FBS 重悬,接种至10 cm皿中贴壁培养,约4~5 d后换液,继续培养,待细胞汇合至90%时,胰酶消化传代。取第3代生长状态良好的细胞,以流式细胞术检测表面抗原CD73、CD90、CD105、CD14、CD34和CD45的表达。
2.3人CD34+细胞和BMMSC的药物处理 将分选后的人CD34+细胞及生长状态良好的第3代BMMSC用培养基重悬至5×108/L;人CD34+细胞培养基中加入细胞因子rhSCF、rhFlt3、rhTPO(终浓度为100 μg/L)和rhIL-3(终浓度为20 μg/L),将其分成4组:PGE2(阳性对照)组、DMSO(阴性对照)组、EP2A(0.1 μmol/L)组和EP2A+EP2AA(浓度同EP2A)组,然后放入37 ℃、5% CO2恒温培养箱中继续培养24 h。收集细胞用于后续实验。
2.4CCK8法检测药物处理后人CD34+细胞的细胞活力 将收集的细胞以每孔100 μL接种于96孔板,EP2A终浓度分别设置0、0.1、0.5、1、5和10 μmol/L,每组设3个平行孔,冰上培养2 h后,继续在37 ℃、5% CO2恒温培养箱中分别培养22 h、46 h、70 h和94 h,每孔加入10 μL CCK-8试剂,轻轻混匀,置于37℃、5% CO2培养箱中培养4 h,在450 nm波长处用酶标仪测吸光度值(A值)。另设立4个组: PGE2(终浓度1 μmol/L)组、DMSO(<0.1%,阴性对照)组、EP2A(1 μmol/L)组和EP2A+EP2AA(浓度同EP2A)组,冰上培养2 h,培养箱中培养22 h,其余操作同上。细胞活力(%)=A实验组/A空白组×100%。
2.5集落形成实验 具体见参考文献[7],2周后倒置显微镜下识别和计数集落形成。
2.6流式细胞术测定细胞周期 取方法2.3中收集的细胞离心弃上清,PBS洗涤后70%冰乙醇-20 ℃固定过夜,PBS洗涤后加入RNase-A和碘化丙啶避光染色30 min,流式细胞仪分析细胞周期分布,具体见参考文献[7-8]。
2.7人CD34+细胞中survivin、β-catenin和CXCR4蛋白的表达情况 取方法2.3中收集的细胞,提取蛋白,具体见参考文献[7]。
2.8ELISA法检测BMMSC分泌的SDF-1α水平 按ELISA试剂盒操作说明检测各组细胞分泌的SDF-1α水平。
3统计学处理
所有数据分析采用统计软件SPSS 24.0。数据方差齐采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1人CD34+细胞的分选与鉴定
人外周血采集产物经CD34+磁珠分选后,用流式细胞仪鉴定分选细胞的纯度,结果显示CD34+细胞纯度达90%以上。
2BMMSC的培养及鉴定
对分离的骨髓单个核细胞进行培养,1周后于倒置显微镜下可观察到呈漩涡状生长的长梭形、纺锤形和多角形细胞,后通过换液和传代对其进行纯化培养。流式细胞术检测发现,细胞表面高表达CD73、CD90和CD105抗原,而不表达CD14、CD34和CD45抗原,说明这群细胞是BMMSC。
3EP2A对人CD34+细胞的时间和浓度效应
采用CCK-8法检测不同浓度的EP2A作用不同时间后CD34+细胞活力的变化,结果显示,相同培养时间下,EP2A浓度在0~10 μmol/L之间时,人CD34+细胞活力没有明显变化;而相同EP2A浓度下,在培养时间为24~96 h之间,EP2A对人CD34+细胞活力的作用也无明显变化。另外,PGE2组的细胞活力是阴性对照组的1.40倍(P<0.05),EP2A组和阴性对照组间无明显差异。这说明EP2A对促进人CD34+细胞生长无明显作用,见图1。
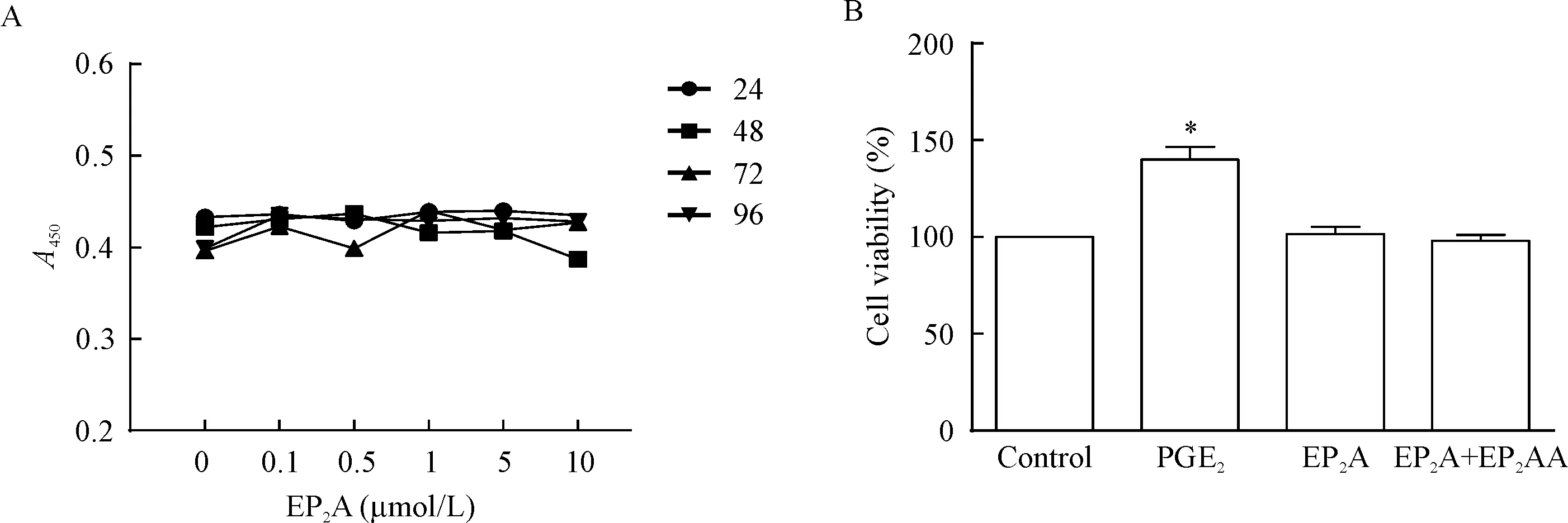
Figure 1. The viability of human CD34+cells detected by CCK-8 assay. A: theAvalue of human CD34+cells treated with different doses of EP2A for different time; B: the viability of human CD34+cells using the control group as 100%.Mean±SD.n=3.*P<0.05vscontrol group.
图1CCK-8法检测人CD34+细胞的活力变化
4EP2A对人CD34+细胞集落形成影响
造血祖细胞由造血干细胞分化而来,它的增殖能力需要依靠造血干细胞增殖来补充,因此集落形成实验可以通过反映造血祖细胞的增殖能力,间接反映造血干细胞的分化能力。本研究采用集落形成实验检测人CD34+细胞的增殖能力,经处理后的人CD34+细胞用甲基纤维素半固体培养基培养2周,倒置显微镜下识别和计数各系集落,结果示EP2A对各系集落形成与阴性对照组的差异无统计学显著性,见图2。
5EP2A对人CD34+细胞的细胞周期分布的影响
采用流式细胞术检测各处理组人CD34+细胞,结果发现PGE2组处于G0/G1期的细胞比例为(79.97±1.71)%,较阴性对照组(85.37±2.25)%下降,差异具有统计学意义(P<0.05),EP2A组处于G0/G1期的细胞比例(85.83±2.48)%,较阴性对照组无明显差别;各药物处理组处于S期的细胞比例与阴性对照组比较差异无统计学显著性;PGE2组处于G2/M期的细胞比例为(11.80±0.87)%,较阴性对照组(6.67±0.71)%明显升高,差异具有统计学意义(P<0.01),EP2A组处于G2/M期的细胞比例较阴性对照组无明显差异。由此可知,EP2A不能促进人CD34+细胞由静止期进入细胞周期,见图3、表1。
6EP2A对人CD34+细胞中survivin、β-catenin及CXCR4蛋白表达的影响
采用Western blot方法检测经处理后人CD34+细胞中survivin、β-catenin及CXCR4蛋白的表达变化情况。结果发现经EP2A干预后,survivin和β-catenin蛋白表达量与阴性对照组比较差异无统计学显著性,而CXCR4蛋白的表达量是阴性对照组的1.65倍(P<0.05),且能被相应拮抗剂所抑制(P<0.05)。以上结果显示,EP2A能促进趋化因子受体CXCR4蛋白表达,不能促进survivin、β-catenin 蛋白表达,见图4。
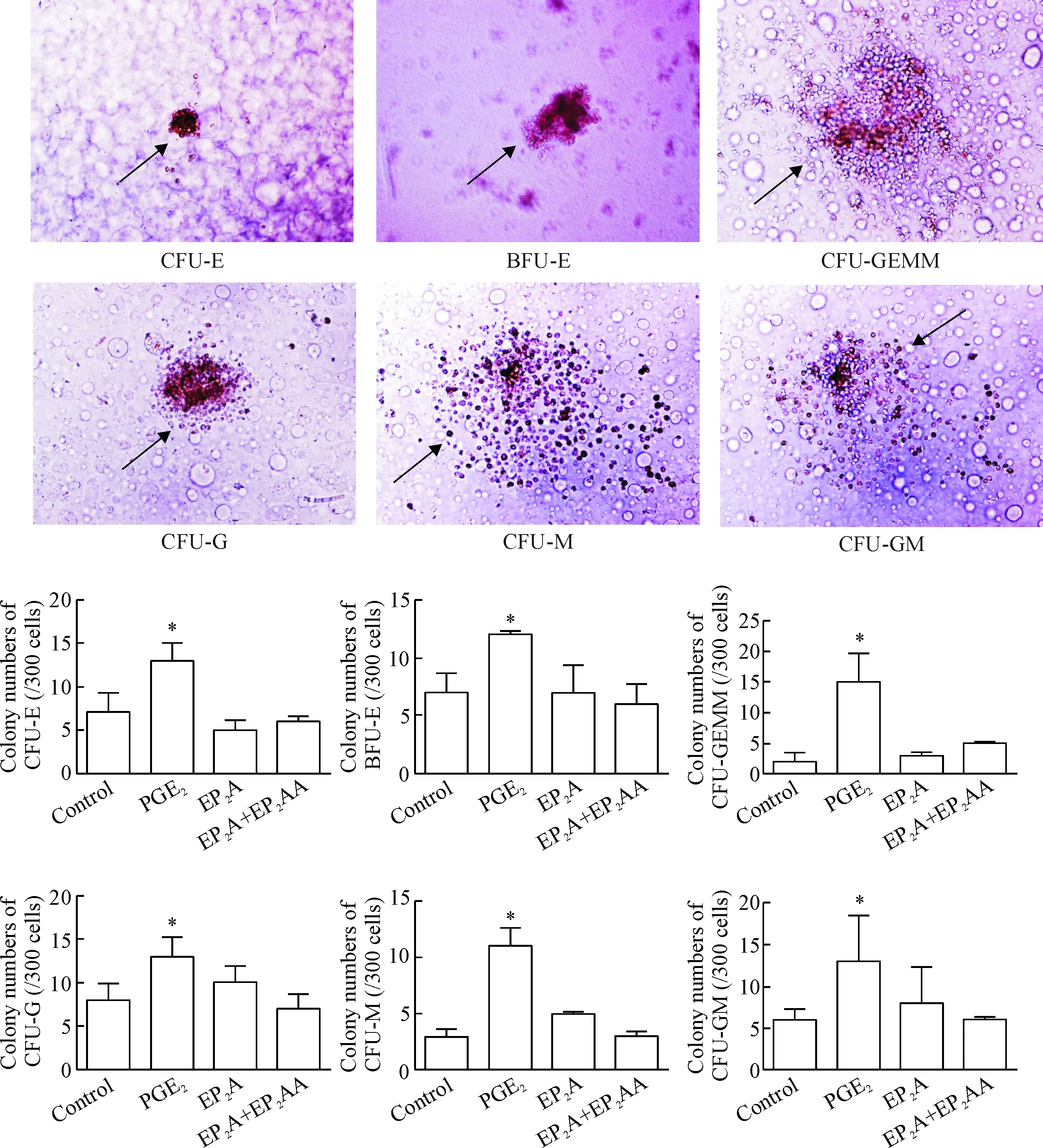
Figure 2. The changes of colony-forming units (CFU) in the human CD34+cells with different treatments (×10). Mean±SD.n=3.*P<0.05vscontrol group.
图2不同药物处理对各集落形成的影响
7EP2A促进BMMSC分泌趋化因子SDF-1α
采用ELISA法检测经处理后BMMSC中SDF-1α的蛋白分泌水平。结果显示EP2A组中BMMSC分泌的SDF-1α 蛋白量是阴性对照组的1.51倍,加入相应拮抗剂后,蛋白表达明显下降,见图5。
讨 论
早在20世纪Fehér 等[9]就首次报道了PGE2能增加小鼠骨髓细胞的集落形成,其后North 等[10]发现,runx1/cmyb蛋白在经PGE2处理的斑马鱼胚胎造血祖细胞中表达增加。目前的研究均证实PGE2在促进移植后的HSC归巢和防止其植入功能不良方面具有巨大的临床应用前景[11]。本课题组前期研究已证实PGE2具有促进人CD34+增殖和归巢的作用,本研究拟进一步明确EP2A是否能通过EP2受体既发挥促进人CD34+归巢作用又发挥促进人CD34+增殖作用。
经EP2A处理后,随着作用时间延长和药物浓度的升高,人CD34+细胞活力并没有明显增加,说明EP2A对人CD34+细胞生长作用不明显。正常生理情况下,人HSC大部分处于静止期,本研究检测,经EP2A处理后,人CD34+细胞处于G0/G1期的比例为(85.83±2.48)%,与阴性对照组相比差异无统计学显著性;处于G2/M期的细胞比例亦无明显变化,这表明PGE2不通过EP2受体促进HSC进入细胞周期。Baba等[12]和Fukuda 等[13]研究表明PGE2可以通过刺激抗凋亡蛋白survivin的表达来促进人CD34+进入细胞周期。本研究发现,经EP2A处理后,人CD34+细胞中survivin在蛋白表达较阴性对照组无明显增加,因此无法实现促使HSC由静止期进入细胞周期。β-catenin是调控细胞增殖的Wnt经典信号途径的经典因子,EP2A组中β-catenin的蛋白表达较阴性对照组没有明显变化。以上结果均表明EP2A对促进HSC增殖没有明显作用。

Figure 3. The changes of the cell cycle distribution in the human CD34+cells with different treatments.
图3不同药物处理后CD34+细胞周期的分布情况
表1经不同方式处理后细胞具体周期分布情况
Table 1. The cell cycle distribution of human CD34+cells with different treatments (Mean±SD.n=3)

Group G0/G1SG2/MControl85.37±2.257.96±1.666.67±0.71PGE279.97±1.71∗8.23±0.9711.80±0.87∗EP2A85.83±2.487.70±1.236.47±1.90EP2A+EP2AA86.03±3.207.50±1.236.47±2.39
*P<0.05vscontrol group.
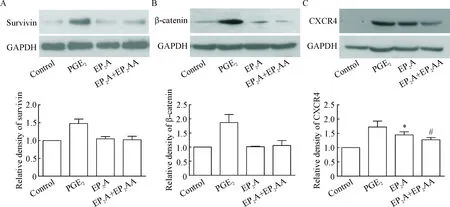
Figure 4. The protein expression of survivin (A), β-catenin (B) and CXCR4 (C) in the human CD34+cells with different treatments. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsEP2A group.
图4不同药物处理后人CD34+细胞中survivin、β-catenin和CXCR4的表达情况
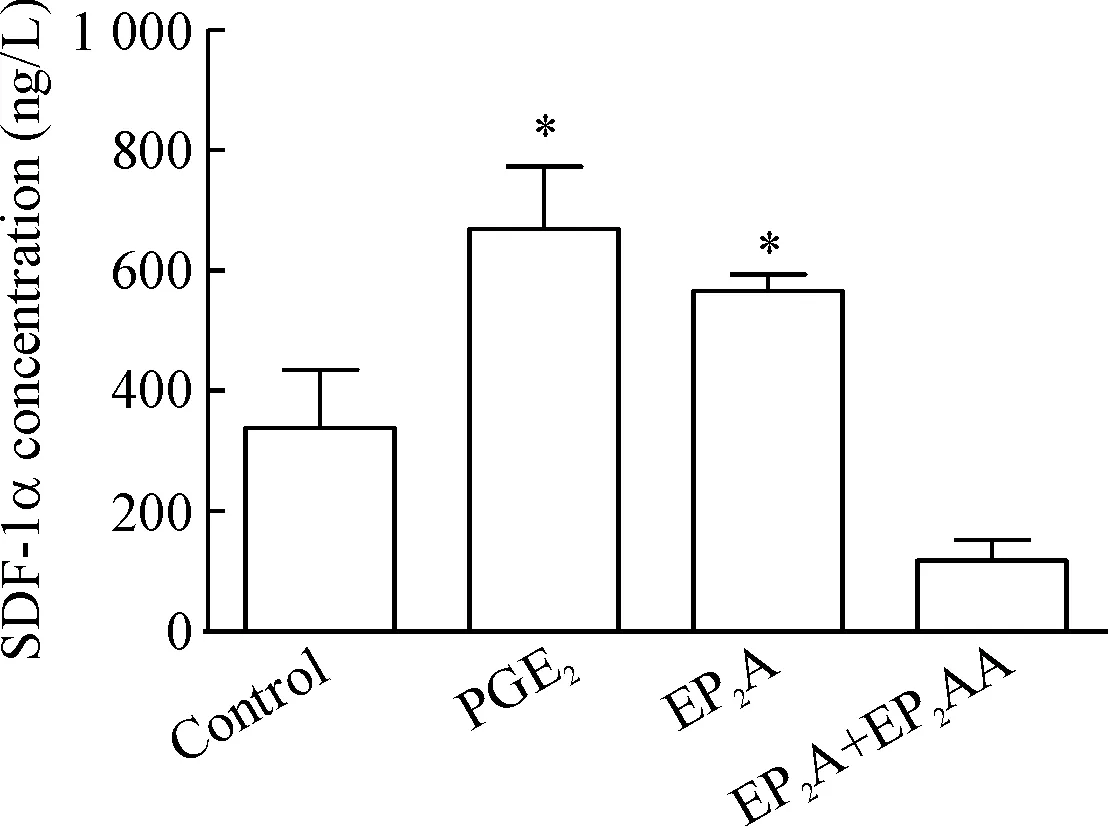
Figure 5. The secretion of SDF-1α in the BMMSCs with different treatments detected by ELISA. Mean±SD.n=3.*P<0.05vscontrol group.
图5不同药物处理后BMMSC中SDF-1α的分泌情况
CXCR4/SDF-1α信号轴在HSC归巢过程中起着关键作用。趋化因子受体CXCR4表达于HSC表面。本实验观察到,与PGE2效应相似,经EP2A处理后人CD34+表面蛋白CXCR4表达增加,而当加入其对应的受体拮抗剂EP2AA后,CXCR4的表达水平明显下降。基质细胞衍生因子SDF-1α主要由骨髓基质细胞合成并分泌,为HSC的体内迁移提供定向动力。当BMMSC经PGE2和EP2A处理后,其合成与分泌的SDF-1α明显升高,当EP2A组加入其对应的受体拮抗剂EP2AA后,SDF-1α的合成与分泌明显减少。
综上所述,我们认为EP2A可促进人CD34+体外归巢,不能促进其增殖,即PGE2不能通过EP2受体促进人CD34+细胞体外增殖。而对于PGE2促进增殖的具体机制以及通过哪一条信号途径促进人CD34+细胞增殖,本课题组正在进一步研究。
[1] Servais S, Beguin Y, Baron F. Emerging drugs for prevention of graft failure after allogeneic hematopoietic stem cell transplantation[J]. Expert Opin Emerg Drugs, 2013,18(2):173-192.
[2] Kim M, Kim DI, Kim EK, et al. CXCR4 overexpression in human adipose tissue-derived stem cells improves homing and engraftment in an animal limb ischemia model[J]. Cell Transplant, 2017, 26(2):191-204.
[3] Larochelle A, Gillette JM, Desmond R, et al. Bone marrow homing and engraftment of human hematopoietic stem and progenitor cells is mediated by a polarized membrane domain[J]. Blood, 2012, 119(8):1848-1855.
[4] Asri A, Sabour J, Atashi A, et al. Homing in hemato-poietic stem cells: focus on regulatory role of CXCR7 on SDF1a/CXCR4 axis[J]. EXCLI J, 2016, 15:134-143.
[5] Goichberg P, Kalinkovich A, Borodovsky N, et al. cAMP-induced PKCζ activation increases functional CXCR4 expression on human CD34+hematopoietic progenitors[J]. Blood, 2006, 107(3):870-879.
[6] Durand EM, Zon LI. Newly emerging roles for prostaglandin E2regulation of hematopoiesis and hematopoietic stem cell engraftment[J]. Curr Opin Hematol, 2010, 17(4):308-312.
[7] 赖淑萍, 戚永磊, 许多荣. 前列腺素E2体外可促进人CD34+细胞增殖[J]. 中山大学学报: 医学科学版, 2013, 34(1):22-27.
[8] 秦瑞英, 夏永华, 任艳芳, 等. AEG-1表达下调对人宫颈癌细胞细胞周期和侵袭能力的影响及其机制[J]. 中国病理生理杂志, 2013, 29(6):1020-1024.
[9] Fehér I, Gidáli J. Prostaglandin E2as stimulator of hematopoietic stem cell proliferation[J]. Nature,1974, 247(442):550-551.
[10] North TE, Goessling W, Walkley CR, et al. Prostaglandin E2regulates vertebrate haematopoietic stem cell homeostasis[J]. Nature, 2007, 447(7147):1007-1011.
[11] Hoggatt J, Pelus LM. Eicosanoid regulation of hematopoiesis and hematopoietic stem and progenitor trafficking[J]. Leukemia, 2010, 24(12):1993-2002.
[12] Baba HA, Wohlschlaeger J, Schmitz KJ, et al. Survivin is upregulated during liver regeneration in rats and humans and is associated with hepatocyte proliferation[J]. Liver Int, 2009, 29(4):585-592.
[13] Fukuda S, Foster RG, Porter SB, et al. The antiapoptosis protein survivin is associated with cell cycle entry of normal cord blood CD34+cells and modulates cell cycle and proliferation of mouse hematopoietic progenitor cells[J]. Blood, 2002, 100(7):2463-2471.
(责任编辑: 陈妙玲, 罗 森)
EP2A promotes human CD34+cell homing in vitro but not proliferation
LIU Fang-jie, WANG Ya-qun, TANG Jing, CHEN Hui-zhen, LAI Shu-ping, SU Chang, LI Juan, XU Duo-rong
(DepartmentofHematology,TheFirstAffiliatedHospital,SunYat-SenUniversity,Guangzhou510080,China.E-mail:xudr@hotmail.com)
AIM: To investigate the role of prostaglandin E2receptor 2 agonist (EP2A) in proliferation and homing of human CD34+cells.METHODSBone marrow fluid and peripheral blood containing stem cells were collected from healthy donors mobilized by granulocyte colony-stimulating factor in our department. Human CD34+cells were isolated by the method of magnetic-activated cell sorting microbeads. Bone marrow mononuclear cells were isolated by Ficoll-Paque centrifugation, and the bone marrow mesenchymal stem cells (BMMSC) were cultured with L-DMEM. Human CD34+cells and BMMSC were divided into 4 groups, and treated with PGE2(as positive control), DMSO (as negative control), EP2A and EP2A+prostaglandin E2receptor 2 antagonist (EP2AA), respectively. After exposed to the reagents, human CD34+cell viability was measured by CCK-8 assay, the number of colonies was evaluated by colony-formation assay, the cell cycle distribution was analyzed by flow cytometry, and the protein expression of survivin, β-catenin and CXC chemokine receptor 4 (CXCR4) was detrmined by Western blot. Moreover, the concentration of stromal cell-derived factor-1α (SDF-1α) in the BMMSC was detected by ELISA.RESULTSThe cell viability and the colony number of human CD34+cells in EP2A group were not higher than those in negative control group. Furthermore, the proportion of human CD34+cells treated with EP2A in G2/M phase was not elevated compared with negative control group. The protein expression of survivin and β-catenin did not up-regulated in human CD34+cells exposed to EP2A, but the protein expression of CXCR4 in human CD34+cells and the concentration of SDF-1α in BMMSC were elevated.CONCLUSIONEP2A promotes human CD34+cell hominginvitrobut not proliferation.
Prostaglandin E2; Prostaglandin E2receptor 2 agonist; Cell proliferation; Homing
1000- 4718(2017)11- 2026- 06
2017- 04- 28
2017- 07- 17
国家自然科学基金资助项目(N0. 81370663)
△通讯作者 Tel: 020-87755766-8911; E-mail: xudr@hotmail.com
R551.3; R363
A
10.3969/j.issn.1000- 4718.2017.11.017
