成纤维细胞生长因子1非促分裂突变体对2型糖尿病大鼠血管功能的保护作用*
2017-11-22邱鹏程胡智盛蔡昌洲孔灵国何正乐
南 燕, 李 娜, 董 育, 邱鹏程, 胡智盛, 蔡昌洲,孔灵国, 何正乐, 应 磊, 汪 洋△
(1温州医科大学附属第二医院育英儿童医院新生儿科, 浙江 温州 325027;2温州医科大学病理生理学教研室, 浙江 温州 325035)
成纤维细胞生长因子1非促分裂突变体对2型糖尿病大鼠血管功能的保护作用*
南 燕1, 李 娜2▲, 董 育2, 邱鹏程2, 胡智盛2, 蔡昌洲2,孔灵国2, 何正乐2, 应 磊2, 汪 洋2△
(1温州医科大学附属第二医院育英儿童医院新生儿科, 浙江 温州 325027;2温州医科大学病理生理学教研室, 浙江 温州 325035)
目的研究成纤维细胞生长因子1非促分裂突变体(nFGF1)对链脲佐菌素和高脂饮食诱导的2型糖尿病大鼠主动脉血管功能的保护作用并探讨其机制。方法将5周龄左右(200±20)g 雄性SD大鼠30只随机分为正常对照组、2型糖尿病模型组和2型糖尿病模型+nFGF1给药组,每组10只。给药组予以0.5 mg/kg nFGF1腹腔注射4周(隔天给药),对照组和糖尿病模型组则给予等量的生理盐水。监测各组大鼠的血糖变化情况,检测大鼠主动脉舒张功能变化,检测动脉组织超氧化物歧化酶(SOD)水平,检测环氧化酶2(COX-2)、磷酸化细胞外信号调节激酶(p-ERK)和内皮型一氧化氮合酶(eNOS)的蛋白表达水平,检测血清中葡萄糖、胆固醇和甘油三酯水平,研究nFGF1对2型糖尿病大鼠主动脉血管功能的调节作用。结果nFGF1可明显降低2型糖尿病大鼠血清中葡萄糖、胆固醇和甘油三酯水平,显著增强主动脉SOD活性及eNOS 蛋白表达水平,并明显下调COX-2和p-ERK的蛋白水平。结论nFGF1可以有效保护2型糖尿病大鼠主动脉血管功能,其机制可能与降低血糖和血脂,减轻炎症和氧化应激反应,以及上调 eNOS 信号通路有关。
2型糖尿病; 成纤维细胞生长因子1; 炎症; 氧化应激
糖尿病(diabetes mellitus,DM)已成为越来越严重的全球性健康问题,其发病率和死亡率都呈日益上升的趋势。我国的糖尿病患病率为11.6%,约有1.139亿人,位居世界首位,且糖尿病发病呈现年轻化趋势,糖尿病所引起的各种并发症严重影响了人们的生活质量和寿命。糖尿病大血管病变是糖尿病重要并发症之一,是糖尿病心脑血管疾病的基础,已成为糖尿病致死致残的首要原因[1-2]。然而,目前糖尿病血管病变的发病机制尚不完全清楚,其中氧化应激和炎症损伤被广泛认为是重要的机制。
成纤维细胞生长因子/成纤维细胞生长因子受体(fibroblast growth factors/fibroblast growth factor receptors,FGFs/FGFRs)家族成员是体内一类重要的生长因子,其中FGF1是一种旁分泌促有丝分裂的信号蛋白,其在旁分泌系统中的促细胞分裂和增殖的作用已经广为熟知[3-4]。2012年和2014年,Ronald M. Evans课题组先后在《Nature》发表论文阐述经典的旁分泌蛋白FGF1在代谢调控中也具有重要的作用。研究表明,予以2型糖尿病(type 2 diabetes,T2D)小鼠模型腹腔注射一定剂量的FGF1,血糖会迅速下降至正常水平。重要的是,在高剂量时,FGF1也不会导致低血糖的发生。注射FGF1可通过增加胰岛素敏感性来恢复小鼠自身自然调节胰岛素和血糖水平的能力,使血糖维持在一个安全范围内,有效地逆转糖尿病的核心症状。然而,目前关于FGF1治疗2型糖尿病并发症的作用及其机制仍不清楚,尤其是FGF1对2型糖尿病大鼠血管功能的保护作用及其机制仍未见报道。鉴于野生型FGF1显著的促细胞增殖活性具有潜在致肿瘤风险,我们将FGF1与肝素结合的位点进行定点突变(Lys127Asp、Lys128Gln和Lys133Val),得到没有促分裂活性的FGF1非促分裂突变体(non-mitogenic FGF1,nFGF1)[5-6]。本文主要从糖尿病血管内皮氧化应激和炎症损伤[7-8]两个角度研究nFGF1对血管功能的保护作用及可能存在的相关机制,为防治糖尿病血管病进一步提供理论支持和潜在的治疗靶点。
材 料 和 方 法
1动物
清洁级雄性5周龄左右SD大鼠30只,体重(200±20)g,购自上海斯莱克实验动物有限责任公司,普通饲料及40%脂肪供能高脂饲料(54.6%普通饲料、16.9%猪油、14%蔗糖、10.2%酪蛋白、2.1%预混料和2.2%麦芽糊精)购于上海普路腾生物科技有限公司。
nFGF1于温州医科大学药学院(浙江省生物技术制药工程重点实验室)制备(在实验室先前参与发表的文章中已证实nFGF1丧失促分裂活性)[6];血糖仪和血糖试纸均购自Roche;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒购自南京建成生物工程研究所;抗内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)抗体购于Abcam;抗磷酸化细胞外信号调节激酶(phosphorylated extracellular signal-regulated kinase,p-ERK)及环氧化酶2(cyclooxygenase-2,COX-2)抗体购于Cell Signaling Technology;II 抗(Goat anti-rabbit IgG-HRP)购于Santa Cruz。 AU600型全自动生化分析仪(Olympus);SpectraMax 多功能酶标仪(Molecular Devices);电泳仪、湿转仪和凝胶成像分析系统(Bio-Rad);HV-4离体组织器官恒温灌流系统(成都泰盟科技有限公司);血糖仪(B.Braun)。
3主要方法
3.1动物处理与分组 30只SD大鼠适应性饲养1周后随机分为正常对照(control)组10只(普通饮食);2型糖尿病模型组20只(高脂饲料)。连续饲养2个月诱发胰岛素抵抗后禁食4~6 h,2型糖尿病模型组予以一次性腹腔注射小剂量(35 mg/kg)链脲佐菌素(streptozotocin,STZ;溶于0.1 mol/L枸橼酸缓冲液,pH 4.5,现用现配,置于冰上),连续4 d。正常组予以等量的0.1 mol/L枸橼酸缓冲液作为对照。注射STZ后3 d、7 d和14 d,监测模型组随机血糖(blood glucose,BG),如BG≥16.7 mmol/L[空腹血糖(fasting blood glucose,FBG)≥11.1 mmol/L]视为造模成功。将成模大鼠随机分为模型对照(T2D)组与nFGF1给药(T2D+nFGF1)组,给药组按0.5 mg/kg剂量腹腔注射nFGF1(0.1 g/L),正常对照组与模型对照组则予以等量的生理盐水,连续隔天给药4周,给药期间监测各组大鼠的血糖情况。
3.2离体主动脉环舒张反应实验 大鼠麻醉后迅速取出主动脉,置于通以95% O2+5% CO2混合气体的Krebs-Henseleit (K-H)液中, 制成长度约为3.0 mm的血管环,标本负荷2 g,平衡90 min。先用KCl测定血管活性,待收缩反应达到坪值后,按累积法加入 10-12~10-3mol/L乙酰胆碱(acetylcholine,ACh),记录ACh每一累积浓度时的血管舒张效应,测定血管舒张的量效曲线。
3.3标本采集与处理 各组大鼠麻醉后心脏采血1 mL,迅速取出主动脉,用PBS冲洗干净,滤纸吸干放入冻存管于-80 ℃中保存。各组血液样本室温放置1 h后离心2次(3 000 r/min,10 min),吸取上清,保存于-80 ℃待测各项血清指标。
3.4血清生化指标检测与SOD活性检测 全自动生化仪检测血清葡萄糖(glucose)、胆固醇(cholesterol)和甘油三酯(triglyceride)水平。取各组大鼠的主动脉低温研磨,加入组织裂解液提取组织蛋白,采用黄嘌呤氧化酶法间接法测定SOD活性。
3.5Western blot检测相关蛋白水平 取冻存主动脉段,低温研磨组织并提取组织蛋白,SDS-PAGE分离蛋白后将COX-2、p-ERK和eNOS蛋白转移至 PVDF膜上,分别用对应 I 抗4 ℃孵育过夜;TBST洗涤 3次后,II 抗37 ℃孵育1 h;TBST洗涤3次后,ECL发光显色,凝胶成像系统扫描分析 。
4统计学处理
作为建筑功能完整实现的重要前提,建筑防水向来受到业界的重点关注。窗户、砖墙之间的缝隙、厨卫间等属于传统建筑容易出现渗漏的部位,但采用PC构件、灌浆连接(或节点现浇)工艺的预制装配式建筑却基本不会在这类部位出现渗漏,其渗漏一般源于外墙存在的大量拼接缝,这使得预制装配式建筑外墙防水密封向来受到业界的重点关注。空腔防水、材料防水属于最为常见的两种预制装配式建筑外墙防水密封方法,前者采用现浇混凝土或密封条形成二次密封,后者则通过嵌填密封材料处理接缝迎水面。但受到多方面因素影响,空腔防水很容易因空腔堵塞或墙板精度偏差而失效,密封胶存在的不足也会直接影响接缝迎水面处理效果[1]。
使用SPSS 19.0软件对实验数据进行分析,GraphPad Prism 6.0软件作图。所有数据均采用均数±标准误(mean±SEM)表示,使用单因素方差分析(one-way ANOVA)比较多组间数据,组间两两比较采用SNK-q检验,以P<0.05为差异具有统计学意义。
结 果
1大鼠造模情况
20只大鼠注射STZ后,模型成功大鼠有18只,之后有2只糖尿病大鼠死亡,正常对照组没有死亡情况。故处死动物时,control组10只,造模成功且存活的有16只,分为T2D组8只和T2D+nFGF1组8只。
2nFGF1对SD大鼠血糖的影响
在实验过程中,给药后 2 d开始检测各组大鼠的随机血糖。结果发现,与control组比较,T2D组随机血糖明显升高(P<0.05);与T2D组比较,T2D+nFGF1组随机血糖明显降低(P<0.05),后期会降到接近正常水平,见图1。
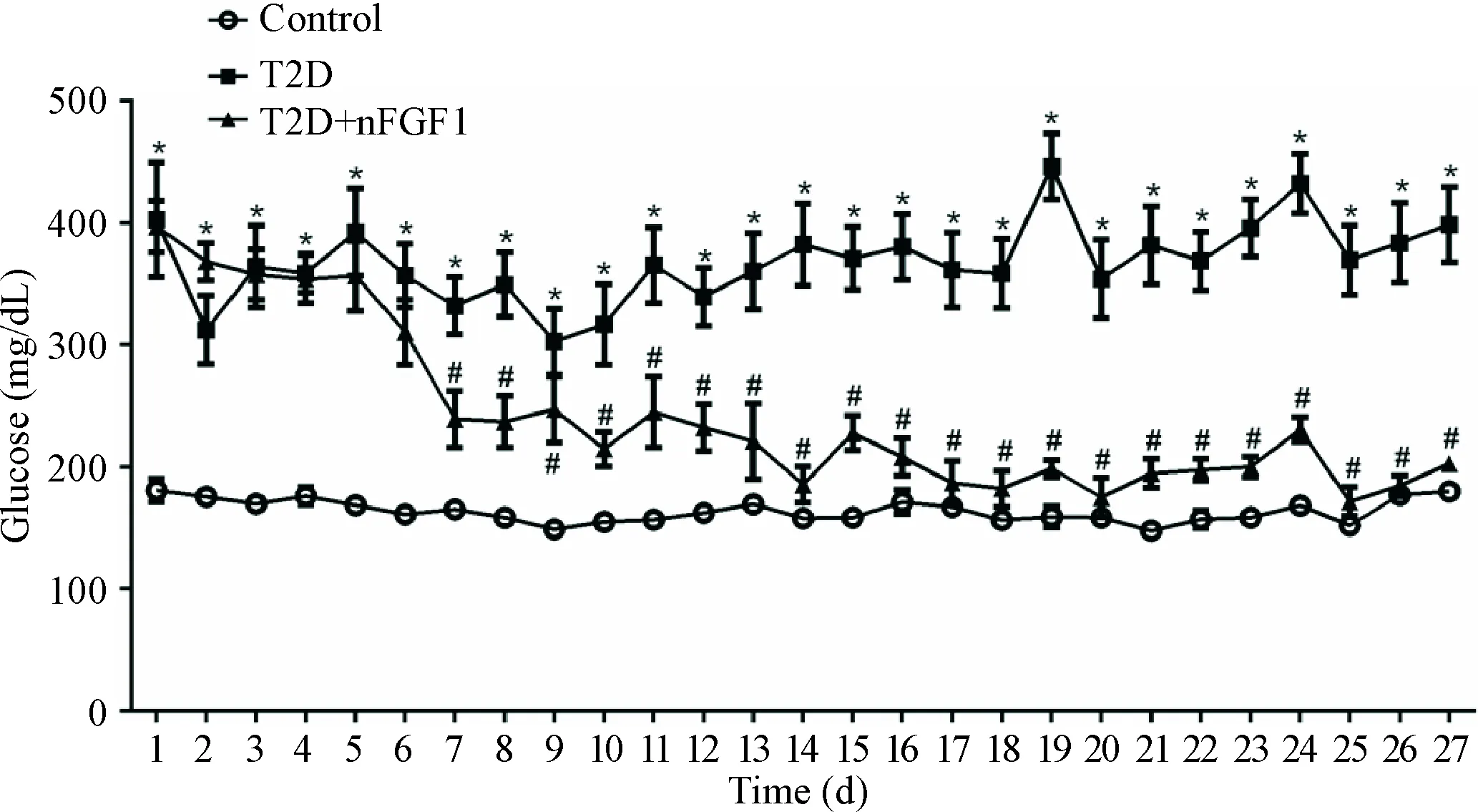
Figure 1. The changes of blood glucose in control, T2D and T2D+nFGF1 groups. Mean±SEM.n=8~10.*P<0.05vscontrol group;#P<0.05vsT2D group.
图1各组大鼠经nFGF1治疗后血糖的变化情况
3大鼠离体主动脉环舒张反应
与control组比较,T2D组大鼠血管环对各浓度ACh舒张反应性均降低(P<0.05);与T2D组比较,予以nFGF1治疗后能显著提高主动脉对ACh的舒张反应性(P<0.05)。我们取正常SD大鼠的主动脉,直接给予高糖刺激和nFGF1孵育(2 h),甘露醇作为对照,实验发现高糖刺激后血管环对各浓度ACh舒张反应性均降低(P<0.05),而予以nFGF1能显著提高主动脉对ACh的舒张反应性(P<0.05),见图2。实验结果说明,nFGF1对大鼠主动脉血管功能的保护作用并不是全部通过其降低血糖的作用来实现。
4各组大鼠SOD活性的检测
与control组比较,T2D组SOD活性明显降低(P<0.05);与T2D组比较,T2D+nFGF1组SOD活性明显升高(P<0.05),介于正常组和模型组之间,说明nFGF1有较强的抗氧化作用,见图3。
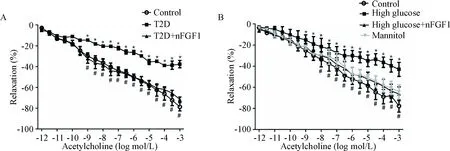
Figure 2. Relaxation of rat aortic rings to actetycholine (ACh) at different concentrations. A: relaxation of aortic rings to ACh from control, T2D and T2D+nFGF1 groups; B: relaxation of aortic rings to ACh from control rats pre-incubated with high glucose, high glucose+nFGF1 or mannitol for 2 h. Mean±SEM.n=8~10.*P<0.05vscontrol group;#P<0.05vsT2D or high glucose group.
图2大鼠主动脉血管环对不同浓度乙酰胆碱的舒张反应率
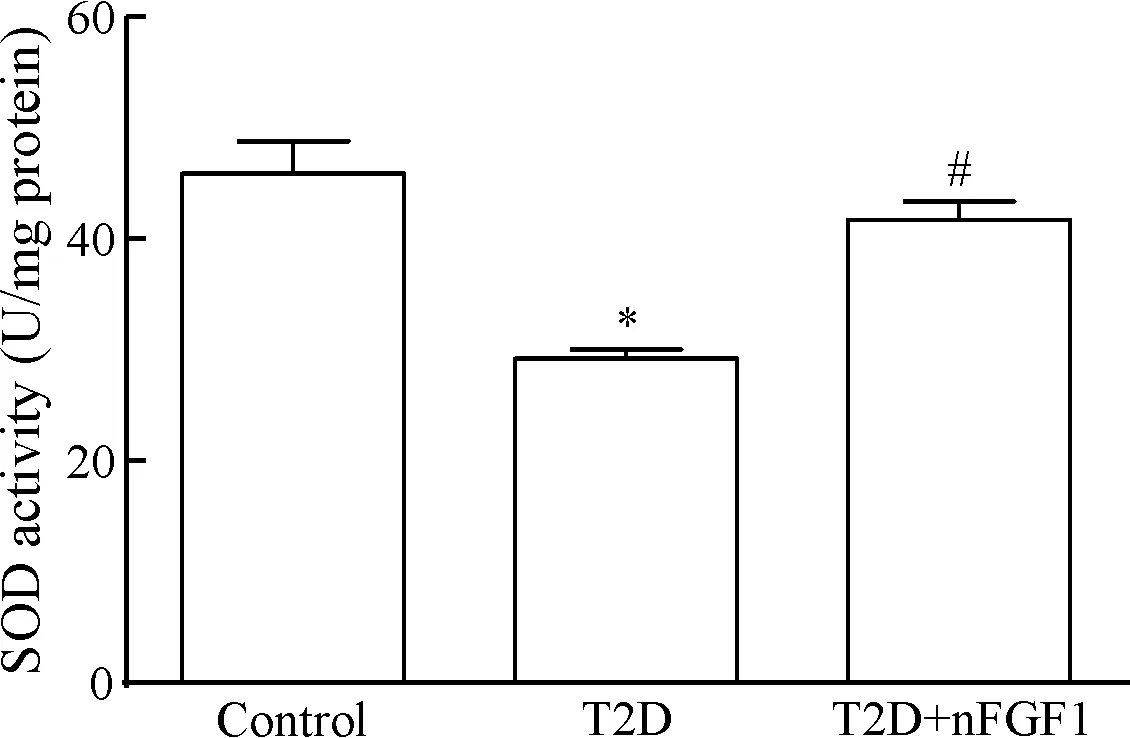
Figure 3. The level of SOD activity in each group. Mean±SEM.n=4~5.*P<0.05vscontrol group;#P<0.05vsT2D group.
图3各组大鼠主动脉组织的SOD活性水平
5各组大鼠血清生化指标的检测
与control组比较,T2D组血清葡萄糖、胆固醇和甘油三酯水平明显升高(P<0.05);与T2D组比较,T2D+nFGF1组血清葡萄糖、胆固醇和甘油三酯水平明显降低(P<0.05),介于正常组和模型组之间,说明nFGF1有较强降低血清葡萄糖、胆固醇和甘油三酯水平的作用,见图4。
6nFGF1对各组大鼠主动脉COX-2、p-ERK和eNOS蛋白表达的影响
与control组比较,T2D组的eNOS 蛋白水平明显减少(P<0.05),而COX-2和p-ERK的蛋白水平明显增加(P<0.05);予以nFGF1治疗后,与T2D组比较,T2D+nFGF1组的eNOS 蛋白水平明显上调(P<0.05),而COX-2和p-ERK的蛋白水平明显下调(P<0.05),见图5。这说明nFGF1能抑制COX-2/p-ERK 信号通路发挥抗炎症、抗氧化的作用,并进一步激活eNOS,从而增强血管舒张功能。

Figure 4. The serum levels of glucose (A), cholesterol (B) and triglyceride (C) in each group. Mean±SEM.n=4~5.*P<0.05vscontrol group;#P<0.05vsT2D group.
图4各组大鼠血清的葡萄糖、胆固醇及甘油三酯水平
讨 论
大血管病变是糖尿病患者最常见慢性并发症之一,80%糖尿病患者死于大血管病变。研究表明,高血糖、高血脂、氧化应激及炎症损伤等诸多因素均参与了糖尿病大血管病变的发生发展[9]。因此,调节糖脂代谢紊乱、减轻或阻断氧化应激以及炎症损伤是防治糖尿病大血管病变的重要途径。
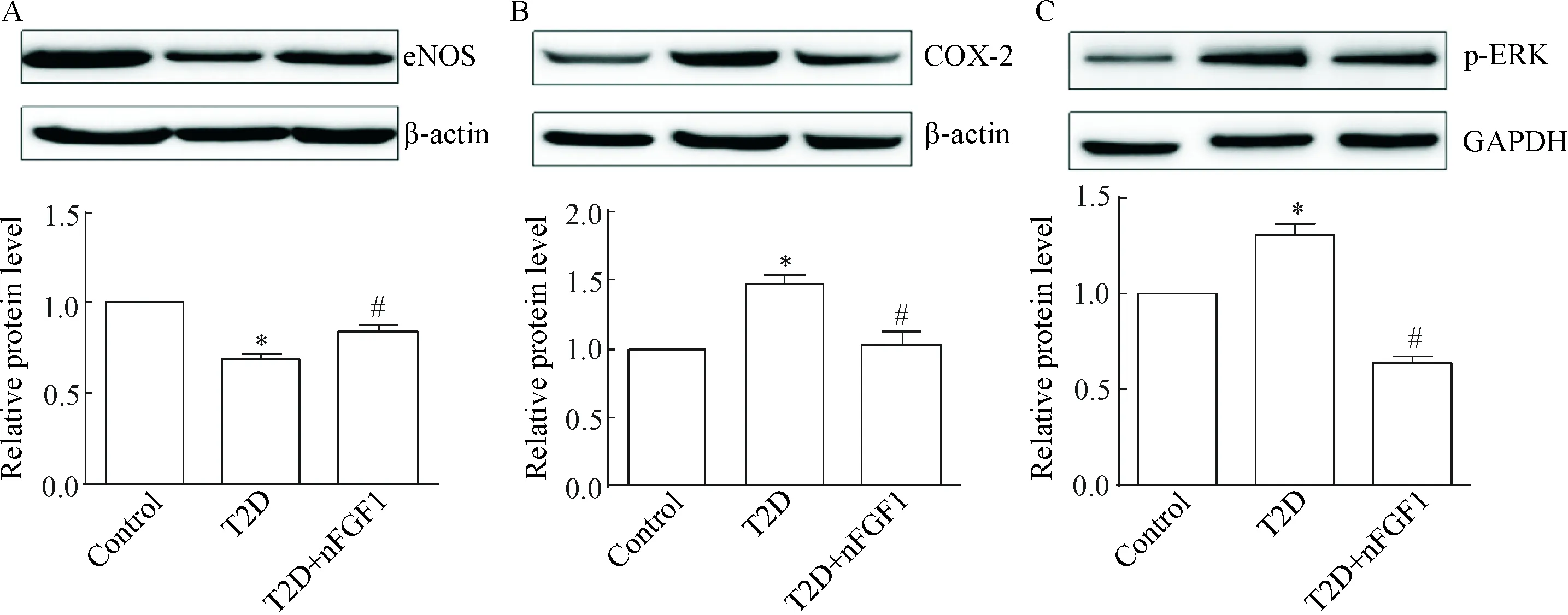
Figure 5. The protein levels of eNOS (A), COX-2 (B) and p-ERK (C) in each group. Mean±SEM.n=3.*P<0.05vscontrol group;#P<0.05vsT2D group.
图5各组大鼠主动脉组织中eNOS、COX-2和p-ERK蛋白水平的变化
在糖尿病大血管病变中,内皮依赖的血管舒张效应明显减弱,与NO合成的减少具有很大的关系。eNOS是内皮细胞NO合成的限速酶,血管内皮功能障碍一般与eNOS活性的降低有关,eNOS产生的NO对平滑肌细胞和内皮细胞本身有一定的调节作用,具有抗糖尿病大血管病变发展的作用,其活性下降会导致NO合成减少,促进糖尿病大血管病变的发生[10]。
FGF1是一种旁分泌促有丝分裂的信号蛋白,其在旁分泌系统中不仅具有促细胞分裂和增殖的作用,在代谢调控中也具有重要的作用[6]。研究表明FGF1能恢复小鼠自身自然调节胰岛素和血糖水平的能力,增加胰岛素敏感性,从而增强外周器官(如肝脏,肌肉等)的胰岛素信号通路,通过促进糖吸收等方式,使血糖维持在一个安全范围内,从而有效地逆转糖尿病的核心症状。FGF1是通过增加胰岛素敏感性起效的,增加胰岛素敏感性通常会降低系统炎症反应,其降糖能力依赖FGFR信号通路。但是FGF1对糖尿病大血管病变是否具有保护作用国内外尚未见报道。鉴于野生型FGF1显著的促细胞增殖活性具有潜在致肿瘤风险,我们将N端的24个氨基酸切掉,制备了没有促分裂活性的nFGF1[6]。
本研究中,我们通过给予SD大鼠高脂饲料诱发胰岛素抵抗,再予以小剂量的STZ腹腔注射成功复制了2型糖尿病模型。我们研究发现,予以nFGF1治疗后,相对于T2D模型组,给药组的血清葡萄糖、胆固醇和甘油三酯水平都明显的降低,血管舒张实验结果也表明nFGF1能改善血管的舒张功能。进一步通过Western blot测定,发现给药组中血管舒张功能的增强与eNOS增高有关,证实了nFGF1能降低血糖,调节血脂代谢紊乱,并可增强血管舒张功能。
研究表明,2型糖尿病可导致血管内皮细胞产生胰岛素抵抗,并抑制eNOS的活性和蛋白的表达。FGF1已被证实是一种高效的胰岛素增敏剂,可有效改善胰岛素抵抗。因此,FGF1改善2型糖尿病大鼠血管舒张功能可能与其对胰岛素抵抗的改善有关[11]。除此之外,糖尿病大血管病变也与氧化应激和血管炎症有重要的相关性[7-8,12]。 Brownlee[13]曾提出“糖尿病并发症的统一机制”学说:指出氧化应激是糖尿病并发症的共同基础。SOD是衡量机体氧化应激水平的主要指标之一,反映了机体抗氧化的能力。流行病学研究表明,糖尿病患者整体有轻度炎症性改变,血液中一些炎症因子如COX-2、p-ERK等增高[14]。之前的研究中亦发现在db/db糖尿病小鼠的主动脉和骨骼肌微血管中存在COX-2、p-ERK表达上调的情况[15-16]。本研究发现,糖尿病血管病变模型组大鼠SOD 活性明显降低,说明氧化应激促进了糖尿病血管病变的发生。而经nFGF1治疗后,其SOD活性明显增加。 FGF1的抗炎作用已在一些研究中有所涉及:它可以抑制ob/ob小鼠血液中某些炎症因子的水平;它也可以抑制非酒精性脂肪肝的炎症反应。我们也发现,通过Western blot可以检测到血管组织中COX-2和p-ERK蛋白水平有明显下调。以上结果说明,nFGF1可能可以通过降低糖尿病大鼠血管中的氧化应激和炎症水平来改善血管的功能。
在离体血管高糖刺激实验中,nFGF1也可以直接改善高糖孵育对血管的损伤作用,提示nFGF1对血管功能的改善还有一部分是不依赖于它的降糖效果而实现的。在这部分实验中,与高糖等渗透压的甘露醇并没有损伤血管功能,说明高糖对血管的损伤并不是通过提高渗透压来实现。研究表明,高糖可以引起血管内皮细胞产生大量的活性氧物质并且损伤内皮细胞的功能,甚至造成内皮细胞的凋亡[17-20]。有文献报道,FGF21可以缓解高糖造成的内皮细胞损伤和eNOS的功能障碍,并可明显提高内皮细胞NO的释放量[20]。由于nFGF1和FGF21都可以通过激活相同的受体FGFR1发挥生物学作用[6,21],同时结合我们的实验结果,我们认为高糖刺激可能是通过使血管内皮细胞产生严重的氧化应激从而损伤血管功能,而nFGF1对高糖刺激下血管功能损伤的缓解作用可能也与其抑制活性氧物质的生成以及恢复eNOS的功能相关。
[1] 刘江月.梓醇对糖尿病大鼠主动脉的保护作用与抗氧化机制研究[J].中国病理生理杂志, 2014, 30(6):1023-1028.
[2] 胡丽叶, 宋光耀, 朱旅云, 等.罗格列酮对2型糖尿病大鼠主动脉与肝病理学变化的干预作用[J].医学研究生学报, 2013, 26(7):700-704.
[3] Belov AA, Mohammadi M. Grb2, a double-edged sword of receptor tyrosine kinase signaling[J]. Sci Signal, 2012, 5(249):pe49.
[4] Karunakaran U, Park SJ, Jun dY, et al. Non-receptor tyrosine kinase inhibitors enhances β-cell survival by suppressing the PKCδ signal transduction pathway in streptozotocin-induced β-cell apoptosis[J]. Cell Signal, 2015, 27(6):1066-1074.
[5] 刘华伟, 赵 勇, 李贵生, 等. FGF-1及其突变体的研究进展[J].中国生物工程杂志, 2005, 25(8):1-5.
[6] Suh JM, Jonker JW, Ahmadian M, et al. Endocrinization of FGF1 produces a neomorphic and potent insulin sensitizer[J]. Nature, 2014, 513(7518):436-439.
[7] Hermans MP. Diabetes and the endothelium[J]. Acta Clin Belg, 2007, 62(2):97-101.
[8] Ceriello A, Motz E. Is oxidative stress the pathogenic mechanism underlying insulin resistance, diabetes, and cardiovascular disease? The common soil hypothesis revisited[J]. Arterioscler Thromb Vasc Biol, 2004, 24(5):816-823.
[9] Aronson D. Hyperglycemia and the pathobiology of diabe-tic complications[J]. Adv Cardiol, 2008, 45:1-16.
[10] Tabit CE, Chung WB, Hamburg NM, et al. Endothelial dysfunction in diabetes mellitus: molecular mechanisms and clinical implications[J]. Rev Endocr Metab Disord, 2010, 11(1):61-74.
[11] Hsueh WA, Quiones MJ. Role of endothelial dysfunction in insulin resistance[J]. Am J Cardiol, 2003, 92(4A):10J-17J.
[12] 徐 雷, 冯 波, 王 华, 等. 抗氧化剂α-硫辛酸对2型糖尿病大鼠动脉组织NF-κB表达的影响[J].中国病理生理杂志, 2007, 23(12):2474-2475, 2493.
[13] Brownlee M. The pathobiology of diabetic complications: a unifying mechanism[J]. Diabetes, 2005, 54(6):1615-1625.
[14] Helmersson J, Vessby B, Larsson A, et al. Association of type 2 diabetes with cyclooxygenase-mediated inflammation and oxidative stress in an elderly population[J]. Circulation, 2004, 109(14):1729-1734.
[15] Bagi Z, Erdei N, Toth A, et al. Type 2 diabetic mice have increased arteriolar tone and blood pressure: enhanced release of COX-2-derived constrictor prostaglandins[J]. Arterioscler Thromb Vasc Biol, 2005, 25(8):1610-1616.
[16] Guo Z, Su W, Allen S, et al. COX-2 up-regulation and vascular smooth muscle contractile hyperreactivity in spontaneous diabeticdb/dbmice[J]. Cardiovasc Res, 2005, 67(4):723-735.
[17] Chakravarthy U, Hayes RG, Stitt AW, et al. Constitutive nitric oxide synthase expression in retinal vascular endothelial cells is suppressed by high glucose and advanced glycation end products[J]. Diabetes, 1998, 47(6):945-952.
[18] Chen F, Qian LH, Deng B, et al. Resveratrol protects vascular endothelial cells from high glucose-induced apoptosis through inhibition of NADPH oxidase activation-driven oxidative stress[J]. CNS Neurosci Ther, 2013, 19(9):675-681.
[19] Wang Y, Ying L, Chen YY, et al. Induction of heme oxygenase-1 ameliorates vascular dysfunction in streptozotocin-induced type 2 diabetic rats[J]. Vascul Pharmacol, 2014, 61(1):16-24.
[20] Wang XM, Song SS, Xiao H, et al. Fibroblast growth factor 21 protects against high glucose induced cellular da-mage and dysfunction of endothelial nitric-oxide synthase in endothelial cells[J]. Cell Physiol Biochem, 2014, 34(3):658-671.
[21] Suzuki M, Uehara Y, Motomura-Matsuzaka K, et al. βKlotho is required for fibroblast growth factor (FGF) 21 signaling through FGF receptor (FGFR) 1c and FGFR3c[J]. Mol Endocrinol, 2008, 22(4):1006-1014.
(责任编辑: 陈妙玲, 罗 森)
Alleviation of aortic vascular dysfunction in STZ/HFD-induced type 2 diabetic rats by nFGF1
NAN Yan1, LI Na2, DONG Yu2, QIU Peng-cheng2, HU Zhi-sheng2, CAI Chang-zhou2, KONG Ling-guo2, HE Zheng-le2, YING Lei2, WANG Yang2
(1DepartmentofNeonatology,TheSecondAffiliatedHospitalandYuyingChildren’sHospital,WenzhouMedicalUniversity,Wenzhou325027,China;2DepartmentofPathophysiology,WenzhouMedicalUniversity,Wenzhou325035,China.E-mail:Wangydh995@163.com)
AIM: To investigate the protective effect of non-mitogenic fibroblast growth factor 1 (nFGF1) on the aortic vascular function in streptozotocin (STZ)/high-fat diet (HFD)-induced type 2 diabetic rats and its underlying mechanisms.METHODSFive-week-old male SD rats (n=30) were randomly divided into 3 groups (n=10 in each group), including normal control group, type 2 diabetic group and nFGF1 treatment group (type 2 diabetic rats were intraperitoneally injected with 0.5 mg/kg nFGF1 every other day for 4 weeks). After the rats were sacrificed, blood glucose, cholesterol and triglyceride levels, aorta diastolic function and superoxide dismutase (SOD) level in the aorta of each group were measured. Besides, the protein levels of cyclooxygenase-2 (COX-2), phosphorylated extracellular signal-regulated kinase (p-ERK) and endothelial nitric oxide synthase (eNOS) in the aorta were determined by Western blot.RESULTSnFGF1 markedly lowered blood glucose, cholesterol and triglyceride levels, enhanced aorta SOD activity and upregulated protein level of eNOS in the type 2 diabetic rats. Furthermore, the increased protein levels of COX-2 and p-ERK in the type 2 diabetic rats were largely abrogated by nFGF1.CONCLUSIONnFGF1 effectively attenuates aortic vascular dysfunction in the type 2 diabetic rats, which may be associated with decreasing blood glucose, cholesterol and triglyceride levels, reducing inflammation and oxidative stress response, and activating eNOS signaling pathway.
Type 2 diabetes; Fibroblast growth factor 1; Inflammation; Oxidative stress
1000- 4718(2017)11- 1945- 06
2017- 04- 10
2017- 07- 24
国家自然科学基金资助项目(No. 81400273);浙江省自然科学基金资助项目(No. LQ13H020006);温州市科技局公益技术研究医学项目(No. Y20140660);温州市科技局公益技术研究医学项目(No. Y20160097)
△通讯作者 Tel: 0577-86689817; E-mail: Wangydh995@163.com
▲并列第1作者
R587.1; R363
A
10.3969/j.issn.1000- 4718.2017.11.004
