BMSCs脑内移植改善AD小鼠学习记忆功能的分子机制研究*
2017-11-22范冲竹黄翠芹甘丹卉赵佳仪朱丽红陆大祥
范冲竹, 李 安, 黄翠芹, 甘丹卉, 李 勤, 赵佳仪, 王 珍, 朱丽红, 陆大祥
(暨南大学医学院病理生理学系, 脑科学研究所, 国家中医药管理局三级科研实验室, 广东 广州 510632)
·论著·
BMSCs脑内移植改善AD小鼠学习记忆功能的分子机制研究*
范冲竹, 李 安▲, 黄翠芹, 甘丹卉, 李 勤, 赵佳仪, 王 珍, 朱丽红, 陆大祥△
(暨南大学医学院病理生理学系, 脑科学研究所, 国家中医药管理局三级科研实验室, 广东 广州 510632)
目的观察骨髓间充质干细胞(BMSCs)脑内移植对阿尔茨海默病(AD)小鼠学习记忆能力及病理改变的影响,并对其分子机制进行探讨。方法将C57/BL6野生型(WT)小鼠和C57/BL6APP/PS1转基因(Tg)小鼠随机分为4组:WT/PBS组、WT/BMSCs组、Tg/PBS组及Tg/BMSCs组,侧脑室注射法将PBS或BMSCs注入小鼠脑内。术后第3天起进行持续8 d的Morris水迷宫实验以检测小鼠认知能力。术后第10天取材,组织免疫荧光染色检测小鼠脑内小胶质细胞的激活;real-time PCR检测CX3C趋化因子配体1(CX3CL1)、CX3C趋化因子受体1(CX3CR1)、IL-1β、TNF-α、Nurr1、YM1、胰岛素降解酶(IDE)和基质金属蛋白酶9(MMP9)的mRNA表达;ELISA检测脑组织匀浆CX3CL1和Aβ42的含量;Western blot检测突触后致密蛋白95(PSD95)、突触小泡蛋白(SYP)、p85和p110蛋白表达以及Akt磷酸化水平的变化。结果术后第10天,在APP/PS1小鼠海马区附近观察到移植的BMSCs。水迷宫实验结果显示,与WT/PBS组小鼠相比,Tg/PBS组小鼠逃避潜伏期明显延长(P<0.01),BMSCs移植治疗后APP/PS1小鼠逃避潜伏期明显缩短(P<0.05);与Tg/PBS组相比,Tg/BMSCs组CX3CL1在海马区的mRNA水平(P<0.01)及皮质区的蛋白水平(P<0.05)明显增加;BMSCs移植可以促进WT和Tg小鼠脑内小胶质细胞的激活,同时M2型小胶质细胞表面标志物YM1的mRNA表达上调(P<0.05)。Tg/PBS组与WT/PBS组相比,皮质区和海马区TNF-α的mRNA表达明显升高(P<0.05),皮质区Nurr1的mRNA表达降低(P<0.01);而与Tg/PBS组相比,Tg/BMSCs组皮质区的TNF-α(P<0.01)mRNA表达降低,CX3CR1和Nurr1的mRNA表达明显上调(P<0.05),海马区TNF-α和IL-1β的mRNA明显下调(P<0.05),CX3CR1和Nurr1的mRNA表达明显增加(P<0.05)。此外,Tg/BMSCs组的PSD95、p85和p110蛋白表达及Akt的磷酸化水平均较Tg/PBS组明显增加(P<0.05)。与Tg/PBS组比,BMSCs移植降低了APP/PS1小鼠脑内Aβ42蛋白的水平(P<0.05),增加了海马区Aβ清除相关酶IDE和MMP9的表达(P<0.05)。结论BMSCs移植可以调控神经炎症因子分泌,促进神经保护因子和突触蛋白的表达,从而改善APP/PS1小鼠的学习记忆能力,其分子机制可能是BMSCs移植上调CX3CL1后激活了PI3K/Akt通路。
骨髓间充质干细胞; CX3C趋化因子配体1; 阿尔茨海默病; 神经炎症; 神经保护
阿尔茨海默病(Alzheimer disease,AD)是一种认知和记忆能力进行性下降的慢性神经系统退行性疾病,病理特征包括胞外β-淀粉样蛋白(β-amyloid protein,Aβ)沉积、胞内神经纤维缠结和神经元丢失[1]。目前已确定的与AD相关的常染色体显性遗传突变基因包括淀粉样前体蛋白(amyloid precursor protein,APP)、早老素1(presenilin-1,PS1)和PS2,这些基因缺陷可导致AD患者和转基因小鼠的Aβ42沉积以及突触功能障碍[2]。目前临床上治疗AD的药物只能缓解症状,不能延缓或阻止AD患者中神经元的丢失和退化。干细胞移植治疗AD除了能分化为神经元整合入宿主脑网络中外,还能分泌神经营养因子、免疫调控因子以及促进Aβ清除;而干细胞修复受损的中枢神经系统主要是源于其调节免疫应答的能力和在宿主中的旁分泌效应[3-5]。在中枢神经系统内,CX3C趋化因子配体1(CX3C chemokine ligand 1, CX3CL1)/fractalkine主要表达于神经元上,它与特异性表达于小胶质细胞表面的相应受体CX3C趋化因子受体1(CX3C chemokine receptor 1, CX3CR1)具有高度亲和力[6]。Giunti等[7]通过体外研究表明,骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)能够通过分泌CX3CL1调控细菌脂多糖(lipopolysaccharide,LPS)诱导激活的小胶质细胞的形态和功能。但BMSCs体内移植是否也能通过对CX3CL1的调控进而改善AD尚未得到证实。为了进一步探讨骨髓间充质干细胞移植对AD模型小鼠的神经炎症、神经保护及突触塑形等的影响及机制,我们将BMSCs分别移植入野生型小鼠和AD模型小鼠脑内,检测BMSCs移植治疗后小鼠的行为学改变,并探讨BMSCs在不同环境下的旁分泌作用及其治疗AD可能的分子机制。
材 料 和 方 法
1动物
C57/BL6APP/PS1双转基因(transgenic, Tg)雄性小鼠9只和C57/BL6野生型(wild-type, WT)雌性小鼠20只(购于广东省动物中心,动物合格证编号为44007200030473和44007200030475)。饲养于SPF环境中,室温(22±2) ℃,12 h 昼/夜交替照明。动物适应环境后,转基因小鼠与野生型小鼠配种,扩群,后代长至3周时取尾部组织做基因型鉴定,鉴定完成后将野生型与转基因型分笼饲养。待小鼠长至18周龄时进行体内实验。
2主要试剂
鼠尾直接PCR试剂盒购自Biotool;Dulbecco’s modified Eagle medium (DMEM)/F12及胎牛血清(fetal bovine serum,FBS)购自Life technologies;绿色荧光蛋白(green fluorescent protein,GFP)腺病毒载体购自上海吉凯基因化学技术有限公司;总RNA提取、逆转录及TaqDNA聚合酶试剂购于TaKaRa;EILSA试剂盒购自BioLegend和Cloud-Clone Corp.;抗突触相关蛋白突触后致密蛋白95(postsynaptic density protein 95, PSD95)、突触小泡蛋白(synaptophysin, SYP)、β-tubulin及离子钙结合接头分子1(ionized calcium-binding adaptor molecule-1,IBA-1)抗体购自Abcam;引物由英潍捷基上海贸易有限公司根据设计合成。
3主要方法
3.1BMSCs的培养及鉴定 取3周龄C57/BL6小鼠股骨及胫骨骨髓,制备成单细胞悬液,采用全骨髓培养法进行培养,培养基为DMEM/F12+12%FBS。当细胞长满培养瓶80%时进行传代(用含0.25% EDTA的胰酶消化)。多次传代法对骨髓干细胞进行纯化。利用茜素红染色法和油红O染色法对提取纯化的第4代BMSCs进行成骨分化和成脂分化诱导;流式细胞术检测BMSCs细胞表面特异性标志物CD105、CD29和Sca1以及造血细胞表面标志物CD45的表达。
3.2动物分组及绿色荧光蛋白标记BMSCs侧脑室注射后的脑内示踪 利用携带GFP的腺病毒感染BMSCs:感染复数为100,稀释液为基础培养基,病毒作用1 h 后换为完全培养基继续培养;48 h后镜下观察荧光表达。侧脑室注射(intracerebroventricular injection,icv):首先用1.25%三溴乙醇对小鼠腹腔注射(15 μL/kg)进行麻醉,后将其固定于脑立体定位仪上,碘伏消毒头顶部皮肤,头顶正中由前向后作长约 1 cm 手术切口,参照小鼠脑立体定位图谱,以前囟向后2.0 mm、矢状缝(mediolateral, ML)左右1.5 mm为注射点,进针深度(dorsoventral,DV)2.5 mm。准确定位后,先用钝性针头作一小孔,见脑脊液溢出,再用微量进样针向侧脑室内缓慢注入8 μL PBS或BMSCs细胞悬液,每注射2 μL停针2 min。注射完毕后留针5 min,缓慢退针,碘伏消毒,缝合术区切口,对皮,再次碘伏消毒。同窝出生Tg或WT小鼠随机分为4组,每组5只:(1)WT/PBS组:icv法将PBS液注入WT小鼠脑内,每只8 μL;(2)WT/BMSCs组:icv法将携带GFP的BMSCs单细胞悬液注入WT小鼠脑内,每只8 μL(1.5×105cells);(3)Tg /PBS组:icv法将PBS注入Tg小鼠脑内,每只8 μL;(4)Tg /BMSCs组:icv法将携带绿色荧光蛋白的BMSCs单细胞悬液注入Tg小鼠脑内,每只8 μL(1.5×105cells)。术程顺利,术中无小鼠死亡。侧脑室注射后第10天,麻醉处死小鼠,取出全脑,常规方法制备冰冻切片,避光。荧光显微镜下观察注入脑内的BMSCs。整个实验过程通过暨南大学实验动物伦理委员会审查。
3.3Morris水迷宫实验检测小鼠空间学习及记忆能力 术后休息2 d后,小鼠进行Morris水迷宫实验。水深约20 cm,平台隐藏于水下,水温22 ℃~24 ℃。(1)第1天~第7天的定位航行实验检测小鼠学习能力: 水迷宫分为4个象限,随机将小鼠从任一象限以脸部面向池壁放入水中,记录小鼠找到隐藏平台所需时间,作为潜伏期;探寻总时长为60 s,若小鼠未能在规定时间内找到平台,则引导其游上平台并在平台停留10 s,其潜伏期记为 60 s。(2)第8天的空间探索实验检测小鼠记忆能力:实验第8天撤去水下平台,选取平台所在象限的对角象限为小鼠入水点,记录小鼠在 60 s内穿过平台区的次数及在平台象限内停留的时间。
3.4Real-time PCR检测脑组织中相关因子的表达 手术后第10天提取小鼠皮质及海马组织的RNA,利用Roche LC480荧光定量PCR仪通过real-time PCR检测相关因子的mRNA表达量。RNA提取、反转录和real-time PCR均严格按试剂说明书操作。以GAPDH作为内参照。扩增反应分为98 ℃解链10 s、55 ℃退火30 s、72 ℃延伸(1 min/kb)3步,共35个循环。引物序列见表1。
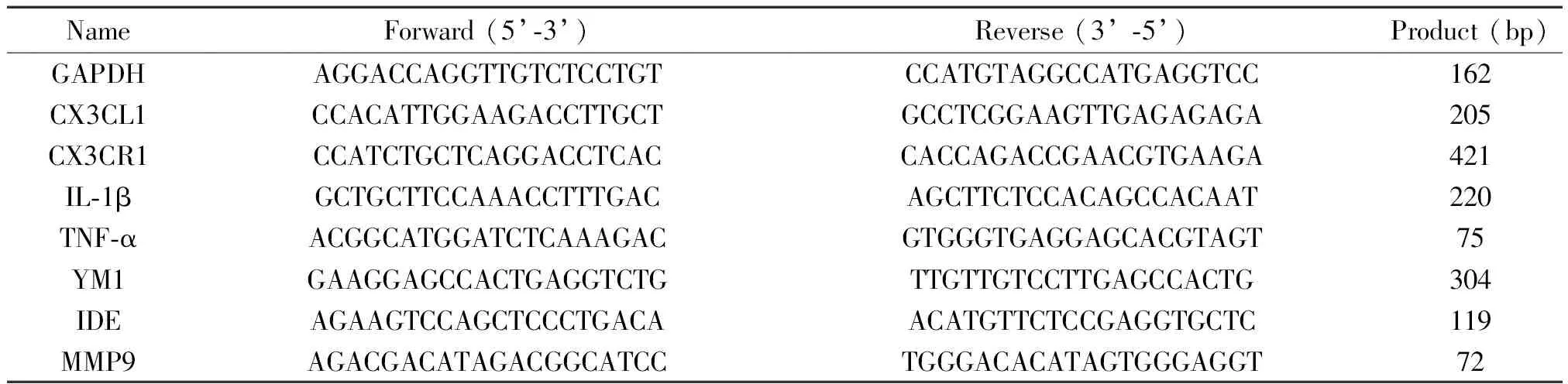
表1 Real-time PCR引物序列
3.5组织免疫荧光染色检测小胶质细胞的激活 将脑组织冰冻切片室温复温15 min,PBS 洗3次;0.3% Triton X-100通透10 min,0.025% Triton X-100/PBS 洗 3 次;1% BSA 室温封闭 1 h,弃封闭液,加入抗IBA-1抗体(1∶100),湿盒中4 ℃孵育过夜。去除Ⅰ抗,PBS 洗 3 次,加入相应的荧光Ⅱ抗室温孵育 1 h ,PBS 洗3 次,DAPI 室温孵育5 min,封片,荧光显微镜下观察并拍照保存。
3.6ELISA法检测CX3CL1及Aβ42的蛋白含量 低温匀浆将小鼠脑组织研磨制成匀浆液。4 ℃、12 000×g离心10 min,取上清,后续实验按照CX3CL1和Aβ42的ELISA说明书严格操作。
3.7Western blot 检测突触相关蛋白的表达 提取各组小鼠脑组织蛋白,BCA定量试剂盒进行蛋白定量。行8% SDS-PAGE,根据 Marker 指示切取目的条带,半干电转移法将蛋白转移至 PVDF 膜,5% 脱脂奶粉室温封闭 1 h;分别加入相应Ⅰ抗(1∶1 000 稀释)后,摇床上4 ℃孵育过夜,TBST清洗3次,每次10 min;加入相应Ⅱ抗(1∶5 000稀释),室温孵育1 h,TBST清洗 4次每次10 min,ECL 发光液发光显色,X 线底片曝光; GAPDH或β-tubulin作为内参照。实验重复 3 次。
4统计学处理
采用SPSS 13.0 统计软件进行统计学分析,数据以均数±标准误(mean±SEM) 表示,组间比较用单因素方差分析(one-way ANOVA),方差齐时组间两两比较用Bonferroni校正的t检验,若方差不齐,则组间两两比较用Tamhane’s T2检验。以P<0.05为差异有统计学意义。
结 果
1骨髓间充质干细胞的培养及鉴定
提取的BMSCs传至第4代时呈均匀的成纤维细胞样生长(图1A),茜素红染色法和油红O染色法诱导后,分别可见大量钙化结节和脂滴形成(图1B、C)。流式细胞术检测发现,BMSCs细胞表面的特异性标志物CD105、CD29和Sca 1呈高表达,阳性率分别为78.0%、81.7%和95.8%,而造血细胞表面标志物CD45的阳性率为3.4%,呈低表达(图1D)。诱导分化结果表明提取的干细胞多向分化能力好,可用于后续实验。
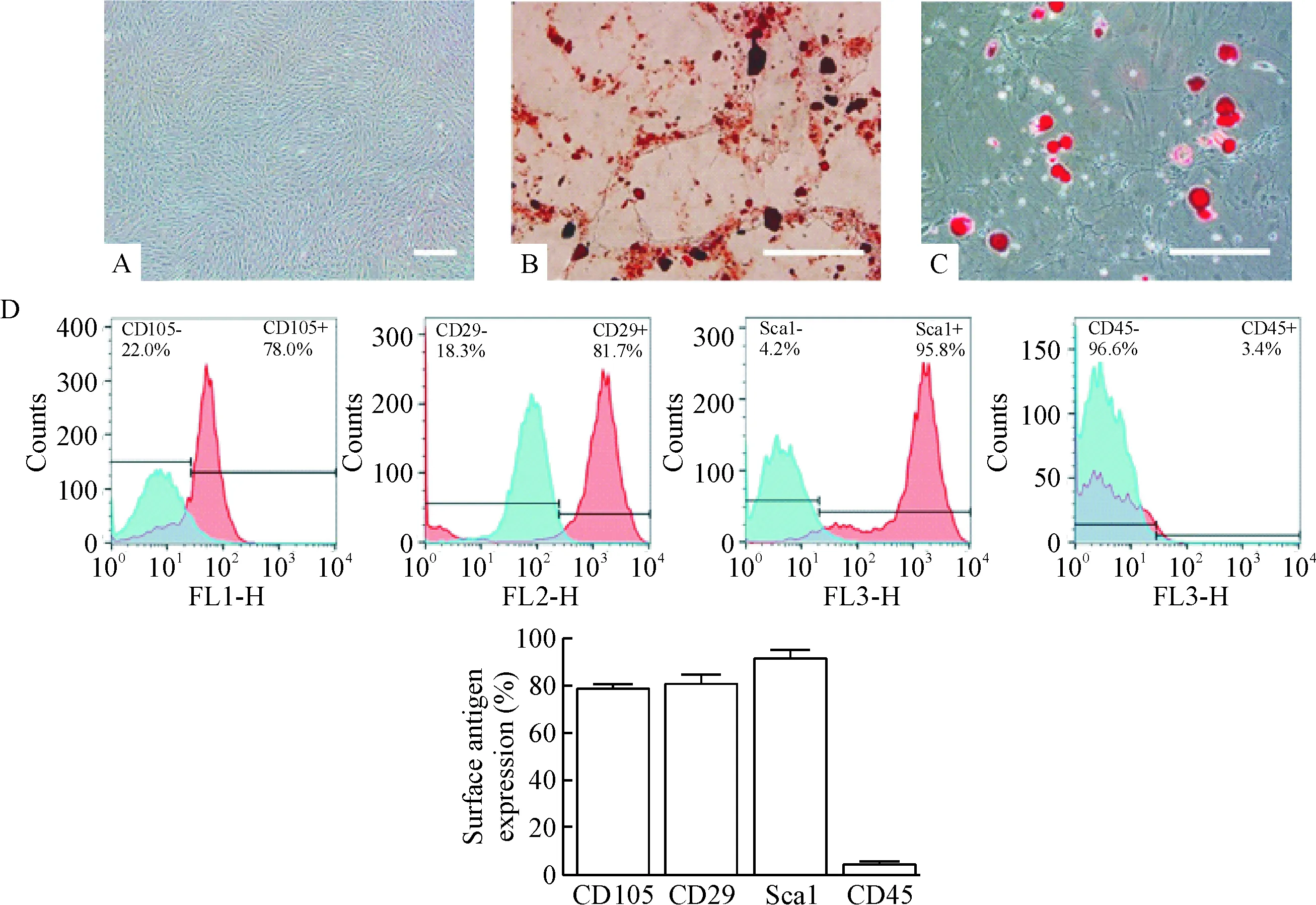
Figure 1. Culture and identification of primary BMSCs. A: phase-contrast micrograph of the BMSCs at passage 4 (P4); B: osteogenic differentiation of P4 BMSCs was determined by alizarin red staining; C: adipogenic differentiation of P4 BMSCs was determined by oil red O staining; D: the expression of CD105, CD29, Sca1 and CD45 on the surface of the BMSCs was detected by flow cytometry. The scale bar=200 μm.
图1原代骨髓间充质干细胞的培养及鉴定
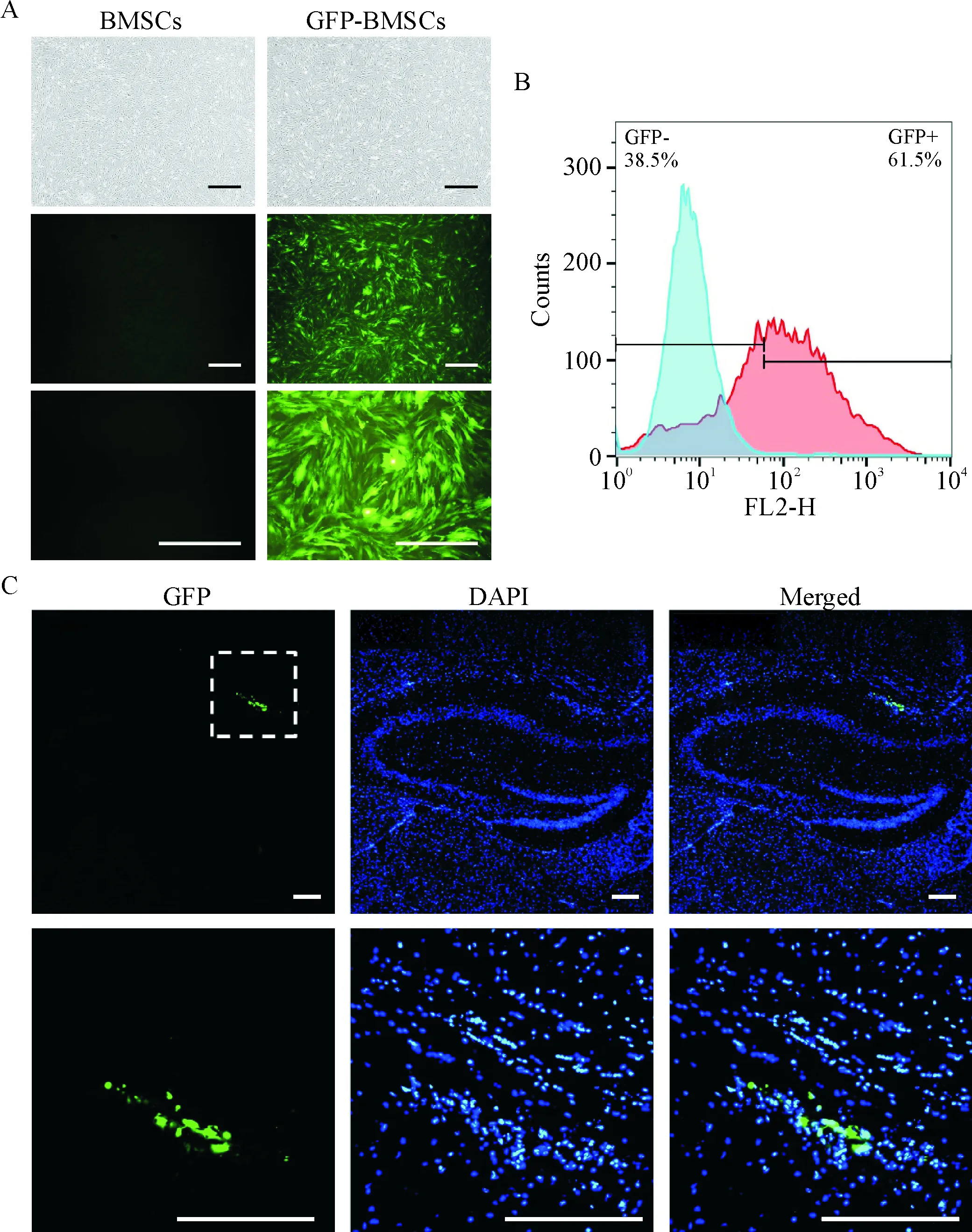
Figure 2. The observation of green fluorescent protein (GFP)-labeled BMSCs and the injected GFP-BMSCs in the lateral ventricles ofAPP/PS1 mice. A: no spontaneous fluorescence in BMSCs, and GFP-labeled cells showed green fluorescence under fluorescence microscope; B: the transfection efficiency was 61.5% determined by flow cytometry; C: immunofluorescence staining of transplanted BMSCs in the brain ofAPP/PS1 mice. Green: GFP; blue: DAPI. The scale bar=100 μm.
图2GFP标记的BMSCs及注射入小鼠侧脑室内BMSCs的示踪观察
2携带绿色荧光蛋白的腺病毒感染BMSCs及小鼠脑室内BMSCs的示踪
携带GFP的腺病毒感染BMSCs 48 h后,可见BMSCs表达大量绿色荧光,细胞形态好,未见明显自发荧光表达。流式细胞术检测转染效率为61.5%。BMSCs移植入小鼠脑内10 d,在海马区附近发现了移植的BMSCs,见图2。
3BMSCs移植治疗后小鼠的行为学及病理改变
3.1BMSCs移植治疗对小鼠空间学习和记忆能力的影响 Morris水迷宫定位航行实验1 d、3 d、5 d和7 d的实验结果表明,与WT/PBS组相比,Tg/PBS组小鼠的逃避潜伏期明显延长(P<0.01);而在BMSCs移植治疗后,APP/PS1小鼠的逃避潜伏期明显缩短(P<0.05);第7天定位航行代表性路径图表明,与Tg/PBS组小鼠相比,BMSCs移植治疗的APP/PS1小鼠导航策略变得更好。第8天的空间探索实验结果显示,Tg/PBS组穿越平台次数为2.40±0.51,Tg/BMSCs组穿越平台次数为5.20±1.16(P<0.05),各组间在目标象限停留时间的差异无统计学显著性;定位航行代表性轨迹图显示,与野生型小鼠相比,PBS处理组APP/PS1小鼠的空间记忆能力更差,在BMSCs移植后APP/PS1小鼠的探索路径趋向于野生型改变。这表明BMSCs移植可以改善APP/PS1小鼠的学习记忆能力,见图3。
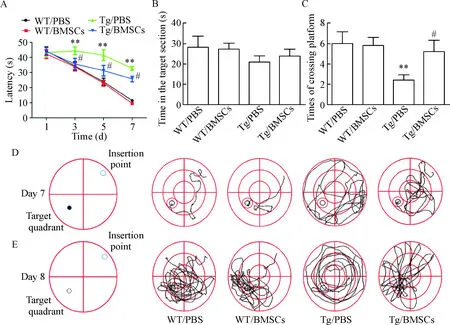
Figure 3. Transplantation of BMSCs improved the spatial learning and memory abilities ofAPP/PS1 mice. A: water maze escape latencies ofAPP/PS1 mice or WT mice which were injected with PBS or BMSCs intracerebroventricularly; B and C: on the final day, the 60-second probe trial was conducted to detect the times of each animal entering the small target zone (C) and the time spent in the target quadrant (B); D: the representative swimming paths at day 7 of training with orientation navigation; E: the representative swimming paths at day 8 of training with space exploration. Mean±SEM.n=5.**P<0.01vsWT/PBS group;#P<0.05vsTg/PBS group.
图3BMSCs移植可以改善APP/PS1小鼠的空间学习和记忆能力
3.2BMSCs移植对小鼠脑内趋化因子CX3CL1表达的影响 实验结果表明,与WT/PBS小鼠相比,Tg/PBS处理组小鼠海马区CX3CL1的mRNA表达降低(P<0.01);BMSCs移植后APP/PS1小鼠海马区CX3CL1的mRNA表达较Tg/PBS组明显增加(P<0.01);皮质区有增加,但差异无统计学显著性。进一步对小鼠皮质区CX3CL1蛋白表达进行检测,结果表明BMSCs移植显著上调了APP/PS1小鼠皮质区CX3CL1蛋白的表达(P<0.05)。同时我们发现BMSCs移植对野生型小鼠脑内CX3CL1的表达无显著影响,见图4。
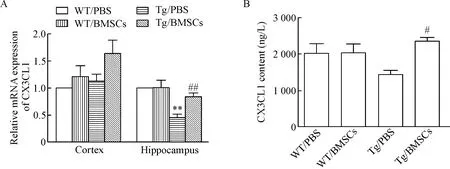
Figure 4. BMSC transplantation up-regulated the expression of CX3CL1 at mRNA and protein levels in the brain ofAPP/PS1 mice. A: the mRNA expression of CX3CL1 in the hippocampus and cortex detected by real-time PCR; B: the protein concentration of CX3CL1 in the cortex detected by ELISA. Mean±SEM.n=4.**P<0.01vsWT/PBS group;#P<0.05,##P<0.01vsTg/PBS group.
图4BMSCs移植对APP/PS1小鼠脑内CX3CL1表达的影响
3.3BMSCs移植上调CX3CL1可以通过对小胶质细胞的调控影响脑内神经炎症因子和神经保护因子的表达 组织免疫荧光结果表明,与PBS处理组相比,无论是在野生型小鼠还是转基因型小鼠,BMSCs移植均可以明显激活脑内的小胶质细胞。Real-time PCR实验结果显示,与Tg/PBS组相比,Tg/BMSCs组M2型小胶质细胞表面标志物YM1的mRNA表达明显增加(P<0.05)。此外,与WT/PBS组相比,Tg/PBS组肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的mRNA表达明显增加(P<0.01),白细胞介素1β(interleukin-1β,IL-1β)表达未见明显上升;BMSCs移植后,APP/PS1小鼠皮质区TNF-α、海马区TNF-α及IL-1β的mRNA表达明显降低(P<0.05);同时增加了皮质区及海马区神经保护因子CX3CR1和Nurr1的mRNA表达(P<0.05)。值得注意的是,与WT/BMSCs组相比,Tg/BMSCs组皮质区的TNF-α及IL-1β的mRNA表达均明显降低(P<0.05),见图5。
Figure 5. The effects of BMSC transplantation on the morphology of microglia and the expression of inflammatory factors and neuroprotective factors. A: immunofluorescence staining showed the activation of microglia in theAPP/PS1 mice or WT mice with intracerebroventricular injection of BMSCs or PBS (the scale bar=200 μm); B: the mRNA expression of YM1 in the brain; C: the mRNA expression of TNF-α, IL-1β, CX3CR1 and Nurr1 in the hippocampus and cortex. Mean±SEM.n=4.**P<0.01vsWT/PBS group;#P<0.05,##P<0.01vsTg/PBS group;△P<0.05vsWT/BMSCs group.
图5BMSCs移植对小胶质细胞的形态及相关炎症因子和神经保护因子表达的影响
3.4BMSCs上调CX3CL1可以促进APP/PS1小鼠脑内突触相关蛋白的表达 Western blot实验结果表明,Tg/PBS组与WT/PBS组小鼠之间突触相关蛋白表达未见明显差异;但与Tg/PBS组相比,BMSCs移植可以显著增加APP/PS1小鼠脑内突触相关蛋白PSD95的表达(P<0.05),SYP蛋白表达在各组间差异无统计学显著性,见图6。

Figure 6. Transplantation of BMSCs increased the protein expression of PSD95 inAPP/PS1 mice. Mean ±SEM.n=4.#P<0.05vsTg/PBS group.
图6BMSCs移植可以促进APP/PS1小鼠脑内突触蛋白PSD95的表达
3.5BMSCs移植可以降低APP/PS1小鼠脑内Aβ42蛋白的水平及上调Aβ清除相关因子的表达 ELISA结果显示,与WT/PBS组相比,Tg/PBS组小鼠脑内Aβ42蛋白水平明显增加(P<0.01);BMSCs移植后APP/PS1小鼠脑内Aβ42蛋白水平明显较Tg/PBS组降低(P<0.05)。此外,与WT/PBS组相比,PBS处理组AD模型小鼠海马区Aβ清除相关因子胰岛素降解酶(insulin-degrading enzyme,IDE)的表达降低(P<0.01),在BMSCs移植后,APP/PS1小鼠海马区的IDE及基质金属蛋白酶9(matrix metalloprotease 9,MMP9)的mRNA表达明显较Tg/PBS组增加(P<0.05),见图7。
3.6BMSCs移植可以上调APP/PS1小鼠脑内的p85、p110和p-Akt的蛋白水平 Western blot结果显示,与WT/PBS组相比,Tg/PBS组小鼠脑内磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)调节亚基p85和催化亚基p110的蛋白表达明显降低(P<0.05);BMSCs移植后APP/PS1小鼠脑内的p85和p110蛋白的表达以及Akt蛋白的磷酸化水平均显著上调(P<0.05),见图8。
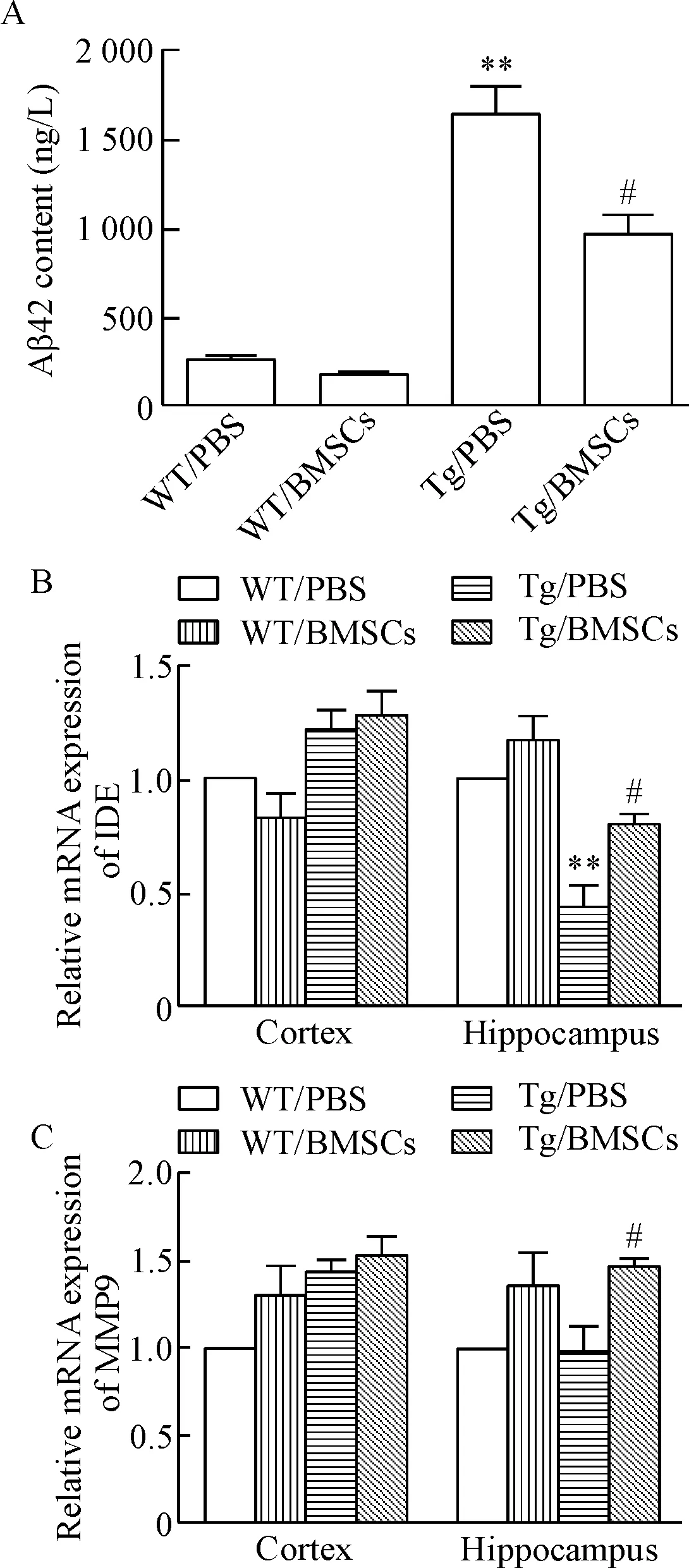
Figure 7. The effects of BMSC transplantation on the protein le-vel of Aβ42 and the mRNA expression of Aβ clearance-related factors inAPP/PS1 mice. A: Aβ42 content measured by ELISA; B: the mRNA expression of IDE and MMP9 in the hippocampus and cortex detected by real-time PCR. Mean±SEM.n=4.**P<0.01vsWT/PBS group;#P<0.05vsTg/PBS group.
图7BMSCs移植对APP/PS1小鼠Aβ42蛋白及Aβ清除相关因子表达的影响
讨 论
随着对干细胞研究的深入,干细胞治疗神经系统退行性疾病已取得较多进展,研究证实,干细胞移植在一定程度上可以改善包括AD在内的神经退行性疾病的认知、学习和记忆能力[9]。但是,由于AD的病理多样性以及干细胞移植后与宿主脑之间相互作用的复杂性,对干细胞移植治疗AD的具体机制至今仍不十分明确,这也是当前研究的重点和难点。本研究旨在探讨干细胞移植治疗AD的作用及其分子机制。行为学检测结果显示,与PBS处理的APP/PS1小鼠相比,BMSCs移植可以显著改善APP/PS1小鼠的学习记忆能力,这进一步证实了Lee等[10]的研究,即BMSCs移植可以改善APP/PS1小鼠的空间学习和记忆能力。
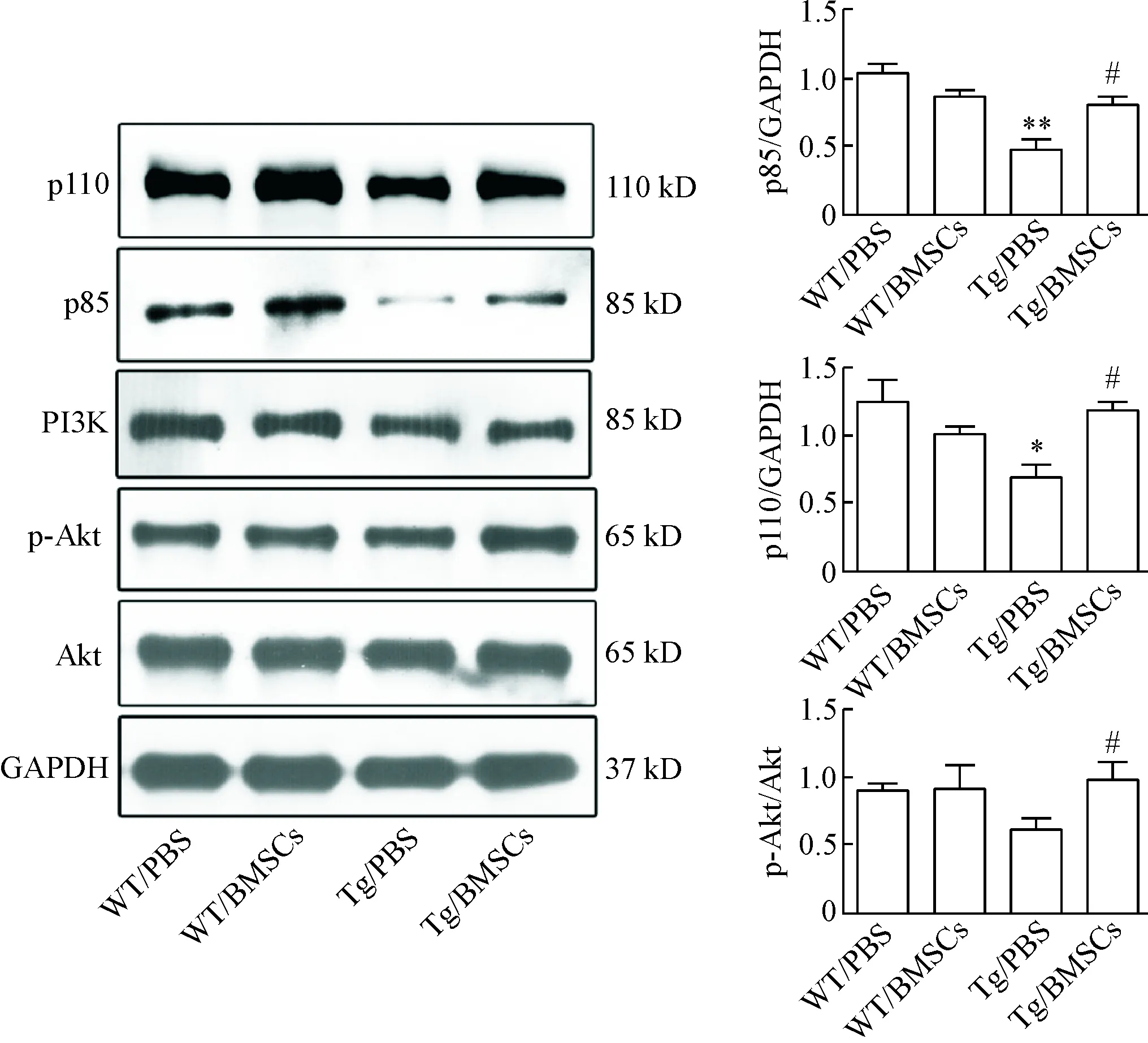
Figure 8. The protein levels of p85, p110 and p-Akt in each group. Mean±SEM.n=4.*P<0.05,**P<0.01vsWT/PBS group;#P<0.05vsTg/PBS group.
图8各组小鼠脑组织p85、p110及p-Akt蛋白水平的比较
BMSCs移植治疗神经系统疾病可能是由于它释放的细胞因子、趋化因子以及神经营养因子等通过对机体免疫反应的调控实现的[11]。体外研究已表明,BMSCs受炎症信号驱动,可以通过释放趋化因子CX3CL1对小胶质细胞的稳态进行调控,进而促使小胶质细胞发挥有益的神经保护作用[7-8]。然而BMSCs移植入AD模型小鼠脑内对CX3CL1分泌的影响尚未见报道,但阐明这一问题对于了解BMSCs治疗AD的机制又非常有意义,故本实验对BMSCs移植后小鼠脑内CX3CL1的表达进行了检测。结果表明,无论是在皮质区还是海马区,BMSCs移植均可以显著上调APP/PS1小鼠脑内的CX3CL1的表达。研究表明,mRNA与蛋白质之间并不是严格的线性关系,而是内在的、复杂的依赖关系,转录本自身的稳定性和被翻译的效率及翻译产物的稳定性都会影响最终产物的表达量,且基因表达的调控层次很多,转录水平的调控只是一个环节,转录后调控、翻译以及翻译后修饰都会影响最后的蛋白量[12]。因此,本研究中皮质区CX3CL1在mRNA水平未见统计学显著性差异,蛋白水平检测可见差异有统计学显著性,这一情况是可以解释的。相对于AD模型小鼠,BMSCs移植对WT小鼠脑内CX3CL1的表达影响并不明显,这表明BMSCs对CX3CL1的调控作用可能受其所在微环境的影响。
小胶质细胞作为中枢神经系统常驻免疫活性细胞,参与了AD脑内的神经炎症、神经保护以及Aβ清除等病理生理过程,而小胶质细胞究竟是发挥神经保护还是神经损伤作用主要取决于脑内微环境的多因素调控,神经趋化因子CX3CL1与其受体CX3CR1的相互作用是小胶质细胞的重要调控因素之一[13]。趋化因子CX3CL1在脑内主要表达于神经元,分为可溶型和膜结合型,两种形态的趋化分子均只与主要表达于小胶质细胞上的唯一受体CX3CR1结合[6],进而对中枢神经系统的稳态维持及疾病发生发展起作用。Hoshiko等[14]的研究表明,CX3CL1-CX3CR1相互作用可以促进正常大脑内神经元存活、突触成熟、突触传导以及成年海马神经发生。正常情况下,中枢神经系统内的小胶质细胞处于相对静止状态,当发生脑损伤和炎症时小胶质细胞会被激活,激活的小胶质细胞可分为“经典激活型”(M1型)和“替代激活型”(M2型)[15]。其中M1型小胶质细胞与多种促炎因子的产生和释放有关,而M2型小胶质细胞则与抗炎因子产生和组织修复相关[16]。Cho等[17]的研究表明BMSCs可以通过增加CX3CR1的释放而诱导小胶质细胞从有害型向保护型转变。小胶质细胞与脑内的炎症反应密切相关,LPS作为致炎因子对小胶质细胞的激活作用也已被证实[7, 15, 18]。近来的研究还表明,CX3CL1可以有效阻断LPS和干扰素γ诱导激活的小胶质细胞所释放的IL-1β和TNF-α,它可能是通过PI3K通路发挥作用的[19]。PI3K/Akt通路参与细胞内多种细胞途径,CX3CL1与其受体CX3CR1结合可以快速激活小胶质细胞内的Akt活化,这一作用还具有时间和剂量依赖性,外源性CX3CL1也可以通过调控PI3K通路维持老年大鼠脑内小胶质细胞的稳态[20]。本研究发现,BMSCs移植后APP/PS1小鼠脑内小胶质细胞的激活增加。同时BMSCs移植处理的APP/PS1小鼠脑内M2型小胶质细胞表面标志物YM1的表达明显增加;且BMSCs移植还提高了APP/PS1小鼠脑内PI3K调节亚基p85、催化亚基p110的蛋白水平和Akt蛋白的磷酸化水平。这提示CX3CL1上调可以通过使小胶质细胞转向保护型来降低APP/PS1小鼠脑内炎症因子TNF-α和IL-1β的分泌,增加神经保护因子CX3CR1和Nurr1的表达;其分子机制可能是通过对PI3K/Akt通路的调控实现的。本研究中海马区各个因子的变化较皮质区改变明显,这可能是由于海马是AD发病时最先受累的区域[21]。需要说明的是,BMSCs移植入WT小鼠上调了其皮质区TNF-α及IL-1β的表达,考虑可能为正常脑组织的排异反应,具体机制有待进一步研究。
神经系统内突触功能障碍时,将导致神经细胞间无法进行有效的信息传递。CX3CL1是有效诱发兴奋性突触传递的神经调节剂,在突触可塑性和神经保护中起重要作用[22]。本研究也表明,BMSCs移植上调CX3CL1可以促进APP/PS1小鼠脑内突触相关蛋白PSD95的表达。CX3CL1-CX3CR1对突触塑形的调控和认知功能障碍的改善可能是通过调控长时程增强实现的[23]。Aβ沉积形成老年斑是AD的重要病理特征之一,Aβ单体由APP受水解酶剪切而来,细胞周围过多的Aβ沉积将通过诱导氧化应激、内质网应激和细胞钙调节紊乱导致一系列神经毒性级联反应[1]。脑内Aβ主要有两种基本清除方式,一种是由小胶质细胞表达的清道夫受体和补体受体等介导,另一种是通过Aβ降解酶如IDE和MMP等进行加工[24]。本研究中,BMSCs移植治疗后APP/PS1小鼠脑内Aβ42蛋白水平降低,Aβ清除相关酶IDE和MMP9表达升高,这说明,BMSCs移植可以减轻Aβ沉积及促进Aβ清除酶表达。尽管有研究认为敲除CX3CR1基因可以减轻APP小鼠脑内的Aβ沉积[25],但是BMSCs移植入脑后它与宿主之间的相互作用是十分复杂的,且本研究使用的模型小鼠处于AD早期,小鼠种属不同、发病阶段不同等都可能是导致差异性的原因。
综上所述,本研究进一步证实了BMSCs移植治疗AD的作用,并对BMSCs移植治疗AD可能的分子机制进行了探讨,发现BMSCs移植上调APP/PS1小鼠脑内趋化因子CX3CL1及受体CX3CR1的表达,后可能通过激活PI3K/Akt通路调控小胶质细胞转向具有神经保护作用的M2型,进而发挥减轻神经炎症、促进神经保护、改善AD小鼠学习记忆能力的作用。这些发现可以为探讨干细胞移植治疗AD提供理论基础和实验依据。
[1] Ballard C, Gauthier S, Corbett A, et al. Alzheimer’s di-sease[J]. Lancet, 2011, 377(9770):1019-1031.
[2] McGough A, Pope B, Chiu W, et al. Cofilin changes the twist of F-actin: implications for actin filament dynamics and cellular function[J]. J Cell Biol, 1997, 138(4):771-781.
[3] Pluchino S, Cossetti C. How stem cells speak with host immune cells in inflammatory brain diseases[J]. Glia, 2013, 61(9):1379-1401.
[4] Uccelli A, Pistoia V, Moretta L. Mesenchymal stem cells: a new strategy for immunosuppression?[J]. Trends Immunol, 2007, 28(5):219-226.
[5] Akiyama Y, Radtke C, Kocsis JD. Remyelination of the rat spinal cord by transplantation of identified bone marrow stromal cells[J]. J Neurosci, 2002, 22(15):6623-6630.
[6] Hughes PM, Botham MS, Frentzel S, et al. Expression of fractalkine (CX3CL1) and its receptor, CX3CR1, during acute and chronic inflammation in the rodent CNS[J]. Glia, 2002, 37(4): 314-327.
[7] Giunti D, Parodi B, Usai C, et al.Mesenchymal stem cells shape microglia effector functions through the release of CX3CL1[J]. Stem Cells, 2012, 30(9):2044-2053.
[8] 黄礼彬, 徐国兴, 谢茂松, 等. 体外骨髓间充质干细胞对脂多糖活化的视网膜小胶质细胞生物学功能的影响[J]. 中华实验眼科杂志, 2016, 34(9):773-779.
[9] Park D, Yang YH, Bae DK, et al. Improvement of cognitive function and physical activity of aging mice by human neural stem cells over-expressing choline acetyltransferase[J]. Neurobiol Aging, 2013, 34(11):2639-2646.
[10] Lee JK, Jin HK, Endo S, et al. Intracerebral transplantation of bone marrow-derived mesenchymal stem cells reduces amyloid-beta deposition and rescues memory deficits in Alzheimer’s disease mice by modulation of immune responses[J]. Stem Cells, 2010, 28(2):329-343.
[11] Lee JK, Schuchman EH, Jin HK, et al. Soluble CCL5 derived from bone marrow-derived mesenchymal stem cells and activated by amyloid β ameliorates Alzheimer’s di-sease in mice by recruiting bone marrow-induced microglia immune responses[J]. Stem cells, 2012, 30(7):1544-1555.
[12] Mathews MB, Sonenberg N, Hershey JW. Translational control in biology and medicine[M]. New York: Cold Spring Harbor Laboratory Press, 2007.
[13] Lauro C, Catalano M, Trettel F, et al.Fractalkine in the nervous system: neuroprotective or neurotoxic molecule?[J]. Ann N Y Acad Sci, 2015, 1351:141-148.
[14] Hoshiko M, Arnoux I, Avignone E, et al. Deficiency of the microglial receptor CX3CR1 impairs postnatal functio-nal development of thalamocortical synapses in the barrel cortex[J]. J Neurosci, 2012, 32(43):15106-15111.
[15] Hanisch UK, Kettenmann H. Microglia: active sensor and versatile effector cells in the normal and pathologic brain[J]. Nat Neurosci, 2007, 10(11):1387-1394.
[16] Liu Y, Hao W, Letiembre M, et al. Suppression of microglial inflammatory activity by myelin phagocytosis: role of p47-PHOX-mediated generation of reactive oxygen species[J]. J Neurosci, 2006, 26(50):12904-12913.
[17] Cho IH, Hong J, Suh EC, et al. Role of microglial IKKβ in kainic acid-induced hippocampal neuronal cell death[J]. Brain, 2008, 131(Pt 11):3019-3033.
[18] 程小凤, 赵佳仪, 袁 羽, 等. 腹腔注射LPS建立认知功能障碍相关的中枢神经系统免疫炎症小鼠模型[J]. 中国病理生理杂志, 2017, 33(5):890-895.
[19] Limatola C, Ransohoff RM. Modulating neurotoxicity through CX3CL1/CX3CR1 signaling[J]. Front Cell Neurosci, 2014, 8:229.
[20] Lyons A, Lynch AM, Downer EJ, et al. Fractalkine-induced activation of the phosphatidylinositol-3 kinase pathway attentuates microglial activationinvivoandinvitro[J]. J Neurochem, 2009, 110(5):1547-1556.
[21] Mu Y, Gage FH. Adult hippocampal neurogenesis and its role in Alzheimer’s disease[J]. Mol Neurodegener, 2011, 6:85.
[22] Bachstetter AD, Morganti JM, Jernberg J, et al. Fractal-kine and CX3CR1 regulate hippocampal neurogenesis in adult and aged rats[J]. Neurobiol Aging, 2011, 32(11):2030-2044.
[23] Maggi L, Trettel F, Scianni M, et al. LTP impairment by fractalkine/CX3CL1 in mouse hippocampus is mediated through the activity of adenosine receptor type 3 (A3R)[J]. J Neuroimmunol, 2009, 215(1-2):36-42.
[24] Doens D, Fernández PL. Microglia receptors and their implications in the response to amyloid β for Alzheimer’s disease pathogenesis [J]. J Neuroinflammation, 2014, 11:48.
[25] Lee S, Varvel NH, Konerth ME, et al. CX3CR1 deficiency alters microglial activation and reduces β-amyloid deposition in two Alzheimer’s disease mouse models[J]. Am J Pathol, 2010, 177(5):2549-2562.
(责任编辑: 陈妙玲, 罗 森)
Molecular mechanism of BMSC intracerebral transplantation in improving learning and memory abilities of AD mice
FAN Chong-zhu, LI An, HUANG Cui-qin, GAN Dan-hui, LI Qin, ZHAO Jia-yi, WANG Zhen, ZHU Li-hong, LU Da-xiang
(DepartmentofPathophysiology,InstituteofBrainResearch,KeyLaboratoryofStateAdministrationofTraditionalChineseMedicine,SchoolofMedicine,JinanUniversity,Guangzhou510632,China.E-mail:ldx@jnu.edu.cn)
AIM: To investigate the effect of bone marrow mesenchymal stem cell (BMSC) transplantation on learning and memory abilities and pathological changes of Alzheimer disease (AD) mice and the molecular mechanisms.METHODSC57/BL6 wild-type (WT) and transgenic (Tg) mice were randomly divided into 4 groups: WT/PBS group, WT/BMSCs group, Tg/PBS group and Tg/BMSCs group. The mice were administered with PBS or BMSCs via intracerebroventricular injection. Spatial learning and memory abilities of the mice were evaluated by Morris water maze test on the 3rd day after surgery. Real-time PCR was applied to detect the mRNA expression of CX3C chemokine ligand 1 (CX3CL1), CX3C chemokine receptor 1 (CX3CR1), IL-1β, TNF-α, Nurr1, YM1, insulin-degrading enzyme (IDE) and matrix metalloproteinase 9 (MMP9). The protein levels of CX3CL1 and Aβ42 were measured by ELISA. Western blot was used to detect the protein expression of postsynaptic density protein 95 (PSD95) and synaptophysin (SYP).RESULTSThe transplanted BMSCs were observed near the hippocampus ofAPP/PS1 mice on the 10th postoperative day. The escape latency of the mice in Tg/PBS group was significantly longer than that in the WT/PBS mice (P<0.05). Compared with Tg/PBS group, the escape latency of Tg/BMSCs group was significantly shorter (P<0.05), and the mRNA and protein levels of CX3CL1 in Tg/BMSCs group were significantly higher than those in Tg/PBS group (P<0.01). The results of immunohistofluorescence staining showed that BMSC transplantation promoted the activation of microglia in the brain of WT and Tg mice. The mRNA expression of YM1 was up-regulated in WT/BMSCs group and Tg/BMSCs group (P<0.05). Compared with WT/PBS mice, the mRNA expression of TNF-α in the cortex and hippocampus of Tg/PBS group was significantly increased (P<0.05), and the mRNA expression of Nurr1 in the cortex was significantly decreased (P<0.01). Meanwhile, the mRNA expression of TNF-α in the cortex of Tg/BMSCs mice was decreased (P<0.01) and the mRNA expression of CX3CR1 and Nurr1 was up-regulated compared with Tg/PBS group (P<0.05). The results of Western blot showed that the protein levels of PSD95, p85, p110 and p-Akt in Tg/BMSCs group were significantly higher than those in Tg/PBS group (P<0.05). Finally, BMSC transplantation reduced the protein level of Aβ42 inAPP/PS1 mice (P<0.05), and increased the mRNA expression of IDE and MMP9 in the hippocampus (P<0.05).CONCLUSIONBMSC transplantation modulates neuroinflammatory responses and promotes neuroprotective factor and synaptic protein expression, thus improving the learning and memory abilities in theAPP/PS1 mice, which may be achieved by up-regulating the expression of CX3CL1.
Bone marrow mesenchymal stem cells; CX3C chemokine ligand 1; Alzheimer disease; Neuroinflammation; Neuroprotection
1000- 4718(2017)11- 1921- 11
2017- 08- 29
2017- 10- 24
国家自然科学基金资助项目(No. 81471236; No. 81371442)
△通讯作者 Tel: 020-85228071; E-mail: ldx@jnu.edu.cn
▲并列第1作者
R741; R363
A
10.3969/j.issn.1000- 4718.2017.11.001
