高效液相色谱法测定益之康胶囊中总蒽醌(大黄素和大黄素甲醚)的含量
2017-11-21,,,,,*
,,,,,*
(1.浙江工业大学化学工程学院,浙江杭州 310014;2.浙江省食品药品检验研究院,浙江杭州 310052)
高效液相色谱法测定益之康胶囊中总蒽醌(大黄素和大黄素甲醚)的含量
寿林均1,程巧鸳2,黄柳倩1,周明昊1,2,*
(1.浙江工业大学化学工程学院,浙江杭州 310014;2.浙江省食品药品检验研究院,浙江杭州 310052)
建立益之康胶囊中总蒽醌含量测定的高效液相色谱法。采用HPLC测定益之康胶囊中2种蒽醌类成分大黄素和大黄素甲醚的含量;流动相为甲醇-0.1%磷酸溶液(75∶25,v/v),柱温30 ℃,流速1.0 mL/min,检测波长254 nm。大黄素和大黄素甲醚分别在0.054~0.65 μg和0.022~0.27 μg范围内呈良好的线性关系,相关系数分别为0.9999和0.9999,检出限分别为0.86 μg/g和0.87 μg/g,平均回收率分别为97.20%(RSD=2.26%)和99.96%(RSD=2.18%)。结论:该方法简便、准确、可靠。
益之康胶囊,大黄素,大黄素甲醚,总蒽醌,高效液相色谱法(HPLC)
益之康胶囊是以丹参、制何首乌、山楂、泽泻、玉竹为主要原料,经提取,辅以淀粉,经制粒、混合、填充胶囊等工艺制成的保健食品,具有调节血脂的功能。其中制何首乌为寥科植物何首乌PolygonummultijiorumThunb.的干燥块根经炖法或蒸法炮制而成。性味苦、甘、涩,微温,归肝、心、肾经。具有补肝肾,益精血,乌须发,强筋骨,化浊降脂的功效,用于血虚萎黄,眩晕耳鸣,须发早白,腰膝酸软,肢体麻木,崩漏带下,高脂血症[1]。现代药理研究表明,何首乌提取物及其有效部位具有调节血脂、抗动脉粥样硬化等作用[2-3]。何首乌的主要化学成分有五大类:二苯乙烯苷类、蒽醌类、黄酮类、磷脂类和多糖类[4],其中蒽醌类化合物主要包括游离蒽醌(游离型大黄素和大黄素甲醚)及其与葡萄糖形成的结合蒽醌,而结合蒽醌是何首乌导致泻下作用的主要成分[5]。何首乌经炮制成制何首乌后,结合蒽醌水解成无泻下作用的游离蒽醌,从而降低毒性,减小副作用[6],但炮制不当或不彻底仍会使结合蒽醌含量偏高[7],长期使用易产生腹泻作用。国家食品药品监督管理总局(国食药监许[2010]2号)要求以何首乌等含蒽醌类成分为原料的保健食品,在产品质量标准中应增加蒽醌类成分的含量检测指标,并按照范围值标示。目前,蒽醌类成分的含量测定方法主要为紫外分光光度法[8-9]和高效液相色谱法[10-19]。紫外分光光度法虽然操作简单,但其干扰大,影响因素多,并且显色不稳定,所以实际难以准确测定总蒽醌的含量。
本文参考中国药典2015年版制何首乌项下蒽醌类成分的含量测定方法以及朱培芳[10],蔡丽芬[12],徐乾丽[16],戴作波[17],胡建华[19]等的研究成果,以大黄素和大黄素甲醚对照品为对照,采用高效液相色谱法测定益之康胶囊中总蒽醌的含量,制何首乌中总蒽醌有游离型和结合型两种,结合型的蒽醌主要与苷元结合存在,需要将其水解成游离型蒽醌,并以原游离型蒽醌和结合型蒽醌水解而成的游离型蒽醌的含量来计算益之康胶囊中总蒽醌的含量。本文用HPLC法测定益之康胶囊中总蒽醌的含量,操作简便,结果可靠,为益之康胶囊的质量控制提供了一种新手段。
1 材料与方法
1.1材料与仪器
对照品大黄素(110756-201512,含量测定用,纯度98.7%,使用前不需干燥)和大黄素甲醚(110758-201415,含量测定用,纯度99.1%,使用前无需处理) 均由中国食品药品检定研究院提供,色谱纯的甲醇和乙腈 默克公司;分析纯的三氯甲烷 南京化学试剂股份有限公司;优级纯的盐酸和分析纯的磷酸 国药集团化学试剂有限公司;益之康胶囊 由正大青春宝药业有限公司提供,批号分别为研究用样、1604001、1604002、1604003、1505001、1108002、20151008。
Agilent1260型高效液相色谱仪(G1311B 1260 Quat Pump,G1367E 1260 Hip ALS,G1316A 1260 TCC,G1314F 1260 VWD);紫外检测器Agilent色谱工作站。
1.2实验方法
1.2.1 色谱条件 色谱柱:Waters Sunfire C18柱(250 mm×4.6 mm,5 μm);检测波长:254 nm;流动相:甲醇-0.1%磷酸溶液(75∶25);流速:1.0 mL/min;柱温:30 ℃;进样量:10 μL。
1.2.2 对照品溶液制备 大黄素对照品溶液:取大黄素对照品约20 mg,精密称定,用甲醇溶解,定容到50 mL,即得。大黄素甲醚对照品溶液:取大黄素甲醚对照品约20 mg,精密称定,先用少量三氯甲烷溶解,然后用甲醇定容到250 mL,即得。分别精密吸取0.4327 mg/mL的大黄素对照品溶液5 mL和0.0884 mg/mL的大黄素甲醚对照品溶液10 mL,混合后用甲醇稀释并定容到20 mL,即得混合对照品溶液。
1.2.3 供试品溶液制备 取本品内容物适量,研细,取约2.000 g,精密称定,置回流瓶中,精密加入8%盐酸溶液25 mL和三氯甲烷25 mL,水浴中加热回流1 h,取出,立即冷却,置分液漏斗中,用少量三氯甲烷洗涤容器,洗液并入分液漏斗中,分取三氯甲烷液,酸液再用三氯甲烷振摇提取3次(30、20、20 mL),合并三氯甲烷液,回收溶剂至干,残渣加甲醇使溶解,转移至10 mL量瓶中,加甲醇至刻度,摇匀,滤过,取续滤液,即得。
1.2.4 检出限 将同一批供试品溶液稀释成一系列浓度的溶液,以取样量为2.000 g,信噪比约为3时计算检出限。
1.2.5 线性关系考察 精密吸取1.2.2中大黄素和大黄素甲醚的混合对照品溶液0.5、1、2、4、6 μL,按照1.2.1中的色谱条件注入高效液相色谱仪中,记录大黄素、大黄素甲醚的峰面积。以对照品进样量(μg)为横坐标、峰面积为纵坐标,绘制标准曲线,标准曲线用Y=aX+b表示。
1.2.6 精密度实验 精密吸取1.2.2中大黄素和大黄素甲醚的混合对照品溶液10 μL,按照1.2.1中的色谱条件注入高效液相色谱仪中且连续进样六次,计算峰面积的RSD。
1.2.7 溶液稳定性实验 精密吸取1.2.3中的供试品(研究用样)溶液10 μL,按照1.2.1中的色谱条件于1、2、4、6、10、12、18、24 h后进样,计算峰面积的RSD。
1.2.8 重复性实验 分别称取同一批供试品(研究用样)6份,按1.2.3中供试品溶液制备法制备,按照1.2.1中的色谱条件进样测定并计算RSD。
1.2.9 专属性实验 取没有制何首乌的阴性样品,按1.2.3中供试品溶液制备法制备,按照1.2.1中的色谱条件进样测定。
1.2.10 回收率实验 取供试品(1604003)适量,研细,取约2.0 g,精密称定,置回流瓶中,按低、中、高三个水平精密加入混合对照品溶液(平行三份),按1.2.3中供试品溶液制备法制备,按照1.2.1中的色谱条件进样测定,计算回收率和RSD。
1.2.11 样品测定 按1.2.3中供试品溶液制备法制备,按照1.2.1中的色谱条件进样,分别测定了厂家提供的6批样品(批号分别为1604001、1604002、1604003、1505001、1108002、20151008)。
1.2.12 计算 大黄素和大黄素甲醚的含量按式(1)计算:
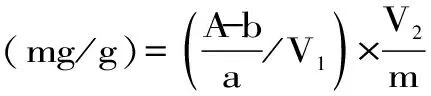
式(1)
注:A-大黄素(或大黄素甲醚)的峰面积;b-大黄素(或大黄素甲醚)线性方程的截距;a-大黄素(或大黄素甲醚)线性方程的斜率;V1-进样体积(μL);V2-稀释倍数(mL);m-供试品称样质量(g)。
总蒽醌的含量按式(2)计算:
总蒽醌含量(mg/g)=大黄素的含量+大黄素甲醚的含量
式(2)
所有计算都在Microsoft Excel 2016中完成。
2 结果与分析
2.1检出限
以供试品溶液信噪比约为3时计算得大黄素和大黄素甲醚的检出限分别为0.86 μg/g和0.87 μg/g。

表2 精密度实验结果Table 2 Precision results of the proposed HPLC method
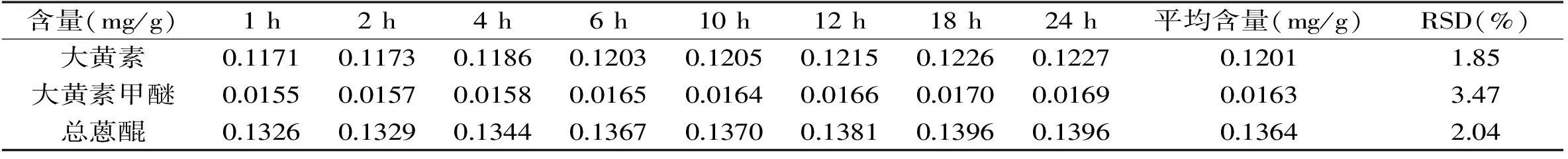
表3 稳定性实验结果Table 3 Stability results of the proposed HPLC method
2.2线性关系考察
如表1所示,大黄素和大黄素甲醚在0.054~0.65 μg和0.022~0.2700 μg范围内呈现良好的线性关系,相关系数分别为0.9999和0.9999。
2.3精密度实验
如表2所示,大黄素和大黄素甲醚的RSD分别为0.08%和0.10%,表示仪器精密度良好。
2.4溶液稳定性实验
如表3所示,大黄素、大黄素甲醚和总蒽醌在24 h内的RSD分别为1.85%、3.47%和2.04%,表示溶液在24 h内稳定。
2.5重复性实验
如表4所示,供试品(研究用样)测得大黄素、大黄素甲醚和总蒽醌的平均含量分别为0.1369、0.0181、0.1549 mg/g,RSD分别为1.37%、1.56%和1.21%,表明方法的重复性良好。
2.6专属性实验
取没有制何首乌的阴性样品,按1.2.3中供试品溶液制备法制备,按照1.2.1中的色谱条件进样测定,结果在大黄素和大黄素甲醚对照品峰处未出现色谱峰,说明按上述方法测定,阴性样品无干扰,见图1。
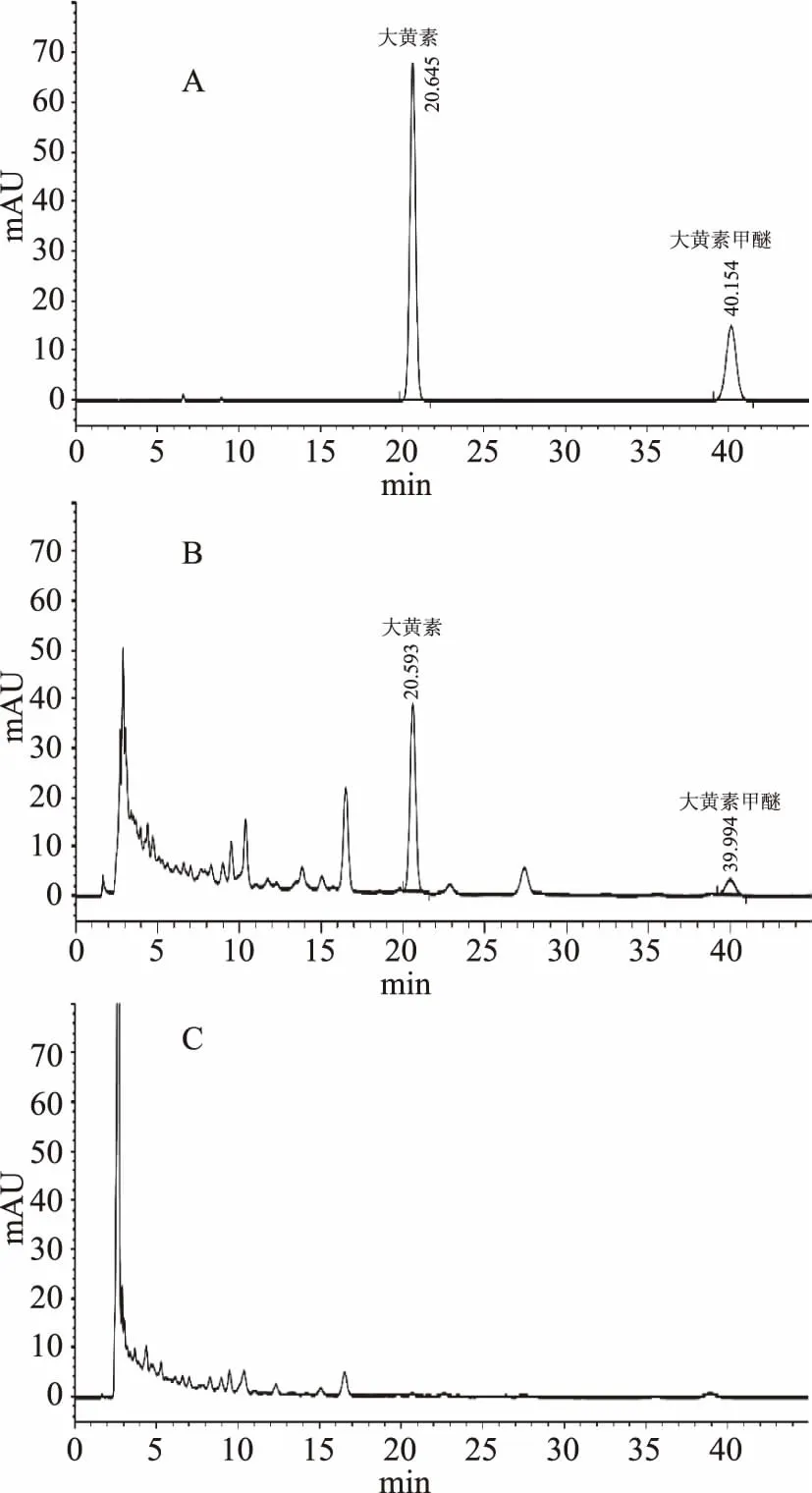
图1 HPLC色谱图Fig.1 Chromatograms of emodin and physcion 注;A:混标色谱图,B:样品色谱图, C:缺制何首乌的样品色谱图。
2.7回收率实验
如表5所示,大黄素的加标平均回收率为97.20%,RSD为2.26%,大黄素甲醚为99.96%,RSD为2.18%。
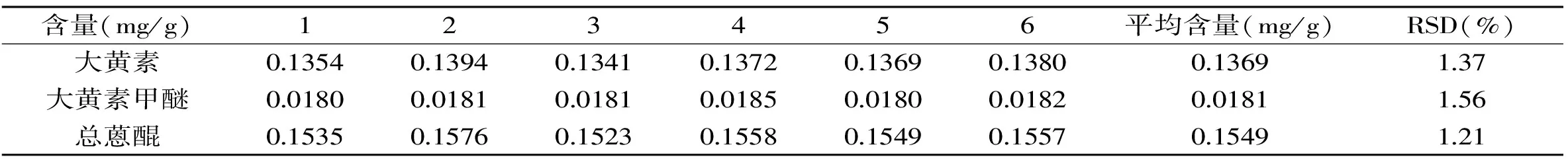
表4 重复性实验结果Table 4 Repeatability results of the proposed HPLC method
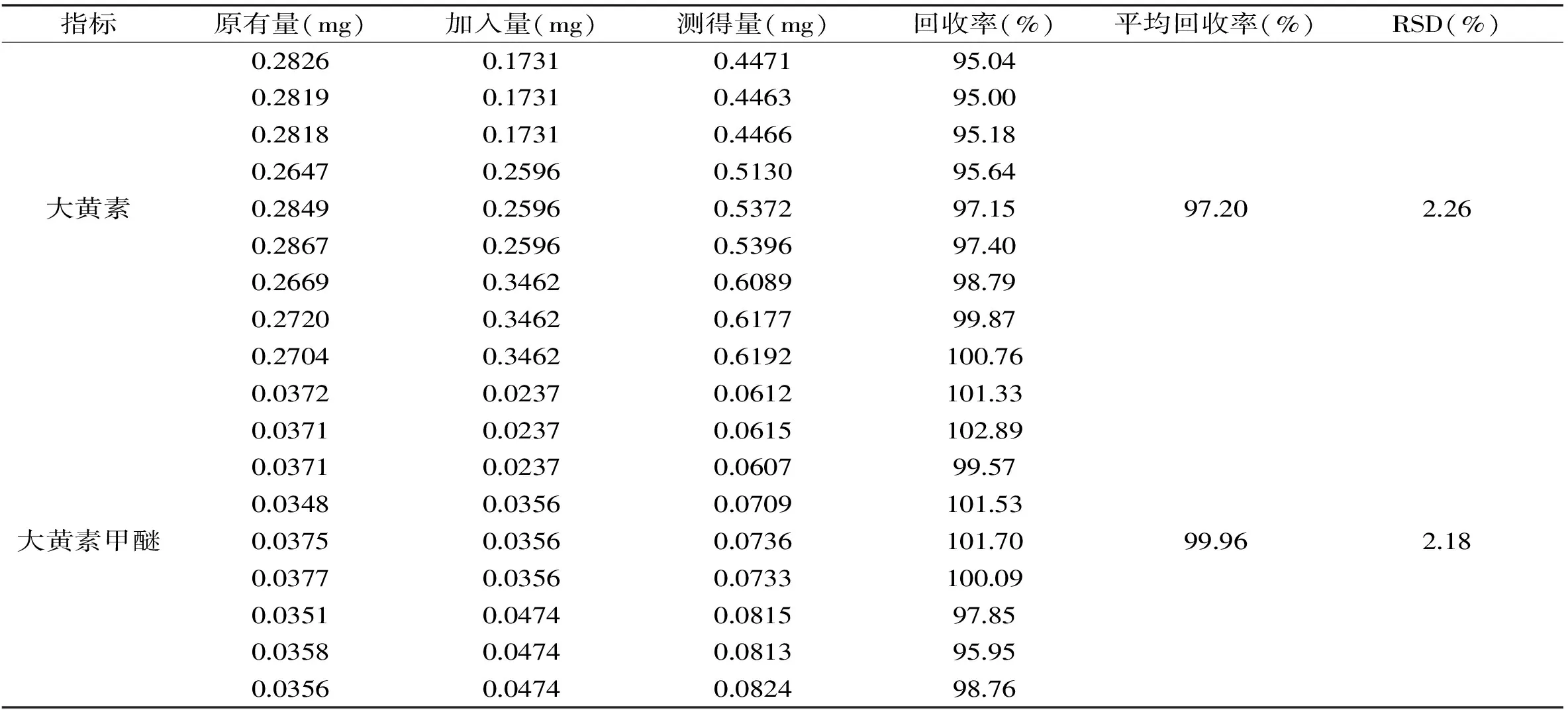
表5 回收率实验结果Table 5 Average spike recoveries and RSDs for emodin and physcion
2.8样品测定
1604001、1604002、1604003、1505001、1108002、20151008样品中的大黄素、大黄素甲醚和总蒽醌的含量如表6所示,本实验中的蒽醌主要来自配方中的制何首乌,2015版中国药典中规定制何首乌中游离蒽醌以大黄素和大黄素甲醚的总量计,并且含量不得少于0.10%,本实验测的总蒽醌包括游离蒽醌和结合蒽醌两部分,目前暂无国标要求。
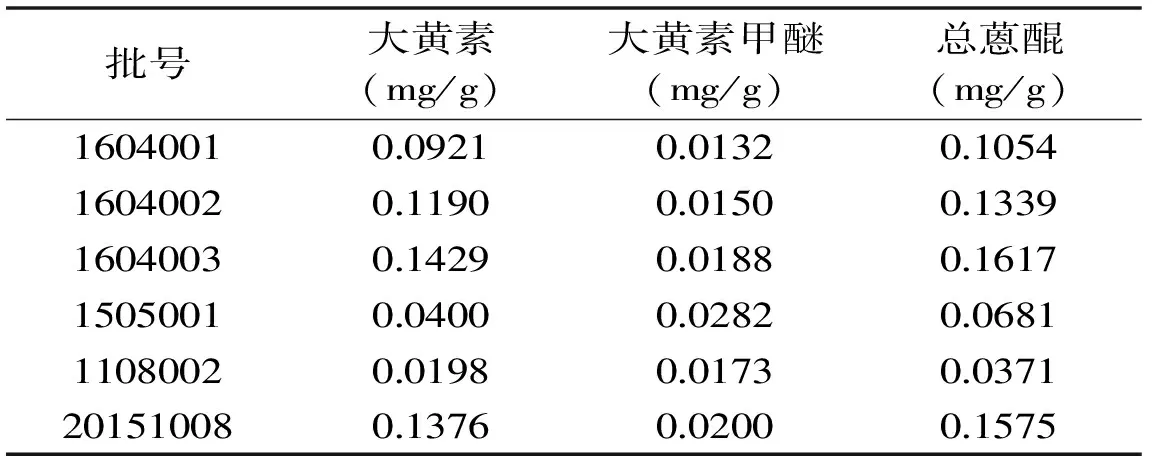
表6 样品测定结果Table 6 The results of samples

表7 前处理优化结果Table 7 The results of preprocessing optimization
2.9前处理优化
采用(1)8%(质量分数)盐酸,三氯甲烷(2)16%(质量分数)盐酸,三氯甲烷来水解结合型蒽醌并提取总蒽醌,结果如表7所示。实验证明8%盐酸,三氯甲烷法的总蒽醌含量最高,其潜在原因可能是大黄素甲醚极性较弱,在甲醇中的溶解性较低,而其在益之康胶囊中含量又不高,故提取效率不高,同时三氯甲烷极性较弱,根据相似相溶原理可知,大黄素甲醚能溶于三氯甲烷,虽然其在益之康胶囊中含量不高,但经过三氯甲烷多次萃取,基本能将游离型蒽醌中的大黄素甲醚提取完全。
2.10流动相的比较
本实验曾对不同流动相(1)乙腈-0.1%磷酸溶液(60∶40)、(2)甲醇-0.1%磷酸溶液(80∶20)、(3)甲醇-0.1%磷酸溶液(75∶25)的色谱行为进行了比较。在(2)甲醇-0.1%磷酸溶液(80∶20)中,大黄素未完全分离,前峰脚位置包含未知物质;在(1)乙腈-0.1%磷酸溶液(60∶40)和(3)甲醇-0.1%磷酸溶液(75∶25)中,大黄素和大黄素甲醚能完全分离,但在(3)甲醇-0.1%磷酸溶液(75∶25)中,大黄素和大黄素甲醚附近干扰较少,同时甲醇的成本比乙腈低廉,所以选择(3)甲醇-0.1%磷酸溶液(75∶25)作为流动相。

图2 不同流动相的色谱图Fig.2 Chromatograms of different mobile phase
2.11柱温的比较
本实验比较了不同柱温30、35、40 ℃对样品分离的影响,结果随着柱温升高出峰时间加快,如图3所示,在30 ℃时峰形较好。

图3 不同柱温的色谱图Fig.3 Chromatograms of different temperature
3 结论
益之康胶囊中的总蒽醌(大黄素和大黄素甲醚)主要来自于配方中的制何首乌,通过8%(质量分数)的盐酸水解结合型蒽醌后经三氯甲烷多次萃取,能较好的提取出大黄素和大黄素甲醚,并用高效液相色谱测定大黄素和大黄素甲醚的含量,将大黄素和大黄素甲醚的含量之和作为总蒽醌的含量。经过方法学验证,说明该方法简便、准确、可靠:大黄素和大黄素甲醚分别在0.05409~0.6491 μg和0.02211~0.2653 μg范围内呈良好的线性关系,相关系数分别为0.9999和0.9999,平均回收率分别为97.20%(RSD=2.26%)和99.96%(RSD=2.18%)。同时,由于大黄素甲醚微溶于甲醇,应先用少量三氯甲烷溶解后再用甲醇定容。
[1]国家药典委员会.中国药典一部[S].北京:中国医药科技出版社,2015:175.
[2]王春英,张兰桐,袁志芳,等.何首乌醋酸乙酯提取部位与二苯乙烯苷的调血脂作用[J].中草药,2008,39(1):78-83.
[3]顾慧,吕圭源,陈素红,等. 何首乌“补肝肾、益精血、强筋骨”功效相关的药理研究[J].世界科学技术-中医现代化,2008,10(2):58-62.
[4]楼招欢,吕圭源,俞静静.何首乌成分、药理及毒副作用相关的研究进展[J].浙江中医药大学学报,2014,38(4):495-500.
[5]梅雪,余刘勤,陈小云,等.何首乌化学成分和药理作用的研究进展[J].药物评价研究,2016,39(1):122-131.
[6]史国兵.炮制对何首乌中有效成分含量的影响[J].中国医院药学杂志,2003,23(2):95-97.
[7]施群,施淑琴.炮制对何首乌总蒽醌含量的变化研究[J].中华中医药学刊,2012,30(12):2770-2772.
[8]刘云娣,李得堂,任结梅,等.紫外分光光度法测定大承气冲剂中大黄总蒽醌的含量[J].中医药导报,2010,16(7):108-110.
[9]王玉宝. 紫外分光光度法测定决明子中蒽醌类成分含量[J].中医药临床杂志,2013,25(8):730-732.
[10]朱培芳,赵荣华,施扬宪. HPLC法同时测定何首乌中二苯乙烯苷和5种蒽醌类化合物的方法[J].中华中医药杂志,2012,27(2):463-465.
[11]付卫华. HPLC法测定何首乌炮制过程中主要化学成分含量[J].亚太传统医药,2013,9(7):50-51.
[12]蔡丽芬,钟国跃,张倩,等. HPLC测定不同生长年限及采收期何首乌中二苯乙烯苷和蒽醌类成分的含量[J]. 中国中药杂志,2010,35(10):1221-1225.
[13]史辑,刘梓晗,王玲,等.HPLC测定不同产地巴戟天中5种茜草素型蒽醌的含量[J].中药材,2015,38(2):245-248.
[14]李樱红,汪瑾,胡磊,等. HPLC测定红曲黄酮片中总蒽醌的含量[J].中国现代应用药学,2012,29(12):1131-1133,1139.
[15]吴迪,袁海铭,曾宪仪,等.HPLC法测定大黄总蒽醌胶囊5种蒽醌苷元及5种游离蒽醌含量[J]. 江西中医药大学学报,2016,28(1):68-70.
[16]徐乾丽,茅向军,熊慧林. HPLC法测定六味安消胶囊中游离蒽醌、总蒽醌和结合蒽醌的含量[J]. 贵阳医学院学报,2010,35(6):578-580,583.
[17]戴作波,张建霞. HPLC法测定自制降脂胶囊中大黄蒽醌衍生物的含量[J]. 临床合理用药,2016,9(2A):95-96.
[18]韩燕全,洪燕,谢道俊,等. HPLC法同时测定黄蒲通窍胶囊中3种蒽醌类成分的总含量[J]. 云南中医中药杂志,2011,32(2):56-58.
[19]胡建华,陈文芝,徐超群,等. HPLC梯度洗脱测定痔康泰纳米粒中大黄蒽醌成分的总含量[J]. 华西药学杂志,2009,24(3):288-290.
[20]袁琦,杨洁,赵辉,等.HPLC测定一清胶囊中的5种大黄蒽醌衍生物[J]. 华西药学杂志,2014,29(4):430-432.
Determinationoftotalanthraquinone(emodinandphyscion)inYizhikangcapsulebyhighperformanceliquidchromatography
SHOULin-jun1,CHENGQiao-yuan2,HUANGLiu-qian1,ZHOUMing-hao1,2,*
(1.Zhejiang University of Technology,College of Chemical Engineering,Hangzhou 310014,China; 2.Zhejiang Institute for Food and Drug Control,Hangzhou 310052,China)
Objective:To establish a High Performance Liquid Chromatography(HPLC)method for determining the totalanthraquinone in Yizhikang capsule. Methods:The contents of emodin and physcion were determined by a HPLC method. The emodin and physcion were separated on a Waters Sunfire C18column(250 mm×4.6 mm,5 μm)using a mobile phase made up of methanol and 0.1% phosphoric acid solution(75∶25,v/v)at a flow rate of 1.0 mL/min and detected by a UV detector at a wavelength of 254 nm.The column temperature was set at 30 ℃.Results:The response showed good linear relationship in the range of 54.09~649.05 μg/mL for emodin,22.11~265.31 μg/mL for physcion with all the coefficients of correlation(R2)=0.9999.The detection limits(LODs)were 0.86 μg/g for emodin,0.87 μg/g for physcion,respectively. The average recoveries of emodin and physcion were 97.20%(RSD=2.26%)and 99.96%(RSD=2.18%),respectively. Conclusions:This method is simple,accurate,reliable and reproducible and can be used for the quality control of yizhikang capsule.
Yizhikang capsule;emodin;physcion;total anthraquinone;high performance liquid chromatography(HPLC)
2017-03-03
寿林均(1993-),男,硕士,研究方向:保健食品及化妆品的检测,E-mail:1837393007@qq.com。
*
周明昊(1971-),男,硕士,主任药师,研究方向:保健食品及化妆品的检测,E-mail:zmh888@hotmail.com。
TS207.3
A
1002-0306(2017)21-0252-06
10.13386/j.issn1002-0306.2017.21.050
