肉桂醛对荧光假单胞菌生物膜形成的抑制作用
2017-11-21,,,,,
,,,,,
(中国药科大学工学院,江苏南京 211198)
肉桂醛对荧光假单胞菌生物膜形成的抑制作用
綦国红,井佳丽,杨志萍,陈贵堂,王海翔,程抒劼
(中国药科大学工学院,江苏南京 211198)
本文拟研究肉桂醛在非抑菌浓度条件下对荧光假单胞菌(Pseudomonasfluorescens)FML05-2生物膜形成的抑制作用。首先测定了肉桂醛对模式细菌紫色杆菌(Chromobacteriumviolaceum)CVO26紫色素产生的影响;再对荧光假单胞菌FML05-2形成的生物膜以及与生物膜形成有关的重要因素胞外多糖进行了测定。结果表明:在非抑菌浓度40、20 μg/mL条件下,肉桂醛对紫色杆菌CVO26紫色素的产生具有抑制作用,抑制率分别为31.53%、17.90%;对荧光假单胞菌FML05-2生物膜形成的抑制率分别为44.22%、21.77%;对荧光假单胞菌FML05-2胞外多糖产生的抑制率分别为15.72%、5.34%。因此,肉桂醛在非抑菌浓度条件下对荧光假单胞菌FML05-2生物膜的形成具有抑制作用。
肉桂醛,群体感应抑制,荧光假单胞菌,生物膜,胞外多糖
细菌生物膜(biofilm,BF)是细菌为了适应环境和维持自身生命而形成的形如膜状的结构,保护膜内细菌免受外界恶劣环境的影响,为细菌生长提供天然屏障。食品腐败菌以及食源性致病菌常常通过形成生物膜附着在食品、食品加工设备、包装材料等表面,难以消杀与清除,从而形成持续性的污染,成为食品安全的一大隐患[1-2]。因此研究如何减少食源性致病菌与食品腐败菌生物膜的形成具有重要意义。研究表明细菌生物膜的形成受群体感应现象调控[3-5],因此可以通过群体感应抑制原理来减少或抑制生物膜的产生,此方法不同于基于抑菌与杀菌而抑制目标菌生物膜的形成的原理,不会导致抗性菌株的产生。目前研究较多的群体感应抑制方法是利用群体感应抑制剂即群体感应信号分子的类似物来干扰群体感应现象,从而减少或抑制由群体感应现象调控的目标性状的表达[6-7]。
肉桂醛(cinnamaldhyde),又名桂皮醛,有独特的香味,是肉桂挥发油的主要活性物质。研究表明,肉桂醛对食源性致病菌大肠杆菌、李斯特氏菌、金黄色葡萄球菌以及导致番茄、胡萝卜等霉变的霉菌等均具有很好的抑制作用[8-10];对大肠杆菌、金黄色葡萄球菌、烟曲霉菌等产生的生物膜也具有抑制作用[8,10]。国外文献报道,肉桂醛对欧文氏菌、耶尔森氏菌的群体感应系统具有抑制作用[11],但对荧光假单胞菌(Pseudomonasfluorescens)群体感应抑制作用目前国内外未见报道。
荧光假单胞菌是一种典型的嗜冷菌,是导致食品腐败的常见细菌,多数菌株生长过程中产生生物膜。且该菌生物膜的形成受其自身群体感应系统调控[12-13]。本文基于群体感应抑制的原理研究肉桂醛在非抑菌浓度条件下对荧光假单胞菌生物膜形成的抑制作用,研究的视角不同于已有的研究,即在抑菌条件下对食品腐败菌生物膜形成的抑制作用,从而揭示肉桂醛对荧光假单胞菌群体感应的抑制作用。
1 材料与方法
1.1材料与仪器
菌种与培养条件:荧光假单胞菌(Pseudomonasfluorescens)FML05-2产生生物膜与N-酰基高丝氨酸内酯类信号分子[12];紫色杆菌(Chromobacteriumviolaceum)CVO26,是工程菌株,不产生N-己酰高丝氨酸内酯,也不产生紫色色素,并且色素的产生受N-己酰高丝氨酸内酯(N-hexanoyl-homoserine lactone,C6-HSL)信号分子的调控[12]。二者均使用LB培养基(氯化钠10 g,胰蛋白胨10 g,酵母粉5 g,蒸馏水1 L,pH7.0)于28 ℃ 150 r/min振荡培养。紫色杆菌CVO26培养时添加卡那霉素至终浓度为20 μg/mL。
肉桂醛分析标准品≥99.5%(GC) Aladdin试剂公司;C6-HSL Sigma公司;硫酸卡那霉素注射液 四川华蜀动物药业有限责任公司;二甲基亚砜(AP) 上海泰坦化学有限公司;苯酚(AP) 国药集团化学试剂有限公司;浓硫酸(AP) 南京化学试剂股份有限公司。
FLX800多功能酶标仪 美国伯腾仪器有限公司;TU-1901双光束紫外可见分光光度计 北京普析通用仪器有限责任公司;Microscope Eclipse 80i光学显微镜 日本Nikon;CR21G 高速冷冻离心机 日立高新技术公司;HZC-250恒温振荡培养箱 苏州太仓实验设备有限公司。
1.2实验方法
1.2.1 肉桂醛溶液的制备 取2.00 mg肉桂醛溶于1 mL 1%的二甲基亚砜溶液中,得到浓度为2000 μg/mL的肉桂醛母液,-20 ℃保存备用。肉桂醛测试浓度用无菌LB培养基对母液按比例进行稀释。
1.2.2 对紫色杆菌CVO26、荧光假单胞菌FML05-2最小抑菌浓度(MIC)的测定 参照文献[4]将活化好的菌液按2%比例接种于无菌新鲜LB培养基中,培养至菌体密度OD600 nm约为0.4,取4.5 mL的菌液分装于标记好的无菌大试管中,加入0.5 mL不同浓度的肉桂醛溶液,对照组为等量无菌LB培养基,于28 ℃,150 r/min振荡培养24 h,观察菌液是否浑浊,同时测定菌液OD600 nm值,确定MIC。
1.2.3 对紫色杆菌CVO26、荧光假单胞菌FML05-2的生长抑制作用 参照文献[4],按1.2.2方法制备含有不同浓度肉桂醛的菌液,分别于0、2、4、6、8、10、12 h时取200 μL培养液加入96孔板中,用酶标仪测定OD630 nm值,取三次测量数值的平均值,绘制生长曲线。
1.2.4 对紫色杆菌CVO26紫色素产生的抑制作用 参照文献[5]按1.2.2方法制备含有不同浓度肉桂醛的CVO26菌液,肉桂醛的最终质量浓度为20、40 μg/mL,对照组为无菌LB培养基。同时添加C6-HSL至终浓度为5 μmol/mL,于28 ℃,150 r/min振荡培养约7 h。取3 mL培养液10000 r/min 4 ℃离心10 min,弃上清,加入3 mL二甲基亚砜,充分混匀。10000 r/min 4 ℃离心10 min,取上清,分光光度计测定580 nm吸光度。按下式计算紫色素抑制率:
抑制率(%)=(对照组OD值-实验组OD值)/对照组OD值×100
1.2.5 对荧假单胞菌FML05-2生物膜形成的抑制作用 光学显微镜对生物膜的定性观察,根据文献[5],按1.2.2方法制备含有不同浓度肉桂醛的菌液,分装于锥形瓶中,将1.5 cm×1.5 cm的无菌玻璃片置于锥形瓶内,28 ℃静置培养48 h后,弃培养液,添加含有肉桂醛的新鲜LB培养基后继续静置培养48 h。取出玻璃片,无菌水冲洗表面浮菌,45 ℃干燥30 min,0.2%的结晶紫溶液染色2 min。无菌水洗掉多余的染色剂,45 ℃干燥30 min。用光学显微镜观察,拍照。对生物膜的定量测定,参照文献[6],按上述方法操作,无菌输液管片代替玻璃片。输液管片45 ℃干燥后,用无水乙醇洗脱3 min,取200 μL洗脱液加入96孔板中,酶标仪测定490 nm处的吸光度。按1.2.4方法计算抑制率。
1.2.6 对荧光假单胞菌FML05-2胞外多糖的抑制作用 按1.2.2的方法制备含有肉桂醛的菌液,28 ℃振荡培养24 h。取菌液10000 r/min 4 ℃离心30 min,取上清,加入上清液3倍体积的冷乙醇,4 ℃静置24 h,12000 r/min 4 ℃离心10 min,得沉淀,2倍体积的蒸馏水稀释沉淀,参照苯酚硫酸法[14]进行测定,即2 mL样品溶液加入1 mL 5%的苯酚溶液,再加入5 mL的浓硫酸,充分摇匀,静止30 min后于490 nm处测量吸光度,蒸馏水对照,按1.2.4方法计算抑制率。
2 结果与分析
2.1对紫色杆菌CVO26和荧光假单胞菌FML05-2最小抑菌浓度(MIC)
观察紫色杆菌CVO26与荧光假单胞菌FML05-2在含有不同浓度肉桂醛的培养基中的生长情况,同时测定培养物的OD600 nm值,确定紫色杆菌CVO26的MIC为100 μg/mL,荧光假单胞菌FML05-2的MIC为150 μg/mL。
2.2对紫色杆菌CVO26和荧光假单胞菌FML05-2生长抑制作用
为进一步验证肉桂醛在MIC浓度以下对CVO26的抑制作用,对其生长曲线进行了测定,并与对照进行了显著性检验,结果表明(图1),肉桂醛浓度≤40 μg/mL时,紫色杆菌CV026的生长趋势与对照组无显著差异(p>0.05),即肉桂醛在此浓度下对其生长没有抑制作用;而肉桂醛浓度≥50 μg/mL时,生长情况与对照相比有显著差异(p<0.05)(50 μg/mL以上浓度数据未显示)。
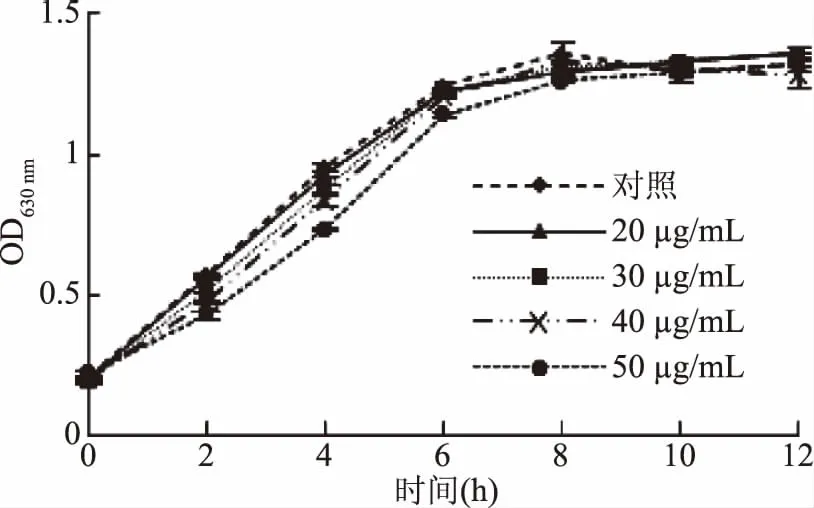
图1 肉桂醛对CVO26的生长抑制作用Fig.1 The growth inhibition of cinnamalhyde to CVO26
用同样的方法,对荧光假单胞菌FML05-2的生长曲线进行了测定和分析,结果(图2)表明,肉桂醛浓度在≤40 μg/mL时对荧光假单胞菌FML05-2生长无抑制作用,与对照无显著性差异(p>0.05),而浓度为50 μg/mL 时对FML05-2生长具有抑制作用,与CVO26一样其抑制作用主要发生在对数生长期,而到达稳定期时菌液的OD630 nm值与对照无显著差异。因此后续肉桂醛对二菌的测试浓度均确定为≤40 μg/mL。

图2 肉桂醛对FML05-2的生长抑制作用Fig.2 The growth inhibition of cinnamalhyde to FML05-2
2.3对紫色杆菌CVO26紫色素产生的抑制作用
由图3可知,肉桂醛在非抑菌浓度条件下对CVO26紫色素的产生具有抑制作用,并且随肉桂醛浓度的增加紫色素的抑制率也随之增加,浓度为40 μg/mL时抑制率达31.53%。
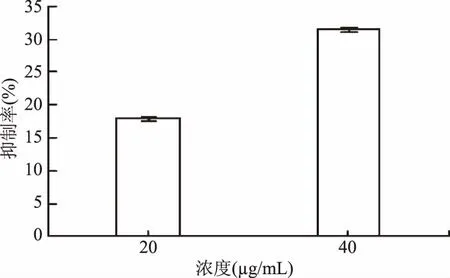
图3 肉桂醛对CVO26紫色素产生的抑制作用Fig.3 Violacein production inhibition in CVO26 by cinnamaldhyde
2.4对荧光假单胞菌FML05-2生物膜产生的抑制作用
利用光学显微镜在400倍条件下对细胞爬片上的生物膜形态进行观察,结果表明(图4),肉桂醛对荧光假单胞菌FML05-2生物膜的形成具有抑制作用,生物膜上的细胞密度、细胞团块的大小随着肉桂醛浓度的升高而降低。当肉桂醛浓度为40 μg/mL时,膜上细胞密度变得很稀疏。为进一步验证肉桂醛对生物膜的抑制作用,进行了定量测定。结果如图5所示,生物膜的抑制率随着肉桂醛浓度的升高而增大,40 μg/mL时达到44.22%,与显微镜观察结果相吻合。

图4 肉桂醛对FML05-2生物膜形成的抑制作用(400×)Fig.4 Inhibition of cinnamalhyde on biofilm formation of FML05-2(400×)注:A:对照;B:20 μg/mL;C:30 μg/mL;D:40 μg/mL。
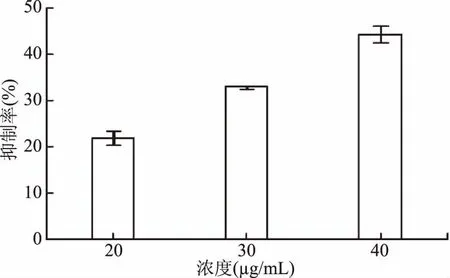
图5 肉桂醛对FML05-2生物膜形成的抑制作用Fig.5 Inhibition of cinnamalhyde on biofilm formation of FML05-2
2.5对荧光假单胞菌FML05-2胞外多糖产生的抑制作用
胞外多糖是构成生物膜的重要成分,影响生物膜产生的因素也会影响胞外多糖的产生,因此对荧光假单胞菌FML05-2胞外多糖的产生进行了测定,由图6可知,肉桂醛在不抑制荧光假单胞菌胞生长的情况下对其胞外多糖的产生具有抑制作用,且随着浓度增加,抑制率随之增加,40 μg/mL时抑制率为15.72%。
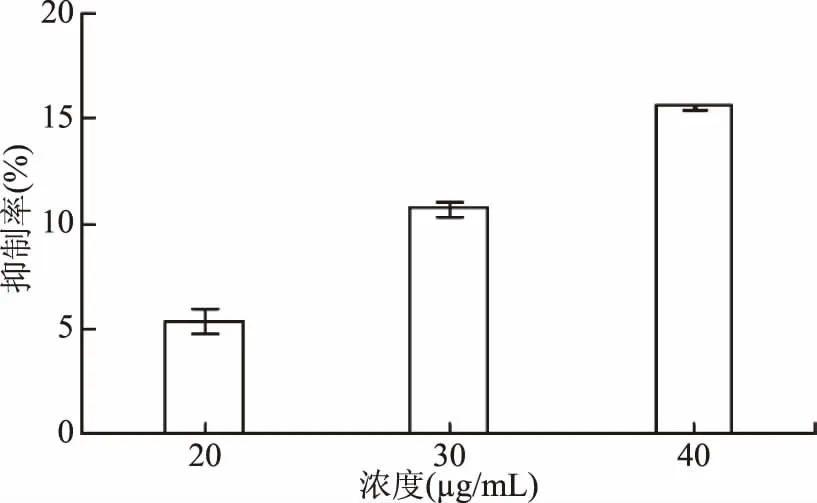
图6 肉桂醛对FML05-2胞外多糖产生的抑制作用Fig.6 Inhibition of EPS production to FML05-2 by cinnamalhyde
3 结论
本文首先利用群体感应抑制研究的模式菌紫色杆菌CVO26对肉桂醛的群体感应抑制活性进行了初步测定,发现肉桂醛具有抑制其紫色素产生的能力,40 μg/mL时抑制率为31.53%。然后研究了肉桂醛在非抑菌浓度条件下对荧光假单胞菌FML05-2生物膜形成的抑制作用,发现肉桂醛处理导致生物膜结构松散,细胞密度与细胞团块大小明显降低;对生物膜定量测定结果表明40 μg/mL时生物膜抑制率为44.22%;对生物膜的主要构成成分胞外多糖进行测定,40 μg/mL时胞外多糖的抑制率为15.72%。因此,肉桂醛对荧光假单胞菌FML05-2生物膜形成具有抑制作用,此种作用不是由于肉桂醛对FML05-2抑制生长所致,而是通过对其群体感应抑制作用所致。
[1]张曙梅,徐向荣,徐浩. 细菌生物膜群体感应系统研究进展[J].生物技术通报,2016,32(12):1-6.
[2]张翼,陈雅蘅,周帼萍,等. 克罗诺杆菌(原阪崎肠杆菌)的生物膜检测和药敏性分析[J].食品科学,2015,36(21):129-134.
[3]You J L,Xue X L,Cao L X,et al. Inhibition of Vibrio biofilm formation by a marine actinomycete strain A66[J].Applied Microbiology and Biotechnology,2007,76(5):1137-1144.
[4]Packiavathy I A S V,Agilandeswari P,Musthafa K S,et al. Inhibition of biofilm development of uropathogens by curcumin-An anti-quorum sensing agent from Curcuma longa[J]. Food Chemistry,2014,148:453-460.
[5]Abraham S V P I,Palani A,Ramaswamy B R,et al. Anti-quorum sensing and antibiofilm potential of Capparisspinosa[J]. Archives of Medical Research,2011,42:658-668.
[6]Packiavathy I A S V,Agilandeswari P,Musthafa k S,et al. Antibiofilm and quorum sensing inhibitory potential of Cuminumcyminum and its secondary metabolite methyl eugenol against Gram negative bacterial pathogens[J]. Food Research International,2012,45:85-92.
[7]Rasmussen T B,Bjarnsholt T,Skindersoe M E,et al. Screening for Quorum-Sensing Inhibitors(QSI)by Use of a Novel Genetic System,the QSI Selector[J]. Journal of Bacteriology,2005,187(5):1799-1814.
[8]张赟彬,刘笑宇,姜萍萍,等. 肉桂醛对大肠杆菌和金黄色葡萄球菌的抑菌作用及抑菌机理研究[J]. 现代食品科技,2015,31(5):31-35.
[9]索标,卢杨柳,王娜,等.肉桂醛对猪肉糜中单核细胞增生李斯特菌的抑制作用及其机制[J].食品安全质量检测学报,2016,7(6):2211-2214.
[10]邬丽红,陈一强,孔晋亮,等.肉桂醛对烟曲霉菌体外生物膜的影响[J].重庆医学,2016,45(3):326-328.
[11]Truchado P,Tomás-Barberán F A,Larrosa M,et al. Food phytochemicals act as Quorum Sensing inhibitors reducing production and/or degrading autoinducers of Yersinia enterocolitica and Erwinia carotovora[J]. Food Control,2012,24:78-85.
[12]綦国红,董明盛,陈晓红,等.鱼源假单胞菌群体感应信号分子与腐败特性相关关系研究[J].中国农业科学,2007,40(7):1486-1491.
[13]Myszka K,Schmidt M T,Majcher M,et al. Inhibition of quorum sensing-related biofilm ofPseudomonasfluorescensKM121 by Thymus vulgare essential oil and its major bioactive compounds[J]. International Biodeterioration & Biodegradation,2016,114:252-259.
[14]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1994:102.
InhibitionofbiofilmformationinPseudomonasfluorescensbycinnamaldhyde
QIGuo-hong,JINGJia-li,YANGZhi-ping,CHENGui-tang,WANGHai-xiang,CHENGShu-jie
(School of Engineering,China Pharmaceutical University,Nanjing 211198,China)
To study the inhibition of development of biofilm inPseudomonasfluorescensFML05-2 by cinnamaldhyde at the non inhibitory concentration. Firstly,it was studied that the effect of the cinnamaldhyde on the purple pigment production byChromobacteriumviolaceumCVO26 as model bacteria,then determined the biofilm formation and extracellular polysaccharide(EPS)production that was important factors correlated with the biofilm formation inP.fluorescensFML05-2. The results indicated that the cinnamaldhyde inhibited the purple pigment production ofC.violaceumCVO26,the inhibition rates were 31.53% and 17.90%,respectively. The inhibition rates of the biofilm development were 44.22%,21.77%,the inhibition rates of EPS production were 15.72%,5.34% inP.fluorescensFML05-2 at the non inhibitory concentration of 40 μg/mL and 20 μg/mL. The results suggest that the cinnamaldhyde can inhibit the development of biofilm inP.fluorescensFML05-2 at the non inhibitory concentration
cinnamaldhyde;quorumsensing inhibition;Pseudomonasfluorescens;biofilm;extracellular polysaccharide
2016-12-23
綦国红(1972-),女,博士,副教授,研究方向:食品微生物与生物技术,E-mail:qghcpu@163.com。
细菌群体感应对鱼虾腐败过程的调控作用及其分子机制(30700627)。
TS255.1
A
1002-0306(2017)21-0147-04
10.13386/j.issn1002-0306.2017.21.030
