Saccharomyces cerevisiae对浓香型白酒发酵的影响
2017-11-21陟垚
,,陟垚,,, ,
(1.宜宾学院生命科学与食品工程学院,四川宜宾 644000; 2.固态发酵资源利用四川省重点实验室,四川宜宾 644000)
Saccharomycescerevisiae对浓香型白酒发酵的影响
王松1,2,汤涵岚1,王陟垚1,姜玉婷1,毛晶晶1,游玲1,2,王涛1,2
(1.宜宾学院生命科学与食品工程学院,四川宜宾 644000; 2.固态发酵资源利用四川省重点实验室,四川宜宾 644000)
为了探究酿酒酵母对浓香型白酒发酵的影响,在混菌固态发酵糟醅中强化接种酿酒酵母,发酵50 d后分析糟醅主要理化指标、风味物质含量及酿造微生物区系构成,发现糟醅中浓香型白酒主要风味物质含量均有所下降,特别是酯类物质生成量减少,乙酸乙酯显著下降,下降幅度达71.0%;同时,糟醅中细菌和真菌多样性降低,优势细菌仍为Lactobacillus和Pseudomonas,而真菌区系中,曲霉属的丰度从1.8%上升到60.4%,取代接合酵母成为新的优势真菌。结果表明,本实验条件下酿酒酵母对浓香型白酒发酵有一定不利影响。
浓香型白酒,酿酒酵母,风味物质,微生物区系
浓香型白酒是中国白酒的典型香型代表之一,最具特色的生产工艺是采用泥窖发酵[1],其发酵过程是酒曲和窖泥中庞大微生物区系,以糟醅为载体发生复杂的物质能量代谢和微生物的有序消长[2]。白酒中的微量成分决定着白酒的风格[3],而酵母在糖化原料淀粉质、生产酒精、形成微量香气物质等方面都起着重要的作用[4-5],是微生物区系中的重要类群,已有研究表明不同香型白酒的酿造酵母区系有明显差异[6-8]。
酿酒酵母(Saccharomycescerevisiae)作为产酒功能菌,广泛用于葡萄酒、啤酒等产品的生产,已有研究主要探讨酿酒酵母在纯培养条件下的产酒精、产酯能力[9-11],同时还研究了酿酒酵母和其他微生物的相互作用,发现酵母菌与细菌、霉菌等之间存在广泛的相互作用[12-13],如凌杰[14]研究了液态发酵条件下地衣芽孢杆菌与酿酒酵母的相互作用,Kurita[15]、唐洁等[16]研究了酿酒酵母和异常毕赤酵母的混合发酵。但迄今为止,酿酒酵母仍主要用于液态纯菌发酵,在浓香型白酒混菌固态发酵糟醅中较为罕见[17],且生产经验表明酿酒酵母可导致糟醅变“瘦”,影响续糟发酵,因此传统白酒生产企业甚至禁止将其用于生产,仅部分企业少量使用且主要用于丢糟酒生产[18],但关于酿酒酵母主要对哪些物质的生成产生影响,通过与糟醅中哪些微生物的相互作用来影响整个发酵体系中物质、能量的转化,进而影响发酵体系稳定性等问题仍未有定论。因此,本研究通过在混菌固态发酵糟醅中强化接种酿酒酵母,从糟醅的碳氮转化、风味物质生成和酿造微生物区系波动方面,探讨其对浓香型白酒发酵的影响,为酿酒酵母在浓香型白酒的生产应用提供一定参考。
1 材料与方法
1.1材料与仪器
高活性干酵母 安琪酵母(白酒专用);入窖糟醅 取自四川宜宾华夏酒业(已添加20%的曲粉),黄水为同批糟醅上一轮发酵黄水,其中一部分糟醅、窖泥和黄水在121 ℃条件下灭菌30 min;培养基 YPD固体(与液体)培养基,灭菌条件为:121 ℃,30 min。
EPPENDORF 5810R冷冻高速离心机 德国艾本德股份有限公司;AGILENT 7890A气相色谱仪 美国安捷伦科技有限公司;WELCH DREFAST MLTRA 2034C-02漩涡振荡仪 上海君翼仪器设备有限公司;NSKY200B SUKUN恒温培养振荡器 上海苏坤实业有限公司。
1.2发酵实验
斜面菌种以YPD培养基活化并扩培后,3000 r/min离心5 min去掉上清液,加入无菌水调整浓度为108个/mL,4 ℃保存备用。
混菌处理:在浓香型白酒酿造车间,入窖粮糟加体积分数为1%的黄水混匀后,分装入1 L的玻璃坛,每坛(0.83±0.05)kg,每个玻璃坛接种50 mL菌悬液,充分混匀后,自内向外依次以丢糟、窖皮泥、保鲜膜、牛皮纸封口。
纯菌对照:添加黄水的糟醅装入玻璃坛后,1×105Pa灭菌30 min,冷却至35 ℃左右接种50 mL菌悬液,其余操作同混菌处理。
空白对照:除以等体积的无菌水代替50 mL菌悬液接种未灭菌的糟醅外,其余操作同混菌处理。处理和对照均设3个重复。
1.3理化指标检测
发酵结束后,剥去封口的窖皮泥等材料后,无菌条件下混匀糟醅后,取20 g糟醅于100 mL容量瓶中加入100 mL无菌水,充分摇匀后浸泡30 min,然后用纱布过滤,取其滤液保存备用。淀粉、还原糖含量、酸度和氨基态氮测定方法参照相关国家标准[19]。
1.4风味物质检测
1.4.1 样品的预处理 固态糟醅发酵结束后,取200 mL的去离子水加入到盛有100 g糟醅的烧杯中,然后再蒸馏出100 mL蒸馏液用于风味物质检测(蒸馏条件:150 mBar、150 r/min、80 ℃)。所有蒸馏液均用0.22 μm细菌滤膜过滤备用。
1.4.2 风味物质检测方法 采用FFAP色谱柱(50 mm×0.25 mm×0.25 μm,Agilent USA)和LZP-930色谱柱(5000 mm×0.25 mm×0.25 μm,郑州普析)检测有机酸及其他主要风味物质[20];采用C18柱(5 μm,250 mm×4.6 mm)应用液相色谱法检测乳酸含量[21]。
1.5微生物区系分析
称取20 g糟醅于500 mL离心管中,加入200 mL灭菌超纯水和2 mL吐温-80涡旋振荡30 s,然后用超声破碎仪(超声破碎仪参数设置如下:振幅60%,总处理时间4 min,运行时间10 s,间歇时间10 s,最高温度40 ℃)处理,采用改进的CTAB法进行总DNA提取。将提取出的总DNA样检测后送上海生工进行高通量测序,测序引物为细菌16S rDNA和真菌ITS1及ITS4通用引物。
用Mothur软件以97%为拟定阈值对序列划分操作分类单元(OTU);利用得出的OTU结果计算样品中微生物的α-多样性,包括Shannon、ACE、Chao 1、Simpson等。为尽量减少错误测序并确保测序质量,在测序前需要将各序列的引物和barcode去掉,并对序列长度进行筛选[22]。删掉长度小于50 bp的序列和低复杂度序列。
1.6数据处理
所得数据均采用SPSS 19.0进行显著性分析。
2 结果与分析
2.1酿酒酵母对碳氮源转化的影响
由图1可知,与空白对照比较,接种酿酒酵母的未灭菌糟醅中,淀粉含量较低,还原糖含量较高,乙醇生成量由6.66 g/100 g锐减到1.93 g/100 g,在糟醅中淀粉正常分解,还原糖充分供给的情况下,乙醇生成量减少,说明接种酿酒酵母后糟醅发酵力明显下降,这可能是由于强化的酿酒酵母未能正常发酵,甚至对糟醅中原有酵母的生长发酵产生了不利影响,这与丢糟酒生产中加入酿酒酵母、糖化酶后出酒率提高的情况不吻合,可能是由于在模拟发酵的玻璃坛内,糟醅由于未经踩窖,内部仍容留了过多空气,导致酿酒酵母繁殖过多,耗费了大量生长资源,抑制了糟醅中酵母群体的发酵。另外,接种酿酒酵母的糟醅中氨基态氮含量减少说明酿酒酵母使糟醅中蛋白分解减弱。

图1 酿酒酵母对碳氮转化的影响Fig.1 Effect of Saccharomyces cerevisiae on the degradation of carbon and nitrogen
与纯菌发酵糟醅比较,混菌发酵糟醅中的淀粉和氨基态氮含量均较低,而还原糖和乙醇生成量较高,可能是糟醅灭菌后,导致整个发酵体系中原有的糖化酶不再起作用,而外加的糖化酶效果较差,由淀粉生成的还原糖量较少,因此产酒精也较少。混菌发酵糟醅中的氨基态氮略高于未添加蛋白酶的灭菌糟醅,也证实了高温对蛋白酶的灭活作用。
可见,强化接种酿酒活性干酵母到混菌发酵糟醅中,酿酒酵母与糟醅微生物共同作用可强化糖化作用和氨基酸的利用,减弱发酵力,但上述影响均不显著。
2.2酿酒酵母对主要风味物质生成的影响
2.2.1 酿酒酵母对醇类物质生成的影响 由图2可知,与空白对照相比,接种酿酒酵母后,正丁醇、正丙醇、异丁醇、异戊醇、苯甲醇和正己醇生成量减少,而甲醇、糠醇和仲丁醇生成量增加;与纯菌发酵相比,甲醇、正丙醇、仲丁醇、正丁醇、异戊醇和糠醇生成量显著上升,且正丙醇、仲丁醇、正丁醇和糠醇达到了极显著上升,说明糟醅中其他微生物与高级醇的生成有密切关系,糟醅原有的混菌发酵微生物共代谢形成的缓冲体系可使高级醇的含量保持在相对稳定的范围。

图2 酿酒酵母对糟醅中醇类物质的影响Fig.2 Influences on the alcohols in fermented grains when enhanced by Saccharomyces cerevisiae注:*表示与纯菌的差异达到显著水平(p<0.05),**表示与纯菌的差异达到极显著水平(p<0.01);表1同。
总体上,酿酒酵母对固态发酵糟醅中高级醇的影响包括以下几个方面:在混菌发酵糟醅中与糟醅中微生物相互作用,直接或间接地促进甲醇、糠醇和仲丁醇的生成;显著抑制正丙醇、正丁醇、异戊醇的生成,对β-苯乙醇的生成也有一定抑制作用;与糟醅中微生物相互作用,减少异丁醇、苯甲醇和正己醇的生成。
2.2.2 酿酒酵母对醛类物质生成的影响 醛类物质对浓香型白酒呈香起着辅助作用,酒中含有适量的醛类,对酒的口味有好处,过量则使白酒有强烈的刺激味和辛辣味。
由表1可知,与空白对照相比,接种酿酒酵母的糟醅中乙醛生成量减少了50%左右,而糠醛和乙缩醛的生成量略有增加;而与纯菌发酵相比较,乙醛生成量却显著上升,乙缩醛生成量减少,推测酿酒酵母可能会使乙缩醛生成量增加,而未灭菌糟醅中微生物和酿酒酵母相互作用使乙醛生成量大幅降低。
2.2.3 酿酒酵母对有机酸生成的影响 由表2可知,与酿酒酵母纯菌发酵相比,混菌发酵糟醅酸度较低,可能酿酒酵母会促进糟醅中有机酸的生成,但与空白对照相比,强化接种酵母后酸度没发生变化,未灭菌的糟醅微生物体系有缓冲作用,使最终接入酿酒活性干酵母的发酵糟醅酸度不变。
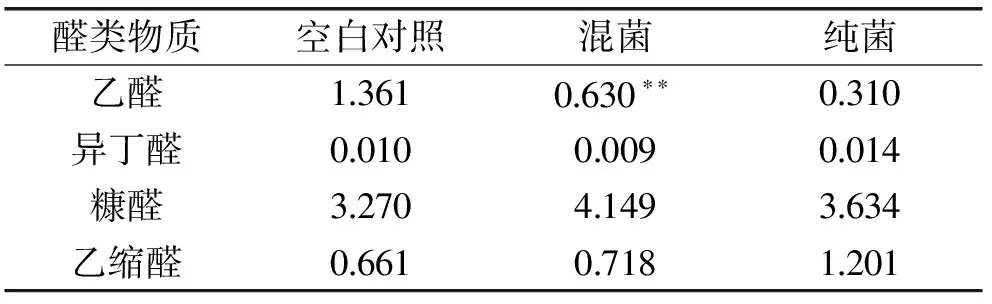
表1 酿酒酵母对醛类物质的影响(mg·100 mL-1)Table 1 Influences on the alcohols aldehydes in fermented grains when enhanced by Saccharomyces cerevisiae(mg·100 mL-1)

表2 酿酒酵母对有机酸的影响(mg·100 mL-1)Table 2 Influences on the organic acids in fermented grains when enhanced by Saccharomyces cerevisiae(mg·100 mL-1)
同时,接种酿酒酵母的混菌发酵糟醅中,乙酸、丁酸、己酸、异戊酸、丙酸和辛酸生成量增加,乳酸生成量略有减少,而酵母纯菌发酵糟醅中乙酸、异戊酸和辛酸生成量增加,且异戊酸的增加了达到极显著水平(p<0.01),乳酸生成量减少较多,表明酿酒酵母倾向于增加乙酸、异戊酸等的生成,减少乳酸的生成,这意味着酿酒酵母可能给白酒带来乙酸的刺激性味感及异戊酸的闷味,并削弱乳酸赋予白酒的柔和味感。
2.2.4 酿酒酵母对酯类物质生成的影响 由表3可知,与空白对照相比,接种酿酒酵母后糟醅中的总酯生成量大幅下降,其中乙酸异丁酯的生成量极显著下降,己酸-2-苯乙酯、乙酸乙酯和戊酸乙酯的生成量显著下降。四大酯中,己酸乙酯下降幅度为44.5%,乙酸乙酯下降幅度高达71.0%,丁酸乙酯下降幅度为38.6%,乳酸乙酯也有所下降,但下降幅度较低,同时,在乙酸、丁酸和己酸含量增加的情况下,酯类物质生成量仍明显下降,推测可能是由于氧气充足,混菌体系中乙醇含量减少(乙醇转化为乙酸),或产酯化酶的厌氧菌生长不良,从而抑制了酯化反应。

表3 酿酒酵母对酯类物质的影响(mg·100 mL-1)Table 3 Influence on the esters in fermented grains when enhanced by Saccharomyces cerevisiae(mg·100 mL-1)
注:a表示与空白的差异达到显著水平(p<0.05),b表示与纯菌的差异达到显著水平(p<0.05),A表示与空白的差异达到极显著水平(p<0.01),B表示与纯菌的差异达到极显著水平(p<0.01)。
但与纯菌发酵相比,除棕榈酸乙酯、肉蔻酸乙酯和月桂酸乙酯生成量减少外,其余乙酯都增加,乙酸-2-苯乙酯和乳酸乙酯的生成量显著增加,丁酸乙酯、己酸乙酯、戊酸乙酯、苯乙酸乙酯和庚酸乙酯的生成量极显著增加,表明混菌发酵可促进多数低级脂肪酸乙酯的生成。
2.3酿酒酵母对糟醅微生物区系的影响

表4 酿酒酵母对糟醅中细菌多样性的影响Table 4 Alpha diversity of bacterial community in fermented grain when enhanced by Saccharomyces cerevisiae

表6 酿酒酵母对糟醅中真菌多样性的影响Table 6 Alpha diversity of fungus community in fermented grain when enhanced by Saccharomyces cerevisiae
2.3.1 酿酒酵母对糟醅细菌区系的影响 由表4可得,测序样品序列覆盖率均在88%及以上,能大致反映糟醅样本中细菌微生物菌群的真实信息。从Chao1指数和ACE指数可以看出,接入酿酒酵母的糟醅中细菌种数减少50%左右,从Shannon指数和Simpson指数也可看出,接入酿酒酵母后糟醅中细菌多样性下降,这与表5中处理糟醅细菌分类单元数在不同分类水平上均少于空白对照的现象是一致的。
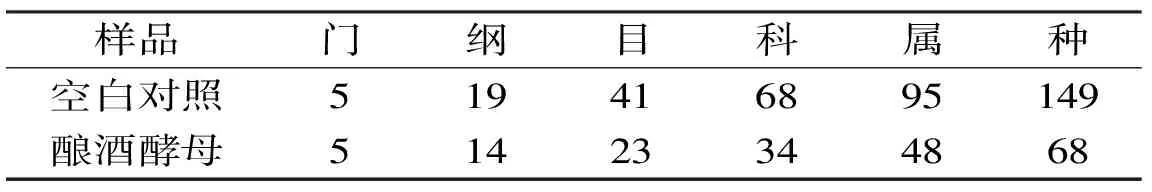
表5 酿酒酵母对细菌不同分类水平下类群数量的影响Table 5 Bacteria groups in fermented grain at different levels of classification when enhanced by Saccharomyces cerevisiae
在属分类水平下,由图3可知,空白对照中丰度低于1%的细菌(other)所占比例较大,接种酿酒酵母后这部分细菌的丰度大幅下降,这是细菌多样性明显降低的主要原因。丰度最高的Lactobacillus由37.3%上升到63.1%,上升幅度达41%,但乳酸生成量没有显著变化;Pseudomonas由22.4%上升到23.7%,Acinetobacter由1.1%上升到3.1%,Xylophilus由0.9%上升到2.5%,Acetobacter由2.2%下降到1.9%,Acetobacter能够发酵葡萄糖产生乙醇,并将乙醇转化为乙酸[23],但乙酸生成量反而上升,说明醋酸杆菌不是产乙酸的唯一因素,乙酸生成量增加可能是与前体物的供给、产物抑制、酶作用和氧气含量等有关,而醋杆菌减少可能是由于其他细菌的竞争抑制。

图3 酿酒酵母对细菌种属构成的影响Fig.3 Effect of Saccharomyces cerevisiae on the bacterial flora in fermented grains
2.3.2 酿酒酵母对真菌区系的影响 由表6可得,测序样本序列覆盖率均为98%,能很好地反映糟醅样本中真菌微生物菌群的真实信息。从Chao1指数和ACE指数可以看出,接种酿酒酵母的糟醅中真菌种数明显减少,从Shannon指数和Simpson指数也可以看出,其真菌多样性也明显下降,这与表7中处理糟醅真菌分类单元数在不同分类水平上均少于空白对照的现象是一致的。
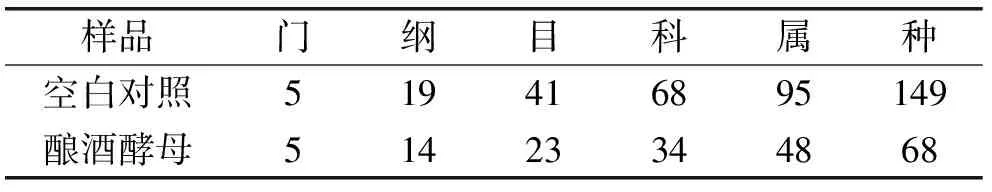
表7 酿酒酵母对真菌不同分类水平下类群数量的影响Table 7 Fungus groups in fermented grain at different levels of classification when enhanced by Saccharomyces cerevisiae
接种酿酒酵母发酵结束后的糟醅中未检测到酿酒酵母,这可能是由于酿酒酵母是快速生长发酵的酵母,在发酵高峰期过后自溶,而糟醅中较低pH使自溶后暴露出来的DNA降解,导致难以检测到酿酒酵母的特征序列,而接合酵母、路德酵母等优势酵母虽然产酒精能力稍差,但对浓香型白酒酿造环境的适应能力较好,一方面其作为柔俨酵母可在整个发酵过程中持续产酒精,另一方面容易产孢,存活能力较好,但酿酒酵母通过在接种初期的旺盛生长代谢仍对糟醅中真菌群体构成产生了重要影响。
从图4可以看出,在属一级分类水平下,与空白对照相比,糟醅中的Zygosaccharomyces由57.2%下降到12.1%,未鉴定真菌(unclassfied fungi)大幅上升(64.5%),将这些未鉴定真菌的对应序列在NCBI中比对,发现其主要是Aspergillusssp.(丰度为60.4%),说明酿酒酵母使Aspergillusssp.取代Zygosaccharomyces成为混菌发酵糟醅中的优势真菌,而它们的发酵产香性能差异较大[24-25]。未鉴定真菌还包括少量的Wickerhamomycesanomalus、Rhizomucorssp.和Rhizopusoryzae,丰度分别为0.8%、2.9%、0.3%,其中酿酒酵母对Wickerhamomycesanomalus、Rhizomucortauricus的丰度影响不大。
另外,还有一些种属真菌的丰度也有明显变化,如Aspergillus由2.0%上升到6.2%,Saccharomycopsis由0.7%上升到3.7%,Xeromyces由1.2%上升到3.4%,Pseudeurotium由0.5%上升到2.4%,Torulaspora由1.4%上升到2.1%,而Chloridium、Fusarium、Lecythophor和Zopfiella则消亡殆尽。

图4 酿酒酵母对糟醅真菌区系构成的影响Fig.4 Influence on the fungi flora in fermented grains of Saccharomyces cerevisiae
3 结论
采用液相和气相色谱对发酵糟醅中风味物质进行测定,结果表明酿酒酵母与糟醅中微生物共同作用促进甲醇、糠醇和仲丁醇的生成,增加乙酸、异戊酸的生成,直接或间接降低总酯及“四大酯”的生成量,其中乙酸乙酯达到显著水平。同时,酿酒酵母使发酵糟醅中的细菌和真菌多样性降低,且对真菌群落结构影响更大,优势细菌Lactobacillus丰度上升,但非优势细菌丰度大幅下降;真菌OTU数量下降65%,曲霉属取代接合酵母成为新的优势真菌。
综上,酿酒酵母不仅可能对浓香型白酒风味带来不利影响,对酿造微生物生态也有重要影响,这种影响将在持续发酵中继续对白酒产量及品质带来不可预知的影响,因此在生产中需慎用。
[1]刘博,杜海,王雪山,等. 基于高通量测序技术解析浓香型白酒中窖泥臭味物质4-甲基苯酚的来源[J]. 微生物学通报,2017,44(1):108-117.
[2]侯小歌,王俊英,李学思,等. 浓香型白酒糟醅及窖泥产香功能菌的研究进展[J]. 微生物学通报,2013,40(7):1257-1265.
[3]Wu Q,Xu Y,Chen L. Diversity of yeast species during fermentative process contributing to Chinese Maotai-flavour liquor making[J]. Letters of Applied Microbiology,2012,55(4):301-307.
[4]赵东,乔宗伟,彭志云. 浓香型白酒发酵过程中酒醅微生物区系及其生态因子演变研究[J]. 酿酒科技,2007(7):37-39.
[5]Holt H,Cozzolino D,Mccarthy J,et al. Influence of yeast strain on Shiraz wine quality indicators[J]. International Journal of Food Microbiology,2013,165(3):302-311.
[6]邵明凯,王海燕,徐岩,等. 酱香型白酒发酵中酵母群落结构及其对风味组分的影响[J].微生物学通报,2014,41(12):2466-2473.
[7]Van-Diep L,Zheng X,Ma K,et al. Characterization of Fen-Daqu through multivariate statistical analysis of 1H NMR spectroscopic data[J]. Journal of the Institute of Brewing,2011,117(4):516-522.
[8]周瑞平,陈云宗,游玲. 多粮浓香型白酒糟醅中的酵母区系的初步研究[J],酿酒科技,2010,189(3):34-39.
[9]方佩佩,王世清,李静,等. 紫外诱变法选育高产酒精及酯类酿酒酵母[J]. 粮油食品科技,2016,24(1):86-90.
[10]牟含. 川南白酒酿造环境中葡萄酒增香酿造酵母菌株的筛选[D]. 西安:西北农林科技大学,2015:32-50.
[11]陈笔. 酱香型白酒酿造过程中霉菌群落结构以及霉菌与酵母相互作用的研究[D]. 无锡:江南大学,2014:23-41.
[12]Rainieri S,Pretorius I S. Selection and improvement of wine yeasts[J]. Annals of Microbiology,2000,50(1):15-31.
[13]吴群,陈笔,李勇,等.芝麻香型白酒酿造功能霉菌及其与酵母的相互作用[J]. 酿酒科技,2015(1):7-11.
[14]凌杰. 白酒酿造中地衣芽孢杆菌与酿酒酵母的相互作用及应用研究[D]. 无锡:江南大学,2013:11-30
[15]Kurita O. Increase of acetate ester-hydrolysing esterase activity in mixed cultures of Saccharomyces cerevisiae and Pichia anomala[J]. Journal of Applied Microbiology,2008,104(4):1051-1058.
[16]唐洁,王海燕,徐岩. 酿酒酵母和异常毕赤酵母混菌发酵对白酒液态发酵效率和风味物质的影响[J]. 微生物学通报,2012,39(7):921-930.
[17]You L,Wang S,Zhou R P,et al. Characteristics of Yeast Flora in Chinese Strong Flavour Spirit Fermentation in Yibin Region,China[J]. Journal of the Institute of Brewing,2016,122(7):517-523.
[18]杜礼泉,王远成,蒲浩,等.活性干酵母在红糟、丢糟中的应用研究[J]. 酿酒科技,2006,2006(11):78-80.
[19]中国国家标准化管理委员会. 浓香型白酒:GB/T 10781.1-2006[S]. 北京:中国标准出版社,2006:2-4.
[20]You L,Wang T,Yang Z R,et al. Performance of indigenous yeasts in the processing of Chinese strong-flavoured liquor during spontaneous mixed solid-state or submerged fermentation[J]. Journal of the Institute of Brewing,2015,121(121):295-303.
[21]马雷,沈小梅,李安军. 超高效液相色谱法测定白酒中乳酸的含量[J]. 食品与发酵科技,2015,52(1):84-86.
[22]Zhu D,Tanabe S,Yang C,et al. Bacterial community composition of South China Sea sediments through Pyrosequencing-Based analysis of 16S rRNA genes[J]. Plos One,2013,8(10):1-9.
[23]吴徐建. 酱香型白酒固态发酵过程中酵母与细菌群落结构变化规律的研究[D]. 无锡:江南大学,2013:37-55.
[24]廖永红,沈晗,石文娟,等. 产香酵母碳源利用及发酵产香特性初步研究[J]. 食品与发酵工业,2010,36(2):1-7.
[25]张继冉,方芳,陈坚,等. 鲁氏接合酵母对酱油中氨基甲酸乙酯前体物的代谢[J]. 微生物学报,2016,56(6):956-963.
EffectofSaccharomycescerevisiaeonthefermentationofstrong-flavouredliquor
WANGSong1,2,TANGHan-lan1,WANGZhi-yao1,JIANGYu-ting1,MAOJing-jing1,YOULing1,2,WANGTao1,2
(1.College of Life Science and Food Engineering,Yibin University,Yibin 644000,China; 2.Key Laboratory of Sichuan Province for the Utilization of Solid State Fermentation Resources,Yibin 644000,China)
In order to explore the fermentation characteristics ofSaccharomycescerevisiaein strong-flavoured liquor fermentation,Saccharomycescerevisiaewas inoculated in the fermentative grains and fermented for 50 days,then main ingredients and flavor substances were detected,and microbial flora was analyzed by high-throughput sequencing. It found that owing to the enhancement ofSaccharomycescerevisiae,the main flavor substances of strong-flavoured liquor in fermented grains decreased,especially the production of esters reduced,and ethyl acetate was significantly decreased by 71.0%. Furthermore,Saccharomycescerevisiaeobviously reduced the diversity of bacterial and fungal in fermentative grains,LactobacillusandPseudomonaswere still the dominant genus in bacteria flora,while the frequency ofAspergilluswas increased from 1.8% to 60.4% in the fungal flora,andAspergillusbecame new dominant fungi instead ofZygosaccharomyces. The results indicated thatSaccharomycescerevisiaehad more negative effects on the fermentation of strong-flavoured liquor than expected benefits.
strong-flavoured liquor;Saccharomycescerevisiae;flavor substances;microbial flora
2017-04-18
王松(1982-),男,硕士,讲师,主要从事发酵食品方面的研究,E-mail:539833974@qq.com。
中国轻工业浓香型白酒固态发酵重点实验室开放基金(2017JJ010);宜宾学院博士启动项目(2016QD09)。
TS261.1
A
1002-0306(2017)21-0142-06
10.13386/j.issn1002-0306.2017.21.029
