中枢神经系统孤立性纤维性肿瘤/血管外皮瘤8例临床病理分析
2017-11-21眭玉霞陈志忠李艳辉王丽萍
晋 龙,眭玉霞,罗 敏,陈志忠,李艳辉,王丽萍
中枢神经系统孤立性纤维性肿瘤/血管外皮瘤8例临床病理分析
晋 龙1,眭玉霞2,罗 敏3,陈志忠1,李艳辉1,王丽萍1
目的探讨中枢神经系统孤立性纤维性肿瘤/血管外皮瘤(solitary fibrous tumors/hemangiopericytoma, SFT/HPC)的临床病理学特点、免疫表型及鉴别诊断。方法回顾性分析8例中枢神经系统SFT/HPC的临床病理学和影像学资料、免疫表型特征,并复习相关文献。结果男性5例,女性3例,年龄38~58岁,平均45.38岁。肿瘤大小从2.9 cm×3.1 cm×2.3 cm到7.8 cm×7.4 cm×5.5 cm不等。镜下根据WHO(2016)中枢神经系统肿瘤的分类,将SFT/HPC分为3级:1级2例,2级3例,3级3例。低倍镜下肿瘤可见细胞丰富区和疏松区交替分布的经典图像,1级细胞密度相对较低,有丰富的胶原纤维;2级具有更多的细胞,较少的胶原,可见HPC图像;3级细胞密度高,可见坏死,核分裂象≥5/10 HFP。免疫表型:vimentin、CD34、CD99和BCL-2(+),并且所有肿瘤细胞核强阳性表达STAT6蛋白。有随访资料的6例中2例术后复发。结论中枢神经系统SFT/HPC是一种少见的软组织肿瘤,具有特征性病理形态表现。结合发生部位、影像学资料、组织病理学特点及免疫表型可明确诊断。中枢神经系统SFT/HPC具有不同于发生于中枢神经系统外肿瘤的分级标准。根据分级不同,治疗方法和预后均有所不同。
颅内肿瘤;孤立性纤维性肿瘤/血管外皮瘤;免疫组织化学
孤立性纤维性肿瘤(solitary fibrous tumor, SFT)是一种少见的间叶来源的梭形细胞肿瘤。1931年,Klemperer和Rabin[1]首次报道了原发于脏层胸膜的孤立性纤维瘤后,其曾一度被认为好发于浆膜腔,随着认识的加深,报道增多,目前认为其可发生于全身各部位[2]。发生于颅内的多为个案报道,大样本的报道较少。血管外皮细胞瘤(hemangiopericytoma, HPC)首次作为软组织肿瘤是在1942年由Stout和Murray[3]命名的。WHO(2016)中枢神经系统肿瘤分类认为SFT和HPC其实是重叠的,可能属于同一肿瘤谱系的不同形态表现,并创建了一个联合诊断术语来描述这类肿瘤:SFT/HPC。本文收集福建省立医院诊断的8例SFT/HPC,按照WHO(2016)中枢神经系统肿瘤标准进行分类分级,探讨中枢神经系统SFT/HPC的临床病理学特点、免疫表型、鉴别诊断、治疗及预后,旨在提高认识水平。
1 材料与方法
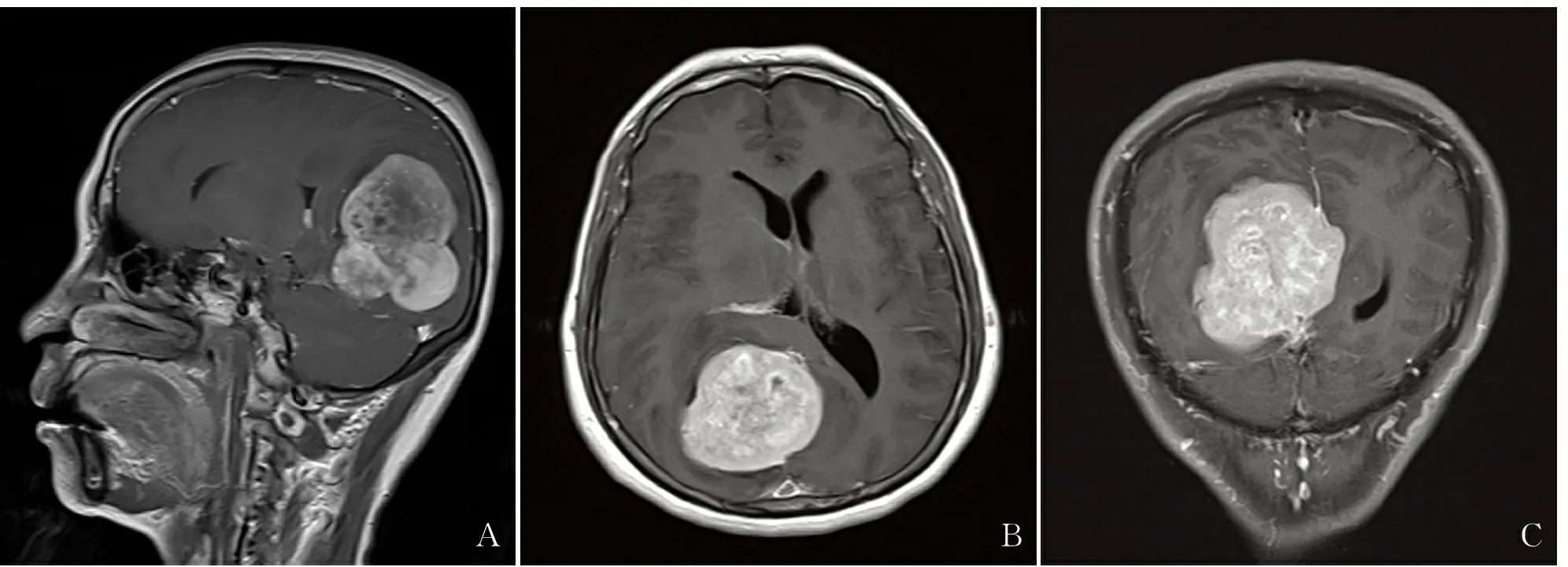
1.1临床资料收集2004~2016年福建省立医院存档的中枢神经系统SFT/HPC手术切除标本,临床资料见表1,其中男性5例,女性3例,复发2例,年龄38~58岁,中位年龄45.38岁,临床症状表现为头痛、头晕、意识障碍、视物重影、视力下降、全身抽搐、四肢乏力、恶心呕吐、反应迟钝等。影像学绝大多数表现为富于血供的肿瘤,有“脑膜尾征”,多数考虑脑膜来源肿瘤可能性大。例1较典型,大脑镰后部右侧旁颅内见宽基底外形呈分叶状的不规则形病灶,部分边界不清,大小5.4 cm×5.4 cm×6.6 cm(左右径×前后径×上下径),呈混杂等稍短及稍长T1、混杂稍短及稍长T2信号,T2WI-FLAIR及DWI呈高低混杂信号,以低信号为主,增强扫描呈不均匀明显强化,邻近部分脑膜(大脑镰)增厚且较明显强化,与病灶相连,形成“脑膜尾征”(图1)。
1.2方法标本均经10%中性福尔马林固定,常规石蜡包埋,4 μm厚连续切片。采用免疫组化MaxVision两步法染色,石蜡切片脱蜡、水化后PBS冲洗,过氧化物酶阻断剂封闭内源性过氧化酶活性,加入一抗,室温孵育,加生物素标记的二抗,加链霉素抗生物素的过氧化酶溶液,孵育后滴加DAB显色,苏木精复染,常规脱水,透明,封片。所用一抗(兔抗人单克隆抗体,即用型)和MaxVision试剂盒均购自福州迈新公司。
2 结果
2.1眼观肿瘤大小从2.9 cm×3.1 cm×2.3 cm到7.8 cm×7.4 cm×5.5 cm不等,8例均为1个孤立性肿瘤,5例与周围脑组织分界清楚,3例包膜不完整,切面鱼肉状,灰白、灰红色或出血,可见多个血管腔。局部质软,易碎,局部略呈分叶状,质地中等偏硬。
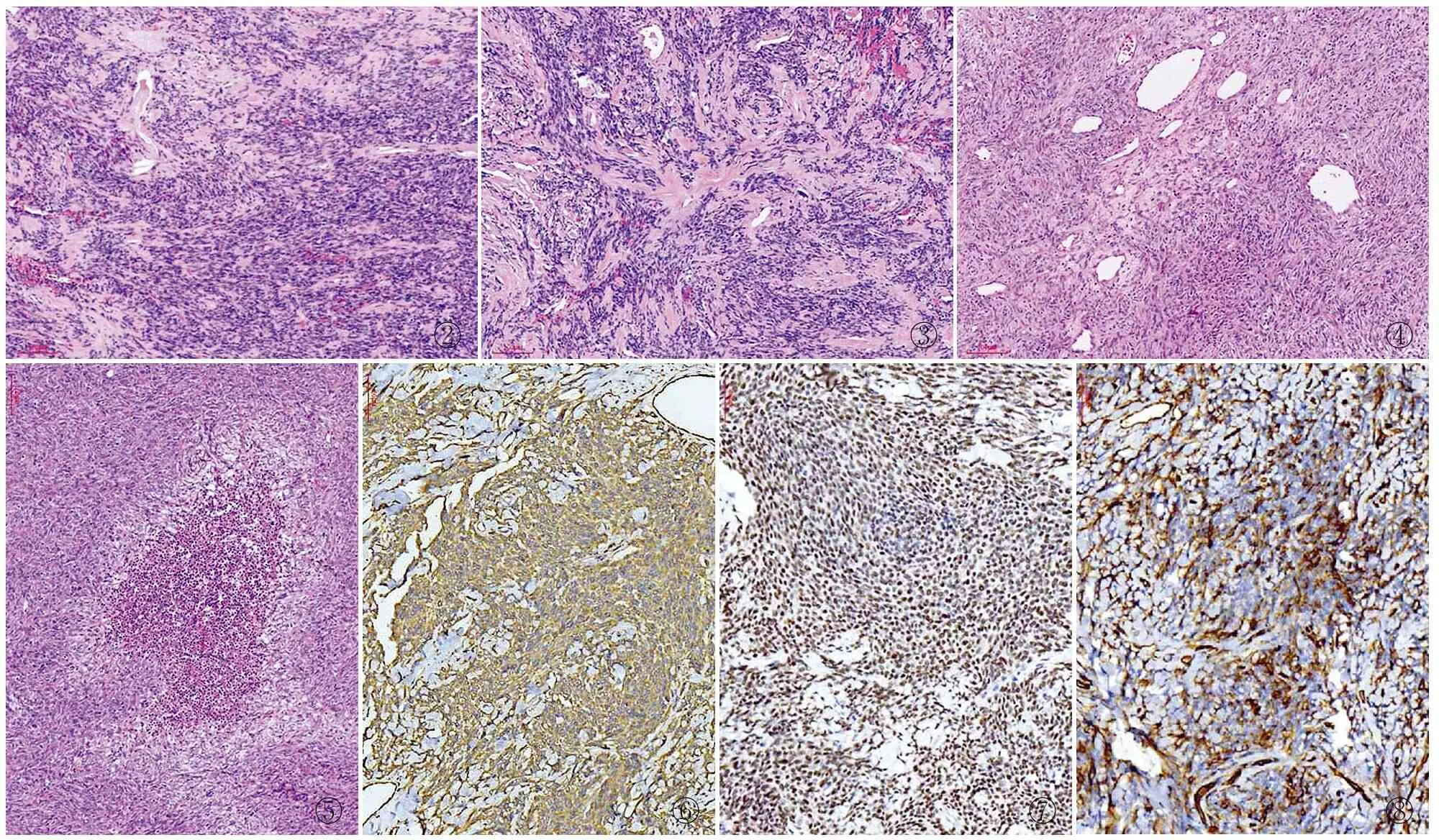
2.2镜检低倍镜下可见肿瘤细胞疏密相间分布,由交替分布的细胞丰富区和细胞稀疏区组成(图2)。细胞丰富区瘤细胞呈束状、漩涡状或不规则状等排列。疏松区瘤细胞稀少伴胶原纤维化及黏液样变性。根据WHO(2016)中枢神经系统肿瘤分类,将SFT/HPC分为3级,其中1级2例,细胞密度相对较低,有丰富胶原纤维(图3)。瘤细胞以梭形细胞构成为主,细胞形态变化较小,梭形细胞界限不清,细胞质嗜酸性或淡染,细胞核呈梭形、短梭形或长杆状,核两端钝圆或稍尖,可出现核内空泡;2级3例,较1级具有更多的细胞,可见肥胖的上皮样细胞,上皮样细胞呈多角形、不规则形或星状,核圆形,核膜薄,核染色质分布较均匀,可有小核仁,核分裂象1~4/10 HFP,较少的胶原,可见HPC样图像(图4);3级3例,细胞密度高,瘤细胞呈圆形、卵圆形或上皮样,异型性明显,核染色质增粗且不均匀,有丰富的血管网,血管口径大小不一,可呈扩张的血窦样、裂隙样、树枝状或鹿角状,并相互连接成网。可见灶性出血和坏死(图5),核分裂象≥5/10 HFP。

表1 8例中枢神经系统孤立性纤维性肿瘤/血管外皮瘤的临床病理学特征
ABC
图1头颅MRI:增强T1WI矢状位(A)、轴位(B)、冠状位(C):病灶不均匀明显强化,邻近部分脑膜(大脑镰)增厚且较明显强化,与病灶相连,形成“硬膜尾征”
2.3免疫表型8例肿瘤细胞vimentin(图6)胞质弥漫强阳性,并且8例STAT6细胞核强阳性(图7)。5例1级和2级病例CD34(图8)胞质弥漫强阳性,3例3级病例CD34局灶阳性。同时不同程度表达CD99和BCL-2。均不表达CKpan、EMA、GFAP、S-100,Ki-67增殖指数2%~45%。
3 讨论
SFT是一种间叶性肿瘤,瘤细胞可能起自于表达CD34抗原的树突状细胞[4]。其曾一度被认为好发于浆膜腔,现研究认为,目前认为其好发于全身各部位,如头颅、腹腔、腹膜后、四肢、眼眶等。WHO将孤立性纤维瘤归入中间型肿瘤,大多数病例呈良性经过,10%~20%属非典型性及恶性[5]。
1996年Carneiro等[6]首次报道了发生于脑膜的SFT,WHO(2007)中枢神经系统肿瘤分类将其列入脑膜肿瘤中间叶性肿瘤的一类[7]。研究发现颅内SFT和HPC在组织形态上有相似之处,并且均具有12q13染色体倒置、NAB2和STAT6基因融合,并且可以通过免疫组化法检测到肿瘤细胞核内表达STAT6蛋白。因此,SFT和HPC可能属于同一肿瘤。于是,WHO(2016)中枢神经系统肿瘤分类创建了一个联合诊断术语来描述这类肿瘤:SFT/HPC。
3.1临床特点中枢神经系统SFT/HPC是一种罕见的软组织肿瘤,大量研究显示SFT/HPC占原发中枢神经系统肿瘤小于1%。中枢神经系统SFT/HPC发病高峰在40~50岁,且男性发病率高于女性。本组实验亦发现男性患者(5例)多于女性患者(3例),平均年龄45.38岁。绝大多数发生于成人幕上的脑膜或脊膜,不同程度侵袭中枢神经系统实质或神经根以及颅底,10%发生于脊髓。临床表现主要取决于肿瘤发生的部位和肿瘤大小不同而异,因肿瘤阻碍脑脊液回流,引起颅内压升高,可出现头晕、恶心、呕吐等症状。部分患者还会出现大面积颅内出血及伴有低血糖等副瘤综合征[8],低血糖主要是因为肿瘤细胞分泌胰岛素样生长因子,后者可产生降血糖效应[9]。
②③④⑤⑥⑦⑧
图2细胞丰富区和细胞稀疏区交替分布图3胶原纤维丰富图4肿瘤细胞丰富,可见血管外皮瘤样图像图5局灶出血和坏死图6中枢神经系统孤立性纤维性肿瘤/血管外皮瘤:vimentin胞质阳性,MaxVision两步法图7中枢神经系统孤立性纤维性肿瘤/血管外皮瘤:STAT6细胞核阳性,MaxVision两步法图81和2级中枢神经系统孤立性纤维性肿瘤/血管外皮瘤中CD34胞质阳性,MaxVision两步法
影像学上平面CT显示无钙化及周边颅骨反应的孤立的、不规则肿物。MRI显示T1加权像等信号,T2加权像为高或混合性信号,伴随不均匀强化。在病变周边可见脑膜对比增强(脑膜尾征)和流动的空隙[10]动脉造影术显示肿瘤富于血管。本组实验发现4例影像学见“脑膜尾征”,全部病例发生于幕上,并且发生部位以大脑镰旁多见。
3.2病理学特征中枢神经系统SFT/HPC组织学上有其特殊的形态特征,低倍镜下可见肿瘤细胞疏密相间分布,由交替性分布的细胞丰富区和细胞稀疏区组成。细胞丰富区瘤细胞呈束状、旋涡状或不规则状等排列。疏松区瘤细胞稀少伴胶原纤维化及黏液样变性。随着肿瘤分级的增高,细胞密度增高,胶原纤维逐渐减少,出现血管外皮瘤样图像,并见灶性出血及坏死。
传统的中枢神经系统肿瘤的WHO分类将分级作为恶性程度的考量,往往是每一种肿瘤对应一个具体的分级,而非一种肿瘤对应多重分级。对于低级别的SFT和较高级别的HPC(过去称为HPC和间变型HPC)创建的联合诊断术语,与传统的其他中枢神经细胞肿瘤相比较,WHO(2016)中枢神经系统肿瘤分类打破了传统分级的原则,建立了新分级标准。将中枢神经系统SFT/HPC分为3个级别:Ⅰ级,对应有丰富的胶原,相对低的细胞密度,可见类似于过去诊断为SFT的梭形细胞;Ⅱ级,具有更多的细胞,较少的胶原,可见肥胖的上皮样细胞和“鹿角”状血管,类似于过去诊断的HPC;出现肥胖的上皮样细胞往往提示肿瘤的生物行为转化[11];Ⅲ级,更多的表现为过去称为间变型HPC的特征,具有核分裂象≥5/10 HFP。然而,一些组织学类似于传统的SFT的肿瘤具有恶性特征,当其具有核分裂象≥5/10 HFP时[7,12],也被划分为WHOⅢ级。
SFT和HPC的进展及命名经历了长时间变化。WHO(2002)软组织肿瘤分类中以胸膜外SFT/HPC命名。WHO(2013)软组织肿瘤分类[13]又以SFT命名,属于中间性肿瘤,而且废弃了“血管外皮瘤”名称。同时沿用了England等[14]提出的胸膜外恶性SFT的诊断标准:细胞丰富密集;核分裂象增多(≥4/10 HFP);细胞有不同程度异型性;肿瘤细胞坏死;和(或)浸润性边界。而对于中枢神经系统这个特殊部位,SFT/HPC分级与其略有不同。Bouvier等[15]研究发现SFT和HPC之间不仅有重叠的组织学和免疫表型特征。在单因素相关分析中,与无瘤生存期和总生存期最相关的组织学预后因素是细胞密度增高、核分裂象计数(≥5/10 HPF)和坏死。
免疫表型:SFT通常表达CD34(80%~90%)、CD99(70%)、BCL-2(30%)、EMA(30%)、actin(20%),不表达desmin、CK和S100[16]。目前认为绝大多数SFT均表达CD34、CD99、BCL-2,其中CD34是公认的比较特异和准确的免疫标志物,但大量研究显示,CD34的阳性率与肿瘤的分化有关,一般情况下,在形态学良性区域CD34阳性率较高,而在明显间变区域,CD34阳性率往往下降或缺失[17]。这也与本实验结果相符,2例1级和3例2级的SFT/HPC弥漫强阳性表达CD34,而3例3级SFT/HPC表达强弱不等。
由于SFT/HPC在遗传学上具有12q13染色体倒置、NAB2和STAT6基因融合,导致STAT6蛋白在瘤细胞核内强表达,利用免疫组化技术检测STAT6蛋白有很高的特异性和敏感性[18]。本组8例中枢神经系统SFT/HPC肿瘤细胞核均阳性,与其研究结果一致。
3.3鉴别诊断中枢神经系统SFT/HPC需与以下肿瘤鉴别:(1)纤维性脑膜瘤:梭形细胞可以与SFT肿瘤细胞相似,但是脑膜瘤细胞典型表达EMA,且CD34和STAT6阴性。(2)尤因肉瘤/原始神经外胚瘤:细胞丰富区可见血管外皮瘤样图像,且CD99膜阳性,但缺失核的STAT6阳性且绝大多数EWS/PNET病例有EWSR1融合基因重排。(3)颅内原发或转移的单相纤维型滑膜肉瘤:单相纤维型滑膜肉瘤常可见血管外皮瘤样结构,免疫组化染色EMA和TLE1阳性,且可以行FISH检测到SS18融合基因。(4)间叶性软骨肉瘤:间叶性软骨肉瘤是一种由分化较成熟的透明软骨小岛和未分化原始间叶细胞组成的软骨肉瘤,当软骨小岛成分较少时,未分化间叶细胞又有血管外皮瘤样结构,易与SFT/HPC混淆,全面取材及镜下寻找软骨小岛可以与其鉴别,且间叶性软骨肉瘤细胞核缺失表达STAT6蛋白。(5)恶性外周神经鞘膜瘤:恶性外周神经鞘膜瘤很少发生于脑膜部位,可以有血管外皮瘤样结构,但是通常不表达CD34和STAT6,而表达S100和SOX10蛋白。
3.4治疗与预后中枢神经系统SFT/HPC的3级分类法对临床治疗和预后有指导意义。1级的中枢神经系统SFT/HPC属良性病变,治疗以单纯手术切除为主。但是局部有非典型性或有脑膜和颅骨侵犯的1级病变目前临床预后尚不清楚。2级和3级肿瘤病变,即使肿瘤手术切除后,仍然有高的复发率,手术切除后超过10年期间复发率高于75%,并且可以发生颅外转移,特别常见于骨、肺和肝脏组织[19],除单纯手术切除外,患者可以从放疗中受益[20]。
[1] Klemperer P, Rabin C B. Primary neoplasms of the pleura. A report of five cases[J]. Arch Pathol, 1931,11:385-412.
[2] Chan J K. Solitary fibrous tumour-everywhere, and a diagnosis invogue[J]. Histopathology, 1997,31(6):568-576.
[3] Stout A P, Murray M R, Hemangiopericytoma: a vascular tumor featuring Zimmermann, s pericytes[J]. Ann Surg, 1942,116(1):26-33.
[4] Bortolotti U, Calabrò F, Loy M,etal. Giant intrapericardial solitary fibrous tumor[J]. Ann Thorac Surg, 1992,54(6):1219-1220.
[5] Saint-Marc O, Pozzo A, Causse X,etal. Solitary fibrous liver tumor: clinical, radiological and pathological characteristics[J]. Gastroenterol Clin Biol, 2002,26(2):171-173.
[6] Carneiro S S, Scheithauer B W, Nascimento A G,etal. Solitary fibrous tumor of the menings: a lesion distinct from fibrous meningioma. A clinicopathologic and immunohisto-chemical study[J]. Am J Clin Pathol, 1996,106(2):217-224.
[7] Louis D N, Ohgaki H, Wiesler O D,etal. The 2007 WHO classification of tumous of the central nervous system[J]. Acta Neuropathol, 2007,114(2):97-109.
[8] Jeong A K, Lee H K, Kim S Y,etal. Solitary fibrous tumor of the parapharyngeal space[J]. Am J Neuroradiol, 2002,23:473.
[9] Sohda T, Yun K. Insulin-like growth factor II expression in primary meningeal hemangiopericytoma and its metastasis to the liver accompanied by hypoglycemia[J]. Hum Pathol, 1996,27(8):858-861.
[10] Wang X Q, Zhou Q, Li S T,etal. Solitary fibrous tumors of the central nervous system: clinical features and imaging findings in 22 patients[J]. J Comput Assist Tomogr, 2013,37(5):658-665.
[11] Martorell M, Pérez-Vallés A, Gozalbo F,etal. Solitary fibrous tumor of the thigh with epithelioid features: a case report[J]. Diag Pathol, 2007,18(2):19.
[12] Mena H, Ribas J L, Pezeshkpour G H,etal. Hemangiopericytoma of the central nervous system: a review of 94 cases[J]. Hum Pathol, 1991,22(1):84-91.
[13] Fletcher C D M, Bridge J A, Hogendoorn P C W,etal. World Health Organization classification of soft tissue and bone tumors[M]. Lyon: IARC Press, 2013:80-82.
[14] England D M, Hochholzer L, McCarthy M J. Localized benign and malignant fibrous tumors of the pleura: a clinicopathologic review of 223 cases[J]. Am J Surg Pathol, 1989,13(8):640-658.
[15] Bouvier C, Métellus P, de Paula A M,etal. Solitary fibrous tumors and hemangiopericytomas of the meninges: overlapping pathological features and common prognostic factors suggest the same spectrum of tumors[J]. Brain Pathol, 2012,22(4):511-521.
[16] Weiss S W, Goldblum J R. Soft tissue tumors[M]. St Louis: Mosby Elsevier Press, 2008:412, 949,1121,1129-1131.
[17] Mosquera J M, Fletcher C D. Expanding the spectrum of malignant progression in solitary fibrous tumors: a study of 8 cases with a discrete anaplastic component: is this dedifferentiated SFT[J]. Am J Surg Pathol, 2009,33(9):1314-1321.
[18] Schweizer L, Koelsche C, Sahm F,etal. Meningeal hemangiopericytoma and solitary fibrous tumors carry the NAB2-STAT6 fusion and can be diagnosed by nuclear expression of STAT6 protein[J]. Acta Neuropathol, 2013,125(5):651-658.
[19] Bisceglia M, Galliani C, Glannatempo G,etal. Solitary fibrous tumors of the central nervous system: a 15-year literature survey of 220 cases (August 1996-July 2011)[J]. Adv Anat Pathol, 2011,18(5):356-392.
[20] Ghia A J, Chang E L, Allen P K,etal. Intracranial hemangiopericytoma: patterns of failure and the role of radiation therapy [J]. Neuroeurgey, 2013,73(4):624-630.
R 739.41
A
1001-7399(2017)10-1156-04
时间:2017-10-23 13:30 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20171023.1330.025.html
10.13315/j.cnki.cjcep.2017.10.025
接受日期:2017-08-11
福建省自然科学基金(2015J01424)、福建省立医院院内优秀青年基金(2014074)
福建医科大学省立临床医学院、福建省立医院1病理科、2药剂科、3放射科,福州 350001
晋 龙,男,副主任医师。E-mail: jinlongdoctor@163.com
眭玉霞,女,博士,副主任药师,通讯作者。E-mail: suiyuxia0467@sina.com
