皱纹盘鲍排氨率变化特征及代谢产物对水质的影响研究
2017-11-21张延青李文亚高霄龙徐建平
张延青, 李文亚, 高霄龙, 徐建平, 李 贤, 刘 鹰, 3
皱纹盘鲍排氨率变化特征及代谢产物对水质的影响研究
张延青1, 李文亚1, 高霄龙2, 徐建平1, 李 贤2, 刘 鹰2, 3
(1. 青岛理工大学, 山东青岛 266033; 2. 中国科学院海洋研究所, 山东青岛 266071; 3. 大连海洋大学, 辽宁大连 116023)
为研究不同规格皱纹盘鲍(Ino)的排氨率变化特征和代谢产物对养殖水质的影响, 于鲍摄食后的3、6、9、12、18、24 h时取水样对主要水质因子的变化情况进行测定, 并根据总氨氮(TAN)浓度计算各规格组鲍的排氨率。实验结果表明, 随着鲍体质量的增加, TAN浓度也随之增加(<0.05), 大规格组和小规格组中TAN浓度均在9 h时出现第一个波峰。大、中、小规格组鲍的单位体质量排氨率最大值依次为16.79、29.96、48.56 μg/(g·h)。且小规格组鲍的排氨率显著高于大、中等规格组(<0.05), 各规格组中的NO2–-N和PO43–-P浓度均在24 h时达到最大值, 且除0 h外, 大规格组中的NO2–-N和PO43–-P浓度均显著高于中、小规格组(<0.05)。9 h时, 大规格组中的NO3–-N浓度达到最大值, 而中等规格组则在24 h时达到最大值。18 h时, 中等规格和小规格组COD均达到最大值, 而大规格组则是在24 h时浓度达到最大。因此, 基于皱纹盘鲍的排氨率变化特征和TAN等在水体中的累积情况, 可以预测水质变化规律并根据实际情况及时采取换水等相关操作, 对促进养殖生物健康生长、降低病害发生风险、提高养殖效益等均有借鉴意义。
皱纹盘鲍(Ino); 规格; 排氨率; 水质指标
皱纹盘鲍(Ino), 隶属于软体动物门、腹足纲, 是分布在中国黄、渤海的一种具有较高经济价值的海产贝类, 是中国北方的重要养殖品种[1-2]。随着中国鲍养殖产业的迅速发展, 特别是集约化、工厂化、规模化养鲍业的兴起, 高密度养殖条件下的水体环境越来越难以满足鲍正常生长、发育的需要。水质状况不佳导致的生长变缓、病害频发, 已成为制约皱纹盘鲍养殖产业健康、可持续发展的关键因素之一[3]。因此, 本实验拟通过研究不同规格皱纹盘鲍摄食后的排氨率变化特征和代谢产物对养殖水质指标(总氨氮TAN、亚硝酸盐氮NO2–-N、硝酸盐氮NO3–-N、活性磷酸盐PO43–-P和化学需氧量COD)的影响, 以期初步查明其基础代谢的日变化规律, 进而为工厂化养殖皱纹盘鲍的水环境调控和优化提供理论依据。
摄食是生物为满足生存、生长和繁殖等生理过程的物质和能量需求而进行的重要活动[4]。摄食后的残饵和自身代谢产生的粪便等是鲍养殖水体污染的主要来源之一。在14~20℃环境下, 对皱纹盘鲍()摄食新鲜海带()后个体能量收支的研究发现, 鲍摄入的能量中大约34.6%~ 48.6 %转化为粪能[5]。贝类的排泄产物中含有大量C、N、P等营养物质, 主要为氨、尿酸、尿素、蛋白质等, 其中氨占总排泄量的比例高达70 %[6], 而代谢产物的分解更会增加养殖水体中N、P和C含量。养殖水环境营养盐及有机污染指标主要包括TAN、NO2–-N、NO3–-N、PO43–-P、COD等,TAN、NO3–-N、NO2–-N等主要来源于水生动物的排泄产物和有机代谢产物在微生物作用下的分解[7], 其中总氨氮和亚硝酸盐氮对贝类均有较大的毒性[8-9]。目前, 国内对皱纹盘鲍()代谢方面的研究主要集中在环境因子和内源性因子对耗氧率和排氨率的影响上[5, 10-11], 对皱纹盘鲍摄食后的排氨率变化特征和代谢产物对养殖水体环境影响的研究报道却较少。
1 材料与方法
1.1 实验材料
实验于2016年6月在中国科学院海洋研究所内开展, 实验所用皱纹盘鲍()购自山东省威海市长青海洋科技股份有限公司, 均为贝壳完好无损、足部伸缩有力的健康个体, 带回实验室后洗刷去除表面附着物, 暂养于事先已充分曝气24 h的水族箱内(70 L, 54 cm×40 cm×32 cm)。
1.2 实验方法
实验所用皱纹盘鲍首先在自然光照下暂养15 d, 水族箱内置黑色波纹板作为附着基, 水温19℃, 盐度为29±1, pH为7.8。暂养期间每天上午10:00清除残饵、粪便并更换新鲜海水, 换水量为100%。18:00投喂新鲜裙带菜(Suringar), 投喂量以鲍湿体质量的4%计算。暂养结束后根据壳长将鲍分为大、中、小3个不同规格组, 其具体生物学数据见表1。

表1 不同规格皱纹盘鲍生物学数据
注: 数据为平均值±标准误,=6。不同字母表示不同处理组间差异显著(< 0.05)
每个规格组设置6个重复。实验开始后, 每组实验随机将同一规格的鲍依次放置于大小相同的水族箱内(10 L, 30 cm×21 cm×19 cm), 每一水族箱内放一只鲍。18:00在每一水族箱内分别投喂等量的新鲜裙带菜(), 投喂量以鲍湿体质量的4%计算。分别于投喂后3、6、9、12、18、24 h时取水样, 测定各时间点水体中的TAN、NO2–-N、NO3–-N、PO43–-P、COD等浓度的变化情况, 并根据总氨氮浓度计算排氨率。实验开始前, 鲍均需饥饿24 h。实验所用海水均经砂滤处理, 温度、盐度和pH值等与暂养期间一致。
1.3 指标和测定方法
总氨氮(TAN)采用纳氏试剂分光光度法[12], 亚硝酸盐氮(NO2–-N)采用萘乙二胺分光光度法[13], 硝酸盐氮(NO3–-N)采用紫外分光光度法[14], 活性磷酸盐(PO43–-P)采用磷钼蓝分光光度法[13], 化学需氧量(COD)采用烘箱加热高锰酸钾法[15]。
排氨率的计算公式为:
=[(–)×1000×(–)]/[16]
式中,代表排氨率,和分别代表实验结束和开始时水体中的总氨氮浓度,代表实验用水族箱体积,代表不同规格鲍的体积,为实验持续时间。
其中鲍的体积的计算公式为:
(m–m) /d
式中,m为鲍在空气中的质量,m为鲍在海水中的质量,d代表海水的密度(1.025 g/cm3)。
1.4 数据分析
实验数据用SPSS16.0 软件进行单因素(One- ANOVA)方差分析, 当显著性差异存在时使用Duncan进行多重比较分析。实验结果均表示为平均值±标准差(Mean ± SD), 显著性水平为<0.05。
2 结果
2.1 总氨氮(TAN)浓度变化
随着时间延长, 各规格组水体中的总氨氮浓度均呈上升趋势, 且随着皱纹盘鲍体质量的增加, 总氨氮浓度也随之增加(图1)。大规格组水体中的总氨氮浓度在9 h时出现波峰, 且此时间点总氨氮浓度显著高于中等规格和小规格组(<0.05)。中等规格组水体中的总氨氮浓度则在18 h时出现波峰, 且在18 h时显著高于小规格组(<0.05)。在小规格组中, 总氨氮浓度波峰也出现在9 h时, 最大值出现在24 h时, 达到0.072 mg/L。
2.2 排氨率变化
各规格组鲍的排氨率均有随时间延长而逐渐升高的趋势, 且实验后期发现随着鲍个体增大, 其单位体质量排氨率显著下降(图2)。各时间点, 小规格组鲍的排氨率均显著高于大规格和中等规格组(<0.05), 且在24 h时达到最大值, 为48.56 μg/(g·h)。在3、18、24 h时, 中等规格组鲍的排氨率均显著高于大规格组, 而在其他时间点二者间并没有显著性差异(>0.05), 最大值出现在18 h, 为29.96 μg/(g·h)。24 h时, 大规格组鲍的排氨率达到最大值, 为16.79 μg/(g·h), 但显著小于中等规格和小规格组(<0.05)。
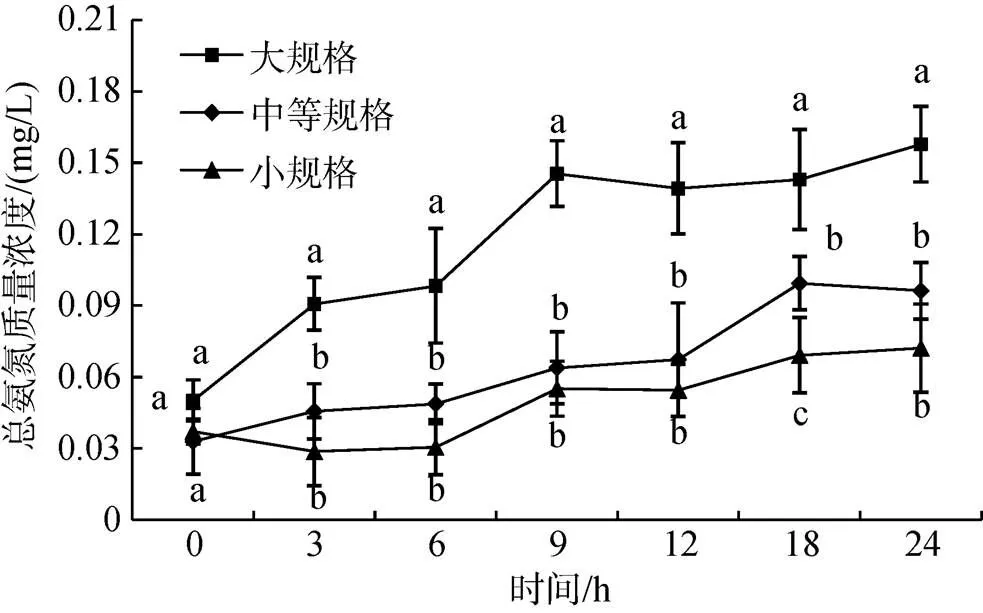
图1 不同规格组总氨氮(TAN)浓度变化情况
图中不同字母表示不同规格在同一时间点上差异显著(<0.05)。下同
Different letters on diagram mean significant difference in different size groups at the same time(<0.05). The same as below.
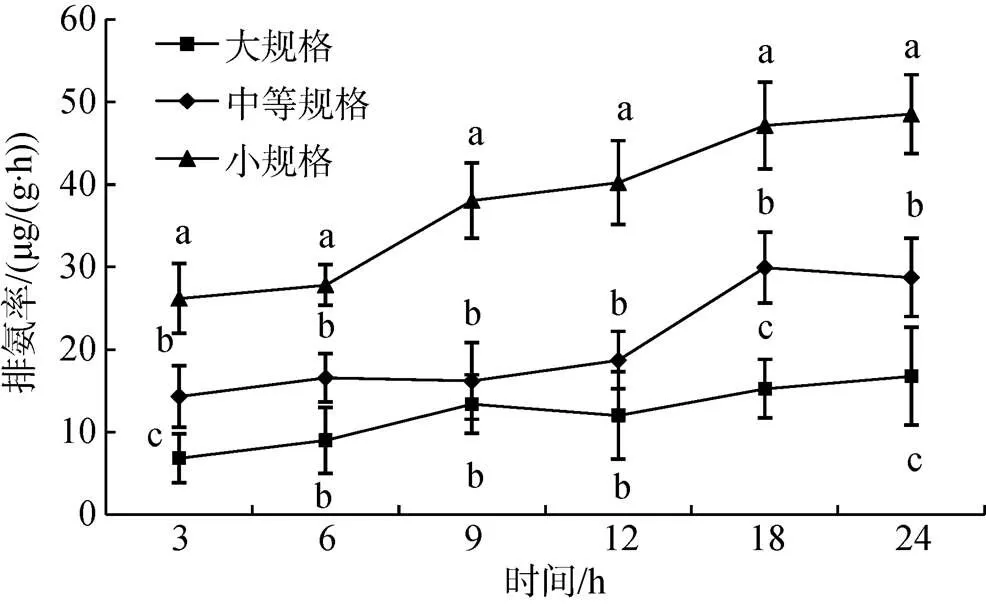
图2 不同规格组排氨率变化情况
2.3 亚硝酸盐氮浓度变化
随着时间延长, 各规格组水体中亚硝酸盐氮浓度也逐渐升高, 且除0 h外, 各时间点大规格组水体中的亚氮浓度均显著高于中等规格和小规格组(图3,<0.05)。中等规格和小规格组中, 亚氮浓度均在24 h时达到最大值, 分别为0.010 7 mg/L和0.005 8 mg/L。18 h和24 h时, 中等规格组亚氮浓度均显著高于小规格组(<0.05), 而在其他时间点两规格组间并没有显著性差异(>0.05)。
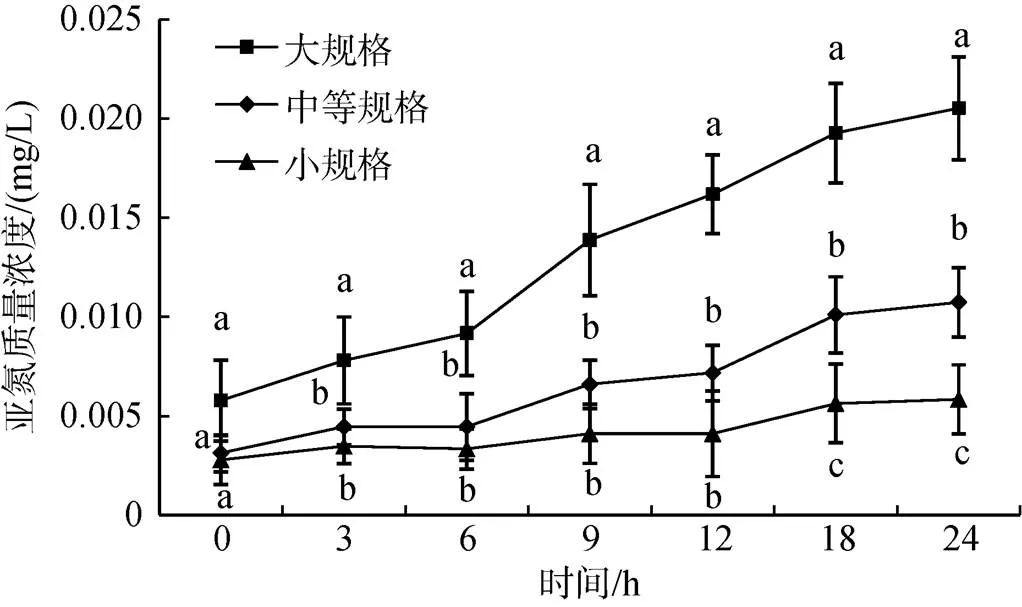
图3 不同规格组亚氮浓度变化情况
2.4 硝酸盐氮浓度变化
实验期间, 大、中、小规格组水体中硝酸盐氮浓度变化范围分别为0.542~0.679 mg/L, 0.443~0.660 mg/L, 0.498~0.571 mg/L(图 4)。9 h时, 大规格组中硝酸盐氮浓度达到最大值, 且显著高于中等规格和小规格组(<0.05)。12 h时, 中等规格组硝酸盐氮浓度显著升高, 达到0.618 mg/L, 且与小规格组相比差异显著(<0.05), 18 h后, 中等规格组均大于大规格组和小规格组, 但二者并没有显著性差异(>0.05)。3 h和6 h时, 小规格组亚硝酸盐氮浓度均显著高于中等规格组(<0.05), 且在6 h时达到最大值, 而后逐渐降低, 至24 h时与其他两个规格组相比并没有显著性差异(>0.05)。

图4 不同规格组硝酸盐氮浓度变化情况
2.5 磷酸盐浓度变化
各规格组磷酸盐浓度均随时间而逐渐升高, 且都在24 h时达到最大值, 分别为0.037 mg/L、0.02 mg/L、0.013 9 mg/L。各时间点, 中等规格和小规格组中的磷酸盐浓度均没有显著性差异(图 5,>0.05)。除0 h外, 各时间点大规格组磷酸盐浓度均显著高于中等规格和小规格组(<0.05)。
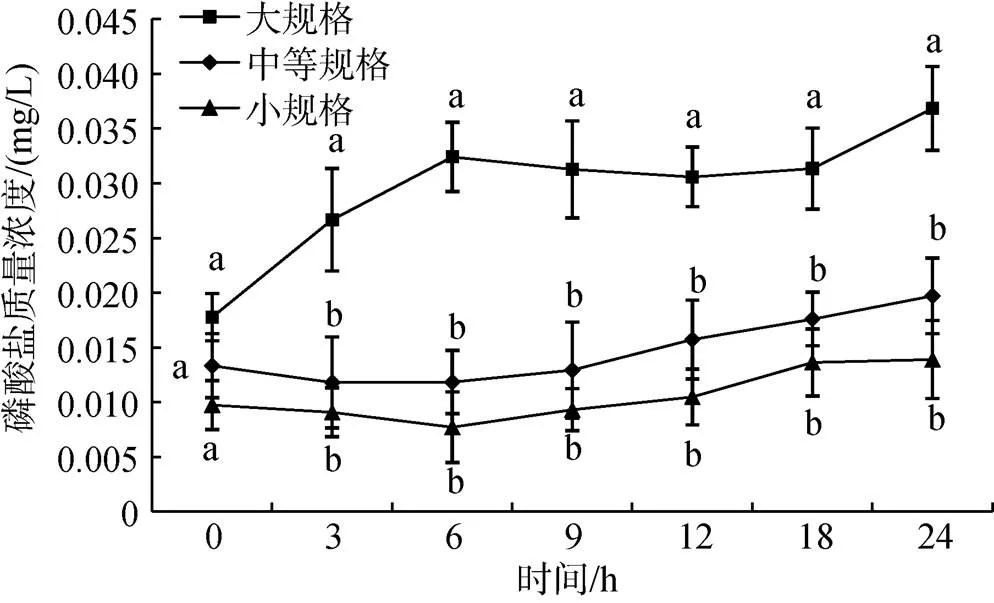
图5 不同规格组磷酸盐浓度变化情况
2.6 COD浓度变化
各规格组COD浓度具有相似的变化趋势, 随时间延长浓度不断升高(图 6)。12 h前, 各规格组间COD浓度值均没有显著性差异(>0.05)。18 h时, 中等规格和小规格组COD浓度均达到最大值, 6 h至24 h,小规格组大于中规格组, 但二者并没有显著性差异(>0.05)。24 h时, 大规格组COD浓度达到最大值, 为1.528 mg/L, 且显著高于中等规格和小规格组(<0.05)。中等规格和小规格组24 h时COD浓度均有下降的趋势, 但二者间并没有显著性的差异(>0.05)。

图6 不同规格组COD浓度变化情况
3 讨论
在贝类能量学研究中, 代谢一般分为标准代谢、活动代谢和特殊动力代谢。因为活动代谢和特殊动力代谢在测定时难以分开, 所以常将两者合并称为常规代谢[17]。摄食后引起的代谢属于常规代谢, 鲍在摄取食物后不断将代谢废物排放到水体中, 其排氨率会呈现出一定的变化趋势, 进而也对水体中的可溶性营养盐和COD等造成影响。
3.1 摄食后总氨氮浓度及排氨率变化情况
排泄是水生动物最基本的新陈代谢活动之一, 氨态氮是排泄的主要含氮化合物[4], 其浓度高低不仅是评价养殖生态环境优劣的重要指标之一, 而且还可能对水生生物的生长产生直接或间接的影响。实验过程中随着时间延长, 总氨氮浓度逐渐增加, 其中大规格组和小规格组均在9 h时出现第一个波峰, 说明此时消化、代谢活动较为活跃, 饵料等经消化分解后以总氨氮的形式排放到水体中。同时发现, 大规格组和小规格组总氨氮浓度多在夜间变化幅度较大, 这可能与鲍昼伏夜出的习性有关。各规格组中, 总氨氮平均浓度依次为: 大规格组0.118 mg/L, 中规格组0.065 mg/L, 小规格组0.050 mg/L, 即随着鲍体质量的增加, 水体中总氨氮浓度也随之升高。这可能是由于鲍壳长、体质量的增加, 其日摄食量逐渐增大, 进而导致代谢产物也随之增多[18]。
排氨率指生物在单位时间内的氨氮排泄量, 是反映代谢活动强弱的一个重要指标[19]。实验结果发现, 随着鲍个体增大其排氨率显著降低, 该现象与栉孔扇贝()[20]、彩虹明樱蛤()[21]、皱肋文蛤()[22]、马氏珠母贝() [23]等的排氨率变化规律类似, 也与毕远溥等[11]关于体质量对皱纹盘鲍()排氨率的影响研究结果相一致。究其原因可能是直接维持水生动物生命的肾脏、肝脏组织的代谢活力高于非直接维持生命的肌肉与脂肪等组织, 且随着鲍个体增大, 肌肉与脂肪等组织较肾脏、肝脏等脏器的积累更多, 从而使个体规格增大而其单位体质量的排氨率呈下降趋势[16, 24-25]。
通过排氨率和总氨氮浓度的对比发现二者的变化趋势基本一致。各规格组鲍的排氨率均在3、18、24 h时出现显著性差异, 大规格组的排氨率在9 h时出现第一个波峰, 与该时刻总氨氮浓度出现波峰相一致。但在此时刻, 中、小规格组均未出现该现象。而是分别在18 h时中等规格组排氨率和总氨氮浓度均达到最大值, 小规格组在24 h时二者达到最大值。中、小规格组个别时刻出现了排氨率下降的现象, 分析原因可能为外部水体中总氨氮的不断累积导致鲍相应的排氨受阻[26]。
3.2 摄食后亚硝酸盐氮、硝酸盐氮、磷酸盐、化学需氧量变化情况
氮循环在养殖水体的营养盐流动和平衡过程中起到非常重要的作用。目前对双壳贝类氮排泄产物的研究报道较多, 而单壳贝类排泄特征的研究相对较少。Cockcroft[27]在对浅海区两种双壳贝类和的氮排泄调查中发现, 20℃或25℃时, 其排泄产物总溶解氮中的NO3–-N 含量小于1%, 且未检测出亚硝酸盐氮。Nakamura等[28]报道, 在日本中等盐度的泻湖中, 27℃时双壳蛤()不排泄硝酸盐和亚硝酸盐。同时也有其他研究表明, 贝类排泄物中包含有NO3–-N、NO2–-N两类物质, 但比例都相对较小[29-30]。与双壳贝类的氮排泄物类似, 皱纹盘鲍排泄产物中硝酸盐氮和亚硝酸盐氮的浓度也较低。
亚硝酸盐被视为水生生物的致病根源, 是氨硝化作用的中间产物, 其在水中的不断累积会影响养殖生物的生理状况, 长期作用会抑制生长、破坏组织器官, 导致死亡率升高[31]。所以, 亚硝酸盐含量的监测是皱纹盘鲍养殖水体水质调控的一个关键因素。本实验过程中, 亚硝酸盐含量随时间延长不断增加, 其含量在实验后期表现出明显差异, 大、中、小规格组中的平均浓度分别为0.013 2、0.006 7、0.004 2 mg/L。各规格组中的亚硝酸盐氮浓度均在24 h时达到峰值, 说明在养殖生产过程中, 亚硝酸盐氮浓度是一个不断累积升高的过程, 对其浓度的适时监测和分析, 对保证养殖生物的健康, 降低养殖风险是十分重要的。硝酸盐的积累对贝类的影响相对较小, 但也有研究认为其逐渐富集会影响鱼类的渗透压和血细胞运输氧的能力[32]。本实验的大、中、小规格组中硝酸盐氮的平均浓度分别为0.616、0.536、0.543 mg/L, 硝酸盐浓度变化与鲍的规格大小无显著相关性。实验前期和后期各规格组中硝酸盐浓度变化均较平缓, 波动时间主要集中在摄食后的6~12 h。其中大规格组在9 h时出现第一个波峰; 而中规格组在12 h时显著增大, 在18 h后硝氮浓度均大于大规格组和小规格组; 小规格组则在12 h时显著下降, 24 h时又稍有上升。中、小规格组相较大规格组波动性大, 规律性不强, 这是由于一方面皱纹盘鲍新陈代谢活动加剧, 产生更多的粪便等有机代谢产物在硝化细菌分解作用下增加了硝酸盐的量, 而另一方面硝氮又可以在反硝化细菌脱氮作用下不断削减, 故硝酸盐在养殖水体内复杂的微生物环境下变化不稳定。
皱纹盘鲍与鱼类等其他水生动物类似, 磷主要从食物中获取, 而水体中的磷主要来自于饲料及粪便等的分解[33]。排泄在养殖水体中的磷主要以磷酸盐(PO43–-P)形式存在[34], 某些鱼类等水生生物排泄物中磷酸盐占总磷排泄量的 85%~95%[35], 故水体中的磷酸盐含量也可以在一定程度上表征磷的总排泄量。实验过程中磷酸盐总体浓度较低, 其含量也随时间和个体规格的增加而增加, 大、中、小规格组中的平均浓度分别为0.030、0.015、0.011 mg/L。在6 h时, 大规格组中的磷酸盐浓度出现第一个波峰, 9~18 h时其值随时间延长呈下降趋势。中、小规格组磷酸盐浓度整体变化趋势一致, 在6 h时达到最低而后逐渐升高。在6 h时, 大规格组和中、小规格组磷酸盐浓度呈现截然相反的变化趋势, 分析原因可能是磷酸盐在水-沉积物(沉降物)界面发生了活跃的吸附-解吸行为[36]。鲍排泄后水体中含有一定量的粪便、残饵等微粒和其他非液态(如黏液)物质, 溶解在水体中的磷极易被这些物质所吸附, 被吸附的磷在一定条件下又会重新溶解到水中, 然而该过程存在时滞性, 最终导致了不同规格组磷酸盐浓度在某些时刻呈现相反的波动特点[37]。
残饵和粪便中含有大量有机质颗粒等还原性物质, 其含量对表征水体有机物相对含量的COD产生影响。水体中COD浓度过高会增加水生动物病害发生的机率, 因此COD可作为养殖过程中的一个重要水质监测指标。随着时间延长, 各规格组水体中COD浓度具有相似的变化趋势, 即随着养殖时间和皱纹盘鲍个体规格的增加, 残饵和粪便等代谢产物逐渐累积并形成颗粒有机碳, 使得水体中的COD浓度升高。这与马建新等[38]在中国明对虾()养殖池塘水体中COD的研究结果类似。实验发现在6 h后, 小规格组COD浓度大于中规格组, 二者差异不显著, 这是由于相较于大规格组, 中、小规格组体质量差异较小, 小规格鲍新陈代谢速率大于中规格组, 6 h后, 单位时间内小规格鲍粪便等有机物积累总量可能大于中规格组, 随即对COD浓度造成影响。
综上所述, 根据皱纹盘鲍摄食后水体中营养盐、有机污染指标COD和其排氨率等的变化规律可知, 随着时间延长TAN、NO2–-N、PO43–-P等均在水体中逐步累积, 且TAN、NO2–-N、PO43–-P的浓度变化与鲍的规格大小成正相关。因此, 在实际生产过程中基于不同规格皱纹盘鲍摄食后的排氨率变化特征和代谢产物对养殖水体的污染程度, 可根据鲍的实际放养情况预估各水质指标在水体中的变化趋势, 对皱纹盘鲍工厂化养殖的水质调控和疾病预防具有良好的指导意义。
[1] 王进可, 严正凛. 鲍养殖现状及发展趋势[J]. 水产科学, 2012, 31(12): 749-753. Wang Jingke, Yanzhenglin. Current status and development trend of abalone culture[J]. Fisheries Science, 2012, 31(12): 749-753.
[2] 唐保军, 王慧. 我国鲍养殖研究现状及展望[J]. 渔业现代化, 2009, 36(1): 30-34. Tang Baojun, Wang hui. Current research situation and prospect on abalone culture in China-a review[J]. Fishery Modernization, 2009, 36(1): 30-34.
[3] 李世英, 张明, 高绪生. 我国北方养鲍业持续发展的思考[J]. 水产科学, 1999, 18(2): 47-48. Li Shiying, Zhang Ming, Gao Xusheng. Consideration of northern abalone industry in sustainable development[J]. Fisheries Science, 1999, 18(2): 47-48.
[4] 李治, 谢小军, 曹振东. 摄食对南方鲇耗氧和氨氮排泄的影响[J]. 水生生物学报, 2005, 29(3): 247-252. Li Zhi, Xie Xiaojun, Cao Zhendong. Effects of feeding on oxygen consumption and ammonia excretion in. Acta Hydrobiologica Sinica, 2005, 29(3): 247-252.
[5] 常亚青, 王子臣. 皱纹盘鲍的个体能量收支[J]. 应用生态学报, 1998, 9(5): 64-69. Chang Yaqing, Wang Zicheng. An energy budget for individual pacific abalone (Ino)[J]. Chinese Journal of Applied Ecology, 1998, 9(5): 64-69.
[6] Bayne B L, Newell R C. Physiological energeties of marine mollusks[M]. New York: Academic Press. 1983: 407-515.
[7] Hall P O J, Holby O, Kollberg S, et al. Chemical fluxes and mass balance in a marine fish cage farm: IV. Nitrogen[J]. Marine Ecology Progress Series, 1992, 89: 81-91.
[8] 蔡继晗, 沈奇宇, 郑向勇, 等. 氨氮污染对水产养殖的危害及处理技术研究进展[J]. 浙江海洋学院学报(自然科学版), 2010, 29(2): 167-172, 195. Cai Jihan, Shen Qiyu, Zheng Xiangyong, et al. Advancement in researches of ammonia pollution hazards on aquaculture and its treatment technology[J]. Journal of Zhejiang Ocean University (Natural Science), 2010, 29(2): 167-172, 195.
[9] 董玉波, 戴媛媛. 亚硝酸盐氮对水产经济动物毒性影响的研究概况[J]. 水产养殖, 2011, 32(4): 28-32. Dong Yubo, Dai Yuanyuan. Research survey of toxic effects of nitrite to aquatic animals.[J]. Journal of Aquaculture, 2011, 32(4): 28-32.
[10] 任黎华, 张继红, 王文琪, 等. 饵料对不同规格皱纹盘鲍能量收支的影响[J]. 渔业科学进展, 2011, 32(5): 51-57. Ren Lihua, Zhang Jihong, Wang Wenqi, et al. Effects of three dietary treatments on the energy budget of different sizedIno[J]. Progress in Fishery Sciences, 2011, 32(5): 51-57.
[11] 毕远溥, 蒋双, 刘海映, 等. 温度、体重对皱纹盘鲍耗氧量和排氨量的影响[J]. 应用与环境生物学报, 2000, 6(5): 444-446. Bi Yuanpu, Jiang Shuang, Liu Haiying, et al. Effects of temperature and weight on oxygen consumption rate and ammonia excretion rate of[J]. Chinese Journal of Applied and Environmental Biology, 2000, 6(5): 444-446.
[12] 闫修花, 王桂珍, 陈迪军, 等. 纳氏试剂比色法直接测定海水中的氨氮[J]. 中国环境监测, 2003, 19(6): 8-10. Yan Xiuhua, Wang Guizhen, Chen Dijun, et al. To determine NH4+-N directly in sea-water using nessler’s reagent-colorimetry[J]. Environmental Monitoring in China, 2003, 19(6): 8-10.
[13] GB17378.4-2007. 海洋监测规范第4部分: 海水分析[S]. 北京: 中国标准出版社, 2008. GB17378.4-2007. The specification for marine monitoring Part 4: Sea water analysis[S]. Beijing: Standards Press of China, 2008.
[14] 杨素霞, 黄琼军. 紫外分光光度法测定海水中硝酸盐氮[J]. 黑龙江环境通报, 2006, 30(4): 35-36. Yang Suxia, Huang Xiongjun. Determining nitrate nitrogen in seawater with ultraviolet spectrophotometric method[J]. Heilongjiang Environment Journal, 2006, 30(4): 35-36.
[15] 沈加正, 侯沙沙, 刘鹰, 等. 海水化学需氧量烘箱加热测定方法的研究[J]. 海洋科学, 2011, 35(8): 1-4. Shen Jiazheng, Hou Shasha, Liu Ying, et al. Determination of seawater chemical oxygen demand by oven heating[J]. Marine Sciences, 2011, 35(8): 1-4.
[16] Ahmed F, Segawa S, Yokota M, et al. Effect of light on oxygen consumption and ammonia excretion in,,and their hybrids[J]. Aquaculture, 2008, 279: 160-165.
[17] 王玲, 陈爱华, 杨大佐, 等. 双齿围沙蚕昼夜代谢规律的初步研究[J]. 水产学报, 2005, 29(1): 48-54. Wang Ling, Chen Aihua, Yang Dazuo, et al. Preliminary studies on the diurnal variation of metabolism of[J]. Journal of Fisheries of China, 2005, 29(1): 48-54.
[18] Barkai R, Griffiths C L. An energy budget for the south African abaloneLinnaeus. Journal of Molluscan Studies. 1988, 54(1): 43-51.
[19] 刘建业, 喻达辉, 李金碧. 盐度和pH对合浦珠母贝 () 耗氧率和排氨率的影响[J]. 海洋与湖沼, 2011, 42(4): 603-607. Liu Jianye, Yu Dahui, Li Jinbi. Effects of salinity and pH on oxygen consumption and ammonia excretion rates in[J]. Oceanologia et Limnologia Sinica, 2011, 42(4): 603-607.
[20] 王俊, 姜祖辉, 唐启升. 栉孔扇贝耗氧率和排氨率的研究[J]. 应用生态学报, 2002, 13(9): 1157-1160. Wang Jun, Jiang Zuhui, Tang Qisheng. Oxygen consumption and ammonia-N excretion rates of[J]. Chinese Journal of Applied Ecology, 2002, 13(9): 1157-1160.
[21] 董志国, 李晓英, 孟学平, 等. 彩虹明樱蛤的耗氧率与排氨率研究[J]. 台湾海峡, 2006, 25(4): 503-508. Dong Zhiguo, Ji Xiaoying, Meng Xueping, et al. Studies on oxygen consumption rate and ammonia-N excretion rate of[J]. Journal of Oceanography In Taiwan Strait, 2006, 25(4): 503-508.
[22] 栗志民, 刘志刚, 徐法军, 等. 体重、温度和盐度对皱肋文蛤耗氧率和排氨率的影响[J]. 海洋科学进展, 2011, 29(4): 512-520. Li Zhimin, Liu Zhigang, Xu Fajun, et al.Effects of body weight, temperature and salinity on oxygen consumption and ammonia excretion rates of[J]. Advances in Marine Science, 2011, 29(4): 512-520.
[23] 栗志民, 刘志刚, 谢丽, 等. 体重和温度对马氏珠母贝耗氧率和排氨率的影响[J]. 广东海洋大学学报, 2009, 29(6): 23-27. Li Zhimin, Liu Zhigang, Xie Li, et al. Effects of body weight and temperature on oxygen consumption rate andammonia excretion rate of(Dunker)[J]. Journal of Guangdong Ocean University, 2009, 29(6): 23-27.
[24] 姜祖辉, 王俊, 唐启升. 菲律宾蛤仔生理生态学研究Ⅰ. 温度、体重及摄食状态对耗氧率及排氨率的影响[J]. 海洋水产研究, 1999, 20(1): 40-44. Jiang Zuhui, Wang Jun, Tang Qisheng. Studies on physiological ecology of short-necked clam (). I. Effects of Temperature, body weight and feeding state on oxygen consumption rate and ammonia excretion rate[J]. Marine Fisheries Research, 1999, 20(1): 40-44.
[25] Gao X L, Zhang M, Tian H Q, et al. Effect of LED light quality on respiratory metabolism and activities of related enzymes of[J]. Aquaculture, 2016, 452: 52-61.
[26] Colt J E, Armstrong D A. Nitrogen toxicity to crustaceans, fish and molluscs [C] // Allen J L, Kinney E C. Proceedings of the Bio-Engineering Symposium for Fish Culture. Bethesda, Maryland: Fish Culture Section, American Fisheries Society, Northeast Society of Conservation Engineers: 34-47.
[27] Cockcroft A C. Nitrogen excretion by the surf zone bivalvesand[J]. Marine Ecology Progress Series, 1990, 60: 57-65.
[28] Nakamura M, Yamamuro M, Ishikawa M, et al. Role of the bivalvein the nitrogen cycle in a mesohaline lagoon[J]. Marine Biology, 1988, 99(3): 369-374.
[29] 蒋红, 崔毅, 陈碧鹃, 等. 乳山湾菲律宾蛤仔可溶性氮、磷排泄及其与温度的关系[J]. 中国水产科学, 2006, 13(2): 237-242. Jiang Hong, Cui Yi, Chen Bijuan, et al. Excretions of dissolved nitrogen and phosphorus in Ruditapes philippinarum at different water temperatures in the Rushan Bay[J]. Journal of Fishery Sciences of China, 2006, 13(2): 237-242.
[30] 周毅, 杨红生, 何义朝, 等. 四十里湾几种双壳贝类及污损动物的氮、磷排泄及其生态效应[J]. 海洋与湖沼, 2002, 33 (4): 424-431. Zhou Yi, Yang Hongsheng, He Yichao, et al. Nitrogen and phosphorus excretion and its ecological effect by several bivalves and fouling animals [J]. Oceanologia et Limnologia Sinica, 2002, 33 (4): 424-431.
[31] 余瑞兰, 聂湘平, 魏泰莉, 等. 分子氨和亚硝酸盐对鱼类的危害及其对策[J]. 中国水产科学, 1999, 6(3): 73-77. Yu Ruilan, Nie Xiangping, Wei Taili, et al. Toxicity of molecular ammonia &nitrite to fishes and the control measures[J]. Journal of Fishery Sciences of China, 1999, 6(3): 73-77.
[32] 卜雪峰. 贝藻处理海水养殖废水的应用研究[D]. 青岛: 中国海洋大学, 2004, 1-70. Bu Xuefeng. The applied study of wastewater treatment in marine culture by filter-feeding bivalves and algae[D]. Qingdao: Ocean University of China, 2004, 1-70.
[33] 贾后磊, 舒廷飞, 温琰茂. 养殖水环境中磷的循环与平衡[J]. 水利渔业, 2002, 22(1): 37-39.Jia Houlei, Shu Tingfei, Wen Yanmao. Cycle and budget balance of phosphorus in the cultivated water[J]. Reservoir Fisheries, 2002, 22(1): 37-39.
[34] Thomas S L, Piedrahita R H. Apparent ammonia-ni- trogen production rates of white sturgeon () in commercial aquaculture systems[J]. Aquacultural Engineering. 1998, 17(1): 45-55.
[35] 阮景荣. 三种鱼的磷排泄及其在微型生态系统磷再循环中的作用[J]. 水生生物学报, 2005, 29(1): 55-60. Ruan Jingrong. Phosphorus excretion of three species of fish and its role in the recycling of phosphorus in freshwater microcosms[J]. Acta Hydrobiologica Sinica, 2005, 29(1): 55-60.
[36] 宋金明. 中国近海沉积物-海水界面化学[M]. 北京: 海洋出版社, 1997. Song Jinming. Chemistry of sediment- seawater interface of the China seas[M]. Beijing: China Ocean Press, 1997.
[37] 葛长字. 鱼类养殖对水体磷酸盐的影响: 源、汇的半现场实验例证[J]. 环境科学与管理, 2010, 35(7): 29-32, 45. Ge Changzi. Effects of pisciculture on phosphate concentration of water body: one source or one sink, a semi-field experiment example[J]. Environmental Science and Management, 2010, 35(7): 29-32, 45.
[38] 马建新, 刘爱英, 宋爱芹. 对虾病毒病与化学耗氧量相关关系研究[J]. 海洋科学, 2002, 26 (3): 68-71. Ma Jianxin, Liu Aiying, Song Aiqin. A study on the relationship between COD and shrimp viral disease[J]. Marine Sciences, 2002, 26 (3): 68-71.
Ammonia excretion rate ofand effects of metabolite on water quality
ZHANG Yan-qing1, LI Wen-ya1, GAO Xiao-long2, XU Jian-ping1, LI Xian2, LIU Ying2, 3
(1. Qingdao Technological University, Qingdao 266033, China; 2. Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 3. Dalian Ocean University, Dalian 116023, China)
Ammonia excretion rates ofof different sizes and the effect of its metabolites on water quality were investigated by collecting water samples at 3, 6, 9, 12, 18, and 24 h after food intake to determine the changes in important water quality factors and calculate the ammonia excretion rate of each group based on TAN concentration. Experimental results showed that TAN concentration of large- and small-sized abalone groups reached the first peak at 9 h and increased with the body mass of abalone. The maximum ammonia excretion rates per unit weight of the large, medium, and small size groups were 16.79, 29.96, and 48.56 μg/(g·h), respectively. The ammonia excretion rate of the small-sized group was significantly higher than that of the medium- and large-sized groups. PO43–-P and NO2–-N concentrations of the small-, medium-, and large-sized groups reached the maximum value at 24 h, and the PO43–-P and NO2–-N concentrations of the large-sized group were significantly higher than those of the small- and medium-sized groups. NO3–-N concentration of the large-sized group reached the maximum value at 9 h, whereas NO3–-N concentration of the medium-sized group reached the maximum value at 24 h. COD concentration of the small- and medium-sized groups reached the maximum value at 18 h, whereas COD concentration of the large-sized group reached the maximum value at 24 h. Therefore, water exchange and other related processes after the food intake by the abalonebased on its ammonia excretion rate and water quality index accumulation in the water body will be somewhat referential to the promotion of the healthy growth of aquaculture organisms, reduction of disease incidence risk, and improvement of aquaculture efficiency.
Abalone; Size; Ammonia excretion rate; Water quality indexes
(本文编辑: 梁德海)
S917.4
A
1000-3096(2017)07-0023-08
10.11759/hykx20160811003
2016-11-20;
2017-02-21
国家自然科学基金(No. 41306152, 31472312, 31402283); 国家贝类产业技术体系项目(CARS-48); 农业部海洋渔业可持续发展重点实验室开放课题(2013-SDMFMA-KF-1); 江苏省重点研发计划项目(BE2015325)
[Natural Science Fundation, No. 41306152, No. 31472312, No. 31402283; National Shellfish Industry Technology System Project, No. CARS-48; The Key Laboratory of Sustainable Development of Marine Fisheries, No. 2013-SDMFMA-KF-1; Key Research and Development Program of Jiangsu Province, No. BE2015325]
张延青(1963-), 女, 山东青岛人, 博士, 教授, 主要从事水处理技术研究与教学, 电话: 0532-84962166, E-mail: zyq_luck@163.com;刘鹰(1969-), 通信作者, 男, 教授, 主要从事水产工程及生态学研究, E-mail: yingliu@dlouedu.cn
Nov. 20, 2017
