丁酸梭菌的分离、鉴定与基本特性研究
2017-11-21樊晓璐张苇莉吴幼茹
樊晓璐,张苇莉,吴幼茹,邹 毅,李 楠
(1.广西大学生命科学与技术学院,广西南宁530004; 2.广西大学糖业工程研究中心,广西南宁530004)
丁酸梭菌的分离、鉴定与基本特性研究
樊晓璐1,张苇莉1,吴幼茹1,邹 毅2,李 楠1
(1.广西大学生命科学与技术学院,广西南宁530004; 2.广西大学糖业工程研究中心,广西南宁530004)
通过厌氧培养法从朗姆酒发酵过程添加的丹多液中分离得到9株纯菌株,经过生理生化实验和16S rDNA序列分析鉴定出1株丁酸梭菌Y-1。研究了Y-1的基本生长特性和安全性,结果表明,其具有较强的耐酸和耐酒精以及产酸能力,发现菌株在梭菌增殖培养液中最适生长温度为37℃,最适生长pH值为7.0,菌株对于酒精的最高耐受能力为9%vol,耐酸能力最低pH值为4.0。丁酸梭菌作为功能微生物在朗姆酒发酵过程中对香气及风味物质的形成具有重要作用。
朗姆酒; 丹多液; 丁酸梭菌; 分离; 鉴定
丁酸梭菌(Clostridium butyricum),属于芽孢杆菌科(Bacillaceae),梭菌属(Clostridium)[1],有芽孢,革兰氏阳性菌,在老培养物中或可变为革兰氏阴性菌,是一种严格厌氧菌[2-3]。丁酸梭菌属于肠道益生菌,对于体内的致病菌有一定的抑制作用,同时可以促进益生菌的增殖[4]。丁酸梭菌可以产生淀粉酶、蛋白酶、酯酶、纤维素酶、半纤维素酶等多种胞外酶,并且能够合成叶酸、烟酸、泛酸、维生素B1、毗哆醇、核黄素等维生素类化合物,主要代谢产物为丁酸、乙酸[5]。该菌主要从奶酪、酸奶、动物和人的肠道以及土壤树叶等自然环境中分离提取[6]。
朗姆酒是以甘蔗汁或甘蔗糖蜜为原料进行发酵生产的蒸馏酒,主要采用甘蔗汁与酵母菌发酵后加入产短链脂肪酸菌的丹多液(Dunder)共发酵[7],丹多液(Dunder)其实是一类耐高酒精度和能利用甘蔗糖的多种微生物菌种构成,通过共发酵生产得到朗姆酒中香味浓郁的风味物质[8]。丹多液内含有众多对朗姆酒发酵有益的微生物,尤其是丁酸梭菌对朗姆酒风味的形成具有重要作用[9]。在朗姆酒香气形成方面,丁酸梭菌的代谢产物丁酸和乙酸可以与乙醇反应生成丁酸乙酯和乙酸乙酯,对于朗姆酒特殊香气的形成具有重要作用[10]。然而从自然环境中得到的发酵底液的丁酸梭菌含量微乎其微,因此从丹多液中筛选出1株丁酸梭菌,并将其增殖培养,后再以一定比例添加到发酵底液中进行研究[11]。本研究以广西海酩威酿酒股份有限公司生产朗姆酒所用的丹多液为筛选材料,从中筛选出对朗姆酒香气形成有利的丁酸梭菌纯菌株,为朗姆酒的香气研究提供重要的菌种资源,也为朗姆酒风味物质研究提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
丹多液,广西海酩威酿酒股份有限公司;PL303电子天平,梅特勒-托利多仪器(上海)有限公司;Julabo TW12恒温水浴锅,优莱博技术有限公司;07HWS-2数显恒温磁力搅拌器,杭州仪表电机有限公司;UV min-1240岛津紫外分光光度计,岛津仪器(苏州)有限公司;c-11厌氧产气袋,日本三菱瓦斯化学株式会社;c-22氧气指示剂,日本三菱瓦斯化学株式会社;c-43圆底立式培养袋,日本三菱瓦斯化学株式会社。
1.1.2 培养基
厌氧完全培养基:大豆胨3 g、蛋白胨10 g、消化血清粉13.5 g、酵母浸膏5 g、牛肉膏2.2 g、牛肝膏(粉)1.2 g、葡萄糖3 g、KH2PO42.5 g、可溶性淀粉5 g、L-半胱氨酸盐0.3 g、硫乙醇酸钠0.3 g、肉汤(牛心汤)1000 mL,调pH7.2~7.4,115 ℃灭菌15 min。
梭菌增殖培养基:酵母浸膏3 g、牛肉浸膏10 g、胰蛋白胨l0 g、葡萄糖5 g、可溶性淀粉1 g、氯化钠5 g、三水合乙酸钠3 g、半胱氨酸盐酸盐0.6 g、0.5%美蓝0.2 mL、琼脂1.5 g(固体培养基时用)、蒸馏水1000 mL;调节pH7.0~7.4,121 ℃灭菌20 min。
产酸指示培养基、明胶液化试验、麦芽糖分解、淀粉水解试验和牛乳试验培养基参照《伯杰细菌鉴定手册》[12]和《常见细菌系统鉴定手册》[13]配制。
1.2 实验方法
1.2.1 富集培养[14]
取丹多液1 mL加入至含20 mL已灭菌的厌氧完全培养液的试管中,80℃水浴处理10 min后,置于37℃恒温培养箱中培养3 d。后再将培养液于80℃中水浴处理10 min,然后以10%(v/v)的添加量将培养液接入到新的已灭菌的含厌氧完全培养液的试管中进行富集培养,37℃恒温箱中培养3 d,如此反复热处理和富集培养3次,选取产气旺盛的试管进行稀释分离。
1.2.2 稀释分离
取富集培养后的样品10 mL加入到90 mL的无菌水中,80℃水浴10 min,杀死非芽孢菌,得到10-1稀释度的样品溶液,后再将样品稀释到10-2、10-3、10-4、10-5、10-6稀释度,取各稀释度的样品0.2 mL涂布于厌氧完全培养基平板上,设置3个平行实验,将平板置于含厌氧产气袋的厌氧培养袋中,37℃培养3 d。
将分离得到的菌种在厌氧完全培养基平板上连续划线培养3~5次,得到菌种纯菌落,用于菌种鉴定。
1.2.3 菌种鉴定[15]
初步鉴定:将菌种进行影印好氧和厌氧培养,去除好氧菌和兼性厌氧菌,得到厌氧菌。选取培养特征、菌落形态、显微形态和丁酸梭菌相似的细菌进行明胶液化、牛乳、糖发酵等生理生化鉴定。
对疑似菌种进行产酸和最大活菌量试验:在接种量5%(v/v),装液量80%(v/v)的条件下,将菌种接入到含有梭菌增殖培养基的培养管中,深层厌氧培养不同时间,培养时记录指示剂变化时间,并在培养结束后计算产酸量和OD600值。
对筛选得到的细菌进行16S rDNA序列分析鉴定:首先参照上海捷瑞生物工程有限公司生产的离心柱型细菌基因组DNA快速提取试剂盒说明书提取目标菌株的DNA;后对菌株进行16S rDNA PCR扩增,采用通用引物(27F:5'-AGTTTGATCCTGGCTCAG-3';1492R:5´-GGTTACCTTGTTACGACTT-3)进行PCR扩增;PCR的反应体系为:基因组DNA 0.5 μL,10XEasy TagBuffer 2.5 μL,dNTP 1 μL,DNA Ploymerase 0.2 μL,上下游引物各0.5 μL,双蒸水19.8 μL;反应程序为:94 ℃ 4 min;94 ℃ 45 s,55℃ 45 s,72℃ 1 min,30个循环;72 ℃ 10 min;4℃保存。PCR反应结束后,取扩增产物进行1%琼脂糖凝胶电泳(150 V,20 min),进行PCR产物回收纯化;测序比对及系统发育分析即将回收的PCR产物送至上海生工测序,后登录NCBI(http//www.ncbi.nlm.nih.gov/),利用BLAST将16S rDNA测序结果与Genbank中的已知序列进行比对,查找相似度最高的菌株,确定菌株所在属,为了进一步确定菌株的进化地位,选取同属亲缘关系较近的模式菌株,用MEGA5.1软件构建系统发育树。
1.3 丁酸梭菌的生长特性测定
1.3.1 丁酸梭菌最适生长温度的测定
取15支含有梭菌增殖培养基的试管,以5%(v/v)的接种量、80%(v/v)的装液量将种子液接种到培养管中,调节温度至27℃、32℃、37℃、42℃、47℃,于恒温培养箱中静置培养16 h,并保持pH7.0,测定菌液的OD600值,每组3个平行。
1.3.2 丁酸梭菌最适生长pH值的测定
取15支含有梭菌增殖培养基的试管,以5%(v/v)的接种量、80%(v/v)的装液量将种子液接种到培养管中,用0.1 mol/L的HCl和NaOH调节培养液pH值至5.0、6.0、7.0、8.0、9.0,于37 ℃恒温培养箱中静置培养,16 h后测定菌液的OD600值,每组3个平行。
1.3.3 丁酸梭菌生长曲线的测定
在最适培养条件下,以5%(v/v)的接种量、80%(v/v)的装液量,将丁酸梭菌种子液接种到含有梭菌增殖培养基的试管中,每隔2 h取出1组,测定其OD600值,得到菌种的生长曲线,试验中每组为3个平行实验[16]。
1.3.4 丁酸梭菌培养过程中产酸量的测定
在最适培养条件下,即培养温度为37℃,初始pH7的培养条件下,以5%的接种量、80%的装液量,将丁酸梭菌种子培养液接种到含有梭菌增殖培养基的试管中,每隔2 h取出1组,测定菌液中总酸含量,每组做3个平行实验,完成菌种培养过程中产酸量的测定[17]。
1.3.5 丁酸梭菌的耐性实验测试
丁酸梭菌的耐酒精性能试验:取梭菌增殖培养基,按表1用95%vol的食用酒精调节培养液中乙醇浓度分别为3%vol、5%vol、7%vol、9%vol、11%vol、13%vol、15%vol,以10%(v/v)的接种量、80%(v/v)的装液量将种子液接入含不同酒精含量的培养液中,调节pH7.0,于37℃恒温培养箱中培养20 h,测定菌液的OD600值[18]。通过计算最终以丁酸细胞浓度确定丁酸菌的耐酒精性能。
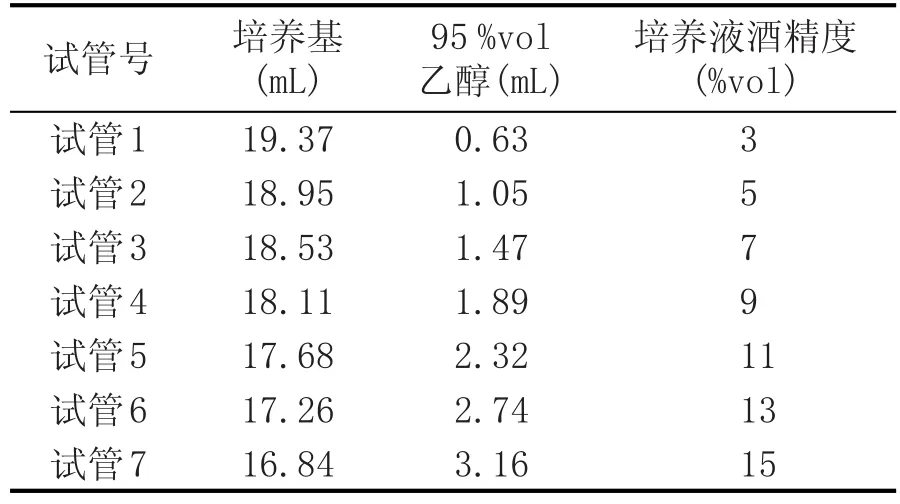
表1 耐酒精度实验培养液配比
丁酸梭菌的耐酸性能试验:取丁酸菌种子培养基,用食用级丁酸调节pH值分别为1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5,以 80%(v/v)的装液量装入培养管中,按体积分数10%(v/v)的菌种量接入不同pH值的培养液中,在37℃恒温培养箱中培养20 h,测定其OD600值。通过最终的丁酸细胞浓度确定丁酸梭菌的耐酸性能[19]。
2 结果与分析
2.1 菌种的分离与鉴定
2.1.1 菌体个体和菌落特征鉴定
实验先将丹多液进行富集培养,后通过稀释涂布平板法在含有厌氧产气袋的厌氧培养袋中分离培养,菌种经过纯化后,共得到9种菌株的单菌落。根据《伯杰细菌鉴定手册》,丁酸梭状芽孢杆菌为严格厌氧菌,菌株在培养过程中可产酸产气,内生孢子为卵圆形到球形,偏心或次端生。9种菌株经过影印平板进行好氧和厌氧培养,后通过显微镜观察细菌形态并结合丁酸梭菌的特征进行比对,可以发现有5株菌株符合条件,后对这5株符合群特征的菌株进行群内的生化鉴定(菌种的个体特征见表2,菌落形态见表3)。
2.1.2 分离菌株的生理生化鉴定
对符合群特征的Y-1、S-2、Z-1、Y-2、Y-3 共5株菌株进行进一步的生理生化鉴定,鉴定结果见表4。发现菌株Y-1和Z-1为丁酸梭状芽孢杆菌。

表2 菌种个体特征

表3 菌株菌落形态

表4 菌株生理生化特征
2.1.3 菌种的产酸及最大活菌量实验
将得到的2株丁酸梭菌进行产酸和最大活菌量实验,以菌株的最大产酸量和最大细胞浓度值OD600为结果[20],筛选得到1株优选菌株。实验结果见表5。从表5可以看出,Y-1菌株有着较好的产酸能力和较高的细胞浓度,因此,选择Y-1(图1)菌株为优选菌株,进行后续实验。

表5 菌株最大产酸实验
图1 Y-1菌落形态
2.1.4 丁酸梭菌Y-1菌种的16S rDNA序列分析鉴定
16S rDNA PCR产物经1%琼脂糖电泳检验合格后,送至上海生工测序,获得了测序结果。结果表明,Y-1菌株的16S rDNA的序列为1307 bp。利用BLAST对获得的测序结果与Genbank中已有序列进行比对,查找相似度最高的序列,是一株序列号为CP016332.1的梭菌属菌株,相似性为100%;为进一步确定菌株的遗传关系和进化方向,利用MEGA 5.1软件对菌种构建系统发育树(图2),由图2可知,Y-1与菌种号为ATCC19398的Clostridium butyricum标准菌株亲缘关系最近,与其在同一个分支,结合细菌的形态和生理生化关系可以确定Y-1菌株为丁酸梭状芽孢杆菌。

图2 菌株Y-1的系统发育树
2.2 丁酸梭菌的生长特性测定
2.2.1 丁酸梭菌最适生长温度的测定(图3)
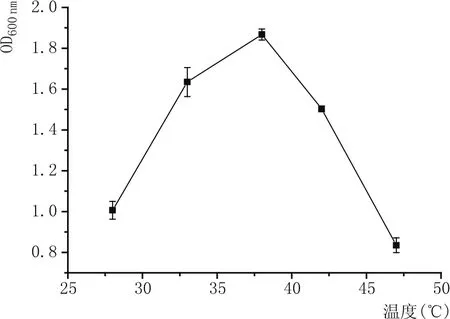
图3 温度对丁酸梭菌菌浓的影响
由图3可知,随着温度的升高,菌浓呈现先增加后降低的趋势,当温度到达37℃时,菌体浓度达到最高值。故菌株Y-1的最适生长温度为37℃。
2.2.2 丁酸梭菌最适生长pH值的测定(图4)

图4 pH值对丁酸梭菌菌浓的影响
由图4可知,菌体浓度随pH值的升高呈现先上升后下降的趋势;当pH7~8时,菌体浓度达到最大,pH7时,菌体浓度最高;当pH9时,试管内菌体浓度基本已无任何变化,pH5时菌体浓度已明显下降,可见,菌体在过酸或过碱的环境中均不能正常生长。可能是由于菌体在生长过程中会产生一定量的酸,故中性或微碱性环境更适合菌体生长。
2.2.3 丁酸梭菌生长曲线的测定(图5)
由图5可知,在最适温度和最适pH值条件下,菌株Y-1在梭菌增殖培养中,在接种初期0~5 h,为菌株生长延迟期,这一阶段丁酸梭菌的生长速率基本为0;在5 h或6 h时菌体进入对数生长期,这一时期,细菌生长旺盛、大量繁殖,菌体数目成指数式增加;对数生长期约维持14 h,在20 h时数目基本不再变化,维持稳定,进入稳定生长期。
2.2.4 丁酸梭菌培养过程中产酸量的测定(图6)

图5 丁酸梭菌生长曲线
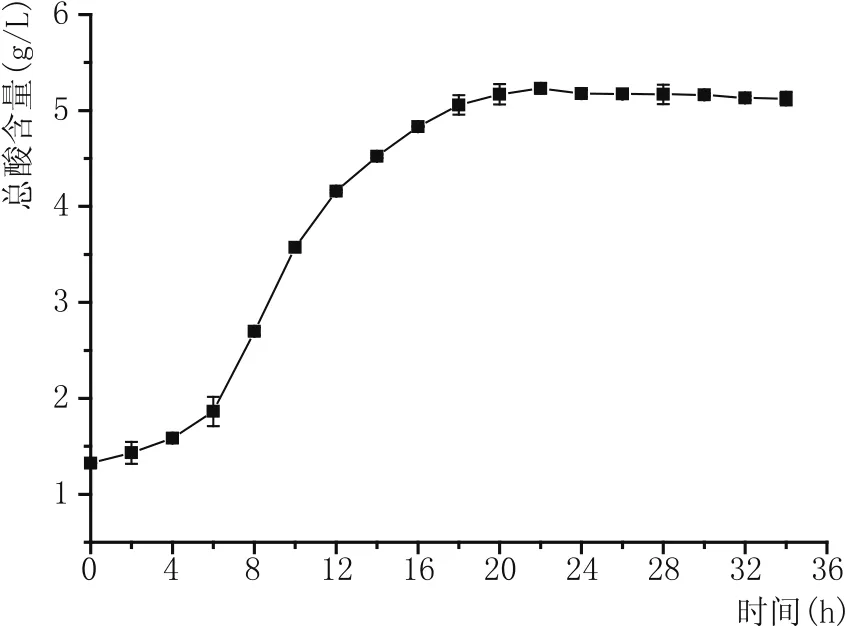
图6 不同生长时间菌液中总酸的变化情况
由图6可知,丁酸梭菌的产酸量和丁酸梭菌的生长是成正比的。当菌体浓度升高时,菌体产酸量也随之增加,同菌体生长曲线一样,菌体的产酸量同样符合“S”型曲线,在0~5 h,菌体处于延迟期,菌液中总酸含量基本没有任何变化;在6~20 h,菌株处于对数生长期,菌体浓度成指数式增加,菌液中总酸含量也成指数式增加;在20 h后,菌体生长进入稳定期,菌浓基本保持不变,菌液中的总酸也基本达到最高值,菌液中总酸含量基本保持不变。
2.2.5 丁酸梭菌的抗性实验测试
2.2.5.1 丁酸梭菌的耐酒精性能试验(图7)
从丁酸梭菌浓度可以确定菌株的耐乙醇特性,由图7可以看出,随着起始乙醇体积分数的增大,培养液中丁酸梭菌的细菌数呈现下降趋势。起始乙醇浓度为1%vol~3%vol之间时,对丁酸梭菌的生长影响不大,丁酸梭菌均可正常生长;当乙醇浓度在5%vol时,丁酸梭菌的生长量明显降低,培养液中丁酸梭菌含量约降低50%。当乙醇浓度超过9%vol以后,菌体基本停止生长,表明9%vol以上的乙醇浓度对菌株的生长具有明显的抑制作用。因此,可以确定丁酸梭菌能够耐受的乙醇浓度为9%vol。

图7 丁酸梭菌Y-1对酒精的耐受能力
2.2.5.2 丁酸梭菌的耐酸性能试验(图8)

图8 丁酸梭菌Y-1对酸的耐受能力
由图8可知,丁酸梭菌在pH值6~7范围内能够正常生长,随着pH值的不断降低,酵母的生长逐渐受到抑制,当pH4.0时,丁酸梭菌已基本不再生长。因此可以确定,该丁酸梭菌的耐酸能力最低pH值为4.0。
3 结论
实验从朗姆酒发酵底液中筛选得到1株丁酸梭菌(命名为Y-I),菌株Y-1为革兰氏阳性菌,严格厌氧,表面光滑、有光泽,奶油色,自身不水解明胶,可将麦芽糖和淀粉水解。
实验对菌株Y-1的生长特性进行初步探究,发现菌株在梭菌增殖培养液中最适生长温度为37℃,最适生长pH7,菌株对于酒精的最高耐受能力为9%vol,耐酸最低pH值为4.0。
[1]FANG Z,ZHANG Y,LÜ Y,et al.Phenolic compounds and antioxidant capacities of bayberry juices[J].Food chemistry,2009,113(4):884-888.
[2] 赵熙,冉陆,杨宝兰,等.丁酸梭菌活菌制剂对肠道菌群影响研究[J].中国微生物学杂志,1999,12(6):332-333.
[3] 冉雪松,王振华,潘康成.丁酸梭状芽孢杆菌的研究进展[J].安徽农学通报,2007,13(4):37-39.
[4] 张凌玲,王素娟,龙在菊.益生菌对肠易激综合征患者肠道微环境及免疫功能影响[J].现代生物医学进展,2016,20(28):5552-5555.
[5] 邓庆,廖美德.多种除氧技术培养丁酸梭菌的研究[J].中国酿造,2013,32(10):44-48.
[6]BENNO Y,SAWADA K,M ITSUOKA T.The intestinal microflora of infants:composition of fecal flora in breast-fed and bottle-fed infants[J].Microbiology and immunology,1984,28(9):975-986.
[7] 邹毅.低浓度糖浆生产重质朗姆酒的方法:CN102952665A[P].2013-03-06.
[8] 贾树彪,李盛贤,吴国峰.新编酒精工艺学[M].北京:化学工业出版社,2004:247-252.
[9]FAHRASMANE L,PARFARTA,JOURET C,et al.Production of higher alcohols and short chain fatty acids by different yeast used in rum fermentation[J].Journal of food sciences,1985,50(5):1427-1436.
[10]DA PORTO C,DECORTI D,TUBARO F.Evaluation of volatile compounds and antioxidant capacity of some commercial rums from Dominican republic[J].International journal of food science and technology,2011,46(5):988-993.
[11] 周新虎,陈翔,李浩.有益功能微生物在酿酒生产中的研究及应用[J].酿酒,2013(9):33-38.
[12] 布坎南.伯杰细菌鉴定手册[M].9版.北京:科学出版社,1995:776-780.
[13] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:358-364.
[14] 匡群,孙梅,施大林.酪酸梭状芽孢杆菌培养条件的研究[J].饲料工业,2005,26(10):36-39.
[15] 赵建新,张灏,田丰伟.丁酸菌的分离、鉴定及筛选[J].无锡轻工大学学报,2002,21(6):597-601.
[16] 扬桂苹.丁酸菌的生物功能研究[J].中国微生态学杂志,1998,10(5):306-531.
[17]LACHENMEIER D W,ATTIG R,FRANK W,et al.The use of ion chromatography to detect adulteration of vodka and rum[J].European food research and technology,2003,218(1):105-110.
[18] 李祺德,康云川,张代芬.甘蔗糖蜜酒精工艺学[M].昆明:云南教育出版社,1993:193-195.
[19]LEE W C,YUSOF S,HAMID N S A,et al.Optimizing conditions for enzymatic clarification of banana juice using response surface methodology(RSM)[J].Journal of food engineering,2006,73(1):55-63.
[20] PINO J A.Characterization of rum using solid-phase micro-extraction with gas chromatography-mass spectrometry[J].Food chemistry,2007,104(1):421-428.
Isolation and Identification of Clostridium butyricum and Study of Its Basic Characteristics
FAN Xiaolu1,ZHANG Weili1,WU Youru1,ZOU Yi2and LI Nan1
(1.College of Life Science and Technology,Guangxi University,Nanning,Guangxi 530004;2.Sugar Industry Engineering Research Center,Guangxi University,Nanning,Guangxi 530004,China)
9 pure strains were isolated from dunder liquid(added during rum fermentation process)through anaerobic incubation.One of the strains was named Y-1 and it was identified as Clostridium butyricum after physiological and biochemical experiments and 16S rDNA sequence analysis.The basic growth characteristics of Y-1 as well as its security were studied.The results demonstrated its strong tolerance to acid and alcohol,and its great capacity of producing acids.The optimum temperature for its growth was 37℃,the best growth pH was 7.0,and its fullest tolerance to alcohol was 9%vol and to acid was pH 4.0.Besides,it played an important role in the process of rum fermentation as the functional microorganism for the formation of fragrance and taste.
rum;dunder;Clostridium butyricum;isolation;identification
TS262.28;TS261.4;TS261.1
A
1001-9286(2017)11-0031-07
10.13746/j.njkj.2017180
2017-06-20
樊晓璐(1994-),在读硕士研究生,研究方向:功能微生物对果酒发酵的影响。
优先数字出版时间:2017-08-17;地址:http://kns.cnki.net/kcms/detail/52.1051.TS.20170817.1424.009.html。
