早期帕金森病患者快速眼动睡眠期行为障碍研究
2017-11-21邹慧莉赵显超江应聪雷革胜杨伟毅宿长军
邹慧莉 赵显超 江应聪 雷革胜 杨伟毅 宿长军
·睡眠障碍相关疾病·
早期帕金森病患者快速眼动睡眠期行为障碍研究
邹慧莉 赵显超 江应聪 雷革胜 杨伟毅 宿长军
目的探讨早期帕金森病患者快速眼动睡眠期行为障碍发生情况,以及帕金森病运动症状、非运动症状和快速眼动睡眠期行为障碍特点。方法共60例原发性帕金森病患者,采用统一帕金森病评价量表第二和第三部分(UPDRSⅡ和UPDRSⅢ)以及Hoehn⁃Yahr分期评价帕金森病非运动症状和运动症状,蒙特利尔认知评价量表评价认知功能,汉密尔顿焦虑量表和汉密尔顿抑郁量表评价焦虑和抑郁症状;中文版快速眼动睡眠期行为障碍筛查量表判断是否伴快速眼动睡眠期行为障碍,Epworth嗜睡量表(ESS)评价白天过度嗜睡程度;多导睡眠图监测睡眠障碍特征,包括下颌位相性肌电活动密度和快速眼动睡眠期肌肉失弛缓。结果60例帕金森病患者中42例(70%)伴快速眼动睡眠期行为障碍(PD+RBD组),多导睡眠图监测其异常行为主要表现为上肢伸展抓握、肢体震颤抽搐、发笑、喊叫和怒骂等非暴力动作,仅2例出现暴力击打、蹬踢等异常行为。PD+RBD组患者年龄(P=0.024)、病程>8年比例(P=0.000)、UPDRSⅡ(P=0.005)和 UPDRSⅢ(P=0.001)评分、Hoehn⁃Yahr分期 2级比例(P=0.007)、焦虑障碍(P=0.044)和抑郁障碍(P=0.001)比例,以及下颌位相性肌电活动密度(P=0.000)和快速眼动睡眠期肌肉失弛缓比例(P=0.000)均高于对照组,其中,PD+RBD组有16例(38.10%)快速眼动睡眠期行为障碍症状早于帕金森样症状5.20(3.91,6.51)年。结论年龄大、病程长、运动症状和非运动症状严重的帕金森病患者易伴发快速眼动睡眠期行为障碍,快速眼动睡眠期行为障碍可能是帕金森病的早期表现。多导睡眠图监测对早期帕金森病伴快速眼动睡眠期行为障碍的诊断有重要参考价值。
帕金森病; REM睡眠行为障碍; 多道睡眠描记术
帕金森病(PD)是中老年人群常见的神经变性病,65岁以上人群发病率为0.5%~1.0%[1],主要表现为运动迟缓、肌强直、静止性震颤、姿势步态异常等典型运动症状。随着对帕金森病研究的不断深入,除上述典型运动症状外,与疾病密切相关的一系列非运动症状(NMS),包括大小便障碍、焦虑、抑郁、认知功能障碍和睡眠障碍等,也引起临床广泛关注[2]。快速眼动睡眠期行为障碍(RBD)表现为梦境相关运动行为。近年研究显示,明确诊断的帕金森病患者快速眼动睡眠期行为障碍发生率约为46%[3],甚至认为快速眼动睡眠期行为障碍可以加重帕金森样症状,严重影响治疗和康复效果[4]。此外,快速眼动睡眠期行为障碍作为帕金森病的前驱症状受到普遍关注。因此,早期识别和及时干预快速眼动睡眠期行为障碍对减轻帕金森样症状、延缓疾病进展、改善生活质量具有一定意义。探讨快速眼动睡眠期行为障碍在早期帕金森病患者中的发生情况,以及帕金森病运动症状、非运动症状和快速眼动睡眠期行为障碍特点,以期早期识别和及时干预帕金森病伴快速眼动睡眠期行为障碍,提高患者生活质量。
资料与方法
一、临床资料
1.纳入标准 (1)原发性帕金森病的诊断符合《中国帕金森病的诊断标准(2016版)》[5]。(2)改良Hoehn⁃Yahr分期 1~ 2级。(3)快速眼动睡眠期行为障碍的诊断符合2014年睡眠障碍国际分类第3版(ICSD⁃3)标准[6]。(4)均行多导睡眠图(PSG)监测。(5)本研究经空军军医大学第二附属医院唐都医院道德伦理委员会审核批准,所有患者或其家属均知情同意并签署知情同意书。
2.排除标准 (1)合并便秘、多汗等自主神经功能障碍。(2)合并脑卒中、疼痛、冠心病、慢性阻塞性肺病(COPD)等可能影响睡眠的疾病。(3)存在家族遗传性疾病病史。(4)近期应用抗抑郁药、抗焦虑药、抗精神病药或合并精神病。(5)酗酒。
3.一般资料 选择2013年10月-2016年10月在空军军医大学第二附属医院唐都医院门诊就诊和住院治疗的早期帕金森病患者60例,男性39例,女性21例;年龄60~82岁,平均(71.23±8.64)岁;受教育程度0~16年,平均为(8.13±2.68)年;病程<5年者26例(43.33%),5~8年14例(23.33%),>8年20例(33.33%);首发症状为静止性震颤33例(55%),运动迟缓22例(36.67%),肌张力增高2例(3.33%),其他3例(5%);左旋多巴等效剂量(LED)375~750 mg/d,平均(420±201)mg/d。
二、研究方法
1.帕金森病评价 由同一位经过神经心理学专业培训的神经内科医师采用统一帕金森病评价量表第二和第三部分(UPDRSⅡ和UPDRSⅢ)以及Hoehn⁃Yahr分期评价帕金森病非运动症状和运动症状;蒙特利尔认知评价量表(MoCA)评价认知功能;汉密尔顿焦虑量表(HAMA)和汉密尔顿抑郁量表(HAMD)评价焦虑和抑郁症状,其中,HAMA评分≥7分为存在焦虑障碍、HAMD评分≥8分为存在抑郁障碍。
2.快速眼动睡眠期行为障碍评价 采用中文版快速眼动睡眠期行为障碍筛查量表(RBDSQ)[7]评价快速眼动睡眠期行为障碍发生情况和严重程度,包括10道大题和13道小题,每道题均有“是”和“否”两项选项,回答“是”计1分、回答“否”计0分,评分≥6分,伴快速眼动睡眠期行为障碍;<6分,不伴快速眼动睡眠期行为障碍。采用Epworth嗜睡量表(ESS)评价白天过度嗜睡(EDS)程度,包括8种情况,即坐位看书时;看电视时;在公共场所(如剧院和会议)静坐时;连续乘车1 h未休息;如果环境允许,午后平卧休息时;坐位与他人谈话时;午饭(不饮酒)后静坐时;乘坐出租车遇交通堵塞,停车数分钟时,每种情况分为0~3分,0分,从不打瞌睡;1分,轻度瞌睡;2分,中度瞌睡;3分,重度瞌睡,总评分为8种情况评分的总和,总评分为24分,其中,评分0~9分,正常;10~13分,轻度嗜睡;14~19分,中度嗜睡;20~24分,重度嗜睡。
3.多导睡眠图监测 所有患者均采用荷兰Philips Respironics公司生产的Alice 5多导睡眠视频脑电图仪连续两晚(夜间22:00至次日清晨6:00)进行多导睡眠图监测,第1晚为适应期、第2晚为评价期,监测指标包括音频和视频脑电图、眼动图、心电图、颏肌和胫骨前肌肌电图、口鼻气流量、腹式呼吸和指端脉搏血氧饱和度(SpO2),同时对睡眠中异常行为进行监测,包括鼾声、梦语等。采用下颌位相性肌电活动密度和快速眼动睡眠期(REM)肌肉弛缓现象评价快速眼动睡眠期行为障碍严重程度。(1)下颌位相性肌电活动密度:将快速眼动睡眠期每2秒为1个微单位,计算含下颌位相性肌电事件的微单位数目占快速眼动睡眠期微单位总数的百分比,其中,下颌位相性肌电事件系指每次肌电活动爆发持续0.30~5.00 s、波幅增高超过背景基线4倍的肌电活动。(2)快速眼动睡眠期肌肉弛缓现象:以快速眼动睡眠期每20秒为1个时间段,若1个时间段内紧张性颏肌肌电活动>50%,则该时间段为紧张性;若≤50%,则为迟缓性,其中,紧张性肌电活动系指肌电图波幅>基线2倍且>10 μV的肌电活动。
三、统计分析方法
采用SPSS 17.0统计软件进行数据处理与分析。计数资料以相对数构成比(%)或率(%)表示,采用χ2检验。呈正态分布的计量资料以均数±标准差(x±s)表示,采用两独立样本的t检验。以P≤0.05为差异具有统计学意义。
结 果
一、临床资料的比较
60例原发性帕金森病患者根据是否伴快速眼动睡眠期行为障碍,分为帕金森病伴快速眼动睡眠期行为障碍组(PD+RBD组)和帕金森病不伴快速眼动睡眠期行为障碍组(对照组)。(1)PD+RBD组:42例患者,男性28例,女性14例;年龄67~82岁,平均(74.20±6.82)岁;受教育程度 0~16年,平均(8.13±2.68)年;病程<5年14例(33.33%),5~8年10例(23.81%),>8年18例(42.86%);左旋多巴等效剂量 260~638 mg/d,平均(449.00±188.50)mg/d;UPDRSⅡ评分 10~27分,平均(18.44±8.06)分;UPDRSⅢ评分23~63分,平均(42.90±19.52)分;Hoehn⁃Yahr分期 1级 18例(42.86%),2级 24例(57.14%);MoCA评分16~25分,平均为(20.07±3.98)分;HAMA评分<7分21例(50%),≥7分21例(50%);HAMD评分<8分者10例(23.81%),≥8分32例(76.19%);ESS评分6~16分,平均(11.02±4.72)分;16例(38.10%)快速眼动睡眠期行为障碍症状早于帕金森样症状,时间3~8年、中位值5.20(3.91,6.50)年。(2)对照组:18例患者,男性11例,女性7例;年龄60~76岁,平均(67.53±7.42)岁;受教育程度5~16年,平均(10.71±2.38)年;病程 <5年12例(66.67%),5~8年4例(22.22%),>8年2例(11.11%);左旋多巴等效剂量187.50~750.00 mg/d,平均(400±198)mg/d;UPDRSⅡ评分7~20分,平均(13.64±5.88)分;UPDRSⅢ评分 17~41分,平均(29.12±11.44)分;Hoehn⁃Yahr分 期 1级 14例(77.78%),2级4例(22.22%);MoCA评分18~29分,平均(23.11±4.92)分;HAMA评分 <7分 13例(72.22%),≥7分5例(27.78%);HAMD评分<8分14例(77.78%),≥8分4例(22.22%);ESS评分5~13分,平均(9.00±3.97)分。两组患者临床资料比较,PD+RBD组年龄(P=0.024)、病程 >8年比例(P=0.000)、UPDRSⅡ(P=0.005)和 UPDRSⅢ(P=0.001)评分、Hoehn⁃Yahr分期2级比例(P=0.007)、焦虑障碍(P=0.044)和抑郁障碍(P=0.001)比例高于对照组且差异有统计学意义,其余各项指标组间差异无统计学意义(均P>0.05,表1)。
二、多导睡眠图监测的比较
多导睡眠图监测显示,帕金森病伴快速眼动睡眠期行为障碍患者的异常行为主要表现为上肢伸展抓握、肢体震颤抽搐、发笑、喊叫和怒骂等非暴力动作,仅2例出现暴力击打、蹬踢等异常行为。PD+RBD组患者下颌位相性肌电活动密度(P=0.000)和快速眼动睡眠期肌肉失弛缓比例(P=0.000)均高于对照组且差异有统计学意义(表2)。
讨 论
帕金森病伴快速眼动睡眠期行为障碍患者的快速眼动睡眠期行为障碍症状可于帕金森病运动症状前出现,也可于其后或同时出现[8],此外,并非所有帕金森病患者均出现快速眼动睡眠期行为障碍,这在某种程度上体现出帕金森病在临床表现和病理生理学机制方面的异质性。研究显示,强直型帕金森病患者伴快速眼动睡眠期行为障碍的比例高于震颤型帕金森病患者,且病程较长的患者运动症状较严重、药物治疗反应较差、相关并发症发生率较高[9]。本研究早期帕金森病患者快速眼动睡眠期行为障碍发生率为70%(42/60),高于既往研究结果,但与Nardone等[10]的发生率为90%相近。帕金森病伴快速眼动睡眠期行为障碍患者总体睡眠质量较差,由于夜间多梦、喊叫和肢体活动等异常行为,导致睡眠片段化,影响睡眠质量甚至日间工作和生活。研究显示,帕金森病伴快速眼动睡眠期行为障碍患者的非运动症状如焦虑和抑郁症状明显加重[4]。在本研究中,PD+RBD组患者焦虑障碍和抑郁障碍发生率均高于对照组。究其原因,可能是由于帕金森病患者受疾病影响易产生应激反应,心理压力较大,此类患者脑桥、中脑和黑质受累后投射至相关脑区的去甲肾上腺素能等神经递质水平明显下降,研究证实其与焦虑和抑郁等负性情绪的产生密切相关[11];快速眼动睡眠期行为障碍可进一步影响睡眠质量,进而加重焦虑和抑郁症状。本研究结果显示,PD+RBD组患者年龄、病程>8年比例、非运动症状和运动症状(UPDRSⅡ和UPDRSⅢ评分、Hoehn⁃Yahr分期2级比例)、焦虑和抑郁障碍(HAMA和HAMD评分)比例均高于对照组,与文献报道相一致[4],尽管本研究高龄、病程长、病情严重、焦虑和抑郁等负性情绪较多的帕金森病患者发生快速眼动睡眠期行为障碍的比例较高,但原因尚不明确,提示临床医师应提高警惕,从病史采集、量表评价和多导睡眠图监测等方面尽早发现和及时干预快速眼动睡眠期行为障碍,从而改善睡眠质量,减少睡眠中伤人和自伤,提高临床治疗效果。帕金森病与路易体痴呆有相似的病理学基础,可能与胆碱能、多巴胺能、5⁃羟色胺能和其他神经递质系统及其相关神经核团[如基底前脑、脑桥脚核或背外侧被盖核、腹侧被盖区(VTA)、中缝核]和神经网络改变有关,上述神经核团均属边缘系统和新皮质神经网络[12],因此,帕金森病晚期神经精神症状可能与上述神经递质系统和神经网络有关。睡眠障碍与帕金森病有关,虽然参与快速眼动睡眠期行为障碍的关键神经网络仍不明确,但是蓝斑下核和蓝斑核前端、大细胞网状结构变性或二者兼有,以及其传入或传出通路功能失调可能与之有关。

表1 PD+RBD组与对照组患者临床资料的比较Table 1. Comparison of clinical data between PD+RBD group and control group
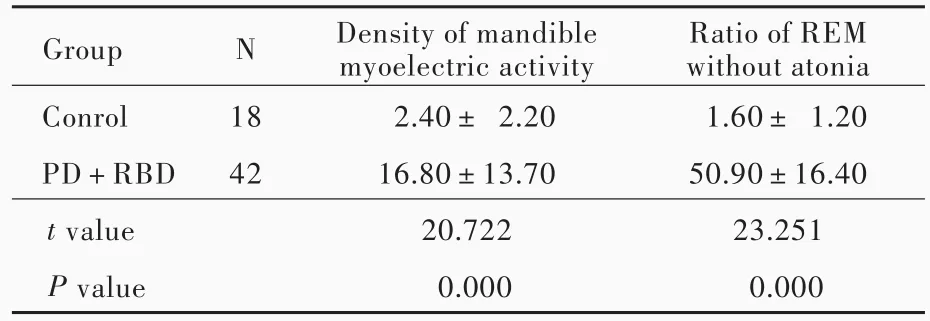
表2 PD+RBD组与对照组患者多导睡眠图监测指标的比较(x±s,%)Table 2. Comparison of PSG parameters between PD+RBD group and control group in REM(x±s,%)
目前,多导睡眠图是明确诊断快速眼动睡眠期行为障碍的主要方法,可以发现快速眼动睡眠期肌肉失弛缓,多导睡眠图诊断快速眼动睡眠期行为障碍的准确性明显高于仅依靠临床病史[13],有助于早期识别亚临床期快速眼动睡眠期行为障碍,并与其他类型睡眠障碍相鉴别。本研究结果显示,PD+RBD组有16例快速眼动睡眠期行为障碍症状早于帕金森样症状5.20(3.91,6.50)年,表明早期帕金森病伴快速眼动睡眠期行为障碍比例较高,可在一定程度上影响睡眠质量,提示快速眼动睡眠期行为障碍可能是帕金森病的早期表现。由于受到临床经验和临床研究程度的限制,多数帕金森病伴快速眼动睡眠期行为障碍患者常合并神经精神症状,尤其是药物治疗早期多有较大的心理压力和恐惧心理。本研究多导睡眠图监测显示,大多数帕金森病伴快速眼动睡眠期行为障碍患者表现为上肢伸展抓握、肢体震颤抽搐、发笑、喊叫、怒骂等非暴力动作,仅2例出现暴力击打、蹬踢等异常行为,与文献报道相一致[13]。研究显示,快速眼动睡眠期行为障碍可以预测帕金森病的进展、神经精神症状和认知功能障碍的出现,因此,应对帕金森病伴快速眼动睡眠期行为障碍患者予以足够重视,早期诊断、及时治疗[14]。在本研究中,PD+RBD组患者下颌位相性肌电活动密度和快速眼动睡眠期肌肉失弛缓比例均高于对照组,与文献报道相一致[15],提示帕金森病伴快速眼动睡眠期行为障碍患者睡眠障碍严重程度高于不伴快速眼动睡眠期行为障碍患者,推测帕金森病亦可以加重快速眼动睡眠期行为障碍,因此认为,帕金森病和快速眼动睡眠期行为障碍是相互作用的两种疾病。
综上所述,帕金森病患者伴发快速眼动睡眠期行为障碍的比例明显高于正常人群,年龄较大、病程较长、运动症状和非运动症状较严重的帕金森病患者更易伴发快速眼动睡眠期行为障碍,帕金森病伴快速眼动睡眠期行为障碍患者焦虑和抑郁等负性情绪及睡眠障碍更严重。因此,快速眼动睡眠期行为障碍可能是帕金森病早期表现,多导睡眠图监测对帕金森病伴快速眼动睡眠期行为障碍的诊断有重要价值,超早期和临床难以诊断的帕金森病患者行多导睡眠图监测,计算下颌位相性肌电活动密度和快速眼动睡眠期肌肉失弛缓比例,可能对诊断帕金森病伴快速眼动睡眠期行为障碍有参考价值。
[1]Zhang JR,Chen J,Yang ZJ,Zhang HJ,Fu YT,Shen Y,He PC,Mao CJ,Liu CF.Rapid eye movement sleep behavior disorder symptoms correlate with domains of cognitive impairment in Parkinson's disease.Chin Med J(Engl),2016,129:379⁃385.
[2]Berardelli A,Wenning GK,Antonini A,Berg D,Bloem BR,BonifatiV,BrooksD,Burn DJ,ColosimoC,FanciulliA,Ferreira J,GasserT,GrandasF,Kanovsky P,Kostic V,Kulisevsky J,Oertel W,Poewe W,Reese JP,Relja M,Ruzicka E,Schrag A,Seppi K,Taba P,Vidailhet M.EFNS/MDS⁃ENS recommendations for the diagnosis of Parkinson's disease.Eur J Neurol,2013,20:16⁃34.
[3]Pessoa Rocha N,ReisHJ,Vanden BergheP,Cirillo C.Depression and cognitive impairment in Parkinson's disease:a role for inflammation and immunomodulation?Neuroimmunomodulation,2014,21:88⁃94.
[4]Sateia MJ.International classification of sleep disorders⁃third edition:highlights and modifications.Chest,2014,146:1387⁃1394.
[5]Parkinson's Disease and Movement Disorder Group,Chinese Society of Neurology,Chinese Medical Association;Specialized Committee ofParkinson'sDisease and MovementDisorder,China Neurologist Association, Chinese Medical Doctor Association.Diagnostic criteria for Parkinson's disease in China(2016 edition).Zhonghua Shen Jing Ke Za Zhi,2016,49:268⁃271[.中华医学会神经病学分会帕金森病及运动障碍学组,中国医师协会神经内科医师分会帕金森病及运动障碍专业委员会.中国帕金森病的诊断标准(2016版).中华神经科杂志,2016,49:268⁃271.]
[6]American Academy of Sleep Medicine. International classification ofsleep disorders.3rd ed.Darien:American Academy of Sleep Medicine,2014:143⁃161.
[7]Zha SY, Ma JF, Chen SD. Evaluation of screening questionnaires for rapid⁃eye⁃movement sleep behavior disorder.Zhen Duan Xue Li Lun Yu Shi Jian Za Zhi,2016,15:258⁃262.[扎圣宇,马建芳,陈生弟.快动眼睡眠行为障碍筛查量表的应用评价.诊断学理论与实践杂志,2016,15:258⁃262.]
[8]Kang SH,Yoon IY,Lee SD,Han JW,Kim TH,Kim KW.REM sleep behaviordisorderin the Korean elderly population:prevalence and clinical characteristics.Sleep,2013,36:1147⁃1152.
[9]Bastiaens J, Dorfman BJ, Christos PJ, Nirenberg MJ.Prospective cohortstudy ofimpulse control disorders in Parkinson's disease.Mov Disord,2013,28:327⁃333.
[10]Nardone R,Bergmann J,Brigo F,Christova M,Kunz A,Seidl M,Tezzon F,Trinka E,Golaszewski S.Functional evaluation of central cholinergic circuits in patients with Parkinson's disease and REM sleep behavior disorder:a TMS study.J Neural Transm(Vienna),2013,120:413⁃422.
[11]Schenck CH,Boeve BF,Mahowald MW.Delayed emergence of a parkinsonian disorder or dementia in 81% of older men initially diagnosed with idiopathic rapid eye movement sleep behavior disorder:a 16⁃year update on a previously reported series.Sleep Med,2013,14:744⁃748.
[12]Bocanegra Y,Trujillo⁃Orrego N,Pineda D.Dementia and mild cognitive impairment in Parkinson's disease:a review.Rev Neurol,2014,59:555⁃569.
[13]Mahowald MW,Schenck CH.REM sleep behaviour disorder:a marker of synucleinopathy.Lancet Neurol,2013,12:417⁃419.
[14]Devnani P,Fernandes R.Management of REM sleep behavior disorder:an evidence based review.Ann Indian Acad Neurol,2015,18:1⁃5.
[15]Ferri R,Marelli S,Cosentino FI,Rundo F,Ferini⁃Strambi L,Zucconi M.Night⁃to⁃night variability of automatic quantitative parameters of the chin EMG amplitude(Atonia Index)in REM sleep behavior disorder.J Clin Sleep Med,2013,9:253⁃258.
Study on rapid eye movement sleep behavior disorder in patients with Parkinson's disease at early stage
ZOU Hui⁃li,ZHAO Xian⁃chao,JIANG Ying⁃cong,LEI Ge⁃sheng,YANG Wei⁃yi,SU Chang⁃jun
Department of Neurology,Tangdu Hospital,the Fourth Military Medical University of Chinese PLA,Xi'an 710038,Shaanxi,China
Corresponding author:SU Chang⁃jun(Email:changjunsu@163.com)
ObjectiveTo investigate the incidence,occurrence time and electrophysiological characteristics of rapid eye movement behavior disorder(RBD)in patients with early Parkinson's disease(PD),and the characteristics of motor symptoms and non⁃motor symtoms(NMS).MethodsSixty PD patients were divided into PD+RBD group(N=42)and control group(N=18)according to whether they were complicated with RBD or not.Unified Parkinson's Disease Rating Scale(UPDRS)ⅡandⅢ,Hoehn⁃Yahr Stage,Montreal Cognitive Assessment(MoCA),Hamilton Anxiety Rating Scale(HAMA),Hamilton Depression Rating Scale(HAMD),RBD Screening Questionnaire(RBDSQ),Epworth Sleepiness Scale(ESS)and polysomnography(PSG)were used in 60 patients.ResultsAmong 60 patients,42(70%)were accompanied by RBD.PSG showed that PD+RBD patients mainly presented upper limb stretching and gripping,body twitching,laughing,shouting,cursing and other non⁃violent actions,except 2 cases presented violent actions,such as hitting,kicking,etc.In PD+RBD group,the age was older(P=0.024),duration was longer(P=0.000),and UPDRSⅡ (P=0.005),UPDRSⅢ(P=0.001),the scale values ofHoehn⁃Yahr Sotage 2(P=0.007),anxiety(P=0.044)and depression(P=0.001)ratio were all higher than control group.There were significant differences in density of mandible myoelectric activity(P=0.000)and ratio of rapid eye movement(REM)without atonia(P=0.000)between 2 groups.In PD+RBD group,16 patients(38.10%)had symptoms of RBD,earlier than PD occurred 5.20(3.91,6.51)years.ConclusionsPD patients with older age,longer duration,more severe motor symptoms and non⁃motor symptoms were more likely to be accompanied by RBD.The severity of RBD in PD patients accompanied with RBD is higher than that in PD without RBD.RBD may be the early manifestation of PD.PSG has important value in the diagnosis of PD with RBD.
Parkinson disease; REM sleep behavior disorder; Polysomnography
10.3969/j.issn.1672⁃6731.2017.10.006
710038西安,空军军医大学第二附属医院唐都医院神经内科
宿长军(Email:changjunsu@163.com)
2017⁃08⁃24)
