前扣带皮层PKMζ在慢性痛伴发痛情绪中的作用研究进展 *
2017-11-20邵晓梅方剑乔房军帆杜俊英
温 存 邵晓梅 方剑乔 房军帆 杜俊英
(浙江中医药大学第三临床医学院针灸神经生物学实验室, 杭州 310053)
·综 述·
前扣带皮层PKMζ在慢性痛伴发痛情绪中的作用研究进展 *
温 存 邵晓梅 方剑乔 房军帆 杜俊英△
(浙江中医药大学第三临床医学院针灸神经生物学实验室, 杭州 310053)
慢性疼痛是临床上常见的症状之一,通常伴随不愉快的感觉和心理体验。它既是一种生理反应,也是一种主观的自觉症状。慢性痛的发生发展通常会加重痛情绪,痛情绪则又会进一步加重疼痛,逐步形成疼痛与情绪的恶性循环。多项研究证明前扣带皮层(anterior cingulated cortex, ACC)与慢性痛痛情绪有着密切的联系。ACC内蛋白激酶M (protein kinase M zeta, PKMζ)及其相关信号分子通路在慢性痛痛情绪的形成和维持中扮演着重要的角色。本综述简要回顾了该领域的主要研究进展,为治疗慢性痛痛情绪提供了新的治疗思路。
慢性痛;痛情绪;PKMζ;前扣带皮层
疼痛是一种与组织损伤或潜在损伤相关的不愉快的主观感觉和情绪体验。它包含感觉分辨(sensory-discriminative component)和情绪反应(affective-emotional component)两种成分,其中痛的情绪反应是与疼痛刺激密切相关的厌恶、焦虑、恐惧及迫切想终止疼痛刺激的愿望等,可分两个阶段:一是“痛不愉快感”(feeling of unpleasantness),它是对痛刺激的即时反应,又称原发性不愉快(Primary unpleasantness);二是继发性不愉快(Secondary unpleasantness),是一种直接与疼痛的远期结局相关的情绪反应,它和接受痛刺激时的背景环境、疼痛对未来生活的影响、长期经受疼痛的恐惧等密切相关,其涉及疼痛、学习记忆,认知等因素,需要脑的高级中枢对这些相关信息的整合。临床上慢性疼痛病人常由于长期疼痛导致失眠以及烦躁、焦虑、抑郁、紧张等负面情绪的产生[1,2],这些情绪不仅会加重疼痛的感觉,而且长期受它们困扰,严重影响病人的生活质量[3~6],因此由疼痛特别是慢性痛导致的情绪问题越来越受到人们的关注,但由于合适的动物模型有限以及先进的技术手段还不完善,痛情绪特别是慢性痛诱发痛情绪的研究明显落后于痛感觉的研究。近几年,有研究员通过建立慢性炎性痛和慢性神经病理性痛模型观察痛的情绪成分对行为学的影响,发现动物在造模后一定时间后会产生诸如焦虑、抑郁、绝望等负面情绪[7~11]。动物行为学、电生理学等相关实验研究表明,前扣带皮层(anterior cingulated cortex, ACC)主要参与情感功能,在痛情绪成分的处理中起重要作用[12~15],前扣带皮层内蛋白激酶M (protein kinase M zeta, PKMζ)及其相关信号分子通路可能通过增强突触传递影响慢性痛痛情绪的产生及维持。本文将总结慢性痛伴发痛情绪的模型及ACC内PKMζ在慢性痛伴发痛情绪中的作用研究进展。
1.慢性痛伴发痛情绪常用模型
研究者多用已有或已成熟的慢性痛模型伴发行为学改变作为慢性痛伴发痛情绪模型。慢性炎性痛常用造模试剂有完全弗氏佐剂(complete Freund's adjuvant, CFA)、甲醛液等。慢性神经病理性痛常用的模型有坐骨神经分支损伤(spared nerve injury,SNI)、部分坐骨神经损伤模型(partial sciatic nerve injury, PSNI)部分脊神经结扎模型(segmental spinal nerve ligation, SNL)、慢性坐骨神经压迫损伤(chronic constriction injury, CCI)等。慢性痛伴发痛情绪行为学改变常见的实验方法有旷场实验、高架O迷宫或十字迷宫实验、糖水试验、社交实验、强迫游泳实验等。这些行为学意义在于测试慢性痛啮齿类动物所伴发的负面情绪如抑郁、焦虑的程度(见表1、2)。
2. ACC与痛情绪关系
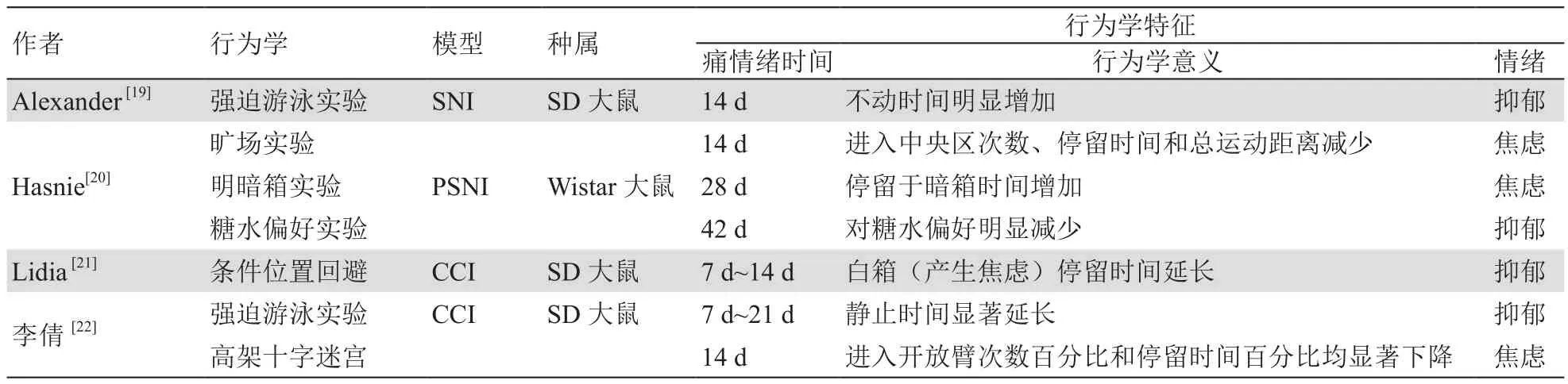
表2 慢性神经性病理伴发的痛情绪
(1)ACC概况
ACC位于胼胝体上方,覆盖胼胝体全长,是大脑皮层内侧痛皮层中的区域之一,接受来自脊髓伤害性刺激。可分为吻侧(rostral Anterior Cingulate Cortext, rACC)和尾侧(caudal Anterior Cingulate Cortext, cACC)。rACC指围绕于胼胝体膝周围的部分,而cACC则指胼胝体膝后部相对应的部分。rACC是主要产生情绪和自主反应的部位,cACC则是ACC运动区和痛相关区所在部位[23]。Min[24]认为ACC能整合来自杏仁核直接或间接的焦虑信号的投射。张玉秋[25]等采用荧光金逆标法发现许多核团都有纤维投射到ACC,而这些核团又大都接受来自脊髓伤害性或持续刺激性信息的传入;其中来自丘脑中线内核群和髓板内核群是接受来自脊髓的伤害性信息传入主要核团,且这些投射更多地到达rACC而不是cACC。ACC与这些脑区广泛的纤维联系,提示它不但能从丘脑等核团接受痛信息,还能接受周围环境的信息,实现痛信息与周围环境信息的双重汇聚,构成了rACC参与痛情绪反应的结构基础。
(2)ACC与痛情绪
人类脑功能成像研究显示ACC不但参与痛的情绪反应,而且能编码情绪反应的强度[26]。有早期报道指出外科消融ACC和周围皮层组织能减少疼痛相关不良情绪而不影响人对伤害性刺激的强度和位置的区分[27]。
Johansen[28]等发现兴奋性毒损毁大鼠rACC可减少由甲醛液诱导的条件位置回避行为(Formalininduced Conditioned Place Avoidance , F-CPA),但不影响甲醛液诱发的伤害性行为,这表明ACC参与由伤害性刺激引起的F-CPA。高永静[29]等用改良过的F-CPA自动记录系统对双侧损毁ACC的大鼠进行F-CPA,发现大鼠条件位置回避的程度明显减轻。Donahue[30]等研究发现,电解损毁ACC明显减低甲醛液引起的第二时相痛反应,但对第一时相反应无影响。进一步分析显示,导致第二时相综合痛反应评分降低的原因是大鼠的舔爪时间缩短,抬腿时间没有显著变化。然而,舔爪行为更多地是反映大鼠对伤害性刺激的不愉快的情绪成分,抬腿现象则主要反映的是刺激的强度。因此,ACC损毁影响的是痛的情绪反应,而非痛的感觉成分。
3. PKMζ与痛情绪
(1)PKMζ概述
Hernandez[31]等研究发现PKMζ是非典型蛋白激酶C (protein kinase C, PKC)的亚型,由于PKMζ的活化不依赖钙离子且对甘油二酯和佛波酯不敏感而被列入非典型蛋白。PKMζ是PKC蛋白水解的碎片,相当于全长PKCζ蛋白的独立催化域,缺乏调节域,无自身抑制功能,因此具有固有活性。这个ζ基因由两个外显启动子产生两套RNAs:一套是全长的PKCζmRNA,另一套是PKMζmRNA。两者比较,PKMζmRNA的5’末端有PKCζmRNA不存在的独立序列,而3’末端两者相同。总之,PKMζ是由PKCζ基因内部启动子启动转录,自身PKMζmRNA翻译而成的分子[32]。
(2)ACC内PKMζ与痛情绪
Min[33,34]研究发现,慢性痛会导致突触的数量增加,功效发生改变,引起突触可塑性的变化,进而增强神经元之间的信息传递。这种突触表现形式为长时程增强(long-term potentiation, LTP),可发生在皮质区如ACC内。有学者研究发现PKMζ对ACC内维持慢性疼痛诱导的突触可塑性改变、参与LTP的维持是充分且必要[35],说明ACC内PKMζ在慢性痛中的作用可能是通过调控LTP来实现。Li[36]等研究发现小鼠周围神经损伤导致ACC脑区内PKMζ被激活;进一步研究发现PKMζ可明显增强和维持对疼痛的敏感性,并在情绪化恐惧记忆中发挥了重要作用。此外,他们还发现ACC内微注射PKMζ抑制剂ZIP可消除这种长时程增强效应,有效阻断痛觉情绪行为的产生。因此,PKMζ很可能是慢性痛伴发痛情绪的一个重要因素,可以作为治疗慢性痛伴发痛情绪的一个靶点。
(3) ACC内PKMζ相关通路和痛情绪
① 慢性痛中PKMζ相关分子信号通路:研究发现,PKMζ具有维持突触增强的作用,是慢性痛发病机制的关键效应分子,且与PKMζ相关信号分子传递这种突触作用还参与慢性痛伴发痛情绪的过程。兴奋性氨基酸尤其是谷氨酸在ACC突触传递和信号处理中有重要作用[27]。各种不同类型的氨基酸受体在ACC内都存在,包括α-氨基-3-羟基-5-甲基-4-异恶唑-丙酸受体(α-amino-3-hydrox-y-5-methyl-4-isoxazole-propionate-receptors,AMPARs)、N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate, NMDAR)、红藻氨酸受体(kainate receptors, KA)和促代谢型谷氨酸受体(metabotropic Glutamate Receptor, mGluR)[37]。在慢性痛信息的传递中,PKMζ受体是NMDA下游通路的关键信号蛋白[32]。雷留根[38]等研究发现通过ACC内注射NMDA受体拮抗剂2-氨基-5-磷酰基戊酸酯(2-amino-5-phosphonovaleric acid, AP-5)可明显降低F-CPA,而注射非NMDA受体拮抗剂二硝基喹酮(6,7-dinitroquinoxaline-2,3-dione, DNQX)对F-CPA行为未观察到明显效应,从形态上证明了NMDA受体参与痛情绪的调制。任文华[39]等对大鼠双侧rACC微量注射不同剂量的Gly位点(NMDA受体激动剂结合位点之一)选择性拮抗剂后发现条件训练前20 min 0.2和2 mM浓度的7-Cl-KYNA完全阻断F-CPA的形成。与此类似的是双侧rACC注射D-型丝氨酸氧化酶DAAO(降解NMDA受体的内源性激动剂)也可明显阻断F-CPA的形成,再次证明ACC内NMDA受体可以调节慢性痛痛情绪。
PKMζ下游信号靶点在慢性痛痛情绪的发病机制中发挥着关键作用。其包括四个亚基:GluR1-4 ACC内兴奋性传递主要由谷氨酸AMPA受体进行,少量KA受体也参与了调节[40]。有研究证明慢性痛模型ACC突触后膜的AMPAR表达增强[41]。外周神经损伤后,PKMζ抑制剂ZIP能选择性减少ACC突触后膜的AMPAR亚基GluR1表达,表明PKMζ可能通过ACC内AMPAR来发挥其功能。
PKMζ上游信号蛋白腺苷酸环化酶1 (calmodulin stimulated adenylyl cyclase1, AC1)在ACC脑区许多层的扣带回神经元高度表达。目前认为AC1成为慢性痛的治疗靶点的理由有三个[42]:①AC1主要表达在神经元上而非内脏细胞上;②AC1是由钙-钙调蛋白依赖的方式激活;③AC1是NMDAR下游信号的作用物质,有助于皮层和脊髓的慢性痛相关神经可塑性的形成和发展。因此,随着慢性痛的发展需要LTP不断持续进行,而改变AC1对慢性痛突出可塑性的影响从而阻止LTP对慢性痛引起的损伤至关重要。
②ACC内相关GluR1-PKMζ通路与痛情绪的联系:已有研究发现,ACC内痛觉相关突触传递过程可能主要是由AMPA受体亚基GluR1介导[43]。有研究证明,GluR1基因敲除小鼠,ACC区域的长时程增强(是病理性疼痛形成的主要原因)消失[44]。作为GluR1的上游物质,PKMζ在LTP的长期维持是充分必要的[45]。关于PKMζ和LTP的关系,有学者证明,无论是离体实验还是活体实验,PKCζ假底物抑制肽ZIP通过抑制PKMζ活性来消除LTP[46,47]。为进一步研究PKMζ活性的消除是否依赖于ZIP,Lenora[48]等用PKMζ和PKCζ敲除小鼠进行试验,发现它们的神经突触传递功能和LTP形成和维持功能正常,并且这些小鼠海马区的学习和记忆工作表现正常,因此ZIP的作用不是直接通过PKMζ来实现。PKMζ磷酸化状态和LTP同步开启,并巩固于晚期LTP。LTP的形成需要GluR1亚基插入细胞膜。Li[36]等研究员用峰值缩放的非平稳波动分析对大量神经进行研究,发现ZIP产生大量的抑制兴奋性突触后电流,且那些被激活的通道下降至65±11% pA,然而AMPA受体单一电导未受任何影响。这些结果表明在慢性痛中,PKMζ通过增加ACC内AMPARs亚基GluR1来发挥作用[49]。
4. PKMζ与慢性痛痛情绪展望
综上所述,ACC内PKMζ通过突触间信号分子相互作用参与并维持了慢性痛诱导的痛情绪过程。有关ACC内参与疼痛与情绪相关调制因素很多,它们之间必定存在着错综复杂的有机联系。鉴于兴奋性氨基酸广泛参与多种形式的学习记忆过程及慢性痛引起的长时程可塑性变化,我们有理由相信ACC内兴奋性氨基酸受体可能参与介导痛厌恶情绪和相关记忆的形成[50]。随着科学研究的深入,大量神经生物学研究发现PKMζ在慢性痛突触可塑性维持中发挥着至关重要的作用,其信号通路可能是[51]:动作电位→谷氨酸盐释放→NMDA受体受体激活→内流→将信号传给AC1→PKMζ磷酸化→增加AMPA受体(GluR1亚型)→引起慢性痛行为及痛情绪。因此,抑制PKMζ表达可能是一个新的治疗慢性痛的神经机制。然而ACC内PKMζ与周围神经系统之间的调节是否与LTP密切相关,是否有直接调节慢性痛痛情绪的可能性以及相关神经分子之间是否存在相互制约和影响还有待深入研究。此外,对PKMζ的与痛情绪有关的认知也局限于长时程增强突触效应,且两者并未有直接关联。因此对深入研究神经生物学机制和针对慢性痛痛情绪治疗手段还有待进一步研究。
[1]龙雄初,龙枚飞,李晓玲,等. 带状疱疹患者的心理调查与分析. 中国健康心理学杂志, 2012, 20(5):679 ~ 681.
[2]Du JY, Fang JQ, Liang Y,et al.Electroacupuncture attenuates mechanical allodynia by suppressing the spinal JNK1/2 pathway in a rat model of inflammatory pain.Brain Res Bull, 2014, 108(6): 27 ~ 36.
[3]Fang JQ, Fang JF, Liang Y,et al.Electroacupuncture mediates extracellular signal-regulated kinase 1/2 pathways in the spinal cord of rats with in fl ammatory pain. BMC Complement Altern Med, 2014, 14(1): 285.
[4]Liang Y, Fang JQ, Du JY,et al.Intervention of electroacupuncture on spinal p38 MAPK/ATF-2/VR-1 pathway in treating in fl ammatory pain induced by CFA in rats. Mol Pain, 2013, 9(1): 1 ~ 14.
[5]Transcutaneous electrical nerve stimulation attenuates CFA-induced hyperalgesia and inhibits spinal ERK1/2-COX-2 pathway activation in rats. BMC Complement Altern Med, 2013, 13(1): 134.
[6]Effect of Electroacupuncture on Activation of p38MAPK in Spinal Dorsal Horn in Rats with Complete Freund's Adjuvant-Induced Inflammatory Pain. Evid Based Complement Alternat Med, 2012, 2012: 1 ~ 6.
[7]冯秀梅. 电针对慢性痛大鼠杏仁核内痛感觉和情绪成分相关受体CRF1R等表达影响. 中国中医科学院,2015: 63.
[8]冯斌. 基底外侧杏仁核motilin抗焦虑作用及其机制研究. 第四军医大学药学院理学教研室, 2014: 62 ~ 63.
[9]王倩. CFA注射致炎性疼痛过程中海马内BNDF的表达及作用研究. 现代生物医学进展杂志, 2014, 14:7001 ~ 7006.
[10]周叶, 都霞, 潘建春. 抑郁症动物模型的研究进展.中国执业药师杂志, 2012, 19(4): 39 ~ 44.
[11]Guo HL, Xiao Y, Tian Z,et al. Anxiolytic effects of sesamin in mice with chronic inflammatory pain. Nutritional Neuroscience, 2016, 19(6): 231 ~ 236.
[12]LaGraize SC, Labuda CJ, Rutledge MA,et al. Differential effect of anterior cingulate cortex lesion on mechanical hypersensitivity and escape/avoidance behavior in an animal model of neuropathic pain. Exp Neurol, 2004,188(1): 139 ~ 148.
[13]Kung JC, Su NM, Fan RJ,et al. Contribution of the anterior cingulate cortex to laser-pain conditioning in rats. Brain Res, 2003, 970(1-2): 58 ~ 72.
[14]李振华, 杨洋, 侯苗苗, 等. 在体多通道电生理记录技术在大鼠痛情绪研究中的应用. 中国应用生理学杂志 , 2016, 32: 41 ~ 45.
[15]任文华, 周东, 贾楠, 等. 前扣带皮层吻侧部的NMDA受体亚单位NR2A与NR2B参与疼痛相关厌恶情绪. 中国神经科学学会第四次会员代表大会暨第七届全国学术会议, 2007, 156 ~ 162.
[16]杜俊英, 温存, 邵晓梅, 等. 前扣带皮层区域磷酸激酶Czeta在弗氏完全佐剂致炎性痛大鼠情绪反应中的作用. 中国实验动物学报, 2016, 24: 414 ~ 421.
[17]Alexandre JP, Nicolas B, Hélène B,et al. Increased Anxiety-Like Behaviors in Rats Experiencing Chronic In fl ammatory Pain. Behav Brain Res, 2012, 229(1): 5 ~ 6.
[18]曹红. 大鼠前扣带皮层ERK/MAPK信号通路参与痛厌恶情绪的胞内机制. 复旦大学生命科学学院,2008: 50 ~ 63.
[19]Le Alexander M, Lee Michelle, Su Chen,et al.AMPA kines have novel analgesic properties in rat models of persistent neuropathic and inflammatory pain,Anesthesiology, 2014, 121(5): 1080 ~ 1090.
[20]Hasnie FS, Breuer J, Parker S,et al.Further characterisation of a rat model of varicella zoster virus(VZV)-associated pain: relationship between mechanical hypersensitivity and anxiety-related behaviour;and the in fl uence of analgesic drugs. Neuroscience, 2007, 144(4):1495 ~ 1508.
[21]Bravo L, Mico JA, Rey-Brea R,et al.Depressive-like States Heighten the Aversion to Painful Stimuli in a Rat Model of Comorbid Chronic Pain and Depression,Anesthesiology, 2012, 117(3): 613 ~ 625.
[22]李倩. NALP1炎症小体在大鼠神经痛及痛情绪中的作用及电针缓解痛情绪作用观察. 复旦大学基础医学院 , 2014: 50 ~ 53.
[23]王锦琰, 罗非, 韩济生. 前扣带回在痛感知中的作用.中国疼痛医学杂志, 2004, 10(2): 113 ~ 116.
[24]Min Z. Neural Mechanisms Underlying Anxiety-Chronic Pain Interactions. Trends in Neurosciences, 2016, 39(3):139.
[25]张玉秋, 高永静, 赵志奇. 大鼠吻侧前扣带皮层的传入投射纤维联系——荧光金逆行追踪法研究. 神经解剖学杂志, 2005, 21(4): 355 ~ 359.
[26]Gao YJ, Ren WH, Zhang YQ. Contributions of the anterior cingulate cortex and amygdala to pain and fear conditioned place avoidance in rats. Pain, 2004, 110(1-2): 343 ~ 353.
[27]王学斌, 张德宽. 前扣带皮层的痛觉感知作用. 神经解剖学杂志, 2011, 27(3): 349 ~ 352.
[28]Johansen JP, Field HL, Manning BH. The affective component of pain in rodents: direct evidence for a contribution of the anterior cingulate cortex. Proc Natl Acad SciUSA, 2001, 98: 8077 ~ 8082.
[29]高永静. 大鼠前扣带皮层参与痛厌恶情绪的神经机制研究, 复旦大学神经生物学研究所, 2004.
[30]Donahue RR, La Graize SC, Fuchs PN. Electrolytic lesions of the anterior cingulate cortex decreases in fl ammatory, but not neuropathic nociceptive behavior in rats. Brain Res,2001, 897:131 ~ 138.
[31]Hernandez AI, Blace N, Crary JF,et al. Protein kinase M zeta synthesis from a brain mRNA encoding an independent protein kinase C zeta catalytic domain. BiolChem, 2003,278(41): 40305 ~ 40316.
[32]郭丽霞, 林春. 蛋白激酶Mζ在慢性疼痛中作用的研究进展. 中国疼痛医学杂志, 2014, 20: 51.
[33]Zhuo M. Cortical excitation and chronic pain. Trends Neurosci, 2008, 31(4): 199 ~ 207.
[34]Zhuo M. A synaptic model for pain: Long-term potentiation in the anterior cingulate cortex. Mol Cell, 2007,23(3): 259 ~ 271.
[35]Sandkuhler J. Understanding LTP in pain pathways.Mol Pain, 2007, 3( 9): 1~ 9.
[36]Li XY, Ko HG, Chen T,et al. Alleviating Neuropathic Pain Hypersensitivity by Inhibiting PKMζin the Anterior Cingulate Cortex. Science, 2010, 330(6009): 1400 ~ 1404.
[37]李冬青. 谷氨酸在慢性痛中的作用探讨. 中国医疗前沿杂志, 2009, 4(20): 17 ~ 19.
[38]雷留根. 痛厌恶“情绪”的神经机制——相关的中枢结构及谷氨酸受体. 中国科学院, 2003: 37 ~ 41.
[39]任文华. 大鼠前扣带皮层吻侧部NMDA受体在痛厌恶情绪形成中的作用. 复旦大学神经生物学研究所,2007: 29 ~ 40.
[40]Wu LJ, Zhao MG, Toyoda H,et al. Kainate receptormediated synaptic transmission in the adult anterior cingulate cortex. Neurophysiol, 2005, 94(3): 1805 ~ 1813.
[41]Adamec RE, Burton P, Shallow T,et al. NMDA receptors mediate lasting increases in anxiety-like behavior produced by the stress of predator exposure-implications for anxiety associated with posttraumatic stress disorder.Physiol Behav, 1998, 65(4 -5): 723 ~ 737.
[42]Wang H, Xu H, Wu LJ,et al. Identi fi cation of an Adenylyl Cyclase Inhibitor for Treating Neuropathic and In fl ammatory Pain. Pain, 2011, 3(65): 2.
[43]Zhuo M. Long-term potentiation in the anterior cingulate cortex and chronic pain. Philos TR Society, 2014, 369:1~9.
[44]Toyoda H, hao MG, lzhöfer B.et al. Roles of the AMPA receptor subunitGluA1 but notGluA2 in synaptic potentiation and activation of ERK in theanterior cingulate cortex. Mol Pain, 2009, 5(46): 1 ~ 15.
[45]Ling DS, Benerdo LS, Serrano PA,et al. Protein kinase Mζ is necessary and suf fi cient for LTP maintenance.Nature Neurosci, 2002, 5(4): 295 ~ 296.
[46]Pastalkova E, Serrano P, Pinkhasova D,et al. Storage of spatial information by the maintenance mechanism of LTP. Science, 2006, 313(5790): 1141 ~ 1144.
[47]Sacktor TC, Mzeta PK. LTP maintenance and the dynamic molecular biology of memory storage. Prog Brain Res, 2008, 169: 27 ~ 40.
[48]Volk LJ, Bachman JL, Johnson R,et al. PKM-ζ is not required for hippocampal synaptic plasticity, learning and memory. Nature, 2013, 493(7432): 1 ~ 12.
[49]Zhang H, Etherington LA, Hafner AS,et al. Regulation of AMPA receptor surface trafficking and synaptic plasticity by a cognitive enhancer and antidepressant molecule. Mol Psychiatry, 2013, 18(4): 471 ~ 484.
[50]张玉秋. 前扣带皮层参与痛情绪和相关记忆过程的神经机制. 中华医学会疼痛学分会.中华医学会疼痛学分会第六届年会论文摘要, 2005, 1.
[51]罗小青, 林春. 突触可塑性在慢性痛发病中的作用研究进展,福建医科大学学报, 2013, 47(5) : 327.
10.3969/j.issn.1006-9852.2017.05.010
浙江省自然科学基金(LQ15H270003, LY15H270009);国家自然科学基金(81574056);中国博士后科学基金(2016T90552);浙江省科技厅公益性(实验动物平台)(2016C37135);浙江省医药卫生科技项目一般项目(2015KYB281)
△通讯作者 dujunying0706@163.com
