草地早熟禾叶片和根颈对低温胁迫的生理响应
2017-11-17田彦锋白小明陈润娟甘肃农业大学草业学院草业生态系统教育部重点实验室甘肃省草业工程实验室美草地畜牧业可持续发展研究中心甘肃兰州730070
田彦锋,白小明,陈润娟,陈 辉(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
草地早熟禾叶片和根颈对低温胁迫的生理响应
田彦锋,白小明,陈润娟,陈 辉
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
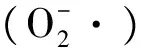
草地早熟禾;低温胁迫;叶片;茎;生理响应
温度作为生物机能的一种动力,影响植物的所有酶促反应和生长发育,它从根本上限制着一个草种在寒冷地区的生存和繁衍[1]。我国北方冬季寒冷,低温成为影响草坪绿期和越冬的主要限制性因素。因此,提高草坪草抗寒性,延长草坪绿期成为目前北方草坪业发展面临的一大难题[2]。
草坪植物的不同营养器官具有不同的抗寒性,Dunn等[3]发现,狗牙根根状茎的抗寒性较匍匐茎差,而Rogers等[4]的研究表明,结缕草Maye的匍匐茎和根状茎的抗寒性相当。也有研究报道,草坪草根茎在低温处理下电解质透出率的变化趋势同叶片大致相同,但根茎变化较缓慢,同一植株的不同器官(叶片、根茎、根)在抗寒锻炼的过程中,各项生理指标的变化不同步,不同植物不同部位之间的抗寒性差异各不相同。有研究报道,兰引3号结缕草、阳江狗牙根和假俭草3种暖季型草坪草的抗寒性均为越冬器官(兰引3号结缕草地下茎、阳江狗牙根地下茎、假俭草地上茎)表现出较强的耐受低温能力。对于草坪植物而言,叶和越冬器官的抗寒性同等重要,叶器官的抗寒性决定了冷地型草坪植物绿期的长短,越冬器官的抗寒性大小决定着草坪植物的返青状况。为此,试验通过研究低温胁迫对草地早熟禾叶片和根茎生理特性的影响,探讨草地早熟禾不同器官对低温胁迫的响应机制,以期为北方地区草地早熟禾草坪的养护管理提供依据。
1 材料和方法
1.1试验材料
试验材料为采自甘肃省定西市安定区的野生草地早熟禾,采集地生境多为山坡,海拔2 490 m,地理坐标N 35°20′41″,E 104°05′26″。
1.2试验设计
试验材料采用盆栽沙培方式在甘肃农业大学草坪试验地培育,花盆直径11 cm,深11 cm,每盆装经过清洗的中细沙0.9 kg,理论播种量15 g/m2。2015年5月播种,用霍格兰完全营养液培养。
试验材料生长4个月后,修剪至8 cm,置于4℃恒温(相对湿度68%~75%、光强3 500~4 000 lx、光照时数12 h/d,黑暗12 h/d)智能型光照培养箱,低温胁迫处理12 d,每隔2 d取叶片和根颈(与根系连接处以上1 cm)测定相关生理指标,以处理0 d(即20 ℃常温)为对照(CK),每个处理3次重复。
1.3测定指标及方法
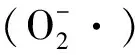
2 结果与分析
2.1低温胁迫对草地早熟禾叶片和根颈Pro含量的影响
随低温胁迫时间延长,草地早熟禾叶片和根颈Pro含量均逐渐增加(图1)。胁迫4 d后叶片Pro含量显著高于CK(P<0.05),胁迫6 d后根颈Pro含量显著高于前4 d(P<0.05),第12 d分别达到344.5 μg/g和221.6 μg/g,较CK增加79.6%和31.8%。

图1 低温胁迫处理下草地早熟禾叶片和根颈Pro的含量Fig.1 Effects of cold stress on Pro contents of leaf and root collar of kentucky bluegrass注:不同小写字母表示同一器官不同处理间差异显著(P<0.05);下同
2.2低温胁迫对草地早熟禾叶片和根颈SS含量的影响
草地早熟禾叶片和根颈中SS含量随低温胁迫时间的延长逐渐增加(图2),处理前期,SS含量缓慢增长,叶片处理6 d、根颈处理10 d后SS含量急剧上升(P<0.05)。12 d时,叶片和根颈SS含量分别达5.08%和4.26%,比CK增加107.7%和62.6%,叶片增幅明显高于根颈。

图2 低温胁迫下草地早熟禾叶片和根颈SS的含量Fig.2 Effect of SS content in leaf and root collar of kentucky bluegrass under cold stress
2.3低温胁迫对草地早熟禾叶片和根颈SP含量的影响
随低温胁迫时间的延长,草地早熟禾叶片和根颈SP含量先上升后下降。胁迫2 d叶片和根颈SP含量与CK差异不显著(P>0.05),叶片在胁迫4 d、根颈在胁迫8 d时SP含量显著高于CK(P<0.05);8 d时均达最大值,分别为9.18 mg/g和7.27 mg/g,比CK增加37.6%和21%,胁迫12 d时SP含量显著低于胁迫8 d(P<0.05),但与CK差异不显著(P>0.05)(图3)。

图3 低温胁迫处理下草地早熟禾叶片和茎SP的含量Fig.3 Effect of SP content in leaf and root collar of kentucky bluegrass under cold stress
2.4低温胁迫对草地早熟禾叶片和根颈MDA含量的影响
随胁迫时间的延长,草地早熟禾叶片和根颈MDA含量均呈先增加后降低的趋势(图4),处理8 d时最大,分别为8.83和5.29 μmol/g,与CK相比,叶片的增幅大于根颈。叶片胁迫10 d、根颈胁迫12 d时MDA含量又迅速下降(P<0.05),但第12 d时叶片MDA含量仍显著高于CK,而茎MDA含量与CK差异不显著(P>0.05)。

图4 低温胁迫处理下草地早熟禾叶片和根颈MDA的含量Fig.4 Effect of MDA content in leaf and root collar of kentucky bluegrass under cold stress
2.5低温胁迫对草地早熟禾叶片和根颈SOD活性的影响
草地早熟禾叶片和根颈SOD活性均随低温胁迫时间的延长先上升后下降(图5),且分别在胁迫第2 d和第6 d时显著高于CK(P<0.05),第8 d均达到峰值,分别为91.1和80.5 μ/g,比CK提高39.8%和28.0%,之后逐渐下降,叶片在胁迫第10 d、根颈在胁迫第12 d时均显著下降(P<0.05)。

图5 低温胁迫处理下草地早熟禾叶片和根颈SOD的活性Fig.5 Effect of SOD activity in leaf and root collar of kentucky bluegrass under cold stress
2.6低温胁迫对草地早熟禾叶片和根颈CAT活性的影响
随低温胁迫时间的延长,草地早熟禾叶片和根颈CAT活性均呈先上升后下降的趋势(图6),且分别在胁迫第6 d和第8 d显著高于CK(P<0.05),第8 d CAT活性均最大,分别为95.0和81.0 μg/min,比CK提高了30.1%和26.6%,第12 d时平均显著下降(P<0.05),接近CK的活性(P>0.05)。
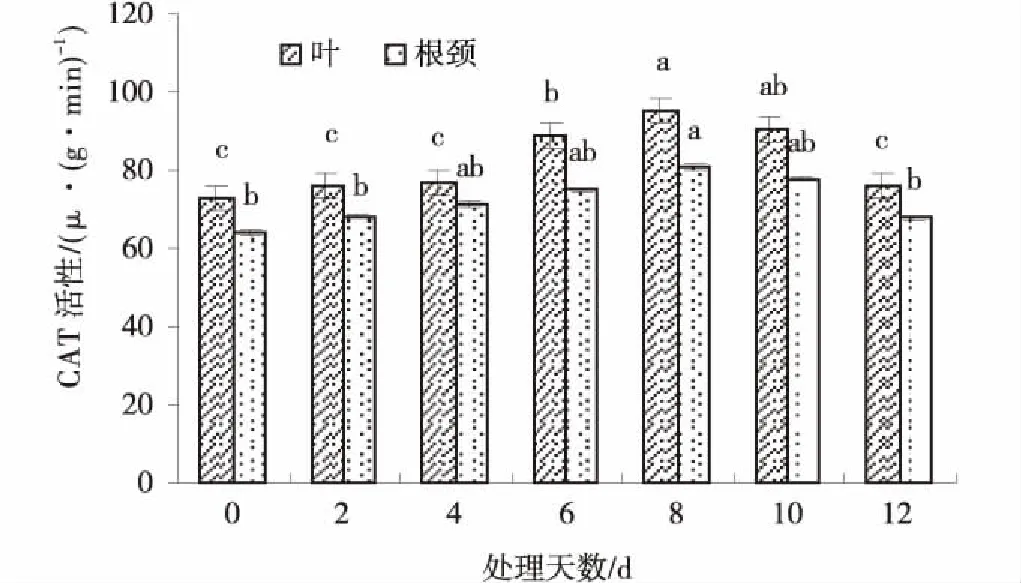
图6 低温胁迫处理下草地早熟禾叶片和根颈CAT的活性Fig.6 Effect of CAT activity in leaf and root collar of kentucky bluegrass under cold stress
2.7低温胁迫对草地早熟禾叶片和根颈POD活性的影响
草地早熟禾叶片和根颈POD活性均随低温胁迫时间的延长先上升后下降(图7),且分别在胁迫2 d和8 d时显著高于对CK(P<0.05),第8 d POD活性均最强,分别为12.48和11.31 μg/min,比CK提高了64.9%和84.8%,第12 d时均显著下降(P<0.05),但与CK差异不显著(P>0.05)。
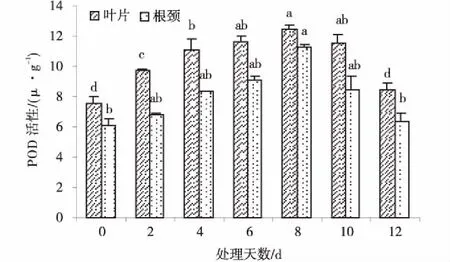
图7 低温胁迫处理下草地早熟禾叶片和茎POD的活性Fig.7 Effect of POD activity in leaf and root collar of kentucky bluegrass under cold stress
2.8低温胁迫对草地早熟禾叶片和根颈·OH含量的影响
随低温胁迫时间的延长,草地早熟禾叶片和根颈·OH含量均先增加后下降(图8)。叶片·OH含量在第4 d时显著高于CK(P<0.05),根颈增加较平缓,第8 d时才显著高于CK(P<0.05),二者·OH含量均在第8 d时最高,分别为2.46和1.86 A/g,比CK增加了103.3%和84.2%。试验到第12 d时均显著下降(P<0.05),但与CK差异不显著(P>0.05)。

图8 低温胁迫处理下草地早熟禾叶片和根颈·OH的含量Fig.8 Effect of ·OH content in leaf and root collar of kentucky bluegrass under cold stress
2.9低温胁迫对草地早熟禾叶片和根颈H2O2含量的影响
草地早熟禾叶片和根颈H2O2含量均随低温胁迫时间的延长呈先上升后下降的趋势(图9),第8 d达最大,分别为20.25和10.85 μmol/g,比CK增加了52.6%和34.0%。处理第12 d,叶片和根颈H2O2含量均显著下降(P<0.05),但叶片H2O2含量仍显著高于CK(P<0.05),而根颈H2O2含量与CK差异不显著(P>0.05)。
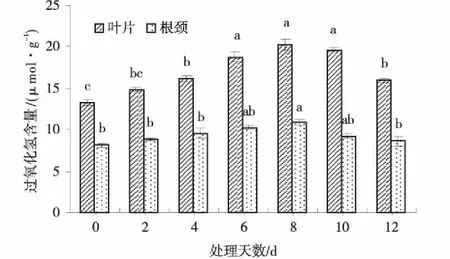
图9 低温胁迫处理下草地早熟禾叶片和根颈H2O2的含量Fig.9 Effect of H2O2 content in leaf and root collar of kentucky bluegrass under cold stress

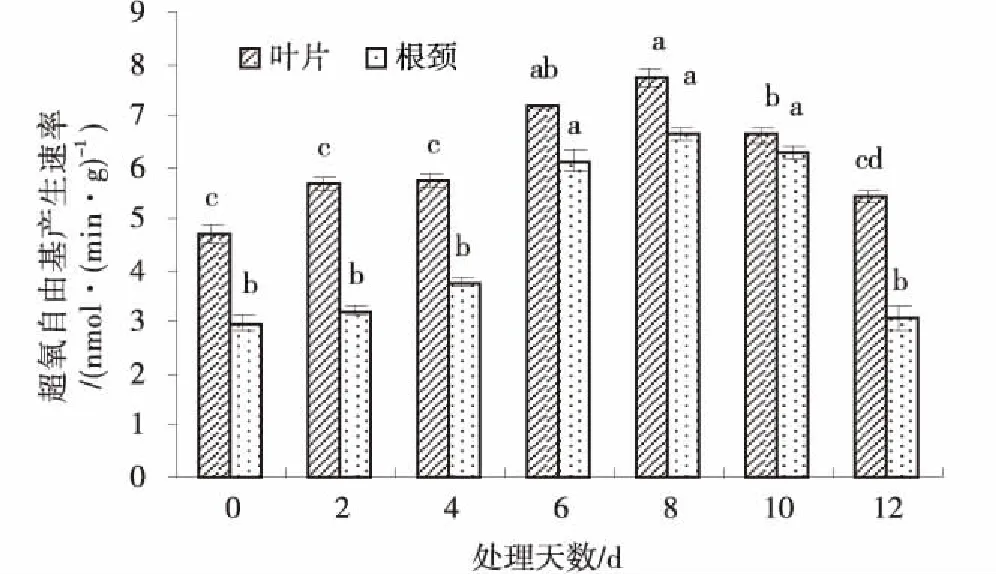
图10 低温胁迫处理下草地早熟禾叶片和根颈O2-·的产生速率Fig.10 Effect of O2- production rate of leaf and root collar of kentucky bluegrass under cold stress
3 讨论
植物体内Pro和SS含量的增加有利于提高抗寒性,低温胁迫后,由于蛋白质合成和氧化受阻,或是蛋白质的降解加快,导致植物Pro含量迅速升高,降低了细胞水势,避免冻害的发生,同时大多数淀粉被水解为SS,增加了植物细胞液浓度,增强细胞液的流动性和原生质粘性,从而提高植物抗寒性[12-15]。有学者研究报道,低温条件下草坪草Pro和SS含量与不同器官的抗冷性以及植物受伤害程度呈正相关[1,16-19]]。SP的含量与植物的抗冷性之间也存在着密切的关系,林善枝等[20]对杨树幼苗的耐寒性研究发现,SP在低温条件下含量增加,随着温度持续降低,SP含量又有所下降。初期低温胁迫SP含量的增加可能是逆境下新的蛋白质合成的结果,随着低温胁迫时间的延长,蛋白质合成受阻,SP含量下降。MDA含量的变化也是反映低温胁迫下质膜稳定性和植物抗寒性的一个重要指标。低温胁迫下MDA含量的增加,降低了抗氧化物的含量和抑制了细胞保护酶活性[21-22],而且MDA本身也是具有细胞毒性的物质,加剧了细胞膜结构的破坏,从而降低植物的抗寒性。本研究表明,低温胁迫使草地早熟禾叶片和根颈SS和Pro含量不断增加,而SP和MDA含量随着低温胁迫时间的延长先增加后下降,第8 d时均达峰值,低温胁迫后SP和MDA含量均显著高于对照,而后期两者含量下降可能是草地早熟禾在低温环境中经过一段时间锻炼后,对低温环境有了一定的适应能力。
植物遭受低温胁迫时,O2-·不断增加,刺激SOD活性增强,但当温度降低到一定程度时,SOD和CAT活性出现钝化现象,两者的活性均迅速下降,细胞内自由基产生和清除所处的平衡状态被打破,H2O2大量积累,而H2O2的积累会导致毒性更大的·OH含量增加,细胞受损,进而对植物造成伤害[23]。梁慧敏等[24]研究发现,5℃低温几小时后,草地早熟禾SOD和CAT活性升高,4 h达最大,之后逐渐降低。试验发现,低温胁迫下草地早熟禾叶片和根颈SOD,POD和CAT活性和H2O2、·OH含量及O2-·产生速率均呈先增加后下降的趋势,第8 d时达峰值。
植物不同器官抗寒性不同,有人研究认为,同一植株的不同部位(叶片、根颈和地下茎)在抗寒锻炼的过程中,体内各项生理指标的变化不同步,且根茎SS含量等部分生理指标的增幅远大于叶片[7]。对于草坪植物而言,叶器官的抗寒性决定其绿期的长短,而越冬器官的抗寒性则决定了草坪植物的返青率,研究认为,阳江狗牙根和假俭草地上茎的抗寒性大于叶片。不同器官的抗寒遗传特性不仅与其自身形态结构特征(如叶片组织结构、茎的组织结构和花器官组织结构等)有关,而且取决于器官内部的生理生化活动[25]。研究表明,草地早熟禾叶片和根颈的各项生理指标随着温度的降低呈现相似的变化规律,SS和Pro含量逐渐增大,其余指标先增大后降低,均在第8 d达峰值,叶片的变化幅度大于根颈。因为植物不同器官忍受低温的能力不同,叶片、茎等暴露在空气中的这些器官与其他的器官相比受到低温的影响最大,最能反应植物对逆境的适应特点[26-27],同时叶片中叶绿体是细胞对低温最敏感的细胞器;而根颈部分被叶鞘包被,部分在土壤中,受低温胁迫影响较小,受到低温伤害也迟于叶片,故根颈比叶片抗寒性强。
4 结论
随低温胁迫时间的延长,草地早熟禾叶片和根颈Pro、SS含量逐渐增加;SP、MDA、H2O2、·OH含量和O2-·产生速率及CAT,POD和SOD活性均呈现先增加后降低的趋势,第8 d时达峰值;叶片各项生理指标的变化幅度均大于根颈,对低温胁迫较根颈敏感。
[1] 张国珍,肖向阳.八种引种草坪植物的抗寒性比较研究[J].植物研究,1997,17(2):202-203.
[2] 黄亮亮,刘晓静,张德罡,等.不同水肥处理对冷季型草坪草返青的影响[J].草原与草坪,2005(2):46-49.
[3] Dunn J H,Nelson C J.Chemical changes occurring in three Bermuda grass turf cultivars relationship to cold hardiness[J].Agron J,1974,66:28-31.
[4] Rogers R A,Dunn J H,Nelson C J.Cold hardeningand carbohydrate composition of Meyer Zoysia[J].Agron J,1975,67:836-838.
[5] 邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000.
[6] Giannopolitis C N,Ries S K.Superoxide dismutases.Occurrence in higher plants[J].Plant Physiology,1977,59:309-314.
[7] Beers Jr R F,Sizer I W.A spectrophotometric method for measuring the breakdown of hydrogen peroxide by catalase[J].Journal of Biological Chemistry,1952,195:133-140.
[8] Urbanek H,Kuzniak-Gebarowaka E,Herka.Elicatation of defense responses in bean leaves by Botrytis cinerea polygalac-turonase[J].Acta Physiologic Plant arum,1991,13:43-50.
[9] 曹宗巽,吴相钰.植物生理学(下册)[M].北京:人民教育出版社,1980.
[10] Velikova V,Yordanov I,Edreva A.Oxidative stress and some antioxidant systems in acid rain -treated bean plants[J].Plant Science,2000(151):59-66.
[11] Halliwell B,Grootveld M,Cutteridge J M C.Methods for the measurement of hydroxyl radicals in biochemical systems:deoxyribose degradation and aromatic hydroxylation[J].Methods Biochem Anal,1988,33:59-90.
[12] 彭艳华,刘成运,卢大炎,等.低温胁迫下凤眼莲叶片的适应[J].武汉植物学研究,1992,10(2):123-127
[13] 董爱玲,颉建明,李杰,等.低温驯化对低温胁迫下茄子幼苗生理活性的影响[J].甘肃农业大学学报,2017,52(1):74-79.
[14] 王静,杨持.冷篙耐寒生理特性的研究[J].内蒙古大学学报(自然科学版),2002,33(6):67-69.
[15] 龚明,刘友良,朱培仁,等.低温下稻苗叶片中蛋白质及游离脯氨酸的变化[J].植物生理学通讯,1989(4):18-22
[16] 盛浩,代恩汝,周萍,等.亚热带城效草坪土壤呼吸对春季天气变化的响应[J].土壤,2014(2):308-312.
[17] 卢少云,郭振飞.草坪草逆境生理研究进展[J].草业学报,2003,12(4):7-13.
[18] 池春玉,丁国华,连永权,等.低温胁迫对三种冷季型草坪草脯氨酸含量及膜透性的影响[J].中国农学通报,2007,23(1):101-104,
[19] Bush E,Wilson P,Shepard D,Freezing tolerance and nonstructural carbohydrate composition of carper grass Hort Sci,2003,35(2):187-189
[20] 林善枝,李雪平,张志毅,等.低温锻炼对毛白杨幼苗抗冻性和总可溶性蛋白质的影响[J].林业科学,2002,38(6)137-141.
[21] 杨建民,孟庆瑞,彭伟秀,等.冰核细菌对杏花器官抗寒性的影响[J].园艺学报,2002,29(1):20-24.
[22] 杜永吉.兰引3号结缕草抗寒性的研究[D].石河子:石河子大学,2007.
[23] 吕成群,黄宝灵.低温下硼对巨尾按叶片膜脂过氧化及体内保护系统的影响[J].热带亚热带植物学报,2003,11(3):217-222.
[24] 梁慧敏,夏阳,杜峰,等.低温胁迫对草地早熟禾抗性生理生化指标的影响[J].草地学报,2001,9(4):283-286.
[25] 赵伟,陈雅君,高阳,等.白三叶品种组织结构与抗寒性的关系[J].草地学报,2008,16(3):234-238.
[26] 刘琳,毛凯,干友民,等.暖地型草坪草抗寒性的研究概况[J].草原与草坪,2004(1):53-58.
[27] 徐娜.低温胁迫对锦熟黄杨生理特性的影响[D].哈尔滨:东北林业大学,2007.
Physiologicalresponseofleafandrootcollarofkentuckybluegrasstocoldstress
TIAN Yan-feng,BAI Xiao-ming,CHEN Run-juan,CHEN Hui
(CollegeofPrataculturalScience,GansuAgriculturalUniversity/KeyLaboratoryofGrasslandEcosystem,MinistryofEducation/PrataculturalEngineeringLaboratoryofGansuProvince/Sino-U.S.CentersforGrazinglandEcosystemSustainability,Lanzhou730070,China)

kentucky bluegrass;cold Stress;leaf;root collar;physiological response
S 688.4
A
1009-5500(2017)05-0047-06
2017-03-06;
2017-03-28
国家自然科学基金(31560667);甘肃农业大学校级自列课题(GSAU-ZL-2015-054)资助
田彦锋(1990-),男,甘肃环县人,硕士研究生。
E-mail:1058134044@qq.com
白小明为通讯作者。
