AMF对紫花苜蓿抗盐生理特性的影响
2017-11-17郑爱琴马玉一张永志王永新朱慧森许庆方郝鲜俊高文俊山西农业大学动物科技学院山西太谷030801
李 倩,郑爱琴,马玉一、张永志,王永新、朱慧森、许庆方、郝鲜俊、高文俊(山西农业大学 动物科技学院,山西 太谷 030801))
AMF对紫花苜蓿抗盐生理特性的影响
李 倩,郑爱琴,马玉一、张永志,王永新、朱慧森、许庆方、郝鲜俊、高文俊
(山西农业大学 动物科技学院,山西 太谷 030801))
试验选用3种丛枝菌根真菌(AMF)接种苜蓿品种金皇后,研究了5个梯度NaCl(0、50、100、150和200 mmol/L)对金皇后苜蓿抗盐生理特性的影响。结果表明:金皇后苜蓿的脯氨酸含量和可溶性糖含量随着NaCl浓度的增加总体呈先升高后降低的趋势,在100 mmol/L NaCl处理下达到最高,接种Gm真菌的二者含量分别为6.37和1.91 μg /g;金皇后丙二醛(MDA)含量随着NaCl浓度的增加呈升高趋势,且在4个NaCl浓度之间差异显著;超氧化物歧化酶(SOD)和过氧化物酶(POD)活性随着NaCl浓度的增加呈先升高后降低的趋势,在150 mmol/L NaCl处理下二者活性下降,接种Gm真菌的2种抗氧化酶活性分别比处理组下降了48.48%和43.71%;同时金皇后在盐环境下光合指标的变化幅度较大,其中Ci随着NaCl浓度的增加而增加,Pn,Gs和Tr随着NaCl浓度的增加而下降;金皇后最大耐盐程度为150 mmol/L NaCl,且接种摩西球囊霉(Gm)效果优于幼套球囊酶(Ge)和根内球囊霉(Gi)。
金皇后苜蓿;丛枝菌根真菌;NaCl;耐盐性
土壤盐碱化是一种非常重要的非生物胁迫,严重影响全球农牧业的发展[1]。丛枝菌根真菌(AMF)与植物形成的共生体作为生态系统的有机组成部分,因其形成的广泛性,能在盐碱地中与不少植物形成共生关系,缓解盐害和高盐对植物根系的氧化伤害[2]。在盐胁迫条件下,接种丛枝菌根真菌(AMF)能提高植物的生长量[3],并通过改变植物对矿质元素、水分的吸收,从而改善磷营养条件、提高植株水势[4],并且增强植物稳定渗透能力、植株抗氧化能力,影响植物光合作用、分子表达量、根系结构等。同时Ruizlozano等[5]研究证实,菌丝吸收的水分能够减轻植物在生理干旱条件下的受害程度,增强植物根系活性,改善代谢情况。因此,通过接种AMF对增强植物抗盐能力具有不可忽视的生态调节作用[6],同时为盐碱地的改良提供依据[7]。
苜蓿的筛选和种植被认为是提高盐碱地利用率,改良盐碱地的最有效措施之一[8-9]。金皇后紫花苜蓿(Medicagosativacv.Golden Empress)作为由美国引进的多年生豆科苜蓿属优质牧草,根系发达,主根粗长,侧根多根瘤,能固定土壤和空气中的氮,具有抗逆性强,营养成分丰富,营养价值高等优点。但金皇后在高盐胁迫下,生长水平容易受到抑制,影响正常的生理代谢。通过对金皇后接种AMF,研究其细胞渗透性、抗氧化系统以及光合特性,探讨AMF在盐胁迫下与金皇后形成共生,提高金皇后耐盐性的生理特性。
1 材料和方法
1.1供试材料
AMF购买自北京市农林科学院植物与资源研究所BGC菌种库,包括幼套球囊霉(Glomusetunicatum,简称Ge) 编号BGC NM03F、摩西球囊霉(Glomusmosseae,简称Gm)编号BGC NM03D、根内球囊霉(Glomusintraradices,简称Gi)编号BGC JX04B。菌剂先由玉米3个月扩繁处理,将含有菌根真菌孢子、根外菌丝体以及侵染根段的根土混合物作为接种菌剂。紫花苜蓿金皇后种子购买自中国农业科学院畜牧研究所。
1.2试验方法
选取大小一致的种子,在75%酒精溶液中浸泡5~10 min,然后用蒸馏水冲洗数次,经光照培养箱过夜催芽处理后播种。基质选择采用按3∶1比例混合后的河沙和土壤,装布袋,在121℃下蒸汽灭菌2 h,取出晾凉后,重复1次,以确保基质中不含任何真菌孢子。试验基质的层次从下到上为灭菌基质,接种菌根,灭菌基质。每个盆栽接种菌根20~30 g。每7 d调换盆栽位置,确保生长条件相同。种子出苗后,每7 d浇1次Hoagland营养液。
1.3试验设计
采用盆栽方式,在山西农业大学牧草站草学实验站进行。试验设NaCl浓度为0、50、100、150、200 mmol/L 5个梯度,4个重复。为了避免盐浓度太高对植物造成损害,NaCl的浓度每日递增50 mmol/L,直到最终处理浓度。苜蓿种子出苗后间苗20株,生长15 d后进行盐胁迫处理。30 d后进行光合指标的测定。无菌对照分别用不同菌种基质滤液做对照,使其与菌种基质保持一样的微生物群落。
1.4测定项目
1.4.1 光合作用指标测定 盐胁迫处理30 d,采用Ui-6400便携式光合仪,在9∶00~11∶00(晴天)采用自然光源对紫花苜蓿进行盆栽活体测定,测定其净光合速率(Pn)、蒸腾速率(Tr)、二氧化碳浓度(Ci)、气孔导度(Gs)等光合生理指标。
1.4.2 生理指标测定 脯氨酸含量参照文献[10]的方法测定;可溶性糖含量用蒽酮比色法测定;可溶性蛋白含量参照文献[11]的方法测定;过氧化物酶(POD)活性参照文献[12]的方法测定;超氧化物歧化酶(SOD)活性参照文献[13]的方法测定;丙二醛(MDA)含量参照文献[14-15]采用硫代巴比妥酸法(TBA)测定。
1.5数据处理方法
实验数据用SAS 9.0进行统计分析,采用Microsoft Excel 2013制表。
2 结果与分析
2.1不同浓度NaCl胁迫下接种AMF对金皇后苜蓿渗透调节物质及膜脂过氧化的影响
2.1.1 不同NaCl浓度下接种AMF对金皇后苜蓿脯氨酸含量的影响 金皇后脯氨酸含量随着NaCl浓度的增加呈先上升后下降的趋势(表1),且每个处理与对照相比有显著性差异,接种AMF的金皇后脯氨酸含量都显著低于未接种处理。在100 mmol/L NaCl处理下,金皇后脯氨酸含量达到最高。在150 mmol/L NaCl处理下,金皇后脯氨酸含量急剧减少,不接种处理地上部分下降了31.31%,接种Gm,Ge和Gi地上部分分别下降了42.16%,38.13%和36.61%。相同盐胁迫浓度条件下,金皇后地上部分的脯氨酸含量显著高于地下部分。且Gm与Ge、Gi在不同NaCl处理下差异显著,Ge与Gi之间差异不显著。

表1 接种AMF与NaCl胁迫处理下金皇后苜蓿的脯氨酸含量
注:差异性是接种及未接种之间的比较,表中同列不同大写字母标注表示差异极显著(P<0.01),小写字母表示差异显著(P<0.05),下同
2.1.2 不同浓度NaCl胁迫下接种AMF对金皇后苜蓿可溶性糖含量的影响 随着NaCl浓度的增加,金皇后中的可溶性糖含量(SS)呈先升高后下降的趋势(表2),在100 mmol/L NaCl处理下达到最高,接种Gm真菌的可溶性糖含量达到1.91 μg/g;在150、200 mmol/L NaCl处理下金皇后SS含量下降,可能是由于盐浓度超过植株最适耐盐浓度;相同NaCl胁迫程度,地上部分的SS含量高于地下部分;接种Ge、Gi的金皇后地上部分SS含量在200 mmol/L NaCl处理下与对照组差异不显著,其余各处理与对照组相比显著提高了金皇后SS含量;接种Gm,Ge和Gi的金皇后地下部分分别与对照组相比差异极显著(P<0.01);Ge与Gi之间差异不显著,且Gm中的可溶性糖含量最高。

表2 接种AMF与NaCl胁迫处理下金皇后苜蓿的SS糖含量
2.1.3 不同NaCl浓度胁迫下接种AMF对金皇后苜蓿MDA含量的影响 在各个浓度的NaCl胁迫条件下,植物中的MDA含量随着NaCl浓度的增加呈上升趋势(表3),各个NaCl浓度之间差异显著(P<0.05);相同NaCl胁迫浓度条件下,接种AMF的金皇后MDA含量显著低于对照;且金皇后地下部分MDA含量高于地上部分,说明植物在受到盐胁迫时,根部受到的胁迫程度大于地上部分,大量积累MDA;接种不同种类的AMF中,Gm,Ge和Gi分别与对照组差异极显著(P<0.01),Ge,Gi和Gm差异显著,Ge、Gi之间差异不显著,且接种Gm真菌中的MDA含量最低。

表3 接种AMF与NaCl胁迫处理下金皇后苜蓿的MDA含量
2.2不同NaCl浓度胁迫下接种AMF对金皇后苜蓿抗氧化系统的影响
2.2.1 不同浓度NaCl胁迫下接种AMF对金皇后苜蓿SOD含量的影响 随着盐胁迫程度增加,金皇后的SOD活性呈先升高后下降的趋势(表4),在100 mmol/L NaCl处理下SOD的活性达到最高,接种Gm的SOD活性达到56.12U/g 蛋白质,在150、200 mmol/L NaCl处理下金皇后超氧化物歧化酶活性下降,可能是由于盐浓度超过植株最适耐盐浓度;相同NaCl胁迫下,植株地上部分的SOD活性大于地下部分;且Gm,Ge和Gi的SOD活性分别与对照组相比差异极显著(P<0.01),而Gm的SOD活性显著高于Ge、Gi,且Gm的SOD活性最高。

表4 接种AMF与NaCl胁迫处理下金皇后苜蓿的SOD活性
2.2.2 不同浓度NaCl胁迫下接种AMF对金皇后苜蓿POD含量的影响 金皇后POD活性与SOD变化相似,随着NaCl胁迫程度增加,植物中的POD活性呈先升高后下降的趋势(表5);在100 mmol/L NaCl处理下POD活性达到最高,接种Gm真菌的POD活性达到48.52,在150、200 mmol/L NaCl处理下金皇后POD活性下降;植株地上部分的POD活性大于地下部分;相同NaCl胁迫下,Gm,Ge和Gi分别与对照组差异极显著(P<0.01),Ge、Gi之间差异不明显且Gm显著高于Ge、Gi,接种Gm真菌的POD活性最高。
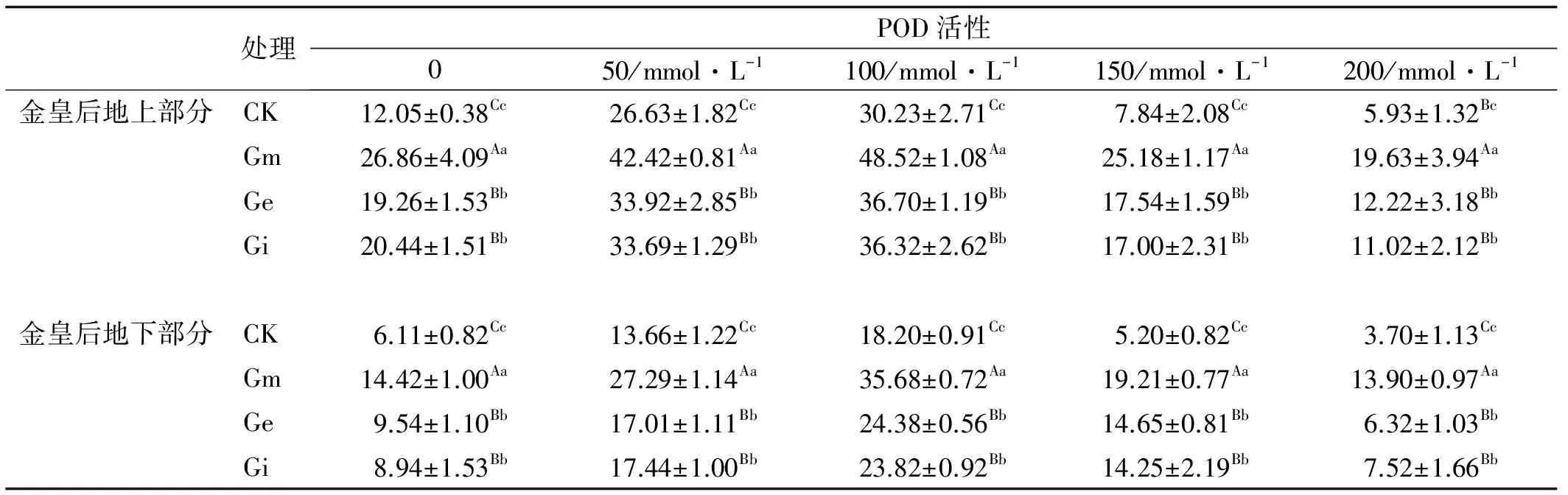
表5 接种AMF与NaCl胁迫处理下金皇后苜蓿的POD活性
2.3不同浓度NaCl胁迫下接种AMF对金皇后苜蓿光合特性的影响
随着盐胁迫程度增加,金皇后的光合速率(Pn),蒸腾速率(Tr)气孔导度(Gs)呈下降趋势,胞间二氧化碳浓度(Ci)呈上升趋势(表6);在0、50 mmol/L NaCl处理下,接种Gm的Pn差异不显著,其他各个浓度之间差异显著;相同NaCl胁迫程度下接种不同种类的AMF的金皇后Tr、Gs显著高于对照;接种AMF的金皇后Ci显著低于对照,且各个NaCl浓度处理下差异显著。相同NaCl处理下,Gm,Ge和Gi与对照组差异极显著(P<0.01),Ge,Gi和Gm差异显著,Ge、Gi之间差异不显著(表6)。

表6 接种AMF与NaCl胁迫处理下金皇后苜蓿的光合参数
3 讨论
3.1不同浓度NaCl胁迫下AMF对金皇后苜蓿渗透调节物质及膜脂过氧化的影响
在盐胁迫的条件下,植物会在细胞中生成各种有机和无机物质来提高植物细胞本身抵抗高渗透压的能力,使植物能够正常生长[16]。试验测定的金皇后苜蓿中脯氨酸、可溶性糖积累在植物细胞后,能减轻植物盐胁迫的伤害程度,并且这些小分子和蛋白质的积累对细胞没有毒害作用[17]。结果表明,接种AMF的金皇后苜蓿的脯氨酸含量可和可溶性糖含量随着NaCl浓度的增加总体呈先升高后降低的趋势,在NaCl浓度达到150 mmol/L时,其生理指标整体下降,并且随着盐胁迫时间的延长,生长水平受到持续抑制;接种AMF后的金皇后苜蓿脯氨酸含量明显降低,由于可溶性糖的含量与渗透胁迫具有很强的关系[18],可溶性糖含量明显升高,说明AMF能有效的调节植物细胞的渗透性。本试验接种Gm,Ge和Gi 3种丛枝菌根真菌,Gm真菌提高植株渗透调节效果优于Ge、Gi,说明接种Gm真菌能有效降低植物中的脯氨酸含量,减少盐胁迫对植物的伤害,调节地下部分的渗透平衡,且有效增加植物中的可溶性糖,通过渗透调节降低水势,维持比较高的渗透压,保持细胞正常生理功能。
膜脂过氧化作用反应了应激细胞的损伤程度,MDA作为脂质过氧化作用的终产物。被广泛的用作逆境中自由基产生和细胞膜损伤的重要指标[19-20]。植物在受到盐胁迫时,O2-和H2O2随着盐浓度的增加而积累,而且随着膜脂过氧化程度的增加,MDA含量增加[21-22]。试验表明,金皇后MDA含量随着NaCl浓度的增加而增加,在200 mmol/L NaCl处理下,MDA含量最高,膜脂过氧化作用最强,很容易对植物造成损伤甚至接近死亡。而接种AMF后的MDA含量显著低于对照,说明AMF在一定程度上降低了高盐胁迫对金皇后的伤害程度,有效保护金皇后苜蓿的膜系统。且接种Gm真菌的金皇后MDA含量显著低于Ge、Gi的MDA含量,接种Gm真菌的效果优于Ge、Gi,说明Gm真菌更能有效降低植物体内MDA积累量,减轻紫花苜蓿受盐害的程度,有效保护金皇后苜蓿的膜系统。
3.2不同浓度NaCl胁迫下AMF对金皇后苜蓿抗氧化酶活性的影响
SOD和POD是植物体内清除活性氧的重要酶。试验结果表明:随着NaCl浓度的增加,SOD、POD的活性逐渐增大,当NaCl浓度达到150 mmol/L,二者含量开始逐渐下降,这与Borde等[23]的研究结果基本一致。SOD、POD活性受盐胁迫上调后,其抗氧化酶活性增加,减弱膜脂过氧化作用[24-25],减轻了盐离子对植株造成的损伤[26]。而土壤中的NaCl浓度较高时,会使植物体活性氧自由基产生速度过快,导致植物体来不及清除新产生的活性氧自由基。这些自由基会破坏细胞的蛋白质、核酸和细胞膜的功能,超出了植物抗氧化系统保护浓度范围,加重了盐分对植物造成的伤害[27-28]。试验接种AM真菌能增强植物抗盐能力,显著提高SOD和POD活性,増强宿主植物体内氧自由基的清除能力,这与张景云等[29]研究结果一致,他们认为盐胁迫下,AMF提高植物的渗透调节机制与抗氧化酶的活性,降低植物细胞膜脂过氧化水平,缓解盐碱胁迫和增强植物的抗盐性。
3.3不同浓度NaCl胁迫下AMF对金皇后苜蓿光合特性的影响
光合作用亦被称为光的生物化学反应过程,很多研究表明盐胁迫条件植物的光合作用效率会下降,主要是由于盐环境有较高的渗透势,Na+浓度的增加导致植物失水,打破了植物体内离子的平衡,破坏其叶绿素的合成,进而直接抑制植物的生长[30]。试验证明了同等NaCl胁迫条件下接种AMF会使植株光合效率上升,虽然植物在受到盐胁迫时的Pn、Tr、Gs、Ci等光合特性变化幅度较大[31],但是接种AMF之后的苜蓿相比未接种AMF的仍能提高植物光合作用,且接种Gm真菌的效果优于Ge、Gi。
4 结论
在盐胁迫条件下,接种AMF可显著提高金皇后苜蓿的抗氧化酶活性,且脯氨酸含量、可溶性糖含量随着NaCl浓度的增加总体呈先升高后降低的趋势,同时接种AMF可降低金皇后苜蓿体内MDA积累量,明显改善植物蒸腾速率等光合作用参数。接种Gm真菌的植物生长状况明显优于接种Gi和Ge的植物,说明苜蓿对Gm真菌的依赖性较高。丛植菌根的运用可以有效改良盐碱地土壤,改善土壤结构,对生态环境保护具有重要意义。
[1] 彭云玲,李伟丽,王坤泽,等.NaCl胁迫对玉米耐盐系与盐敏感系萌发和幼苗生长的影响[J].草业学报,2012,21(4):62-71.
[2] Chien V H,Marco A L G,Yuriko O,etal.Positive regulatory role of strigolactone in plant responses to drought and salt stress[J].Proc Natl Acad Sci USA,2014,111:851-856.
[3] Gupta R,Krishnamurthy K V.Response of mycorrhizal and nonmycorrhizal arachis hypogaea to NaCl and acid stress[J].Mycorrhiza,1996(6):145-149.
[4] 韩志平,张海霞,周凤.盐胁迫对植物的影响以及植物对盐胁迫的适应性[J].山西大同大学学报,2015,31(3):59-62.
[5] Ruizlozano J M,Azlon R,Gomez M.Alleviation of salt stress by arbuscular-mycorrhizal Glomu-s species inLactucasativaplants[J].Physiologia Plant arum,1996,98:767-772.
[6] 任承钢,孔存翠,李岩,等.丛枝菌根真菌-植物共生体耐盐机制的研究进展[J].中国科学(生命科学版),2016(9):1062-1068.
[7] 冯固,张福锁.丛枝菌根真菌对棉花耐盐性的影响研究[J].中国生态农业学报,2003(2):27-30.
[8] 郑普山,郝保平,冯悦晨,等.紫花苜蓿对盐碱地的改良效果[J].山西农业科学,2012,40(11):1204-1206.
[9] 杨真,王宝山.中国盐渍土资源现状及改良利用对策[J].山东农业科学,2015(4):125-130.
[10] Bates L S,Waldren R P,Teare I D.Rapid determination of free proline for water-stress studies[J].Plant and soil,1973,39(1):205-207.
[11] Bradford M M.A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochem-istry,1976,72:248-254.
[12] 李合生.植物生理生化试验原理和技术[M].北京:高等教育出版社,2003.
[13] Giannopolitis C,Ries S.Superoxide dismutases I.Occurrence in higher plants[J].Plant physiology,1977,59(2):309-314.
[14] Puckette M C,Weng H,Mahalingam R.Physiological and biochemical responses to acute ozone-induced oxidative stress inMedicagotruncatula[J].Plant Physiology and Biochemistry,2007,45(1):70-79.
[15] Wang W,Kim Y,Lee H,etal.Analysis of antioxidant enzyme activity during germination ofalfalfa under salt and rought stresses[J].Plant Physiology and Biochemistry,2009,47(7):570-577.
[16] 史湘华,姜国斌,殷鸣放,等.植物体内渗透调节物质及组织结构与耐盐性的关系田[J].内蒙古林业调查设计,2005(6):297.
[17] 付长方,张海艳.盐胁迫对玉米种子萌发、幼苗叶绿素含量和渗透势的影响[J].山东农业科学,2015,47(5):27-30.
[18] Bartels D,Sunkar R.Drought and salt tolerance in plants[J].Critical Reviews in Plant Sciences,2005,24(1):23-58.
[19] 杨海霞,李士美,郭绍霞.丛枝菌根真菌对紫薇耐盐性的影响[J].植物生理学报,2014(9):1379-1386.
[20] Demiral T,Turkan I.Comparative lipid peroxidation,antioxidant defence systems and proline content in roots of two rice cultivars diering in salttolerance[J].J org chem,2005,53(3):247-257.
[21] 陆开行.盐胁迫对大豆光合作用和抗氧化系统的影响及其调控机制[D].杭州:浙江大学,2008:1-143.
[22] 张玉鑫,康恩祥,马凌之,等.NaCl胁迫对甜瓜幼苗叶片膜脂过氧化和渗透调节物质的影响[J].果树学报,2007,24(2):194-198.
[23] 王文,蒋文兰,谢忠奎,等.NaCl胁迫对唐古特白刺幼苗生理指标的影响[J].草地学报,2012,20(5):907-913.
[24] 祝文婷,陈为京,陈建爱.丛枝菌根真菌提高植物抗盐胁迫能力的研究进展[J].湖南农业科学,2013(41):25-29.
[25] Borde M,Dudhane M,Jite P.Growth photosynthetic activity and antioxidant responses of mycorrhizal and non-mycorrhizal bajra(Pennisetumglaucum)crop under salinity stress condition[J].Crop Protection,2011,30(3):265-271.
[26] 张秋芳.盐胁迫对盐生植物叶片SOD及光合特性的效应[D].济南:山东师范大学,2002:1-46.
[27] 王英男.羊草—丛枝菌根共生体对氮沉降与盐碱胁迫互作的生理响应[D].哈尔滨:东北林业大学,2016.
[28] 吕娥娥,周向睿,赵桂琴.NaCl胁迫对蒙古岩黄芪幼苗抗氧化特性的影响[J].草原与草坪,2016(3):42-47.
[29] 张景云,吴凤芝.盐胁迫对黄瓜不同耐盐品种膜脂过氧化及脯氨酸含量的影响[J].中国蔬菜,2007(7):12-15.
[30] 郭鹏,李琳琳,金华,等.盐胁迫下紫花苜蓿突变体形态结构特征和水分利用效率的研究[J].大连民族大学学报,2016(3):193-197.
[31] 裘丽珍,黄有军,黄坚钦,等.不同耐盐性植物在盐胁迫下的生长与生理特性比较研究[J].浙江大学学报(农业与生命科学版),2006(4):420-427.
EffectofAMFonsaltresistancecharacteristicsofalfalfa
LI Qian,ZHENG Ai-qin,MA Yu-yi,ZHANG Yong-zhi,WANG Yong-xin,ZHU Hui-sen,XU Qing-fang,HAO Xian-jun,GAO Wen-jun
(CollegeofAnimalScienceandVeterinaryMedicine,ShanxiAgriculturalUniversity,Taigu030801,China)
The salt resistance of alfalfa (Medicagositivacv.Golden Empress) inoculated with 3 arbuscular mycorrhizal fungi (AMF) were studied under NaCl stress (0,50,100,150 and 200 mmol/L).The results showed the content of proline (Pro) and soluble sugar (SS) had a tend of decreasing firstly and then increased with the increase of NaCl concentration,and the highest value was obtained in the treatment of 100mol/L,the concentrations of Gm fungi were 6.37 and 1.91 (μg/g).The content of MDA increased with the increase of NaCl concentration,and the difference among NaCl concentrations was significant.The content of SOD and POD had a tend of decreasing firstly and then increased with the increase of NaCl concentration.The activity of SOD and POD decreased under the stress of 150 mmol/L NaCl.The The activity of SOD and POD of Gm inoculated alfalfa decreased by 48.48% and 43.71%.At the same time,the change of photosynthetic characteristics was increased.The content of Ci increased with the increase of NaCl concentration,Pn,Gs,Trdecreased with the increase of NaCl concentration.The maximum salt concentration Golden Queen tolerated was 150mmol/L,and the effect ofGlomusmosseae(Gm) was better thanGlomusetunicatum(Ge) andGlomusintraradices(Gi).
Medicagosativacv.Golden Empress;arbuscular mycorrhizal fungi (AMF);NaCl;salt resistance
S 541
A
1009-5500(2017)05-0085-07
2017-03-23;
2017-05-27
山西省回国留学人员科研基金项目(2015-06
1); 国家自然科学基金项目(41601327)资助
李倩(1991-),女,山西孝义人,在读硕士。
E-mail:695631648@qq.com
高文俊为通讯作者。
