遵循药理学原理的细胞毒检验方法探讨
2017-11-17赵承彦河南省肿瘤研究院河南郑州450008
赵承彦(河南省肿瘤研究院,河南 郑州 450008)
遵循药理学原理的细胞毒检验方法探讨
赵承彦
(河南省肿瘤研究院,河南 郑州 450008)
细胞毒检验是了解和评价机体免疫功能状态的重要方法,历来受免疫学家重视。51Cr释放法是上世纪60年代建立的细胞毒活力检验方法,随后又建立了多种检验方法,包括荧光标记流式细胞术方法,统称为传统细胞毒检验方法(TCA)。TCA方法用杀伤率表示细胞毒活力是概念应用错误,以效靶细胞比为条件检测的杀伤率是实验条件应用错误,违背药理学原理,不反映细胞毒活力,没有实用性。本文通过对TCA错误理念和方法条件的探讨分析,遵循药理学原理建立了一个比较实用的细胞毒活力检验方法。新方法以极限稀释分析方法为基础,以效应细胞密度为自变量,用效应细胞含有的细胞毒活性细胞频率(CCF)和100%杀伤率限定的效应细胞密度(ID100)做细胞毒活力指标,通过量-效曲线和条件标准化测定CCF和ID100;不标记细胞,用全或无计数方法定量靶细胞;而且可以预置实验误差和可信度。新方法用K562细胞作为靶细胞,在96孔细胞培养板上检测细胞毒活力,健康人外周血单核细胞(PBMC)的ID100为6.8×104/孔左右;CIK细胞ID100≤4.0×104/孔;人红细胞的克隆抑制率为0;同一个细胞样品,用红细胞裂解液处理,克隆抑制率随处理强度成比例变化;样本批间检测结果变异不大,表明该方法能真实反映细胞毒活力。
细胞毒性;细胞毒活力检验;细胞克隆;极限稀释分析方法;剂量-效应曲线
现代免疫学阐明,免疫是机体识别和排除抗原性异物的反应。免疫反应机制和反应过程非常复杂,有各种各样的免疫细胞和免疫因子参与,协同作用,共同完成。免疫杀伤是免疫细胞和免疫因子引起感染、变异和癌变细胞死亡的反应形式,是免疫功能的集中体现。免疫杀伤既有免疫细胞的作用,也有免疫因子的作用,起杀伤作用的免疫细胞和免疫因子称为效应细胞和效应因子,被杀伤的变异细胞称为靶细胞。细胞毒性是指效应细胞杀伤靶细胞的作用,单纯免疫因子的作用属于药物毒性。细胞毒活力是指效应细胞杀伤靶细胞的能力,是衡量机体免疫功能的重要指标。
细胞毒检验是分析和评价机体免疫反应能力的基本方法。细胞毒检验方法历来为免疫学界所重视,半个多世纪来相继建立了10多种细胞毒活力检验方法。51Cr释放法[1-2]是较早建立的一种方法,该方法涉及辐射防护、污物处理和昂贵的检测仪器,不易普及应用。随后建立了时间分辨镧系元素标记法[3],各种酶释放法[4-6],生物发光法[7-8],荧光标记流式细胞术方法等[9-11],后续方法遵循同样的方法原理和实验条件,只是定量靶细胞方法不同,统称为传统细胞毒检验方法(traditional cytotoxicity assay,TCA)。
51Cr释放法为世界各国所有相关实验室接受,已经应用了半个多世纪,甚至有人将其奉为细胞毒实验方法金标准。作者于上世纪90年代初从事细胞免疫学研究,选择应用以51Cr释放法为代表的多种实验方法检测细胞毒活力,均未获得过满意的实验结果,主要表现是用同一个方法检测同一个样品,不同实验室甚至同一个实验室同一个人,不同批次之间实验结果不相同。后来进行实验方法考核发现,TCA的问题主要是方法原理违背细胞毒反应规律,用效靶比作变量是实验条件应用错误,用杀伤率做细胞毒活力指标是概念应用错误,实验结果不反映效应细胞性能。
1 传统细胞毒检验方法存在原则性错误
1.1TCA违背细胞毒反应规律免疫细胞杀伤靶细胞相当于药物毒性杀伤靶细胞,细胞毒性作用本质上与药物毒性作用相似。药理学研究表明:药物毒性反应,效应是剂量的函数。如果用效应强度为纵坐标,剂量(浓度)为横坐标作图,呈二维双曲线,将剂量改用对数值作图,呈S型曲线,称为量效曲线(图1)。S型曲线表示,药物剂量很低时不产生效应,达到阈值剂量以后效应随着剂量增大而增强,在线性区效应随剂量增加很快,接近饱和剂量时,效应随剂量变化减慢。药物毒性一般用剂量参数半数致死量(median lethal dose,LD50)和LD90作为指标[12-16],通过测定量效曲线获得。

图1 量效曲线模式图
细胞毒性反应规律与药物毒性反应规律一样,细胞毒效应是细胞剂量的函数,即杀伤率(killing rate,KR)是细胞密度的函数。细胞密度很低时,效靶细胞接触机会很小,杀伤率很低;随着细胞密度增高,效靶细胞接触机会增多,杀伤率增高;达到饱和密度时,由于非活性细胞的阻碍作用,效靶细胞接触机会不再增大,杀伤率也不再升高。TCA以效靶细胞比为变量检测KR,效靶细胞比不是细胞密度,KR不体现量效关系,也不是剂量参数,不反映细胞毒活力。TCA没有遵循药理学实验原理,违背细胞毒性反应规律。
1.2用杀伤率表示细胞毒活力是概念应用错误认识TCA的问题,需要先明确细胞毒实验目的和细胞毒性反应原理。细胞毒实验目的是定量分析效应细胞杀伤靶细胞的能力,了解机体细胞免疫功能状态。细胞毒性反应是指免疫活性细胞杀伤或吞噬病原体的作用过程。免疫活性细胞有很多种类型,统称为效应细胞。病原体包括体内变异的突变和癌变细胞,侵入体内的病原微生物等,统称为靶细胞。细胞毒性不是所有效应细胞能够杀伤所有靶细胞,具有选择适应性,即一种效应细胞可以杀伤某几种靶细胞,或几种效应细胞可以作用于某一种靶细胞。细胞毒反应发生的条件:一是效应细胞中含有杀伤活性的免疫细胞,二是效靶细胞有接触的机会。
杀伤率是TCA体外实验测得的靶细胞被杀伤的比率。杀伤率的大小决定于:1)效应细胞中含有的免疫活性细胞频率(cytotoxic cells frequency,CCF);2)效靶细胞接触机会。CCF是细胞样本具有的属性,不随实验条件而变。效靶细胞接触机会决定于细胞密度。TCA检测杀伤率不是以细胞密度为自变量,而是以效靶细胞比为实验条件。效靶细胞比与细胞密度无关,同样的效靶细胞比,细胞密度可以不同。维持效靶细胞比不变,可以做成许多个细胞密度,测出许多个杀伤率。同一个细胞样本用同一个效靶比测出许多个杀伤率,而一个杀伤率反映细胞样本细胞毒活力是不能明确的。这也是同一个细胞样本各个实验室,不同实验者,不同批次,实验结果都不相同的原因所在。杀伤率决定于实验条件,随实验条件而变,而一个细胞样本的细胞毒活力只有一个,不应该随实验条件变化,所以杀伤率不反映细胞毒活力。
再者,机体内的细胞密度与体外细胞毒实验的细胞密度不是一个概念,体液内的细胞随血液循环呈立体运动状态,体外实验细胞毒反应发生在平面上,细胞呈静止状态,两者没有相关性和可比性。即使TCA以细胞密度为变量测定杀伤率,因为体外无法建造与体内完全相同的细胞密度,测得的杀伤率也不反映机体细胞免疫杀伤活力。
1.3以效靶细胞比为条件检测杀伤率是实验条件应用错误效靶细胞比不影响杀伤率,TCA方法以效靶细胞比为自变量测定杀伤率,显然认为杀伤率与效靶比有关,效靶比高杀伤率大。这种认识是不对的。TCA方法细胞毒性反应发生在平面上,效应细胞与靶细胞在平面上均匀分布,彼此之间相对静止。效应细胞中有活性细胞,也有非活性细胞,只有活性细胞与靶细胞接触才能发生杀伤反应。一般是效应细胞多靶细胞少。杀伤反应,细胞之间(效-效、靶-靶)没有竞争,即一个效应细胞杀伤一个靶细胞,与其他效应细胞或靶细胞的存在没有关系。细胞密度大,细胞之间距离小,效靶细胞接触机会多,靶细胞被杀伤的风险大。即使一个靶细胞同时与一个或几个效应细胞接触,由于非活性细胞总是多于活性细胞,总有靶细胞不被杀伤。在细胞密度一定的条件下,效靶比低,相对靶细胞少,被杀伤的靶细胞也少,而没有被杀伤的也少;效靶比高,相对靶细胞多,被杀伤的靶细胞也多,而没有被杀伤的也多,杀伤比率不变。因此杀伤率决定于细胞密度,与效靶细胞比无关。
1.4细胞免疫杀伤活力的指标应该是效应细胞中活性细胞频率细胞毒活力是指效应细胞产生细胞毒反应的能力,能力大小决定于效应细胞中对靶细胞敏感、能杀伤靶细胞的CCF。CCF具有样本属性,与免疫细胞杀伤活力直接相关,不同个体的CCF各不相同,决定细胞毒活力不同。健康人群CCF维持一个正常值水平,CCF水平低的个体免疫细胞杀伤活力会低。而且CCF在体内状态与在体外实验条件下一样,不会随实验操作而改变。因此,CCF是理想的细胞毒活力指标。根据药理学原理创建的细胞毒检验方法,可以检测CCF。
1.5消除TCA错误理念的影响,建立实用的细胞毒实验方法TCA因为不反映真实的细胞毒活力,所以至今没有成为临床检验方法。TCA的问题还没有被认识,TCA现在还在应用,还在继续影响细胞免疫学的研究和应用。这种状况应该尽快改变。通过对TCA方法的认识和检讨再分析,我们建立了一个符合药理学原理的细胞毒检验方法,叫做极限稀释细胞克隆抑制试验(limiting dilution clone inhibition assay,LDCIA)[17]。LDCIA以效应细胞密度为变量检测杀伤率,通过量-效曲线确定100%克隆抑制率对应的效应细胞密度 (density of 100% inhibited,ID100)。ID100具有样本属性。健康人群的ID100有一个正常值,对应一个CCF值。只要测定样本的ID100,通过与ID100正常值比较,就可以确定样本的CCF。LDCIA根据极限稀释分析方法(limiting dilution assay,LDA)[17-19]原理,用全或无计数方法定量靶细胞变化,不用标记细胞,实际应用证明是一个科学、实用的细胞毒活力实验方法。
2 遵循药理学原理的细胞毒检验方法
2.1LDCIA的基本原理
2.1.1 LDCIA实验体系近似于体内环境条件 LDCIA是将靶细胞做极限稀释,均匀分配至克隆单位内,平均1个单位内1个靶细胞;效应细胞按密度大小分成剂量组k,依次加入克隆单位内,每一个剂量组选定一个克隆单位数(n)。实验体系内只有培养基、效应细胞、靶细胞。不对细胞作标记修饰。如果效应细胞没有细胞毒性,培养3~5 d后靶细胞会生成克隆,如果效应细胞有细胞毒性,死伤的靶细胞不会生成克隆。病态靶细胞也不会生成克隆,能生成克隆都是有增殖能力的靶细胞,不存在假阳性和假性杀伤;选用的培养基不使靶细胞发生细胞衰亡,也不产生假阴性。
2.1.2 LDCIA用全或无计数方法定量靶细胞变化 靶细胞计数方法是细胞毒检验方法的核心技术。LDCIA成功地解决了靶细胞计数问题:1)克隆培养的靶细胞,如果未被杀伤,经过5 d左右增殖会形成10多个克隆细胞,在检测单位内容易识别(图2);2)极限稀释可以使克隆单位内平均1个靶细胞,但不会每个单位内都是1个靶细胞,有的可能是0、2、3、… x细胞。概率论证明这种不均匀分布是有规律的,分配到0、2、3、… x细胞的单位数的概率是一定的,服从Poisson分布,可以用Poisson分布函数处理。见公式1:

图2 LD细胞阴性克隆与阳性克隆表现
A、B对照组K562在FBM里生成的阳性克隆,B有红细胞;C细胞病理性死亡形态;D细胞衰亡形态;E、F是杀伤实验组阴性克隆形态,靶细胞被化解,周围较多红细胞被推开形成一片空斑;G阳性克隆形态,克隆的靶细胞周围较多红细胞;H效应细胞形成的簇


2)公式1是Poisson概率分布函数(x=0)的一种特殊形式,表示阴性克隆单位概率对数的负值等于单位内靶细胞均数(μ)。根据这一属性,实验只需计数克隆阴性单位数(r0),由克隆阴性单位概率可以获得靶细胞均数(μ)。阳性克隆比较复杂,单位内的阳性克隆会有1、2、3、…x细胞多种情况,克隆阳性单位只用作鉴别阴性单位,而不管单位内是几个克隆,多少个细胞。于是LDA将靶细胞计数变成了全或无克隆单位计数,计数简单而准确。

2.1.3 通过量-效曲线测定具有样本属性的细胞毒活力指标 效/靶细胞在检验单位里随机相遇发生反应,检测单位内的靶细胞均数μ决定于Poisson分布和细胞毒作用两方面因素。各实验组加入的靶细胞都一样,如果细胞毒活力为0,检测出来的μi与空白对照组的μ0相同;如果有细胞毒作用,μi值会随着效应细胞密度(EDi)增加而减少。这与药物作用于细胞发生的药理效应类似[18],量效关系,即μi和Di(EDi简化用Di表示)的关系为S型曲线,一定剂量范围区间对应S型曲线的一部分(图3)。μi和Di的关系可用公式3表示:μi=e-bDi(公式3),两边取对数,lnμi=a-bDi(公式4)

图3 μ0与靶细胞的关系
其中1)b是斜率,因CCF不同而异。a是截距,与靶细胞有关,对检测数据作标准化处理,使a=1可以消除靶细胞差异的影响(第3节详细论述);2)Di是实验预置值,μi是根据公式1计算得到的,带入公式4求得常数项a和b,得到实际回归方程。根据回归方程,选定Di和μi中任意一个即可求得另一个,用于确定细胞毒活力指标。
2.1.4 LDCIA能够通过设置实验条件控制实验误差和可信度 LDCIA是一个统计学实验方法,实验结果的可信度和实验误差与样本数有关。公式2表明,靶细胞均数μ的误差决定于μ0,r0和n,根据Sμ和n应用方差分析可以计算出μi的可信度;反过来,确定了置信限和误差也可以计算出样本数n。靶细胞和效应细胞稀释极限值(μ0和Di)与克隆单位数n可以选定。极限稀释分析方法原理限定μ0≌1;公式1要求r0必须>1,优选值≥10。如果选定克隆单位数n,Sμ和置信限也就确定。表1是以满足95%置信限概率P(n’,0.95)为标准,计算确定的μ0,n与r0之间的匹配值。应用表1根据实验要求的r0和置信限,可以选定μ0和n值。表中数值表明:1)理想的实验条件要求置信限P(n’,0.05)≥95%,r0≥10,至少需要n>36;2)如果希望n在100以内, μ0值应小于2.0;3)如果选择μ0=3,需要n>180。LDCIA根据表1选定μ0和n,实验获得的μi可信度>95%。
2.1.5 细胞毒活力检验指标

2.1.5.2 细胞毒活力检验指标 本实验室用96孔细胞培养板做载体,用K562细胞作靶细胞,健康人PBMC做效应细胞,以靶细胞μ0=1,效应细胞密度(Di)在(1~4)×104/孔范围内,作为标准检验体系,通过克隆抑制率曲线检测了26例样本的细胞毒活力。以D=6.8×104/孔为标准计算CIR,有50%的检测样本CIR-=100%,均值97%,值域90%~100%;如果以CIR-=100%标准计算对应的Di,均值6.8×104/孔,值域(4.5~11.8)×104/孔。这一实验表明,不同样本含有的CCF不同,达到CIR-=100%的细胞密度不同,CIR-=100%对应的效应细胞密度称为ID100。同样,不同样本,以相同的标准细胞密度D=6.8×104/孔为条件,检测的克隆抑制率各不相同。标准条件下的CIR值称为标准克隆抑制率,为了直观,用CIR6.8表示。ID100和CIR6.8是在低密度条件下由克隆抑制率曲线测定,不能直接以D=6.8×104/孔为条件测定。ID100和CIR6.8是由特定条件界定的实验参数,界定条件根据效应细胞类型与属性确定。CIR6.8适用于以K562细胞作靶细胞,健康人PBMC样本。

表1 极限稀释法中n与μ0、r0、P(n’0.95)(%)的匹配关系表
注:P0.5(0)为μ0=0.5时克隆阴性单位概率,其余类同。P(%)为置信限概率。
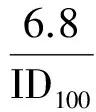
2.2极限稀释细胞克隆抑制实验方法
2.2.1 仪器设备和试剂 LDCIA实验需要标准细胞实验室,主要配置为净化工作台、倒置显微镜、离心机、CO2培养箱、细胞培养板、消毒器具等。主要试剂:细胞培养液,细胞分离液等。
2.2.2 细胞克隆培养体系 根据靶细胞和效应细胞生活特性选择适宜的培养基,确保健康的靶细胞能够形成克隆。推荐使用适合人淋巴细胞生长的无血清培养基,克隆培养载体通常选用96或384孔透明细胞培养板。克隆单位内的细胞密度因条件而异,靶细胞极限值为每单位1~2,效应细胞在350~1 400·mm-2,相当于96孔板(1~4)×104/孔左右。
2.2.3 靶细胞处理方法
2.2.3.1 靶细胞选择 细胞毒活力检验用的靶细胞多为传代培养的癌细胞,如K562、A549和Raji,也有用病原体感染细胞的。靶细胞类型构成细胞毒活力检验体系,如K562细胞检测体系、Raji细胞检测体系等。靶细胞性能决定效应细胞毒活力,同一个效应细胞作用于不同的靶细胞,细胞毒活力不同,互相没有可比性。
2.2.3.2 靶细胞处理、计数与极限稀释 实验前靶细胞先克隆培养几代,保证细胞无污染,能形成克隆的活性细胞>95%。实验用传代1 d的靶细胞。LDCIA实验使用靶细胞很少,以96孔板为例,一个标本300个左右。靶细胞计数要求准确,先将靶细胞粗劣计数,然后取样直接移至细胞培养池内,用带有网格测微器的倒置显微镜直接计数。极限稀释就是将靶细胞稀释至一个极限值:1个克隆单位内平均1~2个细胞,可以是非整数,但要准确。根据细胞数量,用培养液稀释至终浓度为10×μ0·mL-1,然后按每个克隆单位0.1 mL均匀分配至所有克隆单位内。
2.2.4 效应细胞处理方法
2.2.4.1 外周血细胞计数 外周血细胞计数获得白细胞浓度,为计算CCF提供依据。
2.2.4.2 外周血细胞分离 选择常规密度梯度分离方法,操作方法可查阅有关文献。
2.2.4.3 效应细胞计数法 效应细胞密度的准确性决定实验结果的准确度。用血球计数板计数细胞操作简单,但要计数准确并不容易,需要掌握正确的方法,尽量消除影响计数准确性的因素:1)计数前显微镜载物台要调水平;2)计数的细胞样品内如果带有红细胞,要用带有染液的红细胞裂解液稀释细胞;3)取样时细胞悬液要混匀;4)向计数池内加样时要滴在盖玻片边缘的中央,不能吹向池内;5)细胞样品浓度在1.0×106·mL-1左右计数误差较小;6)计数的细胞数越多误差越小。
2.2.4.4 效应细胞稀释方法 效应细胞稀释和分配是影响细胞密度准确性的另一个重要环节。稀释是将计数好的细胞进行适当稀释,首先计算总细胞数,用计数值乘以样品量,样品量必须计量准确,如果样品量为1 mL左右,计数前稀释的细胞压积和计数取样量都不能忽略。效应细胞稀释分为4个密度点:1.0、2.0、3.0、4.0(×104)·mL-1,先将细胞稀释成5.0×105·mL-1。克隆单位数一般是n=48,一个密度点的样品量至少10 mL。稀释从低密度做起:第1个密度点,先在稀释槽里放5.0 mL培养液,取出1.0 mL弃之,然后取细胞液1.0 mL放入混匀,按每孔0.1 mL均匀分配至48个克隆单位内。第2和第3密度点分别取2.0 mL和3.0 mL细胞样品,按同样方法操作,剩余的细胞样品补加1.0 mL稀释液作为第4个实验点样品,加入培养池内。如果效应细胞是诱导培养的各类免疫细胞,直接稀释分配。
2.2.4.5 滋养细胞制备方法 取血细胞分离的底层纯红细胞,洗涤2次用培养液稀释成4.0×105·mL-1,按每孔0.1 mL加入对照组的克隆单位内。
2.5细胞克隆培养与克隆单位计数处理好的克隆培养板置于37 ℃、体积分数5% CO2、饱和湿度条件下培养。克隆培养3~5 d,在倒置显微镜下记录阴性克隆和阳性克隆单位数,必要时可延至7 d,超过5 d需更换培养液。


表2 LDCIA实验数据计算用表

图4 克隆抑制率曲线
3 LDCIA可行性检验
3.1稳定的LDCIA培养体系是细胞毒活力检验成功的必要条件极限稀释细胞克隆培养,一个培养孔内平均只有1~2个靶细胞,单个细胞培养很难存活和生长,生成克隆更不容易。实验证明,含有活力正常的15% FBS-DMEM,15% FBS-RPMI-1640培养基都能使健康的K562细胞生成克隆,克隆率达到90%以上,血清活力高克隆率也高,但是细胞培养过程中会有细胞分化衰亡。不含血清的DMEM、RPMI-1640及无血清培养基SFM都不能使K562细胞生成克隆,但是K562细胞也不分化衰亡。无血清培养基GT-T551既能使K562形成克隆又无细胞分化衰亡。见表3。
3.2LDCIA克隆单位计数的可行性与准确性Poisson概率分布函数从理论上把复杂的靶细胞计数变成全或无计数。克隆单位内只要有克隆的靶细胞,不管多少均为克隆阳性单位,无靶细胞克隆的为克隆阴性单位。靶细胞克隆是指聚集的多个靶细胞,克隆细胞多少与培养液活力、克隆时间长短有关系。阴性克隆单位是指没有靶细胞,或靶细胞已经死亡。死亡的靶细胞膜破裂,或细胞收缩,外观灰暗、无光泽。在LDCIA克隆单位里靶细胞很少,而且细胞形态、大小、活力状况外貌特征与效应细胞差别明显。阳性克隆单位里的靶细胞与效应细胞,差别明显,容易区别。用红细胞做滋养细胞的对照实验,红细胞与靶细胞明显不同。有些效应细胞聚集形成的簇,与靶细胞克隆也明显不同。因此阴性单位与阳性单位容易分辨,克隆单位计数准确率很高,误差一般不超过1或2个克隆单位。如果靶细胞是贴壁细胞,计数克隆单位前将非贴壁细胞洗去,计数会更快捷、准确。见图2。

表3 不同培养基的极限稀释细胞克隆形成率与细胞衰亡率
3.3靶细胞分化衰亡是影响细胞毒活力检验的重要因素细胞生长、增殖、分化一定时期以后都会衰老死亡。衰亡是细胞衰老死亡的过程,凋亡是细胞程序死亡的形式。靶细胞衰亡在对照组和实验组里表现一样,与细胞毒作用无关,但是与生活环境有关,在无血清培养基里看不到细胞衰亡,加入血清以后细胞出现衰亡。在密度很低,细胞互不依附情况下,细胞凋亡形式完整可见。光镜下细胞衰亡首先是停止增殖和分化,然后变圆和膨大,胞内出现空泡,大空泡或破灭或分解成小空泡,胞质和核变化看不清,最后胞膜破裂,胞质蛋白摊开成一片,上面黏附聚集空泡小体,有的小泡可分散到培养基里。衰亡的细胞不具有完整的细胞特征(图2)。密集培养的细胞,众多衰亡细胞产生的胶原黏附在一起漂浮在培养基内,看不到完整的细胞凋亡形态。在无血清或血清活力低的培养基里细胞不表现衰亡,而是呈现病理性死亡,是由饥饿、理化因素和免疫杀伤引起的死亡,表现为细胞收缩,胞膜和胞质化解,进而成碎片消失(图2)。细胞衰亡发生在细胞有增殖分化能力的培养基里,如果不是衰亡就会形成克隆,因此在LDCIA实验中有衰亡细胞的克隆单位是阳性单位。
衰亡是细胞生长过程中的普遍现象,我们检查了悬浮生长的细胞K562、NS/1和贴壁生长细胞A549,在克隆培养过程中都有细胞衰亡,形态相同。51Cr释放法等也存在细胞衰亡的问题,细胞衰亡,膜破裂标记物释放造成假性杀伤。衰亡的靶细胞在有效应细胞的克隆单位内不易识别,影响克隆单位的准确计数。细胞毒活力检验必须解决好细胞衰亡的问题。解决办法是使用具有细胞克隆活力的无血清培养基,如GT-T551培养基。本实验室检查了1个批次样品,K562细胞克隆率94.5%(表3),新配制的GT-T551克隆率达到95%以上。
3.4细胞毒活力决定于效应细胞密度与含有的活性细胞频率
3.4.1 效靶细胞互相接触是发生细胞毒反应的必要条件 具有细胞毒作用的免疫细胞发挥杀伤作用都需要与靶细胞接触。体外条件下细胞不会自主运动,即使有趋化能力也是范围有限,因此一般情况下,在体内或体外实验体系内,效靶细胞的接触机会是随机的。如果克隆培养单位内的细胞密度很低,效靶细胞没有接触机会,即使有细胞毒活力也表现不出来。随着细胞密度增大,效应细胞有了接触靶细胞的机会,才有杀伤靶细胞的可能,当细胞密度大到一定程度时,每一个靶细胞至少会接触到一个效应细胞,这时,如果每一个效应细胞都具有杀伤活力,靶细胞全部被杀伤,检测到的细胞毒活力就是100%;如果效应细胞有一部分没有杀伤活力,靶细胞不会被全部杀伤,检测到的细胞毒活力低于100%。这就是说,在低密度条件下测定的细胞毒活力,有时测定值低,或等于0,不表示细胞毒活力低,或没有活力,而是条件不具备。
3.4.2 效靶细胞在细胞毒实验体系中的分布状态决定细胞毒反应发生的概率 效靶细胞的形态特征和在细胞毒实验体系中的分布状态。以K562细胞作为靶细胞,PBMC作效应细胞为例,K562细胞直径18~23 μm,均值21 μm;效应细胞有大有小(大型细胞群:单核细胞,直径15~20 μm,所占比率3%~5%;中型细胞群:中性粒细胞、嗜酸、嗜碱粒细胞,直径12 μm左右,所占比率55%~75%;小型细胞群:淋巴细胞,直径7 μm左右,所占比率20%~40%),兼顾细胞群的比例和直径大小,取平均直径11 μm。效-靶细胞直径合计32 μm。要满足一个靶细胞平均接触2个效应细胞,2个效应细胞之间的距离≤32 μm,1 mm2面积上有效应细胞977个。要满足一个靶细胞平均接触3个效应细胞,2个效应细胞之间的距离≤28 μm,1 mm2面积上有效应细胞1 302个。以此类推。96孔和384孔培养板底面直径分别为6 mm和2.7 mm,表面积分别为28.274 3 mm2和5.725 6 mm2。表4列出不同细胞密度条件下效靶细胞接触类型、细胞间距以及在96孔或384孔细胞培养板中的细胞数。

表4 不同效-靶细胞接触类型对应的细胞间距与细胞密度
3.4.3 效应细胞密度决定细胞毒性反应发生的概率 体外细胞毒活力检验,细胞是排列在一个平面上,一般情况下细胞是平面靠近,出现叠加机会很少。假如一个靶细胞平均接触2个效应细胞,有时可能只接触到1个或0个效应细胞;一个靶细胞平均接触3个效应细胞,有时可能接触4个或2个或1个或0个效应细胞。这相当于将效应细胞分到许多个小单位里,平均每个单位里有n细胞,但不会每个单位里都是n细胞;可能会有0、1、2、…细胞的情况。随着n增大,即效应细胞密度增大,效靶细胞接触机会也增加,发生反应的概率也增大。效应细胞中会有一部分不具有细胞毒活性,只有细胞毒性细胞与靶细胞接触才能发生细胞毒性。当细胞密度达到一个靶细胞平均接触5个以上效应细胞时,情况比较复杂,理论上1个靶细胞可以接触5个以上效应细胞,实际上只能接触4个或5个效应细胞,几乎没有机会能同时接触5个以上效应细胞。这是由于细胞密度过大时,靶细胞接触远处细胞的机会受到限制(图5)。这相当于太多细胞挤在1个小单位里,靶细胞放入以后接触不到下层的细胞。效应细胞达到一定密度以后,再提高细胞密度不增加效-靶细胞接触机会,称为饱和密度效应。饱和密度条件下,细胞毒性反应发生的几率决定于表层细胞毒性细胞比率,与细胞密度没有关系。非饱和密度条件下,细胞毒活力既与细胞密度有关,也与细胞毒性细胞频率有关。

图5 2个细胞相对距离模式图
3.4.4 克隆抑制率与效应细胞密度的关系 图6是LDCIA以96孔培养板为载体,用PBMC作效应细胞,K562细胞做靶细胞μ0=1,改变效应细胞密度(Di),测得的克隆抑制率(CIR-)与效应细胞密度之间的关系。3条曲线都是CIR-随效应细胞密度增大而升高,在低密度区,CIR-随细胞密度增加升高很快,以后变慢,逐渐达到最大值,随后效应细胞密度再增大,CIR-不再明显升高。各实验组每个克隆单位内加入的靶细胞数都一样,如果效应细胞对靶细胞没有作用,根据极限稀释法原理各实验组测得的阴性单位数都相同μi=μ0,CIR-与细胞密度应该是CIR-=0的一条直线。实际测得的是曲线,表明是效应细胞作用减少了靶细胞,细胞密度越大效应越强,μi值越低。细胞样本不同,即使细胞密度相同,细胞毒活力也不一样。细胞毒活力决定于效应细胞中的CCF,CCF高, CIR-升高快,饱和的CIR-值也高,但是饱和CIR-对应的细胞密度值基本都在同一个效应细胞密度位置。图6是以96孔板为载体,饱和CIR-对应的细胞密度值为每孔 4×104细胞(1 415·mm-2)左右。样本的细胞毒活性细胞频率是一定的,在非饱和密度条件下,克隆单位内细胞毒活性细胞数随细胞密度增大而增多,效靶细胞接触的机会也随之增大,所以CIR-升高。饱和密度条件下,效靶细胞接触的机会达到饱和值,此时CIR-只与效应细胞中细胞毒活性细胞频率有关,CCF高,CIR-也高。图6中CIR-1>CIR-2>CIR-3,反映效应细胞中细胞毒活性细胞频率依次降低。表明CIR是细胞密度的函数。

图6 CIR-与细胞密度关系曲线

图7是用实验值表示的μi、CIRi和lnCIR与Di之间的关系。图7中乘以5、10和100是为了图示直观,把不同量值的数放在一个图上,不改变参数属性。μi和CIRi与Di是曲线关系,可用指数函数CIR+=ae-bD表示,μi和CIRi+是降函数,CIRi-是升函数,指数曲线是s型曲线中的一部分。指数曲线方程两边取对数即为线性方程,图7表示lnCIR与Di之间为线性关系,前4个点在直线上,第5个点在饱和密度区,CIR+偏高不在直线上。
药理学研究常用半致死剂量LD50表示药物性能,LD50通过药物反应量效曲线测定。细胞毒活力用全抑制率细胞密度ID100或半抑制率细胞密度ID50作为指标,能准确地体现细胞毒活力。
3.5饱和密度概念与CCF检测方法细胞毒活力检验中的细胞密度一般是指效应细胞密度。饱和密度是指克隆抑制率达到最大值对应的细胞密度。饱和密度有2种:1)表观饱和密度(modal saturated density,mSD),LDCIA在细胞密度达到mSD以后克隆抑制率不再升高,而CIR-不一定是100%;2)实际饱和密度 (practical saturated density,pSD),克隆抑制率CIR-=100%对应的细胞密度值,也称为全克隆抑制率密度,用ID100表示。

图7 CIR与mD的关系曲线
3.5.1 表观密度与表观饱和密度 效应细胞排列分布在载体平面上构成的细胞密度称为表观密度(modal density,mD),用单位面积上的细胞数表示。以mSD为条件检测细胞毒活力CIR-已达到最大,但CIR-不一定达到100%。效-靶细胞空间距离与细胞密度关系的论述表明,1个靶细胞平均接触4个效应细胞一般可以达到饱和,密度再增大,效靶细胞的接触机会不再明显增加。这是一个理论推算值,实际情况可能是细胞有大有小,形状也不全是圆形,免疫细胞还有趋化、聚集能力。真实的mSD以实际检测值为准。前面一节,以96孔板为载体检测细胞毒活力,mD在4×104/孔左右CIR-达到最大值,细胞密度再增大CIR-升高不多或不再升高。实际验证的mSD与推算值基本一致。mSD与检验体系有关,同一个体系内的mSD是一个定值,不随细胞样本而变。
3.5.2 实际饱和密度 pSD是克隆抑制率CIR-=100%对应的效应细胞密度,pSD就是ID100。一般效应细胞中CCF都比较低,能直接测出ID100的很少。一般是以mD为变量,在低密度区设置几个密度点检测同一个样本的CIR-,密度越高CIR-越大,CIR-与细胞密度在二维坐标图上构成一条曲线,将曲线外推至CIR-=100%(CIR100)对应的细胞密度就是ID100。ID100因样本不同而异,体现效应细胞的性能。效应细胞CIR100对应的ID100值低,表示杀伤全部靶细胞需要较少细胞数,表示CCF高,CCF与ID100呈反比例关系。
3.5.3 表观克隆抑制率、标准克隆抑制率与细胞毒活性细胞频率 mD和mSD是细胞毒活力检验实验条件预置参数。在饱和与非饱和密度条件下检验的细胞毒活力意义不同。细胞毒活力检验,细胞以mD限定在平面上,不能自主运动,可以稀疏也可以密集,密集情况下细胞互相之间的阻碍作用会降低效靶细胞的接触机会。平面、密集、细胞之间的阻碍现象是体外检验体系特有的,与体内情况不同。体内生活的细胞,特别是血液体系内的流动细胞,处于三维立体运动状态,细胞不会过于密集,细胞之间互相接触是随机相遇,机会远远大于体外平面状态。如果mD=977·mm-2,立体状态时可以达到为3.05×104·mm-3。在饱和密度条件下检测细胞毒活力,CIR-值比实际偏低,细胞毒活力越低差别越大。在mSD条件下测定的CIR称为表观克隆抑制率(modal cloning inhibited rate,mCIR)。mCIR一般指以mSD≥1 600·mm-2(96孔板4.5×104/孔,表示为mCIR4.5)为条件的测定值。mCIR具有效应细胞样本特异性,体现效应细胞中CCF不同,但是反映的只是CCF相对比例高低,不能准确定量CCF,不是真实的细胞毒活力,因此不能用作细胞毒活力检验指标。
在低密度条件下,效靶细胞接触是随机相遇,与体内细胞活动状态近似,检测的细胞毒活力接近于体内情况。但是,由于体内细胞密度随饮食和生活状况变化,实验设置的mD不可能与体内情况一致,由一个密度点获得的检验结果只是细胞毒活力在该密度点的表现。因此,细胞毒活力检验选择多点实验方法,测定CIR-mD关系曲线,由曲线可以确定任意密度点对应的CIR值或CIR对应的mD值。
在mSD条件下可以测定一个CIR,在mD条件下可以测定很多个CIR,任意条件下测定一个CIR是没有意义的。细胞毒活力检验的目的是了解不同人群、不同个体的细胞毒活力状态,不同样本的细胞毒活力,有比较才有高低,比较应有统一标准,条件相同,比较才有意义。细胞毒活力检验用于病因分析和疗效评价,应该以健康人检验结果为依据,以50%的样本CIR达到最大值为条件,建立比较标准。应用LDCIA检测26例次健康人标本,以mD=6.8×104/孔作标准,计算CIR值,有50%以上的标本达到或接近CIR100,均值(97.3%±1.7)%,下限值90%。如果以mD=5.0×104/孔作标准,计算CIR值,只有少数标本达到CIR100,下限值低于70%。显然以mD=6.8×104/孔为条件测得的CIR做标准比较合适。标准条件下的CIR值称为标准克隆抑制率(standard cloning inhibited rate,sCIR),为了直观,用CIR6.8表示。CIR6.8在低密度条件下由克隆抑制率曲线确定,有CIR100和ID100=6.8×104/孔等2个限定条件,能真实反映效应细胞杀伤活力,用作比标准意义明确,有一定实用性。
CCF是一个功能概念,与以表型特征分类的细胞概念不同。CCF可以是某一种类型细胞的一部分,也可以是几种类型细胞的一部分,是效应细胞质量效应和数量效应的综合体现。质量是指效应细胞杀伤靶细胞的能力,通常1个效应细胞杀伤1个靶细胞,有时也可以杀伤几个靶细胞,或几个效应细胞杀伤1个靶细胞。我们在实验中将同一个细胞样本分成几份,用红细胞裂解液处理,时间越长对细胞的损伤越大,然后在同样条件下测定细胞毒活力。结果裂解液处理过的样本,细胞毒活力明显降低(见应用举例)。细胞密度和组成没有变,杀伤活力降低表明细胞质量出现了问题。细胞质量问题可以转化为数量问题,原来具有细胞毒活性的细胞因为损伤失去了杀伤能力,细胞属性没有变,但功能上变成了无活性细胞,有活性的细胞数量相对减少。CCF是影响细胞毒活力的主要因素,在检测样本内是恒定的,不随细胞密度变化,具有样本特异性。因为是在效靶细胞随机相遇条件下检测得到的,能比较真实地反映细胞毒活力情况。因此CCF是反映细胞毒活力的特异性指标。
3.5.4 细胞毒活性细胞频率测定方法 LDCIA定量CCF值的基本原理是,选择一种或一类效应细胞样品,检测CIR-mD曲线,计算CIR-达到100%的样本概率(probability of specimen-CIR100,PS-CIR100)。如果一个靶细胞接触一个效应细胞即被杀伤,在饱和密度条件下,CCF为100%时,检测到的CIR-应该是100%,由于LDCIA实验是一个统计学实验方法,不会每次都检测到CIR-=100%.LDCIA相当于将效应细胞分隔成许多个小单位,平均每个单位里n细胞,但不会每个单位里都是n细胞,可能会有0、1、2、3、…n细胞。靶细胞随机放到1个单位里可能会遇到单位里有0、1、2、3、…或n细胞的情况。如果遇到0个细胞就不会被杀伤。零杀伤概率由Poisson分布函数确定。根据极限稀释方法原理,当细胞密度达到1个靶细胞平均接触4个效应细胞(1 953·mm-2)时,如果效应细胞全是细胞毒活性细胞,检测到的CIR100的概率是98.2%;如果细胞毒活性细胞是1/4(Ac=1),检测到的CIR100的概率是63.2%;如果活性细胞是1/8(Ac=0.5),检测到的CIR100的概率低于 40%;1个靶细胞平均接触1个、2个、3个或5个效应细胞的情况类似。表5列出不同的效靶细胞接触类型与不同细胞毒活性细胞比率检测到CIR100的概率(PS-CIR100)。在mD一定条件下,PS-CIR100决定于效应细胞中的活性细胞比率,比率越高PS-CIR100越大。PS-CIR100是一个测定值,用PS-CIR100可以计算活性细胞比率。例如mD=1 953·mm-2,1个靶细胞平均接触4个效应细胞,如果PS-CIR100为63.2%,表示4个效应细胞中有1个是活性细胞,CCF=1/4=25%。

表5 不同效-靶细胞接触类型、活性细胞比率与检测到CIR100的样本概率
我们应用LDCIA方法,以96孔细胞培养板为载体检测了34例效应细胞样品的克隆抑制率CIR。26例健康人外周血细胞,在密度mD=6.8×104/孔(相当于2 402/孔)条件下检测细胞毒活力,其中14例为CIR100,PS-CIR100为54%,表示1个靶细胞平均接触4.5个效应细胞,其中有0.807 5个活性细胞,CCF=0.807 5/4.5=18.0%。8例CIK细胞,有7例在4×104/孔条件下CIR-达到100%,PS-CIR100为87.5%。mD=4×104/孔相当于1个靶细胞平均接触3.08个效应细胞,表示其中有2.11个活性细胞,CCF=2.11/3.08=68.5%。

以CIR6.8为参照标准,RPSD的正常值范围为0.56~1.50。实际上CCF值就是用RPSD与标准CCF值相乘计算出来的。不过RPSD只是一个比值,没有CCF意义不明确。CCF的重要意义不仅仅是提供一个细胞毒活性细胞频率及其正常值范围,另一个用处是计算外周血中细胞毒活性细胞的数量,为评价免疫功能状态提供重要信息。例如,患者体检,1例白细胞是9×109·L-1,另1例是3×109·L-1,两者CCF相同,都是15%,他们外周血中的细胞毒活性细胞数量是不一样的,前者为1.35×109·L-1,后者为0.45×109·L-1。反过来,白细胞相同,CCF不同,外周血中细胞毒活性细胞数量还是不一样。
细胞毒活力高低是相对于参照标准的比较值。参照标准是根据检验对象和检验目的,应用标准样本通过实际检验确定。靶细胞,效应细胞不同,标准不相同。如上述细胞毒活力检验是用LDCIA实验方法,以K562细胞作靶细胞,以CIK细胞和外周血细胞为检测对象建立的检验体系。检验结果只适用于该体系,如果换了靶细胞或效应细胞,就不适用。上述检验得到的CCF值,因为标本数少,可信度可能不够高,希望有条件的实验室能检测更多的标本建立更实用的参照标准。
3.6细胞毒活力检验方法与实验条件标准化
3.6.1 细胞毒活力检验方法的标准化 细胞毒活力检验方法标准化,是选取4个mD实验点,前几个在非饱和密度区,最后一个在饱和密度区(mD≥4.5×104/孔)用于测定mCIR4.5。靶细胞做极限稀释,各实验点相同。每个实验点测得1个μi,细胞毒活力越大,μi越小。μi=0或CIR-=100%,对应的细胞密度即ID100值。靶细胞极限稀释值μ0是一个预置值,由于操作误差或克隆培养过程中的细胞自然死亡,预置的μ0值和实测值不一定相等,数据处理以对照组实测值为准。测定mCIR4.5的目的是建立一个参照标准, mCIR4.5直接测定值,一般低于曲线计算值,如果曲线计算值低于测定值,说明实验结果有问题。见图6。
LDCIA实验以96孔板做克隆载体需要效应细胞5.5×106。如果检测样本细胞数不够可以减少实验点,首先减掉一个非饱和密度点;如果细胞数还不够,应该去掉mSD密度点;如果不足1.0×106细胞,可以按实际细胞数作1个实验点,与对照组构成2个数据点,用两点形成的一条直线代替多点曲线计算相关参数。单点法需要注意:1)效应细胞计数和取样分配要非常准确;2)数据处理必须按曲线条件转换,不能直接用μi计算CIR。正常情况下不用单剂量点方法。
3.6.2 细胞毒活力实验条件的标准化 效应细胞的标准化。关于表观饱和密度的论述,验证在mSD条件下检测到的CIR不反映真实的细胞毒活力。为了真实反映细胞毒活力,应该在低密度区选择多个密度点,通过克隆抑制率曲线测定细胞毒活力指标。效应细胞密度不同,杀伤率不同。不同样本,用相同的效应细胞密度为标准进行比较才有意义。选择什么样的细胞密度做标准由样本属性决定。健康人PBMC以mD=6.8×104为标准检测CIR,用CIR6.8做标准。
靶细胞的标准化。靶细胞对杀伤率有影响,为了消除靶细胞的影响,LDCIA设定用同样的靶细胞密度,但操作总会有失误,要做到每次实验条件(μ0和mDi)都完全相同不太可能。表6是同一个细胞样本,用不同的靶细胞预置值μ0,相对于同样的mD,检测到的μi.。预置μ0项是加在克隆单位内的靶细胞数,0.0项下的μi是实际检测值,两者会有差异,数据处理以检测值为准。图3是根据表6中的数据,通过ln100μi对mD作图。取前4个点作图呈直线(第5个点属于饱和密度值,不在直线上)。3个预置的μ0,3条线平行,其与横坐标的交点不同。因此,pSD值不同。表明同一个检测样本,靶细胞预置μ0值不同,检验结果不同。
靶细胞μ0标准化是以μ0=1做标准,将μ0不等于1的实验值μi按比例放大或缩小,即对实验值μ0和μi都除以μ0,表6中μ0=1.0一行是上面3组数据作标准化处理后的结果。同一个检测样本,3个预置μ0获得3组实验数据,标准化处理后都与μ0=1.0相同。线性拟合前后的斜率b都一样,不受预置条件影响,由样本性质决定;常数项a受预置条件影响;3组数据CIR4.5、CIR6.8相同是因为CIR计算时已经除以μ0,等于做了标准化处理。
标准化处理将条件不同的实验结果转化为条件相同的实验结果,消除了条件差异,使检验结果有了可比性。
3.6.3 细胞毒活力检验成功的基本条件 标准化处理将条件不同的实验结果转化为条件相同的实验结果,是以实验条件真实、准确为基础。如果实验条件不真实或不准确,标准化处理也没有意义。图8中3条曲线是同一个实验因条件不同得到的结果。曲线a是效应细胞计数准确,稀释无误获得的实验结果,预置细胞密度值mD=0.6、2.4、3.6、5.0(×104)。曲线b是第1个密度点稀释操作有误,0.6×104误计为1.2×104,其他计数值准确。曲线c是计数不准,稀释操作无误,各点数值偏高,造成曲线平移。由3条曲线计算出来的参数列在表7中。计数不准和曲线平移对实验结果影响最大;单点计数错误影响较小,是其他各点计数准确给予了纠正。

表6 细胞毒活力实验数据标准化举例

图8 计数误差对实验结果的影响
LDCIA实验参数的计算值都与效应细胞计数值有关,效应细胞计数值是回归计算自变量,回归计算以自变量无误差为条件。因此,效应细胞计数值是影响LDCIA实验结果精密度和准确度的主要因素,准确计数效应细胞是细胞毒活力检验成功的基本条件。

表7 效应细胞计数准确性对检验结果的影响
注:1)取4个点数值计算;2)取前3个点数值计算。
3.7细胞毒活力检验指标的选择与应用LDCIA检测细胞毒活力,既计量靶细胞变化,又计量效应细胞变化,导出多个细胞毒活力指标,为不同检验目的提供选择参考。CIR是靶细胞变化参数,与实验条件有关,不具有样本属性。但是以靶细胞单位均数μ0=1,效应细胞密度mD=6.8×104/孔为条件,检测健康人PBMC的CIR6.8.,是一个限定条件杀伤率。限定条件不是随意选定,由样本属性确定,可以用作细胞毒活力指标;ID100和CCF是效应细胞变化参数,具有样本属性。两者可以独立作为细胞毒活力指标;3)CIR-mD回归系数b,是杀伤率随效应细胞密度变化率,具有样本属性,是一个隐形参数,意义不太明显。
3组细胞毒活力检验参数,是由同一组实验数据计算出来的,有内在联系,可以互相替代,实际应用选择一个即可。一般选择CIR6.8和CCF,如果没有CCF标准值,可以直接用ID100。用ID50也可以。
4 LDCIA实验方法的实际应用
应用LDCIA方法,以限定条件的CIR6.8为指标,检验不同样本的细胞毒活力。考查LDCIA方法的灵敏性、稳定性与检验结果的准确性和真实性。
4.1LDCIA实验方法简单易行,经济实用LDCIA实验方法,实施条件简便,一般细胞实验室即可满足要求。实验程序只需分离细胞、计数、稀释和分样处理。因为只计数阴性克隆单位而不计数细胞,计数简便而准确。因为不用标记和染色细胞,不用多次转移和洗涤细胞,减少了操作程序,降低了操作误差。因此该方法安全,经济,实用。
4.2用LDCIA检测不同类型效应细胞的杀伤活力表8是用LDCIA方法对4种效应细胞做的检验结果。实验以96孔细胞培养板为载体,用K562细胞作靶细胞。细胞因子诱导的杀伤细胞 (cytokine inducing killer,CIK)是一类用细胞因子在体外诱导生成的免疫细胞。CIK细胞毒活力很高,一般在mD =3.5×104/孔,CIR-可达到100%,故检测 CIK 细胞毒活力选择mD=4.0×104/孔。PBMC是用外周血分离的单核细胞,健康人PBMC以mD =5.0×104条件,检测到的CIR5.0只有1例接近70%,其余都在90%以上;以mD =6.8×104为条件检测CIR6.8有14/26达到或接近100%。健康人外周血分离的红细胞是无核细胞,没有细胞毒作用,以空白实验组作对照,检测结果CIR-为负值,表明红细胞不仅无细胞毒作用,而且还能滋养靶细胞生长。这也是本方法用红细胞做滋养细胞的依据。这表明LDCIA实验结果能够反映不同类型效应细胞的细胞毒活力。
4.3LDCIA的灵敏性我们用几个有代表性的CIK诱导条件制备CIK细胞,然后进行细胞毒活力检验。检验结果(表9)表明,FBS和IL-2是影响细胞毒活力主要因素。血清活力因子是支持细胞生长增殖的基本条件。IL-2能促进细胞增殖和获得免疫杀伤活性,但以细胞能正常生长为条件。CD3+抗体和IFN-γ对细胞毒活力作用不明显。植物凝集素PHA也有诱导细胞毒活力的作用,在该实验条件下,没有IL-2作用力强。

表8 LDCIA检测不同人群PBMC的细胞毒活力
注:1)是回归方法计算的CIR-误差

表9 LDCIA检测不同条件下制备的CIK杀伤活力
注:CIR4.0是以效应细胞4.0×104/孔为条件检测的CIR-;Sreg是用回归计算的CIR误差
表10是两类受损伤效应细胞的细胞毒活力检验。一类效应细胞是健康人PBMC,用红细胞裂解液(0.16 mol·L-1,NH4CL×0.17 mol·L-1Tris-HCL,pH7.2)处理,然后用PBS(0.05 mol·L-1pH7.3)洗涤1次,再用培养液稀释做效应细胞。红细胞裂解液能裂解红细胞,也能损伤有核细胞。细胞毒活力检验表明,裂解液作用效应细胞后杀伤活力明显降低,处理时间越长细胞毒活力越低。另一类效应细胞是用IL-和CD3+抗体联合诱导的CIK细胞,体外培养的CIK能强力杀伤K562细胞,大部分CIK的ID100为3.5×104/孔,CIR4.0全部达到100%。但是改变环境条件,如放回自体血浆内继续培养,失去了血清和细胞因子的支持,CIK的杀伤活力很快丧失殆尽CIR4.0=0。LDCIA对不同条件下生成的免疫细胞与细胞损伤前后细胞毒活力检验结果表明,LDCIA方法对效应细胞性能变化有灵敏的反应性。
4.4LDCIA的稳定性表11是对4个自愿者PBMC进行的重复细胞毒检验。1号受试者在7个月期间进行了9次检验;2号受试者在1个月期间进行了2次检验;3号受试者是1例年轻人,不相信较低的结果,要求重复检验,2次检验结果差别不大。4例外周血PBMC杀伤活力检验结果变异都不大于5%,表明稳定性比较好。

表10 LDCIA检测效应细胞损伤前后的杀伤活力
注:CIR5.8和CIR4.0是以效应细胞5.81×104/孔和4.0×104/孔为条件检测的CIR-

表11 LDCIA实验方法的稳定性
5 LDCIA方法讨论
细胞毒活力检验是评价免疫功能的重要方法。51Cr释放法是建立较早、被视为经典的检验方法,实际上是一个错误方法,辐射防护、污物处理和检测仪器昂贵,只是使用难易问题;以效靶细胞比为条件检测杀伤率,用杀伤率做细胞毒活力指标是原则性错误,违背毒理学原理[16,19-21],是检验结果不稳定,无法建立检验标准,不反映细胞毒活力的主要原因。为解决实用问题,先后建立了10多种替代方法,都没有触及基本原理和方法条件。51Cr释放法的错误理念影响细胞免疫学半个多世纪,要想建立实用的细胞毒活力检验方法,必须正确认识和消除51Cr释放法的影响。
LDCIA用于细胞毒活力检验遵循药理学原理:1)用CCF或ID100做细胞毒活力指标,以效应细胞密度为变量测定杀伤率,体现了细胞毒性反应规律,反映真实的杀伤活力;2)通过量-效曲线测定CCF或ID100,避免了单剂量点实验结果的不确定性;3)不对靶细胞作标记或修饰,用红细胞做滋养细胞,细胞毒性反应条件接近于体内环境。靶细胞能增殖才能形成克隆,死伤细胞不会形成克隆,没有假性杀伤,应用特殊培养基消除细胞衰亡,避免了假阴性,实验结果更具真实性;4)LDCIA将靶细胞计数转换成克隆单位计数,计数方便、快捷、准确;可以预置实验可信度。我们对LDCIA方法的可行性和实用性进行了验证,由于能力和条件所限,检测样本例数不够多,像健康人PBMC的CIR6.8正常值检测样本只有36例,CCF正常值只有26例,可信度不是很高,仅供参考。希望同行们进一步检验认证。
LDCIA用于细胞毒活力检验,需要解决好3个问题:1)做好细胞计数。细胞计数准确性是LDCIA成功的决定性因素。效应细胞密度准确,获得的量效曲线才能规则、平滑、误差小、可信度高;2)解决好细胞衰亡问题。消除细胞衰亡的办法是选择适宜的培养基;3)正确认识LDCIA中的靶细胞变化规律。靶细胞作极限稀释,分布在检测单位内的靶细胞均数与克隆阴性单位概率呈指数关系;由于细胞毒性作用,单位内靶细胞因被杀伤而减少,杀伤率与单位内效应细胞密度为非线性关系。实验数据处理,需要先按Piosson分布函数计算靶细胞均数,然后将靶细胞计数与效应细胞密度再做一次非线性转换。从克隆单位计数到克隆抑制率曲线,经过两次非线性转换。有人用LDA检测细胞毒活力没有成功[22-23],原因是:1)当时的LDA体系还不成熟,不完善;2)受51Cr释放法的错误理念影响,仍以效靶细胞比为条件检测杀伤率,只是用克隆阴性单位概率计算靶细胞均数;3)没有处理细胞衰亡的问题。
总之,LDCIA方法遵循药理学原理,改变细胞毒检验方法理念,是细胞毒活力检验方法的一次革命。
[1] BRUNNER KT,MAUEL J,CEROTTINI JC,et al.Quantitative assay of the lytic action of immune lymphoid cells on51Cr-labelled allogeneic target cells in vitro; inhibition by iaoantibody and drugs[J].Immunology ,1968,14(2):181-195.
[2] MOTZER SA,TSUJI J,HERTIG V,et al.Johnston SK,Scanlan J.et al.Natural killer cell cytotoxicity: a methods analysis of 51chromium release versus flow cytometry[J].Biol Res Nurs 2003,5(2):142-152.
[3] BLOMBERG K,HAUTALA R,LOVGREN J,et al.Time-resolved fluorometric assay for natural killer activity using target cells labelled with a fluorescence enhancing ligand[J].J Immunol Methods,1996,193(2):199-206.
[4] FERRARI M,FORNASIERO MC,ISETTA AM.MTT colorimetric assay for testing macrophage cytotoxic activity in vitro[J].J Immunol Methods,1990,131(2):165-172.
[5] 邵树军,刘彩玉,陆维权,等.微量NAG酶释放法鉴定牛血清促进细胞生长的活性[J].河南肿瘤学杂志,2001,14(2):90-92.
[6] AGHBALI A,MORADI AF,DELAZAR A,et al.Induction of Apoptosis and Cytotoxic Activities of Iranian Orthodox Black Tea Extract (BTE) Using in vitro Models[J].Adv Pharm Bull,2014,4(3):255-260.
[7] KARIMI MA,LEE E,BACHMANN MH,et al.Measuring cytotoxicity by bioluminescence imaging outperforms the standard chromium-51 release assay[J].PLoS One,2014,9(2):e89357.
[8] FU X,TAO L,RIVERA A,et al.A simple and sensitive method for measuring tumor-specific T cell cytotoxicity[J].PLoS One,2010,5(7):e11867.
[9] GOLDBERG JE,SHERWOOD SW,CLAYBERGER C.A novel method for measuring CTL and NK cell-mediated cytotoxicity using annexin V and two-color flow cytometry[J].J Immunol Methods,1999,224(1/2):1-9.
[10] ZARITSKAYA L,SHURIN MR,SAYERS TJ,et al.New flow cytometric assays for monitoring cell-mediated cytotoxicity[J].Expert Rev Vaccines 2010,9(6):601-616.
[11] VALIATHAN R,LEWIS JE,MELILLO AB,et al.Evaluation of a flow cytometry-based assay for natural killer cell activity in clinical settings[J].Scand J Immunol,2012,75(4):455-462.
[12] FRISAN T,LEVITSKY V,MASUCCI M.Limiting dilution assay[J].Methods Mol Biol,2001,174:213-216.
[13] JULES MATTES M.High-sensitivity cytotoxicity assays for nonadherent cells[J].Methods Mol Med,2005,110:29-37.
[14] CHOU TC,TALALAY P.Quantitative analysis of dose-effect relationships: the combined effects of multiple drugs or enzyme inhibitors[J].Adv Enzyme Regul,1984,22:27-55.
[15] 许文妍,董希玮,张马忠.麻醉药的药代/药效学模型及其临床应用[J].药学进展,2017,41(5):355-360.
[16] CHANG SL,MAO X.Neuroimmune pharmacology: an elective course for molecular and cellular biosciece graduate programs[J].J Neuroimmune Pharmacol 2011;6:71-5.
[17] GARCIA-CANTON C,MINET E,ANADON A,et al.Metabolic characterization of cell systems used in in vitro toxicology testing: lung cell system BEAS-2B as a working example[J].Toxicol In Vitro,2013,27(6):1719-27.
[18] JOSHI SD,MORE UA,KULKARNI VH.Synthesis,Antimicrobial and cytotoxic activity of New Heterocyclic Hybrids Based on 2,5-Dimethylpyrrole and Pyrrole Scaffolds[J].Indian J Pharm Sci,2013,75(3):310-323.
[23] ZHAO CY.The assay of limiting dilution[M].Salt lake city:Academic press,2014:98-101.
[21] KAMINSKI E,HOWS J,GOLDMAN J,et al.Optimising a limiting dilution culture system for quantitating frequencies of alloreactive cytotoxic T lymphocyte precursors[J].Cell Immunol,1991,137(1):88-95.
[22] WANG XN,PROCTOR SJ,DICKINSON AM.Frequency analysis of recipient-reactive helper and cytotoxic T lymphocyte precursors using a combined single limiting dilution assay[J].Transpl Immunol,1996,4(3):247-251.
[19] YURDAKÖK B,BAYDAN E.Cytotoxic effects of eryngium kotschyi and eryngium maritimum on Hep2,HepG2,Vero and U138 MG cell lines[J].Pharm Biol,2013,51(12):1579-1585.
[20] UDDIN SJ,GRICE D,TIRALONGO E.Evaluation of cytotoxic activity of patriscabratine,tetracosane and various flavonoids isolated from the bangladeshi medicinal plant acrostichum aureum[J].Pharm Biol,2012,50(10):1276-1284.
赵承彦(1938-),男,硕士,研究员,主要从事细胞免疫与肿瘤免疫治疗相关研究。E-mail:cyzhao.01@163.com
10.3969/j.issn.1673-5412.2017.05.025
Q2-33;R73-36
A
1673-5412(2017)05-0446-16
2016-10-26)
