花椒油树脂酶法提取工艺优化及GC-MS分析
2017-11-16柴丽琴王立霞卢跃红田呈瑞
柴丽琴 - 原 洪 王立霞 - 卢跃红 - 田呈瑞 -
(陕西师范大学食品工程与营养科学学院,陕西 西安 710119) (College of Food Engineering and Nutritional Science of Shaanxi Normal University, Xi’an, Shaanxi 710119, China)
花椒油树脂酶法提取工艺优化及GC-MS分析
柴丽琴CHAILi-qin原 洪YUANHong王立霞WANGLi-xia卢跃红LUYue-hong田呈瑞TIANCheng-rui
(陕西师范大学食品工程与营养科学学院,陕西 西安 710119) (CollegeofFoodEngineeringandNutritionalScienceofShaanxiNormalUniversity,Xi’an,Shaanxi710119,China)
以花椒为原料,采用纤维素酶酶解法结合响应面优化花椒油树脂提取工艺。结果表明:最佳工艺条件为:50%的乙醇为提取剂、纤维素酶用量62.3 mg/L、酶解时间2.3 h、酶解温度50 ℃、液料比47.4∶1 (mL/g),该条件下花椒油树脂提取率为 37.22%。采用气相色谱—质谱(GC-MS)联用技术对花椒油树脂进行分析,共鉴定出47种化合物,主要有D-柠檬烯、芳樟醇、月桂酸、柠檬烯二醇、松油醇、驱蛔萜、柠檬酸月桂酯、花椒素等。
纤维素酶;花椒油树脂;提取率;GC-MS
花椒(Zanthoxylumbungeanum)系芸香科花椒属植物,为传统调味料和中药[1]。具有抗菌[2]、消炎[3]、杀虫[4]止痒、抑制血小板凝集[5]等药理作用。目前花椒主要以整粒或磨碎的形式使用,具有香味释放慢、味道不匀、有效成分利用率低等缺陷。花椒油树脂作为一种重要的花椒产品,除了含有挥发性精油成分外,还包含可增强麻香味的非挥发性成分,从而使其具有更厚重的花椒特有的麻香味[6-7]。
目前对油树脂的提取主要以传统的溶剂浸提法为主[8],提取率较低。邵杰等[9]在采用响应面法优化花椒油树脂的超声提取工艺中,只研究了液固比、乙醇浓度和超声功率对花椒油树脂提取率的影响,未涉及超声时间和超声温度对试验结果的影响,在其最佳试验条件下花椒油树脂提取率为33.60%。陶志杰等[10]在采用纤维素酶辅助提取花椒油树脂的试验中只研究了酶用量、酶解时间和酶解温度3个因素对试验结果的影响,花椒油树脂提取率为30.2%。本试验引入酶法辅助提取技术[11-13]结合响应面分析法[14-15]更加系统探究提取溶剂及其体积分数、酶用量、酶解时间、酶解温度及液料比5个因素对花椒油树脂提取率的影响,与前人研究结果相比更全面系统。通过GC-MS分析更加直观地体现最佳工艺条件所得花椒油树脂的主要成分及含量。以期在控制成本节约能源的前提下,提高花椒油树脂得率,并能保证产品品质,促进食品、调味品领域对花椒产品的开发与利用。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
大红袍花椒:购于陕西韩城;
正己烷:色谱纯,西安化学试剂厂;
纤维素酶:10 000 U/g,西安热默尔生物科技有限公司;
甲醇、无水乙醇、丙酮:分析纯,西安化学试剂厂。
1.1.2 仪器与设备
电子天平:PL203型,梅特勒-托利多仪器上海有限公司;
数显鼓风干燥箱:GZX-9146MBE型,上海博迅实业有限公司医疗设备厂;
高速万能粉碎机:FW400A型,北京科伟永兴仪器有限公司;
循环水式真空泵:SHZ-D(Ⅲ)型,巩义市予华仪器有限责任公司;
旋转蒸发器:RE-52A型,上海亚荣生化仪器厂;
数显电子恒温水浴锅:HH-4型,金坛市正基仪器有限公司;
气相色谱质谱联用仪(单四极杆):QP-2010Ultra型,日本岛津公司。
1.2 试验方法
1.2.1 花椒油树脂提取方法 花椒干燥去杂后,粉碎过60目筛,得花椒粉,备用。准确称取2.5 g花椒粉于锥形瓶中,加入一定剂量纤维素酶[16]并按一定液料比加水在一定温度下酶解一定时间,然后加入不同体积分数的甲醇、乙醇和丙酮提取90 min。将提取液真空抽滤后用旋转蒸发仪浓缩,置于50 ℃烘箱烘干除去多余水分,得浸膏状花椒油树脂,称重。花椒油树脂提取率按式(1)计算:
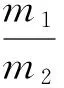
(1)
式中:
c——花椒油树脂提取率,%;
m1——花椒油树脂质量,g;
m2——花椒粉末质量,g。
1.2.2 单因素试验
(1) 提取溶剂:在酶用量60 mg/L,酶解时间2.0 h,酶解温度50 ℃,液料比40∶1 (mL/g)的条件下,分别考察不同提取溶剂(甲醇、乙醇和丙酮)在不同体积分数(40%,50%,60%,70%,80%)的条件下对花椒油树脂提取率的影响,重复3次,取平均值。
(2) 酶用量:在提取溶剂为50%乙醇,酶解时间2.0 h,酶解温度50 ℃,液料比40∶1 (mL/g)的条件下,分别考察酶用量(0,20,40,60,80,100 mg/L)对花椒油树脂提取率的影响,重复3次,取平均值。
(3) 酶解时间:在提取溶剂为50%乙醇,酶用量60 mg/mL,酶解温度50 ℃,液料比40∶1 (mL/g)的条件下,分别考察酶解时间(0.5,1.0,1.5,2.0,2.5,3.0 h)对花椒油树脂提取率的影响,重复3次,取平均值。
(4) 酶解温度:在提取溶剂为50%乙醇,酶用量60 mg/mL,酶解时间2.0 h,液料比40∶1 (mL/g)的条件下,分别考察酶解温度(35,40,45,50,55,60 ℃)对花椒油树脂提取率的影响,重复3次,取平均值。
(5) 液料比:在提取溶剂为50%乙醇,酶用量60 mg/mL,酶解时间2.0 h,酶解温度50 ℃的条件下,分别考察液料比[20∶1,30∶1,40∶1,50∶1,60∶1 (mL/g)]对花椒油树脂提取率的影响,重复3次,取平均值。
1.2.3 响应曲面法(RSM)优化设计 依据响应面Box-Behnken设计原理,在单因素试验的基础上,探究酶用量、酶解时间、酶解温度及液料比4个因素对花椒油树脂提取率的影响,采用4因素3水平响应面分析法,得二次回归方程并确定最佳工艺参数。
1.2.4 花椒油树脂GC-MS成分分析 将最佳工艺条件下得到的浸膏状花椒油树脂(密封良好)于35 ℃条件下水浴融化后,快速取100 μL按体积比用正己烷稀释1 000倍后过0.22 μm 微孔滤膜,上机测定。色谱条件:色谱柱(Rtx-5MS)30 m×0.25 mm×0.25 μm;柱箱温度100 ℃;进样口温度280 ℃;柱升温程序:100 ℃以10 ℃/min升至200 ℃,再以5 ℃/min 升至250 ℃保持5 min;载气为He;流速为1 μL/min;分流比30∶1;柱前压60 kPa。质谱条件:电离方式为EI,电子能量70 eV,离子源温度230 ℃,接口温度250 ℃,扫描范围20~600[17]。
2 结果与分析
2.1 花椒油树脂提取单因素试验结果
由图1(a)可知,溶剂对花椒油树脂提取效果为:乙醇>丙酮>甲醇>水。乙醇组中当乙醇浓度为50%时提取率最高,可能是油脂类物质溶解度与溶剂极性有较大相关性,50%乙醇与花椒油树脂极性相近,使得花椒油树脂溶解度增大,当乙醇浓度持续升高时,极性差距增大,导致提取率降低。因此选50%乙醇作为花椒油树脂最佳提取溶剂。
由图1(b)可知,当酶用量过小时,组织破碎不完全,花椒油树脂提取率较低;随着酶用量升高,酶与底物的接触面积增大,酶解反应速率增大,组织破碎效果增强,提取率增加;当酶用量达到60 mg/L时,提取率最高;此后随着酶用量增加,提取率呈稍微下滑趋势,可能由于酶用量达过饱和,底物浓度相对较低,酶与底物相互竞争,从而对酶产生抑制作用。由此可知应控制酶用量在60 mg/L左右为宜。
由图1(c)可知,酶解时间在2.0 h内随着酶解时间的延长,花椒油树脂提取率逐渐增大,当酶解时间达到2.0 h时酶活力被充分利用提取率达最大,此后随着时间的延长提取率趋于平稳。可见过长时间的提取并不能增加花椒油树脂的提取率,还会增加成本[18],因此应控制酶解时间2.0 h左右为宜。
由图1(d)可知,当酶解温度在35~50 ℃时,随着酶解温度的增加,花椒油树脂提取率逐渐增大,当酶解温度达50 ℃时提取率达到最大。此后随着温度的增加花椒油树脂提取率呈下降趋势。原因可能与纤维素酶的最适温度有关,在一定范围内随着温度升高,酶的活性增强,反应速度加快;当达到最适温度后随着温度继续升高,酶的稳定性降低,酶活性减弱,使花椒油树脂提取率下降。因此,50 ℃为花椒油树脂提取的较适宜温度。
由图1(e)可知,花椒油树脂提取率在试验范围内随着液料比的增加均有所增大。当液料比较小[20∶1 (mL/g)]时,花椒油树脂提取率较低;随着液料比的增大,固液两相接触面增大,有利于加快提取速率使花椒油树脂提取率增加;当液料比为40∶1 (mL/g)时花椒油树脂提取率达到较高状态,此后随着液料比的增大,花椒油树脂提取率虽呈增加趋势,但增幅极缓。综合考虑实际生产中的能耗和成本问题,选40∶1 (mL/g)为花椒油树脂提取的较适宜液料比。
2.2 花椒油树脂提取响应面试验结果
2.2.1 试验设计及结果 花椒油树脂提取响应面设计因素与水平见表1,试验设计与结果见表2。
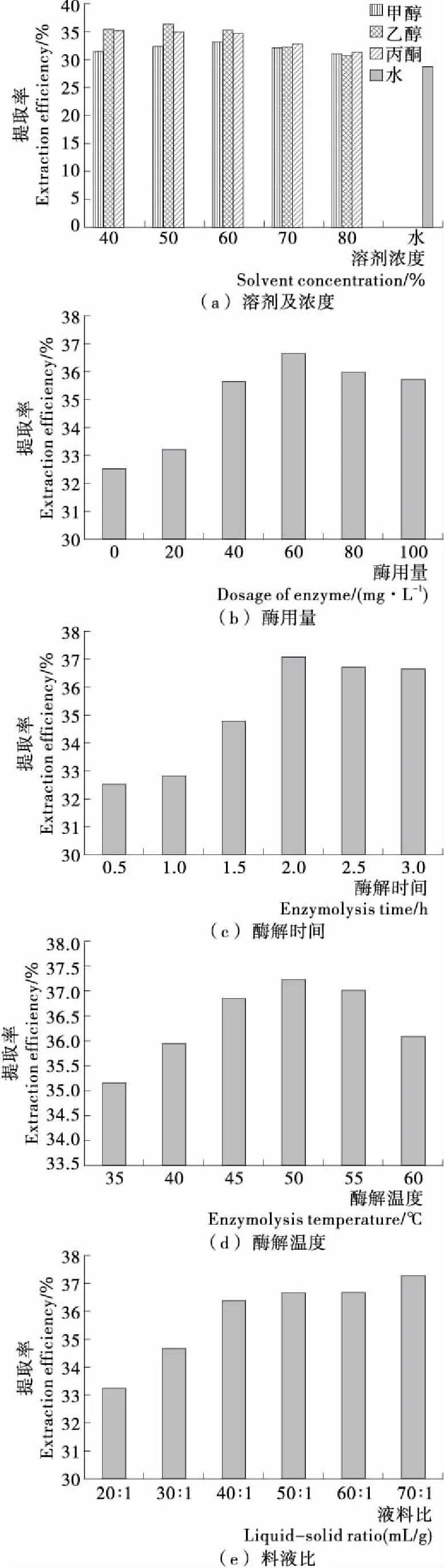
图1 各单因素对花椒油树脂提取效果的影响Figure 1 Effect of each single factor on extraction efficiency of Zanthoxylum oleoresin
2.2.2 二次回归方程及方差分析 利用Design-Expert 8.0软件对表2试验数据进行二次多项式回归拟合,得到花椒油树脂提取率的回归方程模型:
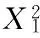
(2)
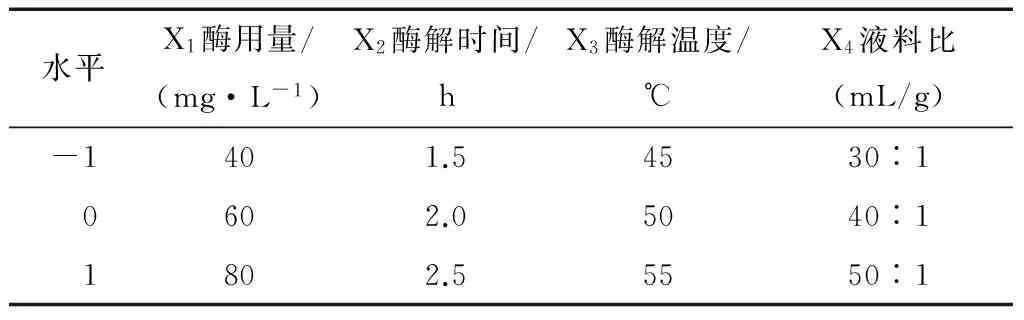
表1 Box-Behnken响应面设计因素与水平表Table 1 The table of variables and levels of Box-Behnken
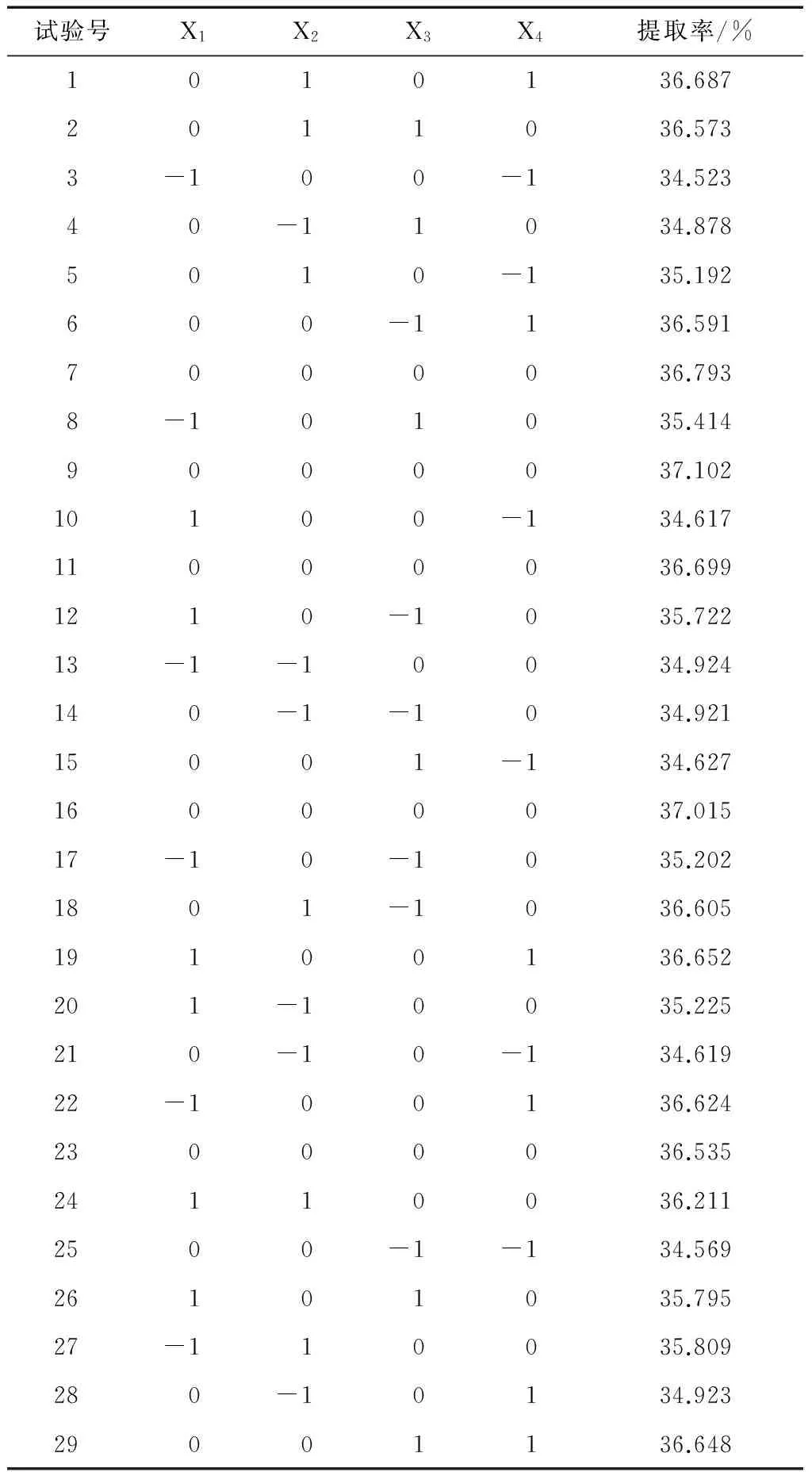
表2 响应面试验设计与结果Table 2 Response surface experimental design and results

2.2.3 两因素间交互作用对花椒油树脂提取率的影响 由图2可知,6个响应面都有一定陡峭程度,总趋势大致相同,结合方差分析表(因素交互作用的P值均>0.05)可知各因素交互作用对花椒油树脂提取率影响不显著。但图2(e)曲面相对最陡,说明液料比与酶解时间的交互作用对花椒油树脂提取率有一定影响(可能与液料比和酶解时间的显著影响有关),但影响不显著(P>0.05);图2(a)、(c)、(d)、(f)曲面相对较陡,说明酶用量和酶解时间、酶用量和液料比、酶解温度和液料比的交互作用对花椒油树脂提取率有影响,但影响较小;图2(b)曲面相对最缓,说明酶用量和酶解温度的交互作用对花椒油树脂提取率影响很小[20]。
2.2.4 最佳条件的确定和回归模型的验证 通过响应面分析得花椒油树脂提取最佳工艺条件为:酶用量62.3 mg/L、酶解时间2.32 h、酶解温度50.12 ℃、液料比47.36∶1 (mL/g),此条件下花椒油树脂理论提取率为37.35%。
在实际操作中对上述条件稍作调整并进行实验验证,最终确定最佳工艺条件为:酶用量62.3 mg/L、酶解时间2.3 h、酶解温度50 ℃、液料比47.4∶1 (mL/g),此时花椒油树脂提取率为37.22%,与理论预测值(37.35%)相比相对误差为0.35%<1%。因此,采用响应面法优化得到的条件参数较为可靠。
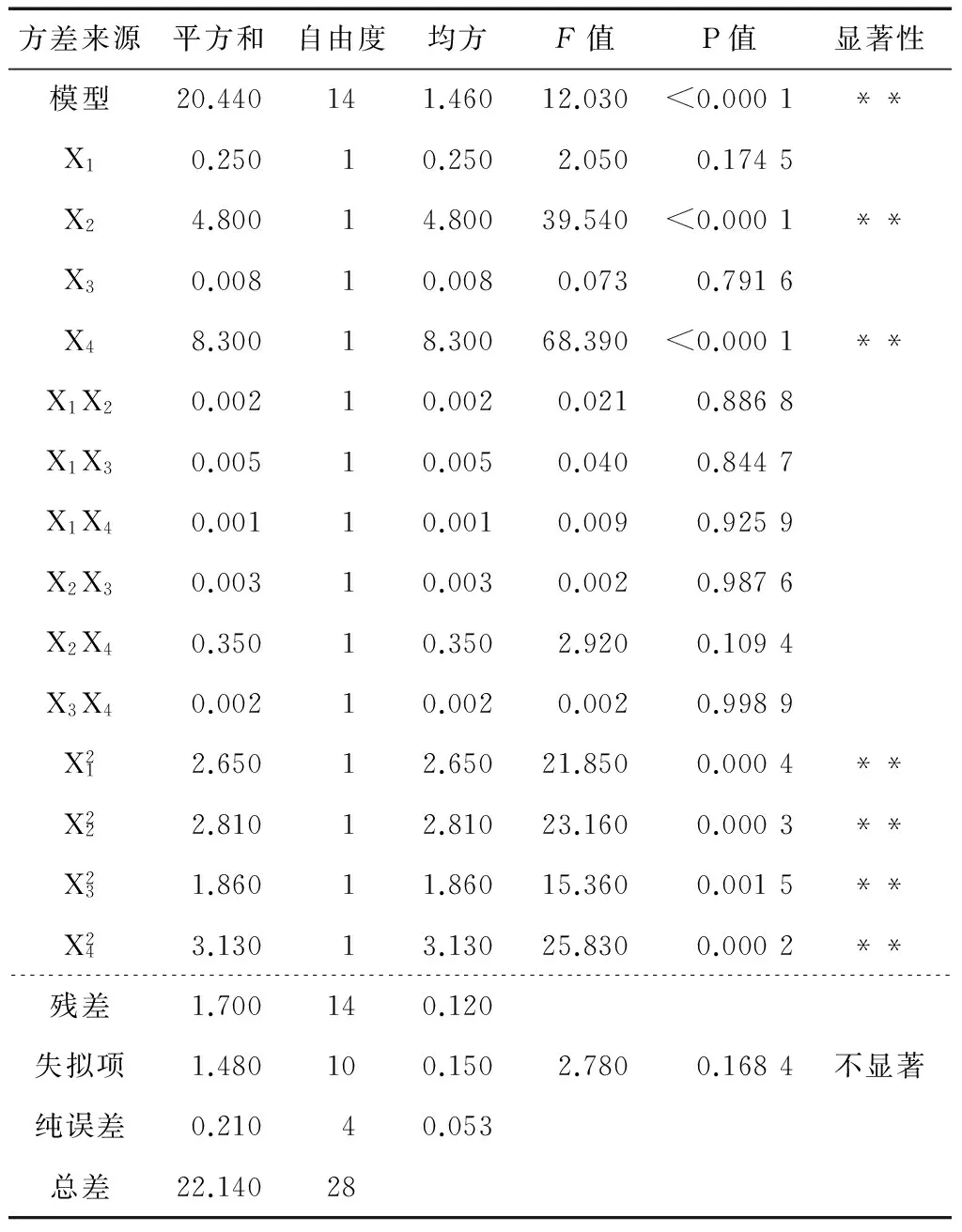
表3 响应面回归模型的方差分析†Table 3 Analysis of variance for the response surface regression model
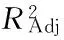
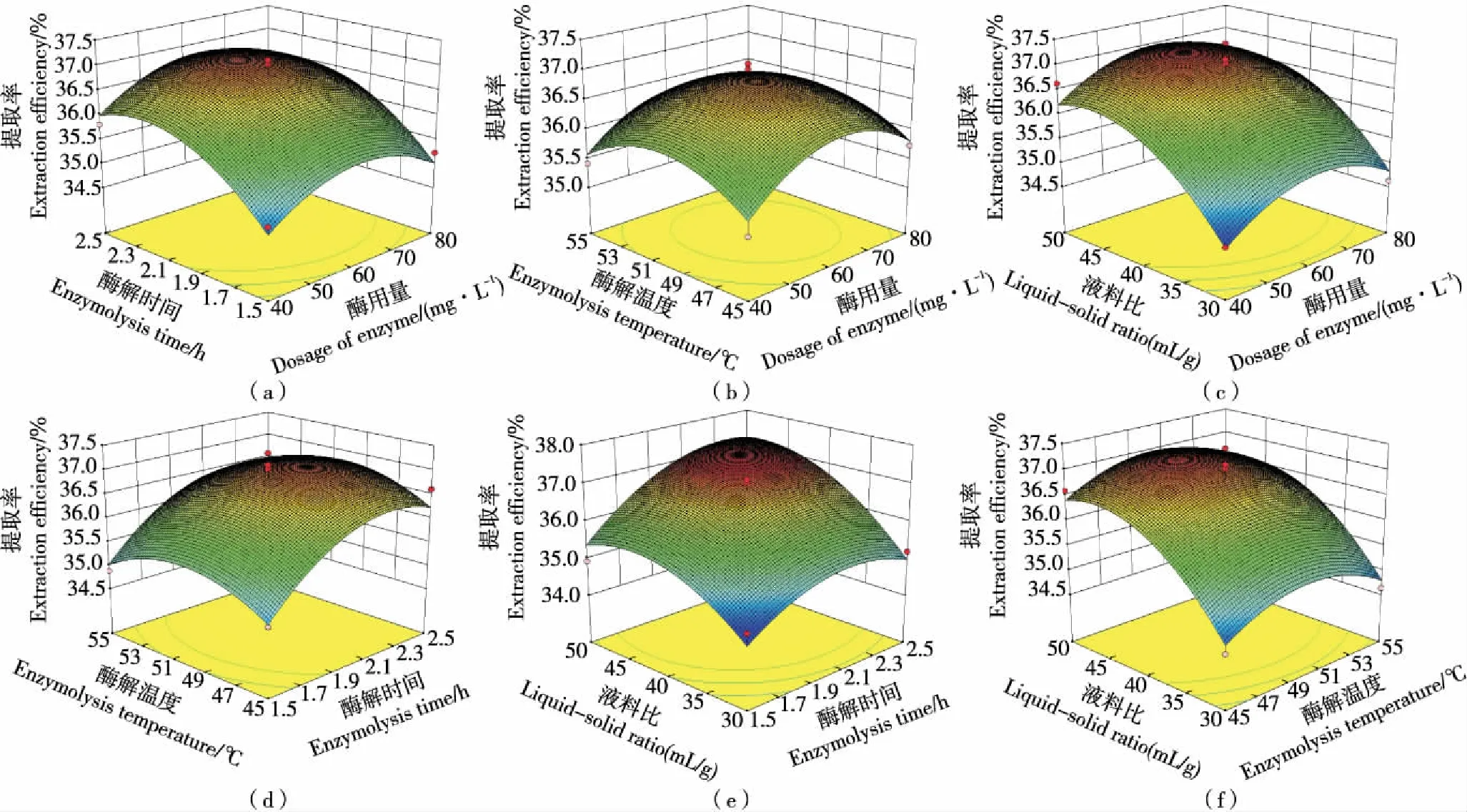
图2 两因素交互作用对花椒油树脂得率影响的响应面图
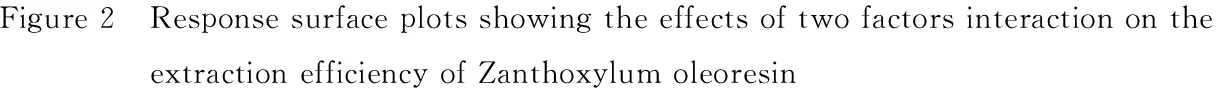
2.3 花椒油树脂GC-MS分析结果
对酶解法提取的花椒油树脂进行GC-MS分析,共鉴定出47种化合物,占总化合物的97.7%,其中含量较多的有:花椒素(10.85%)、柠檬烯二醇(5.94%)、柠檬酸月桂酯(5.38%)、月桂酸(4.98%)、驱蛔萜(4.68%)、松油醇(4.59%)、D-柠檬烯(4.43%)、芳樟醇(4.21%)、香草酸甲酯(3.71%)、月桂醇(3.33%)、香叶酸甲酯(3.20%)、乙酸松油酯(3.20%),其中含量最高的花椒素是决定花椒麻味的主要成分。
3 结论
(1) 本试验采用纤维素酶辅助乙醇提取花椒油树脂,与传统有机溶剂浸提法相比不仅可以缩短提取时间,而且能够提高花椒油树脂提取率。结果表明,花椒油树脂提取最佳工艺条件为:酶用量62.3 mg/L、酶解时间2.3 h、酶解温度50 ℃、液料比47.4∶1 (mL/g),此工艺条件下所得花椒油树脂提取率为37.22%,与李国强[8]采用溶剂浸提法所得花椒油树脂提取率32.50%相比增长了14.5%,因此采用纤维素酶辅助提取技术可以较高程度地提高花椒油树脂的提取率。
(2) 由GC-MS分析结果可知,花椒油树脂中花椒主要麻味成分花椒素含量高达10.85%,对花椒油树脂产品麻味具有重要决定作用,对工业化生产花椒油树脂具有一定指导意义,并能够促进食品、调味品领域对花椒新产品的开发与利用。
(3) 本试验只研究了一种酶对花椒油树脂提取的促进作用,后期将继续考察多种酶复合后的作用效果,以及所得产物的品质及活性。
[1] 肖培根. 新编中药志: 第二卷[M]. 北京: 化学工业出版社, 2002: 253-259.
[2] LEI Hong, WU Jing, WANG Qing, et al. Inhibitory effect of Zanthoxylum bungeanum essential oil (ZBEO) on Escherichia coli and intestinal dysfunction[J]. Food & Function, 2017, 8(4): 1 569-1 576.
[3] LEI Xu-lu, CHENG Shi-rui, PENG Hong-lian, et al. Anti-inflammatory effect of Zanthoxylum bungeanum-cake-separated moxibustion on rheumatoid arthritis rats[J]. African Journal of Traditional Complementary and Alternative Medicines, 2016, 13(1): 45-52.
[4] ZHANG Wen-juan, GUO Shan-shan, YOU Chun-xue, et al. Chemical composition of essential oils from Zanthoxylum bungeanum Maxim. and their bioactivities against Lasioderma serricorne[J]. Journal of Oleo Science, 2016, 65(10): 871-879.
[5] YANG Qian, CAO Wei-dong, ZHOU Xuan-xuan, et al. Anti-thrombotic effects of alpha-linolenic acid isolated from Zanthoxylum bungeanum Maxim seeds[J]. British Medical Council Complementary and Alternative Medicine, 2014, 14: 1-8.
[6] 付陈梅, 阚建全, 陈宗道, 等. 花椒的成分研究及其应用[J]. 中国食品添加剂, 2003(4): 83-85, 122.
[7] 赵秀玲. 花椒的化学成分、药理作用及其资源开发的研究进展[J]. 中国调味品, 2012, 37(3): 1-5.
[8] 李国强. 花椒油树脂提取工艺研究[J]. 中国果菜, 2015, 35(6): 30-33.
[9] 邵杰, 宋瑞雯, 王改玲, 等. 响应面法优化花椒油树脂的超声提取工艺[J]. 食品工业科技, 2012, 33(24): 329-331.
[10] 陶志杰, 王睿, 王改玲, 等. 酶解法辅助提取花椒油树脂的工艺优化[J]. 绥化学院学报, 2014, 34(9): 150-153.
[11] 张巾英, 张明春. 应用纤维素酶提取中草药有效成分的研究进展[J]. 上海中医药杂志, 2007, 41(1): 79-81.
[12] SONG Hui-ting, GAO Yuan, YANG Yi-ming, et al. Synergi-stic effect of cellulase and xylanase during hydrolysis of natural lignocellulosic substrates[J]. Bioresource Technology, 2016, 219: 710-715.
[13] KUHAD R C, DESWAL D, SHARMA S, et al. Revisiting cellulase production and redefining current strategies based on major challenges[J]. Renewable and Sustainable Energy Reviews, 2016, 55: 249-272.
[14] BAS D, BOYACI I H. Modeling and optimization I: Usability of response surface methodology[J]. Journal of Food Engineering, 2007, 78(3): 836-845.
[15] 陈龙飞, 王敏, 范柳萍, 等. 响应面法优化玛咖全粉直接压片法研究[J]. 食品与机械, 2017, 33(2): 169-174.
[16] BUDIHAL S R, AGSAR D, PATIL S R. Enhanced production and application of acidothermophilic Streptomyces cellulase[J]. Bioresource Technology, 2016, 200: 706-712.
[17] 吴秋, 王成忠, 刘家惠. 超临界CO2萃取毛梾籽油及GC-MS分析[J]. 中国粮油学报, 2017, 32(1): 135-140.
[18] 王琛, 石太渊. 双酶酶解法提取姜油树脂工艺优化[J]. 食品科学, 2011, 32(12): 60-63.
[19] 张雪春, 田智宇, 王振兴, 等. 核桃青皮多糖微波辅助提取工艺及抗氧化活性研究[J]. 食品与机械, 2016, 32(7): 146-151.
[20] 张盼盼, 王丽, 时志军, 等. 蓝莓果渣花青素的超声辅助提取工艺优化[J]. 食品与机械, 2017, 33(2): 152-157, 210.
ExtractionoptimizationofenzymehydrolysismethodandGC-MSanalysisonoleoresinfromZanthoxylum
Zanthoxylum was used as the material. Combined cellulase hydrolysis with response surface method to optimize the Zanthoxylum oleoresin (Zoleoresin) extraction process. Results showed that the optimum extraction conditions of Zoleoresin as follows: 50% ethanol as extractant, cellulase dosage was 62.3 mg/L, enzymolysis time was 2.3 h, enzymolysis temperature was 50 ℃, liquid ratio was 47.4∶1(mL/g). In this condition, the extraction efficiency of Zoleoresin was 37.22%. A total of 47 compounds were identified by gas chromatography-mass spectrometry (GC-MS). Main ingredients wereD-limonene, linalool, lauricacid, limonene glycol, alpha-terpineol, ascaridole, citronellyl myristate, xanthoxylin, etc.
cellulase; zanthoxylum oleoresi; extraction efficiency; GC-MS
陕西省重点研发计划项目(编号:2017NY-142)
柴丽琴,女,陕西师范大学在读硕士研究生。
田呈瑞(1955—),男,陕西师范大学教授,博士。
E-mail:chrtian@snnu.edu.cn
2017—05—24
10.13652/j.issn.1003-5788.2017.09.034
