玫瑰发酵液的抗氧化及美白功效探究
2017-11-16曹玉峰丁文玉王昌涛史豆豆张佳婵
赵 丹 曹玉峰 - 丁文玉 -,2 王昌涛,2 -,2 史豆豆 - 虞 旦 张佳婵 - 李 萌
(1. 北京工商大学植物资源研究与开发重点实验室,北京 100083;2. 北京食品营养与人类健康高精尖创新中心,北京 100083) (1. Beijing Key Laboratory of Plant Resources Research and Development, Beijing Technologyand Business University, Beijing 100083, China; 2. Beijing Advanced Innovation Centre for FoodNutrition and Human Health, Beijing 100083, China)
玫瑰发酵液的抗氧化及美白功效探究
赵 丹1ZHAODan1曹玉峰1CAOYu-feng1丁文玉1DINGWen-yu1,2王昌涛1,2WANGChang-tao1,2史豆豆1SHIDou-dou1虞 旦1YUDan1张佳婵1ZHANGJia-chan1李 萌1LIMeng1
(1. 北京工商大学植物资源研究与开发重点实验室,北京 100083;2. 北京食品营养与人类健康高精尖创新中心,北京 100083) (1.BeijingKeyLaboratoryofPlantResourcesResearchandDevelopment,BeijingTechnologyandBusinessUniversity,Beijing100083,China; 2.BeijingAdvancedInnovationCentreforFoodNutritionandHumanHealth,Beijing100083,China)
通过对玫瑰发酵液的抗氧化和美白功效及皮肤安全性进行评价,探究美白机理。利用酿酒酵母发酵玫瑰获得玫瑰发酵液,检测其对自由基的清除作用以及对酪氨酸酶活性与黑色素合成的影响,利用基因芯片检测其美白机理,采用人体斑贴试验评估其皮肤安全性。结果表明,玫瑰发酵液具有较强的清除DPPH自由基能力,对细胞外酪氨酸酶活性的抑制作用与浓度呈正比,对B16细胞内酪氨酸酶活性以及黑色素合成都有一定的抑制作用;玫瑰发酵液能够抑制黑色素瘤通路上游的NGF和FGF2基因表达;人体斑贴试验显示玫瑰发酵液未引起阳性刺激反应。玫瑰发酵液具有较高的皮肤安全性,同时具有抗氧化、抑制酪氨酸酶活性与黑色素生成的功效,其通过抑制NGF和FGF2的表达发挥美白作用。
玫瑰;发酵;美白;抗氧化
蔬菜、谷物等经过发酵处理产生各种香味物质,原料本身的风味得到改善。此外,微生物代谢产生果胶酶、纤维素酶等胞外酶,可以促使植物细胞破裂,释放有效成分,还能去除多种大分子的杂质,并将大分子物质有效降解为小分子物质,更易于人体吸收,从而增强药效[1]。基于以上优势,以及发酵产品价廉物美,质量稳定的特点,现已广泛用于人们的食品和日用品中,如发酵获得酸奶、酒、醋等食品,酵母发酵产品、乳酸菌发酵产品用于保湿、抗老化类的日用品[2-4]。
玫瑰是集药用、食用、美化和绿化为一体的木本植物[5]。成熟的玫瑰中含有大量的维生素、氨基酸、可溶性糖及生物碱[6]。当前,人们对玫瑰进行发酵主要获取玫瑰酒[7]、玫瑰醋[8]、玫瑰饮料[9]等。近年随着酵素的兴起,越来越多的人制作、食用玫瑰酵素,普遍认为其具有消除疲劳,增强体质,美容养颜的功效[10]。但玫瑰发酵后的抗氧化及美白功效方仍缺少科学性、理论性的报道。本试验利用酿酒酵母对玫瑰进行发酵处理,并从抗氧化和美白功效上对其进行评价,以期挖掘发酵玫瑰在抗氧化及美白相关食品方面的应用价值。
1 材料与方法
1.1 材料和仪器
1.1.1 材料与试剂
酵母:酿酒酵母,食品酿造研究所;
玫瑰:大马士革玫瑰,上海仪玳化妆品有限公司;
DPPH:分析纯,西格玛奥德里奇(上海)贸易有限公司;
盐酸、过氧化氢:分析纯,北京化工厂;
硫酸亚铁、邻苯三酚、L-酪氨酸、水杨酸:分析纯,国药集团化学试剂有限公司;
熊果苷:分析纯,上海阿拉丁科技股份有限公司;
酪氨酸酶:25 kU,西格玛奥德里奇(上海)贸易有限公司;
小鼠黑色素瘤细胞(B16)、人角质细胞、人成纤维细胞:中国医学科学院基础医学研究所细胞资源中心;
DMEM低糖(干粉):D523 10×1L,西格玛奥德里奇(上海)贸易有限公司;
二甲基亚砜(DMSO):99.7%,北京百灵威科技有限公司;
FBS:1×(无需稀释可直接使用),美国康宁公司;
青霉素-链霉素:100× (稀释100倍后使用),美国康宁公司。
1.1.2 主要设备仪器
紫外可见分光光度计:T6新世纪型,北京谱析通用仪器有限责任公司;
振荡培养箱:HZQ-X100型,太仓市实验设备厂;
CO2培养箱:WJ-80A-Ⅱ型,上海圣科仪器设备有限公司;
离心机:HC-2518型,北京东南仪诚实验室设备有限公司;
酶标仪:Tecan Sunrise型,帝肯(上海)贸易有限公司;
微型离心机:5810R型,德国Eppendorf公司;
超净工作台:SV-CJ-1FD型,上海苏净实业有限公司。
1.2 试验方法
1.2.1 玫瑰发酵液的制备 取10 g玫瑰干粉与300 mL去离子水于500 mL锥形瓶中混合,并于121 ℃灭菌30 min。吸取20 mL浓度为106~108CFU/mL的酿酒酵母菌菌液在无菌操作台接种到玫瑰干粉与水的混合液中,于35 ℃摇床中震荡培养30 h,获得玫瑰发酵产物;产物于121 ℃灭菌30 min后,于5 000 r/min离心25 min,收集上清液,即为玫瑰发酵液。
1.2.2 成分测定
(1) 总糖:按GB/T 5009.8—2008执行。
(2) 总酚:按GB/T 8313—2008执行。
(3) 蛋白质:按GB 5009.5—2010执行。
(4) 总黄酮:按GB/T 5009.124—2003执行。
1.2.3 玫瑰发酵液的抗氧化能力测定
(1) DPPH 自由基清除试验:取3 mL不同浓度的玫瑰发酵液与2×10-4mol/L的DPPH溶液混匀(A1);取等体积的去离子水与2×10-4mol/L的DPPH溶液混匀(A2);取等体积的无水乙醇与待测液混匀(A3);反应30 min后,在517 nm下测吸光度值。按式(1)计算DPPH自由基清除率。
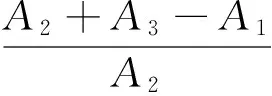
(1)
式中:
EDPPH·——DPPH自由基清除率,%;
A1——样品与DPPH混合液的吸光度;
A2——去离子水与DPPH混合液的吸光度;
A3——无水乙醇与DPPH混合液吸光度。
(2) 羟自由基清除试验:取3 mL浓度为2 mmol/L的FeSO4与3 mL浓度为1 mmol/L的H2O2混匀;加入3 mL浓度为6 mmol/L的水杨酸,摇匀后放入37 ℃水浴中加热15 min后取出;分别加入1 mL不同浓度的样品;以1 mL去离子水作为对照。混匀后水浴加热15 min,取出测其吸光度A样,对照管(去离子水)为A对照。样品用量不变,反应体系替换为去离子水,方法同上,测得样品本底光密度A本。按式(2) 计算羟自由基清除率。

(2)
式中:
E——自由基清除率,%;
A样品——样品与反应液的吸光度;
A对照——以水代替样品与反应液的吸光度;
A本底——与反应体系相同浓度下样品的本底吸光度。
(3) 超氧阴离子清除试验:取2.25 mL 0.05 mol/L 的Tris-HCl缓冲液(pH 8.2)于试管中,在25 ℃水浴中预热20 min,加入0.5 mL不同浓度的玫瑰发酵液和0.2 mL 25 mmol/L的邻苯三酚溶液并混匀,25 ℃水浴中反应5 min后加入0.5 mL 8 mol/L 盐酸终止反应。以Tris-HCl缓冲液作参比,空白对照组以0.5 mL试样溶剂代替样品,以上处理均做3个重复,在299 nm处测吸光度(A样品和A对照)。取不同浓度待测样品0.5 mL,以去离子水代替反应体系于299 nm测定吸光度(A本底)。按式(2)计算超氧阴离子清除率。
1.2.4 玫瑰发酵液的美白能力测试
(1) 体外酪氨酸酶活性的测定:采用酪氨酸酶多巴速率氧化法。各反应体系的物质加入量及顺序见表1。在加入酪氨酸酶后,将反应体系置于37 ℃水浴中保温10 min,再加入0.98 g/L的L-多巴溶液,混匀,反应3 min后于475 nm处测定吸光值。其中,磷酸盐缓冲液为pH=6.8,25 mmol/L。
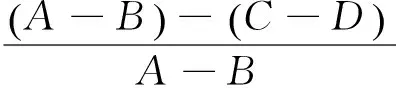
(3)
式中:
A——对照组于有酪氨酸酶体系反应3 min时的吸光度值;

表1 反应液组成Table 1 Composition of reaction solution mL
B——对照组于无酪氨酸酶体系反应3 min时的吸光度值;
C——样品组于有酪氨酸酶体系反应3 min时的吸光度值;
D——样品组于无酪氨酸酶体系反应3 min时的吸光度值;
I——酪氨酸酶活性抑制率,%。
(2) 胞内酪氨酸酶活性抑制试验:将对数生长期间的B16细胞,接种于6孔细胞培养板,于37 ℃,5% CO2培养箱中培养过夜。加入终浓度为0.1%,1.0%,10.0%的样品,样品用DMEM稀释。未加样品组做为细胞对照组,每组3个复孔。培养48 h后,弃上清液,PBS洗涤1次,每孔加入100 μL细胞裂解液,用刮刀刮取收集细胞,收集后取上清离心。取上清液50 μL至96孔板,加入1%左旋多巴50 μL,置于CO2培养箱中孵育1 h。测量475 nm处吸光度值。按式(4)计算细胞反应体系下酪氨酸酶的相对活性。

(4)
式中:
A细胞——细胞反应体系下酪氨酸酶相对活性,%;
OD样品——含有待测样反应体系的吸光度;
OD空白对照——不含任何物质的空板吸光度;
OD细胞对照——不含待测样反应体系的吸光度。
(3) 黑色素合成抑制试验:将对数生长期B16细胞接种于T25细胞培养瓶中,于37 ℃,5% CO2培养箱中培养过夜。分别加入终浓度为0.1%,1.0%和10.0%的玫瑰发酵液,未加样品组做为细胞对照组。培养48 h后,弃上清,PBS洗涤1次,加入1 mol/L NaOH (10% DMSO),用刮刀刮取收集细胞,于80 ℃水浴30 min,取上清液于475 nm处测吸光值。按式(5)计算黑色素相对含量。

(5)
式中:
C黑色素——黑色素相对含量,%;
OD样品——含有待测样反应体系的吸光度;
OD空白对照——不含任何物质的空板吸光度;
OD细胞对照——不含待测样反应体系的吸光度。
1.2.5 玫瑰发酵液作用机理研究
(1) 样品处理及总RNA提取:取对数生长期人表皮角质形成细胞,接种于6孔细胞培养板,待细胞贴壁后,加入终浓度为1.82%的玫瑰发酵液(此浓度下细胞活率为80%),细胞对照组不加样品。于37 ℃,5% CO2培养箱中培养24 h, PBS洗涤1次,按照总RNA提取试剂盒的说明提取细胞总RNA。提取得到RNA后进行琼脂糖凝胶电泳,使用微量分光光度计进行分析。
(2) 人全基因谱表达芯片检测:芯片检测流程由博奥精典有限公司完成。
(3) RT-PCR验证:RT-PCR验证使用天根生化科技(北京)有限公司cDNA第一链合成试剂盒(去基因组)进行cDNA 第一条链合成反应。根据NCBI中发布的待测基因的序列,通过Primer Express软件设计特异性引物,各基因引物序列见表2。
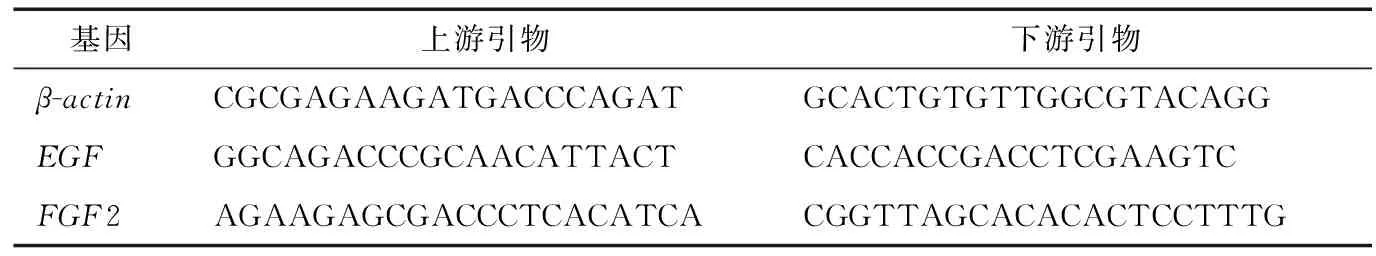
表2 荧光定量PCR引物序列Table 2 Primer sequence of Real-Time PCR
(4) 荧光定量PCR:以cDNA为模板,使用前在1 mL MIX 中加入40 μL的Dye Ⅰ混匀,取MIX 10.4 μL,加入上下游引物各0.5 μL, cDNA 1.0 μL,最后用ddH2O补足到20 μL。
1.2.6 玫瑰发酵液的安全性测试 采用人体皮肤斑贴试验进行测试,具体试验方法参照2007年版《化妆品卫生规范》。
2 结果与分析
2.1 玫瑰发酵液成分测定
玫瑰发酵液富含多糖和蛋白质。由表3可知,经发酵后,总糖含量显著增加,蛋白含量无明显变化;多酚与黄酮含量整体较低,不足1 mg/mL,与未发酵相比,均有下降,可能是高温作用会使多酚和黄酮发生氧化损失。酿酒酵母在发酵过程中会产生多糖[11],可能是引起总糖含量增加的主要原因。
2.2 玫瑰发酵液抗衰老功效评价
如图1所示,采用3种不同的方法检测了20%浓度范围内玫瑰发酵液对DPPH自由基、羟自由基和超氧阴离子的清除能力,在相同作用浓度下,玫瑰发酵液对DPPH自由基的清除作用远高于其对羟自由基和超氧阴离子的。玫瑰发酵液中较高的多糖含量可能是其发挥抗氧化功效的主要成分[12-13]。
2.3 玫瑰发酵液的美白功效评价
2.3.1 生化水平对酪氨酸酶活性的抑制 由图2可知,玫瑰发酵液浓度越高,其对酪氨酸酶活性的抑制效果越强。黑色素的生成过程需要氧化条件,而氧化条件也是影响酪氨酸酶活性发挥的重要因素[14]。玫瑰发酵液对酪氨酸酶活性的抑制可能是其较强的抗氧化作用导致的。
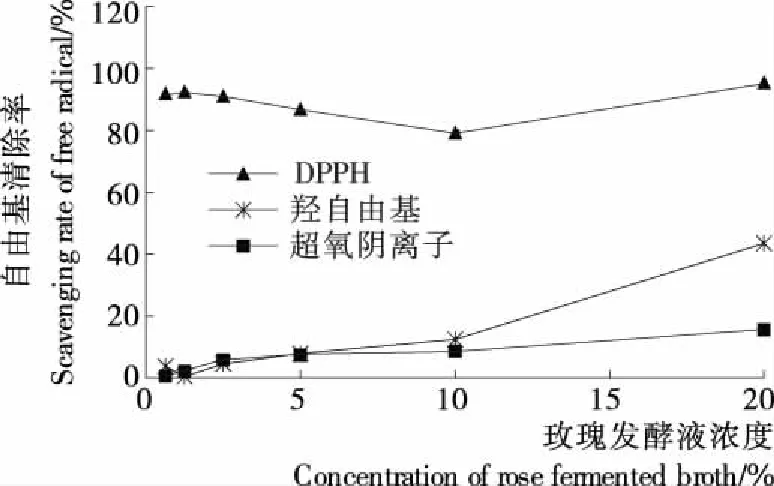
图1 玫瑰发酵液对DPPH自由基、羟自由基和 超氧阴离子的清除作用
Figure 1 Scavenging effect of rose fermented broth on DPPH free radical, hydroxyl radical and superoxide anion

图2 玫瑰发酵液对酪氨酸酶活性的抑制Figure 2 Inhibitory effect of rose fermented broth on activity of tyrosinase
2.3.2 细胞水平玫瑰发酵液的美白功效评价 由图3可知,随玫瑰发酵液浓度增加,其对B16细胞活率的抑制作用越强。0.2%,1.0%,5.0%的玫瑰发酵液作用均能在一定程度上抑制黑色素的合成,其中5.0%浓度时对黑色素的合成及酪氨酸酶活性抑制效果最为显著。表明在此浓度范围内,玫瑰发酵原浆对B16中的酪氨酸酶活性和黑色素合成有抑制效果。
2.3.3 美白作用机理研究 为探究玫瑰发酵液美白作用的分子机理,采用人全基因表达谱芯片对玫瑰发酵液作用后的角质细胞中基因表达情况进行检测。由图4可知,样品所提RNA的电泳条带清晰,同时28S rRNA∶18S rRNA 条带亮度≥2∶1,表明RNA质量符合人全基因表达谱芯片试验要求。OD260/280>1.9,纯度符合要求,综上玫瑰发酵液作用下所提取的角质细胞RNA纯度、完整性均符合表达谱芯片试验要求,可以进行后续的检测。
玫瑰发酵液作用下,黑色素瘤通路发生改变,此通路中共有8个基因发生显著变化,其中位于黑色素瘤通路上游的NGF基因和FGF2基因表达显著降低(见表4)。

图3 玫瑰发酵液对黑色素合成、酪氨酸酶活性及 细胞活率的影响
Figure 3 Effect of rose fermented broth on melanin synthsis, tyrosinase activity and cell viability
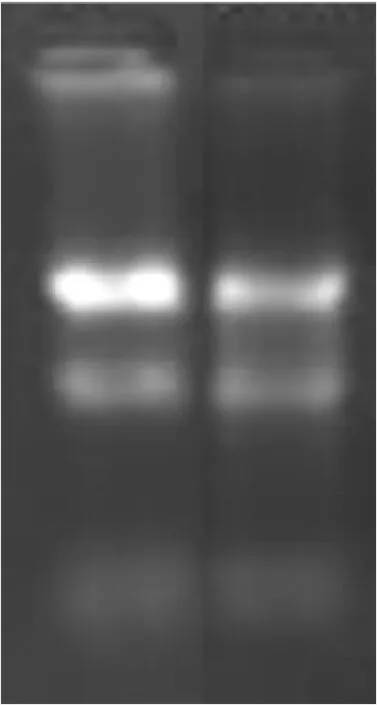
图4 电泳检测总RNA质量Figure 4 Quality detection of RNA by electrophoresis
在黑色素瘤通路中,神经细胞生长因子NGF基因属于GF一类,在角质细胞中,NGF基因能够促进黑色素的合成,其表达在黑色素的形成过程中起重要作用。神经营养因子(NTs)能够提高中央和外周神经系统中神经元的生存神经生长因子(NGF)的表达,可以提高黑色素细胞的生存率。在受到紫外辐射后,NGF表达水平的增加能够提高抗凋亡蛋白 Bcl-2 的表达水平,从而减少黑色素细胞的凋亡[15-16]。玫瑰发酵液作用下NGF基因的下调,可能是降低黑色素合成的关键机制。FGF2是黑色素细胞有丝分裂原[17-18]。角质细胞暴露于UVB下会刺激FGF2的产生,从而对黑色素细胞活性产生影响。然而FGF2 由角质细胞产生,其本身缺少分泌信号,因此FGF2 可能通过角质细胞与黑色素细胞之间的相互接触来影响黑色素细胞的生长。GF家族因子位于黑色素瘤信号通路上游,FGF2、NGF通过与酪氨酸激酶跨膜受体相互作用,在cAMP 升高因子存在时诱导黑色素细胞的有丝分裂功能(见图5)。玫瑰发酵液作用下FGF2和NGF表达降低,通过黑色素瘤通路抑制其有丝分裂,从而抑制黑色素的生成。

表4 黑色素瘤通路中主要变化基因Table 4 The main genes changed in Melanoma signaling pathway

图5 Melanoma信号通路图Figure 5 Melanoma signaling pathway
通过荧光定量方法对NGF和FGF2基因的表达情况进行确认(见图6),NGF与FGF2的相对表达量均降低,小于内参基因β-actin的表达量,此荧光定量结果与芯片结果一致。表明基因芯片检测结果可信。
2.4 皮肤安全性
根据化妆品卫生规范[19],人体斑贴试验结果的判定准则:30例测试者中出现1级皮肤不良反应的多于5人,或者出现2级皮肤不良反应的多于2人,或出现任何1例3级或3级以上不良反应时,则认为受试物对人体有不良反应,反之,则视为对人体无不良反应。
如表5所示,空白组未发生可疑反应,玫瑰发酵组摘除斑试器30 min后有可疑反应1例,24 h后,该例可疑反应消失。根据2007年化妆品规范,可疑反应不足5例可视为样品对人体是安全的,不会产生不良反应。

图6 RT-PCR法验证基因表达量Figure 6 Confirmation of genes expression by RT-PCR表5 人体斑贴试验结果†Table 5 Results of human patch test
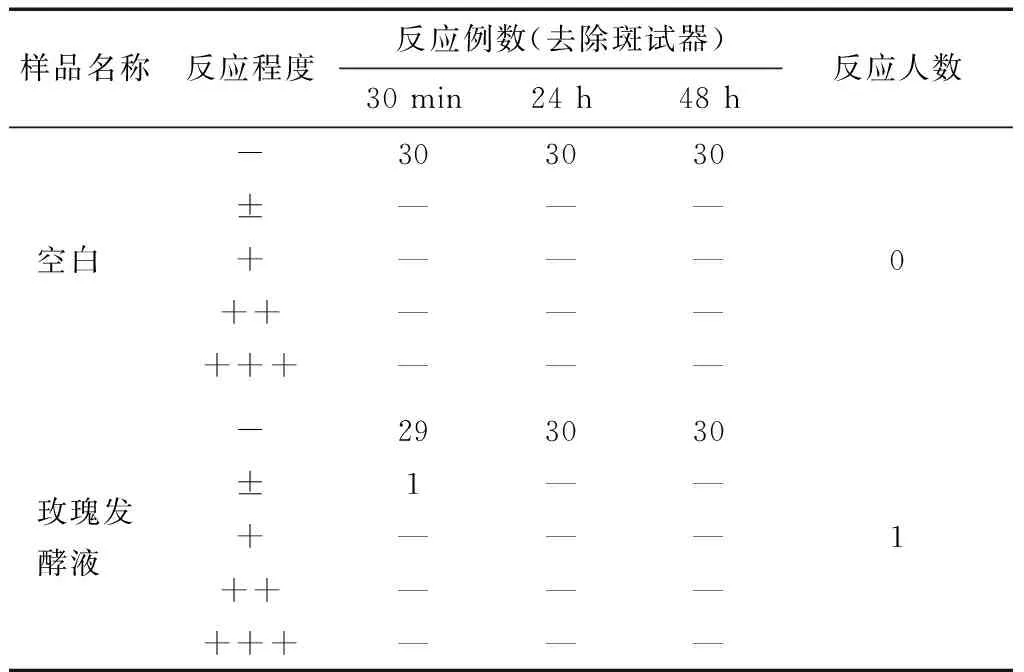
样品名称反应程度反应例数(去除斑试器)30min24h48h反应人数空白 -303030±———+———++———+++———0玫瑰发酵液 -293030±1——+———++———+++———1
† “—”表示阴性反应,0级;“±”表示可疑反应,1级;“+”表示弱阳性反应,2级;“++”表示强阳性反应,3级;“+++”表示极强阳性反应,4级。
3 结论
玫瑰发酵液富含多糖和蛋白质,具有较强的DPPH自由基清除能力;对酪氨酸酶活性有较强的抑制作用,且抑制效果随浓度增加而增强;对B16细胞内的酪氨酸酶活性和黑色素合成有一定的抑制作用。其通过抑制黑色素瘤通路的上游基因FGF2和EGF的表达,降低黑色素细胞的增殖,从而发挥美白功效。玫瑰发酵液具有皮肤安全性。本试验研究了玫瑰发酵液的成分、美白功效,可为其在抗衰老及美白功效食品中的应用提供参考。
[1] 孙静, 马琳, 吕斯琦, 等. 中药发酵技术研究进展[J]. 药物评价研究, 2011, 34(1): 49-52.
[2] 施昌松. 天然活性化妆品的现状与发展趋势[J]. 日用化学品科学, 2012, 35(2): 1-5.
[3] 方燕玉. 天然活性成分在化妆品中的应用研究[D]. 北京: 北京化工大学, 2008: 1-2.
[4] 赵兴秀, 何义国, 邹伟, 等. 发酵培养基对不同方法测量透明质酸结果的影响[J]. 食品与机械, 2016, 32(2): 7-10.
[5] 贾长虹, 常丽新, 杨亚男, 等. 玫瑰叶黄酮提取及其对亚硝酸盐的清除作用[J]. 食品与机械, 2009, 25(5): 78-81.
[6] 张建成. 大马士革玫瑰精油提取和综合利用[D]. 北京: 北京化工大学, 2006: 1-3.
[7] 刘绍军, 刘畅, 张艳霞, 等. 特色玫瑰香葡萄酒发酵工艺优化[J]. 河北科技师范学院学报, 2012(1): 1-4.
[8] 林森. 浙江玫瑰醋纯种发酵技术的研究[D]. 杭州: 浙江工商大学, 2009: 8-12.
[9] 杨洋, 高航. 玫瑰樱桃复合风味发酵乳的研制[J]. 中国奶牛, 2015(5): 43-46.
[10] 莫大美, 吴荣书. 复合菌种发酵法制备玫瑰酵素工艺研究[J]. 食品工业, 2016, 37(10): 64-69.
[11] 包怡红, 刘奇, 王薇. 酿酒酵母胞外多糖发酵工艺条件优化[J]. 酿酒, 2012, 39(2): 58-62.
[12] 帕尔哈提·柔孜, 阿依姑丽·艾合麦提, 朱昆, 等. 玫瑰花瓣总黄酮和总多糖的体外抗氧化活性[J]. 食品科学, 2013, 34(11): 138-141.
[13] 白伟芳, 崔波. 玫瑰花多糖提取及抗氧化活性研究[J]. 食品与机械, 2009, 25(6): 83-86.
[14] 庄永亮, 张燕新, 唐远龙. 玫瑰蜂花粉中不同存在形态酚类物质的组成及其抑制B16黑色素瘤细胞的活性[J]. 现代食品科技, 2016, 32(8): 1-7.
[15] MARCONI A, PANZA M C, BONNET M, et al. Expression and function of neurotrophins and their receptors in human melanocytes[J]. International Journal of Cosmetic Science, 2006, 28(4): 255-261.
[16] YAAR M, GROSSMAN K, ELLER M, et al. Evidence for nerve growth factor-mediated paracrine effects in human epidermis[J]. The Journal of Cell Biology, 1991, 115(3): 821-828.
[17] IMOKAWA G. Autocrine and paracrine regulation of melanocytes in human skin and in pigmentary disorders[J]. Pigment Cell Research, 2004, 17(2): 96-110.
[18] BRENNER M, VINCENT J. Modifying skin pigmentation - approaches through intrinsic biochemistry and exogenous agents[J]. Drug Discovery Today Disease Mechanisms, 2008, 5(2): 189-199.
[19] 中华人民共和国卫生部. 卫监督发〔2007〕1号 化妆品卫生规范[S]. 北京: [出版者不详], 2007: 277-279.
Studyontheantioxidantandwhiteningeffectofrosefermentedbroth
To evaluate the antioxidant, whitening effect and skin safety of rose fermented broth. Method: Rose fermented broth was acquired by fermenting saccharomyces cerevisiae with rose. The skin safety, antioxidant effect and whitening effect were evaluated. The human whole gene expression profile chip was used to explore the whitening mechanism of rose fermented broth. The results showed that the scavenging effect of rose fermented broth on DPPH radical scavenging was obvious and its inhibitory effect on the activity of extracellular tyrosinase was in direct proportional to the concentration. The intracellular tests showed that rose broth had inhibitory effect on tyrosinase activity and melanin synthesis. The gene chip detection showed that the possible mechanism of whitening was inhibiting the growth of melanoma cells by down regulating the gene expressions ofNGFandFGF2 in the melanoma pathway. Human patch test showed that none positive reaction was caused by rose fermented broth. Conclusion: the rose fermented broth had a high skin safety as well as antioxidant and whitening effect. The whitening effect might be caused by down regulation ofNGFandFGF2.
rose; fermentation; whitening; antioxidant
北京工商大学青年教师科研启动基金项目(编号:QNJJ2016-30);质检公益性行业科研专项项目(编号:201410019)
赵丹,女,北京工商大学实验师,硕士。
王昌涛(1975—),男,北京工商大学教授,博士。
E-mail: wangct@th.btbu.edu.cn
2017—06—27
10.13652/j.issn.1003-5788.2017.09.030
