林烟草NsylCBL10启动子的克隆及功能分析
2017-11-16毛静静王倩史素娟张鸽许迪之李书贵刘好宝
毛静静,王倩,史素娟,3,张鸽,3,许迪之,李书贵,3,刘好宝
1 中国农业科学院烟草研究所,农业部烟草生物学与加工重点实验室,山东省青岛市崂山区科苑经四路11号 266101;2 中国农业科学院烟草研究所,烟草行业烟草基因资源利用重点实验室,山东省青岛市崂山区科苑经四路11号 266101;3 青岛农业大学,农学与植物保护学院,山东省青岛市城阳区长城路700号 266109
林烟草NsylCBL10启动子的克隆及功能分析
毛静静1,王倩2,史素娟1,3,张鸽1,3,许迪之1,李书贵1,3,刘好宝1
1 中国农业科学院烟草研究所,农业部烟草生物学与加工重点实验室,山东省青岛市崂山区科苑经四路11号 266101;2 中国农业科学院烟草研究所,烟草行业烟草基因资源利用重点实验室,山东省青岛市崂山区科苑经四路11号 266101;3 青岛农业大学,农学与植物保护学院,山东省青岛市城阳区长城路700号 266109
【目的】探究林烟草(Nicotiana sylvestris)类钙调神经素B亚基蛋白(Calcineurin B-like protein,CBL)基因家族成员NsylCBL10的启动子在烟草不同生长发育过程及光信号刺激下的活性变化。【方法】克隆NsylCBL10启动子并初步预测其顺式作用元件;构建NsylCBL10启动子驱动β-葡萄糖苷酸酶基因(GUS)的融合表达载体并将其转入普通烟草(Nicotiana tabacum),获得转NsylCBL10pro::GUS的纯合材料;利用所获转基因材料探究NsylCBL10启动子在种子萌发期、幼苗期和成熟期的组织特异活性和在幼苗下胚轴的光诱导活性。【结果】预测结果表明,NsylCBL10启动子含有与组织特异性和响应光信号、植物激素和胁迫等相关的顺式作用元件;组织化学染色试验表明,NsylCBL10启动子驱动的GUS基因在种子萌发期主要在子叶节区-根过渡区、根尖表达,子叶伸展期主要在子叶、子叶节区-根过渡区和根尖表达,十字期主要在叶片中表达,成熟期在柱头、成熟的花药、侧根根尖和侧根根基部表达量较高;幼苗下胚轴中,NsylCBL10启动子驱动的GUS的基因表达在光下受到抑制,黑暗下被增强。【结论】NsylCBL10启动子活性在烟草不同发育期的组织中呈现动态变化。在烟草分生能力强的部位和成熟期的花器官中其启动活性较强,在幼苗下胚轴中的启动子活性受到光信号的调控。
林烟草;NsylCBL10;启动子;GUS活性;组织特异性
植物在整个生长发育期易遭受多种生物或非生物胁迫,因而它们在长期的进化过程中形成了复杂的防御机制。类钙调神经素B亚基蛋白(Calcineurin B-like protein,CBL)家族是一类植物中特有的钙感受器,在细胞响应外界生物或非生物胁迫过程中发挥重要作用[1]。当感应到胁迫刺激时,细胞通过增加Ca2+流入使胞内的Ca2+浓度骤增[2],这些Ca2+浓度的改变会被下游的CBL感知[3]。CBL通过EF手型结构结合Ca2+后,构象发生改变并导致分子疏水特性等的改变[4]。通常情况下,这种改变促使CBL与下游CBL互作蛋白激酶(CBL-interacting protein kinase,CIPK)结合并使其激活,进一步将信号向下游靶标传递,最终引起植物对胁迫的响应[5]。
CBL10是CBL蛋白家族中的重要成员,该蛋白参与植物抵抗高盐、干旱和低温胁迫、调节钾素营养和应对病菌侵染等功能已在多个物种中被证实。拟南芥(Arabidopsis thaliana)编码AtCBL10的基因AtCBL10缺失后,突变体cbl10在高盐胁迫下表现出盐敏感表型,而过表达AtCBL10可消除cbl10突变体的盐敏感表型[6]。研究认为,AtCBL10-AtCIPK24蛋白复合体通过磷酸化液泡膜上的Na+/H+转换体,使该转运体将细胞内多余的Na+转运到液泡中,从而避免胞内Na+浓度过高造成的生理紊乱[6-7]。过表达AtCBL10还可促进拟南芥在高盐胁迫下的结实,但该过程不依赖于AtCIPK24[8]。CBL10增强植物耐盐能力的功能同样在白杨(Populus trichocarpa)[9]、胡杨(Populus euphratica)[10-11]和玉米(Zea mays)[12]中得到验证。研究中同时发现,胡杨PeCBL10转入毛白杨中,可增强后者对干旱、低温的抵御能力[11]。AtCBL10可直接作用于钾离子通道AKT1(Arabidopsis K+transporter),抑制其K+内流活性,从而参与细胞内钾离子平衡的调节[13]。番茄细菌性斑点病菌侵染后,番茄(Solanum lycopersicum)SlCBL10-SlCIPK6蛋白复合体可激活位于质膜上的呼吸爆发氧化酶(Respiratory burst oxidase,RBOH)家族成员RBOHB,诱导活性氧产生,使被侵染部位的组织发生细胞程序性死亡从而避免病菌的进一步扩散[14]。
利用GUS组织化学染色的方法研究启动子的活性调控,或采用实时荧光定量PCR(qRT-PCR)技术分析基因的转录表达模式,可为研究基因的调控机理及新功能提供线索。研究表明,拟南芥AtCBL10启动子驱动GUS报告基因表达的研究表明,GUS主要在拟南芥萌发期的子叶与成熟期的茎、叶和花中表达,在成熟期根中的表达较弱[6-7]。qRT-PCR测定结果与之基本一致[6]。该结果为后续进一步阐明AtCBL10在耐盐及高盐胁迫下的育性提供了数据支持[6-8]。对杜梨(Pyrus betulaefolia)PbCBL10启动子的研究表明,CaCl2、NAA和6-BA处理可提高启动子的活性[15]。qRT-PCR也证明在上述处理下,PbCBL10的表达上调。推测这些信号通过调节PbCBL10启动子活性增强下游基因的表达[15]。
本课题组前期研究发现高盐可诱导林烟草(Nicotiana sylvestris)NsylCBL10的表达上调,在拟南芥中过表达该基因显著增强了植株的耐盐能力[16]。但NsylCBL10在烟草自身的生长发育过程及其它信号刺激下的功能尚不清楚。本研究旨在通过克隆NsylCBL10的上游启动区序列并进行启动子活性分析,预测NsylCBL10基因的转录表达模式,进而为研究NsylCBL10的调控机理及新功能提供线索。
通过生物信息学和GUS化学染色手段,探究NsylCBL10启动子在烟草生长发育不同阶段及光信号刺激下的活性。所获结果对解析NsylCBL10在烟草生长发育过程和响应外界环境信号中的作用提供试验数据。
1 材料与方法
1.1 试验材料
植物材料:实验材料为林烟草(Nicotiana sylvestris)和普通烟草(Nicotiana tabacum)中烟100,由中国农业科学院烟草研究所种质资源中心提供。
菌株和载体:质粒构建所用菌株为大肠杆菌(Escherichia coli)DH5α,所用载体为pMD19-T载体,均购自宝生物工程(大连)有限公司。转基因实验所用菌株为根癌农杆菌(Agrobacterium tumefaciens)EHA105, 转 化 载 体 为 pBI101(GenBank号:U12639.1),均由本课题组自存。
1.2 试验方法
1.2.1 NsylCBL10启动子的克隆及质粒构建
在 NCBI网 站(https://www.ncbi.nlm.nih.gov/)上,以本课题组克隆到的NsylCBL10(GeneBank号:KF667488.1)[16]序 列 进 行BLAST分 析, 将NsylCBL10定位到Contig NW_009386659.1上的Sca ff old Nsyl_sca ff old14307。根据Nsyl_sca ff old14307的序列设计引物对NsylCBL10-1F/NsylCBL10pro-1R(表1),以林烟草基因组DNA为模版,扩增NsylCBL10上游启动子片段。将该片段连入pMD19-T后获得质粒pMD19-T-NsylCBL10pro。以质粒pMD19-T-NsylCBL10pro为模版,以NsylCBL10pro-2F/NsylCBL10pro-2R(表1)为引物对,扩增获得两端引入XbaⅠ和SmaⅠ酶切位点的启动子片段,片段经酶切后连入pBI101载体相对应的酶切位点,最终得到NsylCBL10启动子驱动β-葡糖醛酸酶基因(GUS)的表达载体pBI101-NsylCBL10pro::GUS,测序无误后用于转基因试验。

表1 引物目录Tab.1 Primers design
1.2.2 NsylCBL10启动子序列分析
启动子元件采用PLANTCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线软件和网站SoftBerry(https://www.softberry.com/)中的Nsite工具进行预测,转录起始序列采用网站SoftBerry中的Motif Explorer工具进行分析。
1.2.3 烟草转NsylCBL10pro::GUS纯合株的获取
采用农杆菌介导的叶盘转化法[17]将NsylCBL10::GUS片段转入中烟100中获得T0代转基因植株;用引物对NsylCBL10pro-3F/GUS-R(表1)对T0代转基因植株进行PCR鉴定,收获PCR鉴定阳性材料的自交种(T1代);对T1代进行硫酸卡那霉素(Kanamycin,Kan)抗性筛选(筛选浓度=50 mg/L,下同;筛选量>200粒),其中抗性分离比约为3:1(抗:不抗)的材料为单拷贝插入株系;分别收获T1代单拷贝插入株系材料的单株自交种(T2代),对T2代进行Kan抗性筛选(筛选量>100粒),其中全部具有Kan抗性的材料为T2代纯合转基因植株;收获T2代纯合单株的自交种(T3代),用于GUS组织化学染色试验。
1.2.4 GUS组织化学染色方法
GUS染色液的配制参照Je ff erson[18-19]的方法并加以调整。GUS染液配方为:0.1 mol/L的磷酸盐缓冲液(pH 7.0),1 mg/mL的X-Gluc(先用DMF将X-Gluc溶解为100 mg/mL溶液),0.05 mmol/L的铁氰化钾,0.05 mmol/L的亚铁氰化钾,0.1%的Triton X-100。
取NsylCBL10pro::GUS转基因纯合材料的相应组织,在避光条件下加入-20℃预冷的90%丙酮中,于冰上固定15~20 min,然后转移浸入X-Gluc染液中,37℃避光孵育3~10 h(萌发期组织染色3 h,其他时期组织全部染色10 h),然后用乙醇乙酸混合物(75%乙醇+25%冰醋酸)将组织色素漂净,最后存储在75%乙醇中。
2 结果与分析
2.1 林烟草NsylCBL10基因启动子的克隆及序列分析
扩增得到的NsylCBL10启动子长度为2026 bp(图1),在林烟草基因组中位于起始密码子ATG上游-2110~-85 bp处(以A碱基位置为“0”)。启动子序列预测结果表明,NsylCBL10转录起始序列位于-177~-148 bp处且-169 bp处存在一个TATA-box。启动子上有14个得分(Matrix Score)大于5的增强元件CAAT-box(表2)。通过与已知真核生物的顺式调控元件比较,共预测到5种主要的顺式作用元件(表2),分别为:(1)组织特异性元件,包括花器官特异性表达元件CArG2、胚乳特异性表达元件Skn-1 motif和分生组织特异性表达元件CAT-box;(2)光响应元件,如I-box、G-box和GT1-motif等;(3)生理周期调控元件circadian;(4)植物激素响应元件,包括与水杨酸相关的TCA-element和TGA-box,与生长素相关的TGA-box和与茉莉酸甲酯相关的TGACG-motif;(5)胁迫响应元件,如与低氧胁迫相关的ARE以及高低温响应元件HSE。另外,启动子上还有其他一些调节元件的存在,如蛋白结合位点HD-Zip 3和代谢调节元件O2-site。以上分析表明,NsylCBL10启动子可能受光调控,在烟草的花、胚乳及分生组织中有活性,其活性可能还受到一些激素和非生物胁迫的调控。

图1 NsylCBL10基因启动子PCR扩增结果Fig.1 PCR ampli fi cation result of NsylCBL10 promoter

表2 NsylCBL10启动子顺式作用元件预测结果汇总Tab.2 Prediction of cis-acting elements of NsylCBL10promoter

续表2
2.2 烟草纯合NsylCBL10pro::GUS转基因株系的获得
按照1.2.3的筛选方法,采用叶盘法将NsylCBL10pro::GUS片段转入普通烟草,经基因组水平阳性鉴定(图2A)后共获得20个T0代株系,收获自交种T1代;对T1代进行抗性筛选(图2B),获得2个单拷贝插入的T1株系;T1单株自交后收获T2代,抗性筛选(图2C)后,获得2份不同单拷贝插入的NsylCBL10pro::GUS转基因纯合材料;自交后收获T3代,用于GUS组织化学染色试验。
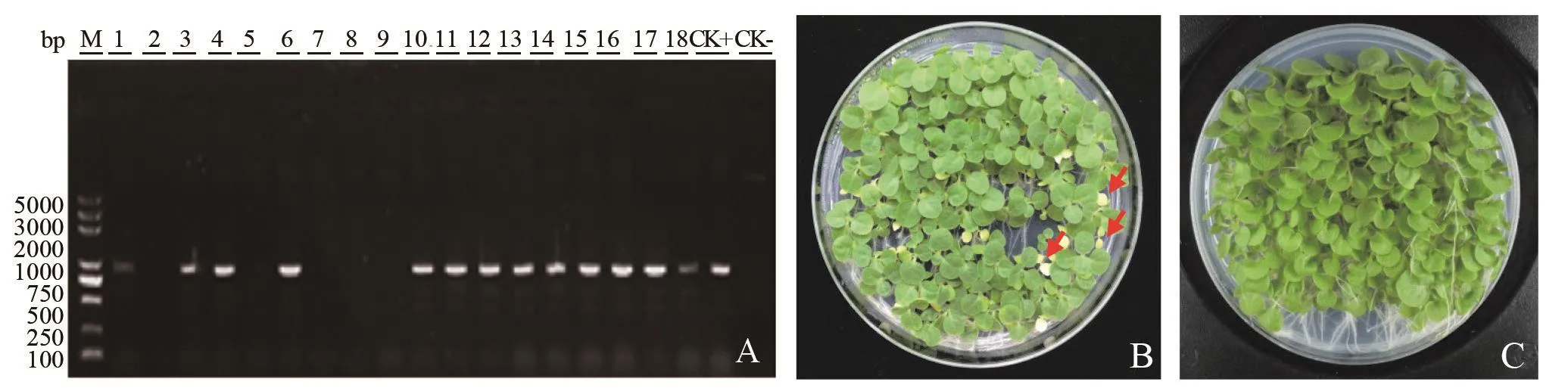
图2 烟草NsylCBL10pro::GUS转基因纯合株的筛选Fig.2 The screening of homozygous NsylCBL10pro::GUS transgenic tobacco lines
2.3 NsylCBL10pro::GUS转基因烟草的组织化学染色分析
利用GUS化学染色方法,对NsylCBL10pro::GUS转基因材料的未成熟种子及幼苗进行GUS活性检测,以确定NsylCBL10的表达定位情况。结果表明,在未成熟的种子表皮中检测到GUS活性(图3A);在种子萌发期,主要在子叶节区—根过渡区[20]周围和根尖处检测到GUS活性(图3B-E);在子叶伸展期,主要在子叶中检测到GUS活性,而子叶节区-根过渡区具GUS活性区域有所减少,根尖处仍能检测到GUS活性(图3F-G);在烟草小十字期,烟草叶片中具有很强的GUS活性(图3H-I);在烟草大十字期,叶片中具有较强的GUS活性,根部也可检测到微弱的GUS活性(图3J)。
对NsylCBL10pro::GUS转基因材料成熟期的花器官和根部组织进行GUS活性检测。结果表明,柱头在整个发育过程中均有很高的GUS活性;更细致的观察发现,柱头上的乳突细胞中GUS活性很强(图3K-L)。花药中的GUS活性随着雄蕊的成熟逐渐增强,主要表现为:花器官形成初期的花药中未检测到明显的GUS活性,花药成熟散粉时具较强的GUS活性(图3K)。成熟期的多数花粉被染成蓝色,仅有个别无着色(图3M)。侧根根尖和侧根根基部也检测到较强的GUS活性(图3N)。
以上结果说明,NsylCBL10启动子在烟草生长发育期的不同组织中有不同程度的活性,与顺式作用元件的预测结果基本吻合。推测NsylCBL10基因在胚乳、叶片、根尖、柱头和成熟的花粉中发挥作用。
2.4 烟草幼苗下胚轴NsylCBL10启动子活性受光信号调节
NsylCBL10启动子序列预测表明,该序列上分布有多个光信号响应元件,如GA-motif、GT1-motif、box4、G-box和DOF1等(表2)。同时,还含有与昼夜节律相关的生理周期调控元件circadian(表2)。因此,推测NsylCBL10启动子活性受光信号的调节。
为了进一步验证上述推测,分别对光照和黑暗下萌发的NsylCBL10pro::GUS转基因材料种子进行GUS活性检测。结果发现:在萌发期,光照条件下的幼苗在根部和子叶节区-根过渡区都检测到GUS活性,子叶和下胚轴中未检测到明显GUS活性(图3C-E;图4A-C),黑暗条件下的幼苗各个部位均有很强的GUS活性(图4E-G);在子叶期,光照条件下的幼苗在根尖、子叶节区—根过渡区、子叶中检测到很强的GUS活性,下胚轴中未检测到明显GUS活性(图3F-G;图4D),而黑暗条件下的幼苗各个部位均检测到较强的GUS活性(图4H)。上述结果初步表明,烟草幼苗下胚轴中NsylCBL10启动子活性可能受到光信号的调控,在光下该活性受到抑制。
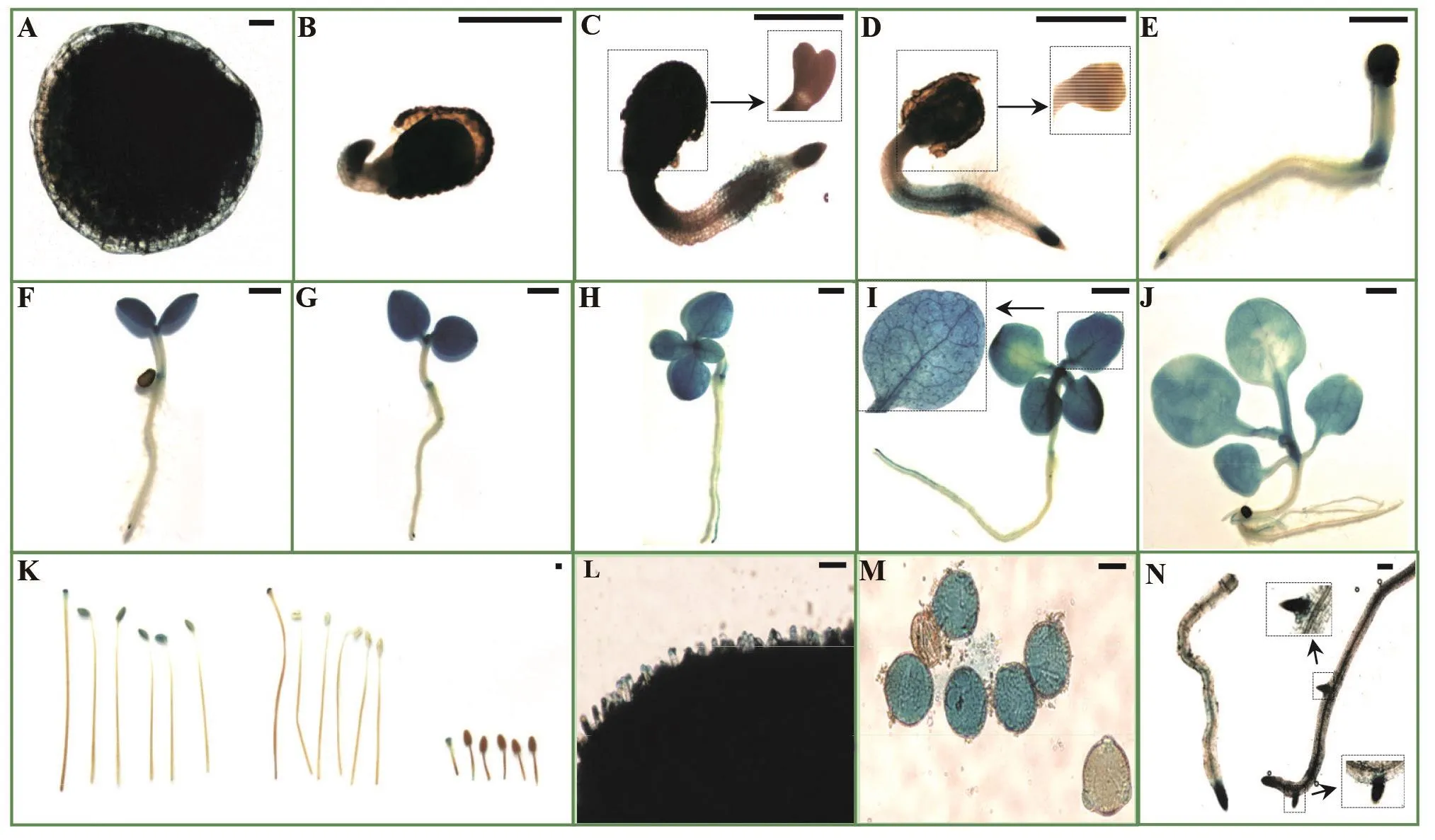
图3 不同生育期NsylCBL10pro::GUS转基因烟草的GUS染色结果Fig.3 The GUS staining of NsylCBL10pro::GUS transgenic tobacco plants in different developmental stages

图4 光照或黑暗条件下萌发的NsylCBL10pro::GUS转基因烟草的GUS染色结果Fig.4 The GUS staining of light- or dark-germinated NsylCBL10pro::GUS transgenic tobacco plants
为进一步探究光照对NsylCBL10启动子活性的影响,对连续光照培养10 d的NsylCBL10pro::GUS转基因幼苗进行0 d、2 d、6 d、9 d和12 d的黑暗处理。结果发现,处理6 d后下胚轴开始检测到GUS活性,且该活性具有随处理时间的延长逐步增强的趋势,黑暗处理6-12 d启动子活性增强更为明显(图5)。12 d后,对NsylCBL10pro::GUS转基因幼苗恢复光照处理,取恢复光照后3 h、6 h、9 h和12 h的转基因苗进行GUS染色。结果发现,恢复光照3 h后下胚轴GUS活性开始降低,12 h后已经检测不到明显的GUS活性(图5B)。上述结果初步表明,烟草幼苗下胚轴处NsylCBL10启动子活性受到光信号调控,在光照条件下被抑制,在黑暗条件下被激活。

图5 黑暗处理或恢复光照处理下NsylCBL10pro::GUS转基因烟草幼苗的GUS染色结果Fig.5 The GUS staining of dark- or recovered light-grown NsylCBL10pro::GUS transgenic tobacco plants
3 讨论
3.1 NsylCBL10启动子在不同生长期的组织特异活性分析
NsylCBL10启动子包含与分生组织表达相关调控元件CAT-box和生长素相关的调节元件TGA-box和TGA-element。组织化学染色结果显示,幼苗期烟草的叶片、子叶节区-根过渡区、根尖、暗培养条件下的下胚轴成熟期烟草的根尖、侧根根基部GUS活性较高,说明该启动子在生长旺盛或分生能力较强的组织中驱动能力较强。前人结果也表明,NsylCBL10在腋芽中表达量较高[16],PbCBL10在新叶中的表达量显著高于老叶[15]。因此,推测生长素可能在NsylCBL10启动子活性的调控过程中发挥重要作用,NsylCBL10可能参与这些分生组织的形成分化。
已有研究表明,AtCBL10的启动子在拟南芥雄蕊的花丝、雌蕊的柱头和传导管中可驱动GUS大量表达[8],且AtCBL10已被证明在拟南芥的雄蕊和雌蕊的发育中发挥重要作用[8]。在高盐胁迫下,AtCBL10缺失后导致拟南芥雄蕊不能正常伸长、花药无法正常开裂、花粉在柱头上萌发和花粉管的伸长受阻,过表达AtCBL10可恢复cbl10突变体在高盐条件下的雄蕊和雌蕊的发育[8]。本研究中,NsylCBL10启动子中含有与花器官发育相关的作用元件CarG2[21],且其在成熟花药和雌蕊的柱头中有较强的驱动活性。因此推测NsylCBL10启动子可能通过调节NsylCBL10的表达,参与烟草花器官的发育过程。
3.2 NsylCBL10启动子在幼苗下胚轴的光诱导活性分析
NsylCBL10启动子包含多个光响应元件,如I-box[22]、G-box[22]和GT1-motif[23]等。进一步研究发现:连续光照培养下的NsylCBL10pro::GUS转基因幼苗进行黑暗处理6 d后,下胚轴中开始检测到GUS活性,黑暗处理6~12 d内GUS活性逐渐增强;恢复光照6 h后下胚轴中的GUS活性开始减弱,恢复光照12 h后已经检测不到GUS活性。这表明幼苗下胚轴中NsylCBL10启动子的驱动能力在光照被抑制,黑暗下被激活,且对光信号的抑制调控更加敏感。光照可影响生长素的分布和极性运输[24],参与调节下胚轴的生长发育[25]。推测光照使下胚轴中生长素的浓度改变,进而激活NsylCBL10启动子上的生长素响应元件,从而增强了下胚轴中NsylCBL10启动子的驱动活性。
4 结论
本研究通过分析NsylCBL10启动子驱动GUS报告基因在烟草中的表达情况,系统检测了该启动子在烟草萌发期、幼苗期和成熟期组织中的活性及其在幼苗下胚轴的光诱导活性。结果表明:(1)NsylCBL10启动子在烟草多个组织中具有驱动活性,且该活性在萌发期、幼苗期和成熟期中发生动态变化。(2)NsylCBL10启动子在幼苗的根尖和子叶节区—根过渡区、花器官的柱头和成熟的花药等组织中具有组织特异活性。(3)NsylCBL10启动子活性在幼苗下胚轴中受到光信号的调节。因此,NsylCBL10启动子是一个诱导性启动子,可随生长发育阶段和环境因素的变化从转录水平上实现对下游基因的精密调控。在分子育种中,可根据NsylCBL10启动子对生长发育信号和外界环境信号的响应特点,结合NsylCBL10基因的功能,使NsylCBL10按照人们的意愿在适当的发育阶段和外界条件的诱导下表达,实现对烟草性状的精确改良。
[1]Kudla J, XU Qiang, Harter K, et al. Genes for calcineurin B-like proteins in Arabidopsis are differentially regulated by stress signals[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(8):4718-4723.
[2]Trewavas A J and Malhό R. Ca2+signalling in plant cells:the big network![J]. Current Opinion in Plant Biology,1998, 1: .428-433.
[3]Allen G J and Schroeder J I. Combining genetics and cell biology to crack the code of plant cell calcium signaling[J].Science’s Stke, 2001, 2001: re13.
[4]Sánchez-Barrena M J, Martínez-Ripoll M, ZHU Jiankang,et al. The structure of the Arabidopsis thaliana SOS3:molecular mechanism of sensing calcium for salt stress response[J]. Journal of Molecular Biology, 2005, 345(5):1253-1264.
[5]MAO Jingjing, Manik S M, SHI Sujuan, et al. Mechanisms and physiological roles of the CBL-CIPK networking system in Arabidopsis thaliana[J]. Genes, 2016, 7(9): 1-15.
[6]Kim B G, Waadt R, Cheong Y H, et al. The calcium sensor CBL10 mediates salt tolerance by regulating ion homeostasis in Arabidopsis[J]. The Plant Journal, 2007,52(3): 473-484.
[7]QUAN Ruidang, LIN Huixin, Mendoza I, et al. SCABP8/CBL10, a putative calcium sensor, interacts with the protein kinase SOS2 to protect Arabidopsis shoots from salt stress[J]. The Plant Cell, 2007, 19(4): 1415-1431.
[8]Monihan S M, Magness C A, Yadegari R, et al. Arabidopsis calcineurin B-like 10 functions independently of the SOS pathway during reproductive development in saline conditions[J]. Plant Physiology, 2016, 171(1): 369-379.
[9]TANG Renjie, YANG Yang, YANG Lei, et al. Poplar calcineurin B-like proteins PtCBL10A and PtCBL10B regulate shoot salt tolerance through interaction with PtSOS2 in the vacuolar membrane[J]. Plant Cell and Environment, 2014, 37(3): 573-588.
[10]LI Dandan, XIA Xinli, YIN Weilun, et al. Two poplar calcineurin B-like proteins confer enhanced tolerance to abiotic stresses in transgenic Arabidopsis thaliana[J].Biologia Plantarum, 2012, 57(1): 70-78.
[11]LI Dandan, SONG Shuyu, XIA Xinli, et al. Two CBL genes from Populus euphratica confer multiple stress tolerance in transgenic triploid white poplar[J]. The Plant Cell, Tissue and Organ Culture (PCTOC), 2012, 109(3): 477-489.
[12]张凡. 玉米逆境胁迫响应基因ZmSnRK2.11、ZmCBL9及ZmCBL10的功能分析[D]. 北京: 中国农业大学, 2014.ZHANG Fan. Functional analysis of maize stress response genes ZmSnRK2.11, ZmCBL9 and ZmCBL10[D]. Beijing:Chinese Agriculatural University, 2014.
[13]REN Xiaoling, QI Guoning, FENG Hanqian, et al.Calcineurin B‐like protein CBL10 directly interacts with AKT1 and modulates K+homeostasis in Arabidopsis[J].The Plant Journal, 2013, 74(2): 258-266.
[14]de la Torre F, Gutiérrez-Beltrán E, Pareja-Jaime Y, et al. The tomato calcium sensor Cbl10 and its interacting protein kinase Cipk6 define a signaling pathway in plant immunity[J]. The Plant Cell, 2013, 25(7): 2748-2764.
[15] 许园园, 蔺经, 李晓刚, 等. 杜梨PbCBL10基因表达与启动子功能分析[J]. 果树学报, 2014, 31(6): 1024-1031.XU Yuanyuan, LIN Jing, LI Xiaogang, et al. Expression of the PbCBL10 gene and functional analysis of its promoter in pear plants (Pyrus betulaefolia)[J]. Journal of Fruit Science, 2014, 31(6): 1024-1031.
[16]DONG Lianhong, WANG Qian, Manik S M N, et al.Nicotiana sylvestris calcineurin B-like protein NsylCBL10 enhances salt tolerance in transgenic Arabidopsis[J]. Plant Cell Report, 2015, 34(12): 2053-2063.
[17]Horsch R B, Fry J E, Hoffman N L, et al. A simple and general method for transferring genes into plants[J].Science, 1985, 227: 1229-1231.
[18]Je ff ersion R A. Assaying chimeric genes in plants: the GUS gene fusion system[J]. Plant Molecular Biology Reporter,1987, 5(1): 387-405.
[19]Jefferson R A, Kavanagh T A and Bevan M W. GUS fusions: β-glucuronidase as a sensitive and versatile gene fusion marker in higher plants[J]. The EMBO Journal,1987, 6(13): 3901-3907.
[20]谷安根, 王立军. 子叶节区理论研究进展[J]. 植物学通报, 1997, 14(3): 30-39.GU Angen, WANG Lijun. Advances in cotyledon node zone theory [J]. Chinese Bulletin of Botany, 1997,14(3): 30-39.
[21]Tilly J J, Allen D W and Jack T. The CArG boxes in the promoter of the Arabidopsis floral organ identity gene APETALA3 mediate diverse regulatory effects[J].Development, 1998, 125: 1647-1657.
[22]Donald R G and Cashmore A R. Mutation of either G box or I box sequences profoundly a ff ects expression from the Arabidopsis rbcS-1 A promoter[J]. The EMBO Journal,1990, 9(6): 1717-1726.
[23]Lam E and Chua N H. GT-1 binding site confers light responsive expression in transgenic tobacco[J]. Science,1990, 248(4954): 471-474.
[24]Halliday K J, Martinez-García J F and Josse E M.Integration of light and auxin signaling[J]. Cold Spring Harbor Perspectives in Biology, 2009, 1(6): 1-11.
[25]Jensen P J, Hangarter R P and Estelle M. Auxin transport is required for hypocotyl elongation in light-grown but not dark-grown Arabidopsis[J]. Plant Physiology, 1998, 116:455-462.
:MAO Jingjing, WANG Qian, SHI Sujuan , et al. Cloning and functional analysis of NsylCBL10 promoter in Nicotiana sylvestris[J]. Acta Tabacaria Sinica, 2017, 23(2)
*Corresponding author.Email:liuhaobao@caas.cn
Cloning and functional analysis of NsylCBL10 promoter in Nicotiana sylvestris
MAO Jingjing1, WANG Qian2, SHI Sujuan1,3, ZHANG Ge1,3, XU Dizhi1, LI Shugui1,3, LIU Haobao1*
1 Key Laboratory of Tobacco Biology and Processing, Tobacco Institute of Chinese Academy of Agricultural Sciences, Qingdao 266101, China;2 Key Laboratory of Tobacco Gene Resources, Tobacco Institute of Chinese Academy of Agricultural Sciences, Qingdao 266101, China;3 Institute of Agriculture and Plant Protection, Qingdao Agricultural University, Qingdao 266109, China
【Objective】The aim of current study was to identify promoter activities of Nicotiana sylvestris Calcineurin B-like Protein family gene NsylCBL10 in the developmental processes and light-responsive processes of tobacco plants. 【Methods】The promoter of NsylCBL10 was cloned and its cis-acting regulatory elements were analyzed. A fusion vector NsylCBL10pro::GUS was constructed and transformed into Nicotiana tabacum. GUS staining of the transgenic plants was conducted to analyze the tissue-speci fi c and lightresponsive characteristics of NsylCBL10 promoter. 【Results】NsylCBL10 promoter was predicted to contain various cis-acting regulatory elements, including tissue-speci fi c elements, light-responsive elements, phytohormone responsive elements and stress-responsive elements.The activity of NsylCBL10 promoter was mainly detected in cotyledon node-root transition section and root tips during germination stage,while the active region expanded to cotyledons during cotyledon extension stage. The activity was detected in leaves of seedlings at crossseedling stage, and in stigma, mature anther, tip and base of lateral root of adult plants. Additionally, it was found that the activity of NsylCBL10 promoter was down-regulated under light condition while up-regulated in the dark. 【Conclusions】The activity of NsylCBL10 promoter varied in temporal and spatial manners in tobacco tissues and was greatly regulated in hypocotyl by the light signal.
Nicotiana sylvestris; NsylCBL10; promoter; GUS activity; tissue speci fi city
毛静静,王倩,史素娟,等. 林烟草NsylCBL10启动子的克隆及功能分析[J]. 中国烟草学报,2017, 23(2)
中国农业科学院科技创新工程(No. ASTIP-TRIC03);烤烟优质轻简高效栽培技术研究(No. SCYC201602)
毛静静(1992—),硕士,研究方向为作物栽培,Tel:0532-88701031,Email:maojingjing40@163.com
刘好宝(1964—),Tel:0532-88702576,Email:liuhaobao@caas.cn
2017-01-09;< class="emphasis_bold">网络出版日期:
日期:2017-03-14
