人参皂苷CK联合5-氟尿嘧啶对人胰腺癌PANC-1细胞的增殖、凋亡及上皮间质转化的影响Δ
2017-11-16崔江河韩光宇何光梅尹媛媛马娜刘琳牡丹江医学院附属红旗医院消化科黑龙江牡丹江570牡丹江医学院附属红旗医院普外科黑龙江牡丹江570牡丹江医学院附属红旗医院泌尿外科黑龙江牡丹江570
崔江河,韩光宇,何光梅,尹媛媛,马娜,刘琳(.牡丹江医学院附属红旗医院消化科,黑龙江牡丹江570;2.牡丹江医学院附属红旗医院普外科,黑龙江牡丹江570;.牡丹江医学院附属红旗医院泌尿外科,黑龙江牡丹江570)
人参皂苷CK联合5-氟尿嘧啶对人胰腺癌PANC-1细胞的增殖、凋亡及上皮间质转化的影响Δ
崔江河1*,韩光宇2#,何光梅3,尹媛媛1,马娜1,刘琳1(1.牡丹江医学院附属红旗医院消化科,黑龙江牡丹江157011;2.牡丹江医学院附属红旗医院普外科,黑龙江牡丹江157011;3.牡丹江医学院附属红旗医院泌尿外科,黑龙江牡丹江157011)
目的:研究人参皂苷CK联合5-氟尿嘧啶(5-FU)对人胰腺癌PANC-1细胞的增殖、凋亡及上皮间质转化(EMT)的影响。方法:将对数生长期的PANC-1细胞分为空白对照组、人参皂苷CK组(30 mg/L)、5-FU组(25 mg/L)和联用组(人参皂苷CK 30 mg/L+5-FU 25 mg/L)。采用MTT法检测各组细胞作用24、48、72 h后的细胞增殖抑制率,流式细胞术检测作用48 h后的细胞凋亡率,酶联免疫吸附法检测作用24、48、72、96 h后细胞中纤连蛋白表达,Western blot法检测作用48 h后细胞中波形蛋白、N-钙黏蛋白、E-钙黏蛋白、蛋白激酶(Akt)及磷酸化Akt(p-Akt)蛋白表达。结果:人参皂苷CK、5-FU及其二者联用对细胞的增殖均有抑制作用;与空白对照组比较,人参皂苷CK组、5-FU组和联用组各作用时间点的早期和晚期凋亡率、E-钙黏蛋白表达水平均明显升高(P<0.05),纤连蛋白、波形蛋白、N-钙黏蛋白表达水平和p-Akt/Akt水平均明显降低(P<0.05),其中联用组上述指标效果均优于人参皂苷CK组和5-FU组(P<0.05)。结论:人参皂苷CK和5-FU均可抑制PANC-1细胞增殖、诱导细胞凋亡、抑制EMT,该作用可能与抑制磷脂酰肌醇3-激酶/Akt通路有关;且二者联用效果更好。
人参皂苷CK;5-氟尿嘧啶;人胰腺癌PANC-1细胞;联合给药;增殖;凋亡;上皮间质转化
胰腺癌为多发的恶性消化系统肿瘤,发病率呈逐年上升趋势。由于早期诊断存在困难,多数患者在确诊时就已出现周围器官转移和侵袭,手术切除率不到30%,5年生存率低于5%[1]。而全身化疗能够根除机体内残余的肿瘤细胞,从而提高外科手术的治愈率。因此,化疗在胰腺癌的治疗中占有重要地位。5-氟尿嘧啶(5-FU)是临床上治疗胰腺癌的常用药物之一,疗效确切,但容易引起骨髓抑制、外周神经毒性、口腔黏膜炎等较大的毒副作用,加之耐药性的出现,限制了其临床应用范围的扩大及疗效的进一步提高[2]。人参皂苷CK为人参皂苷在生物体内的活性转化产物,具有抗肿瘤、保肝、提高免疫力、抗炎及降血糖等多种药理活性[3]。有研究表明,中药联合传统化疗药物能显著降低化疗药物的毒副反应,提高抗肿瘤疗效[4-5]。因此,本研究拟通过人参皂苷CK联合5-FU,探讨联合用药对人胰腺癌细胞PANC-1的增殖、凋亡及上皮间质转化(EMT)的影响,以期为临床中药联合传统化疗药物治疗胰腺癌提供实验依据。
1 材料
1.1 仪器
TDL-50B型离心机(上海安亭科学仪器厂);MCO-5AC型细胞培养箱(日本Sanyo公司);550型酶标仪(美国Bio-Rad公司);EPICS XL/XL-MCL型流式细胞仪(美国Beckman公司);DYCZ-24DN型蛋白电泳及转印仪(北京六一仪器厂)。
1.2 药品与试剂
人参皂苷CK(四川维克奇生物科技有限公司,批号:20160128,纯度:>98%);5-FU注射液(上海旭东海普药业有限公司,批号:151415,规格:0.25 g∶10 mL);胎牛血清、RPMI 1640培养基(美国Gibco公司);MTT检测试剂盒(美国Amresco公司);膜联蛋白Ⅴ-异硫氰酸荧光素/碘化丙啶(AnnexinⅤ-FITC/PI)细胞凋亡检测试剂盒(南京凯基生物科技发展有限公司);纤连蛋白酶联免疫吸附(ELISA)检测试剂盒(上海酶联生物科技有限公司);鼠源波形蛋白、N-钙黏蛋白、E-钙黏蛋白、蛋白激酶(Akt)、磷酸化Akt(p-Akt)及甘油醛-3-磷酸脱氢酶(GAPDH)多克隆抗体(美国Cell Signaling Technology公司);辣根过氧化物酶(HPR)标记的二抗(北京中杉金桥生物技术有限公司)。
1.3 细胞
人胰腺癌PANC-1细胞购自中国科学院上海细胞库。
2 方法
2.1 分组与给药
将对数生长期的PANC-1细胞分为4组,即空白对照组、人参皂苷CK组(30 mg/L)、5-FU组(25 mg/L)和联用组(人参皂苷CK 30 mg/L+5-FU 25 mg/L),每组设3个复孔。空白对照组细胞仅加入完全培养基,其余组细胞加入含相应药物的完全培养基。
2.2 MTT法检测细胞增殖抑制率
常规方法培养PANC-1细胞,至对数生长期时,用0.25%的胰蛋白酶消化,制备单细胞悬液,接种于96孔细胞培养板中,每孔1×104个细胞。培养24 h至细胞完全贴壁后,弃培养液,按“2.1”项下分组加入相应完全培养基,孵育24、48、72 h后,每孔加入10 μL MTT(5 mg/mL)溶液,继续孵育4 h。用酶标仪检测492 nm波长处光密度(OD),按公式计算细胞增殖抑制率,细胞增殖抑制率(%)=(1-OD给药组/OD空白对照组)×100%。
2.3 流式细胞术检测细胞凋亡率
将PANC-1细胞接种于6孔培养板中,每孔1×106个细胞,培养24 h至细胞完全贴壁后,弃培养液,按“2.1”项下分组并加入相应完全培养基,孵育48 h。3 000×g离心10 min,收集细胞并重悬于预冷的磷酸盐缓冲液(PBS)中;3 000×g离心10 min,加入预冷的75%乙醇,固定30 min;3 000×g离心10 min,加入5 μL AnnexinⅤ-FITC/PI溶液,在4℃条件下孵育20 min后,补加400 μL PBS溶液。用流式细胞仪检测并采用Cell Quest软件分析早期和晚期细胞凋亡情况。
2.4 ELISA法检测细胞中纤连蛋白表达
将PANC-1细胞接种于6孔培养板中,每孔1×106个细胞,培养24 h至细胞完全贴壁后,弃培养液,按“2.1”项下分组并加入相应完全培养基,分别孵育24、48、72、96 h。收集细胞上清液,按照ELISA检测试剂盒说明书操作步骤进行裂解、离心,检测各组细胞中纤连蛋白表达水平。
2.5 Western blot法检测细胞中波形蛋白、N-钙黏蛋白、E-钙黏蛋白、Akt和p-Akt蛋白表达
将PANC-1细胞接种于6孔培养板中,每孔1×106个细胞,培养24 h至细胞完全贴壁后,弃培养液,按“2.1”项下分组并加入相应完全培养基,继续孵育48 h。3 000×g离心10 min,收集细胞,加入细胞裂解缓冲液,剧烈振荡30 s混匀,于冰上放置30 min;12 000×g离心10 min,取上清液,分装,存放于-80℃冰箱中,备用。取等量蛋白,常规方法行10%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)及半干法转膜后,分别加入适量鼠源波形蛋白、N-钙黏蛋白、E-钙黏蛋白、Akt、p-Akt和GAPDH多克隆抗体(1∶500),在4℃条件下孵育24 h;加入HPR标记的二抗(1∶2 000),常温下孵育2 h。增强化学发光法显色,X线曝光显影。图像分析仪扫描后,采用IPP 6.0软件分析各条带平均光密度值,蛋白相对表达水平分别以波形蛋白/GAPDH(内参)、N-钙黏蛋白/GAPDH、E-钙黏蛋白/GAPDH、p-Akt/Akt的平均光密度比值表示。
2.6 统计学方法
3 结果
3.1 PANC-1细胞增殖抑制率
人参皂苷CK、5-FU及其二者联用对细胞增殖均有抑制作用。与人参皂苷CK组和5-FU组比较,联用组细胞作用24、48、72 h后的细胞增殖抑制率均显著升高(P<0.05)。各组细胞增殖抑制率的测定结果见表1。
3.2 PANC-1细胞凋亡率
与空白对照组比较,人参皂苷CK组、5-FU组和联用组细胞作用48 h后早、晚期细胞凋亡率均显著升高(P<0.05)。与人参皂苷CK组和5-FU组比较,联用组细胞的早、晚期细胞凋亡率均显著升高(P<0.05)。各组细胞凋亡率的流式图见图1,测定结果见表2。
表1 各组细胞增殖抑制率的测定结果(±s,n=3)Tab1 Determination results of cell proliferation inhibition rate in each group(±s,n=3)
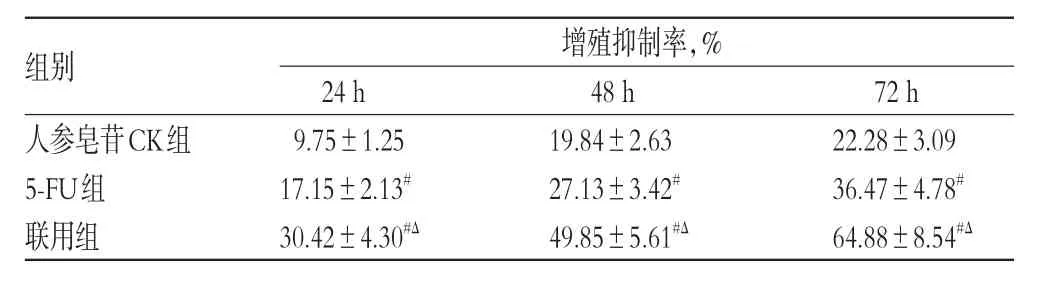
表1 各组细胞增殖抑制率的测定结果(±s,n=3)Tab1 Determination results of cell proliferation inhibition rate in each group(±s,n=3)
注:与人参皂苷CK组比较,#P<0.05;与5-FU组比较,ΔP<0.05Note:vs.ginsenoside CK group,#P<0.05;vs.5-FU group,ΔP<0.05
增殖抑制率,%组别人参皂苷CK组5-FU组联用组48 h 19.84±2.63 27.13±3.42#49.85±5.61#Δ 24 h 9.75±1.25 17.15±2.13#30.42±4.30#Δ 72 h 22.28±3.09 36.47±4.78#64.88±8.54#Δ
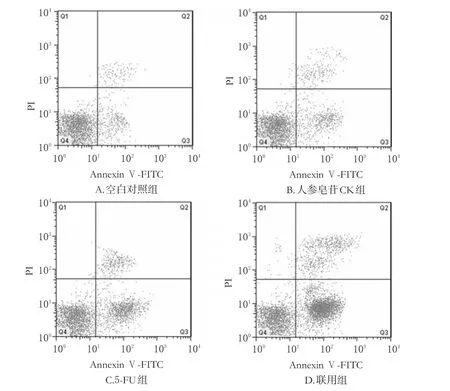
图1 各组细胞凋亡率的流式图Fig1 Flow cytometry chart of cell apoptosis rate in each group
表2 各组细胞凋亡率的测定结果(±s,n=3)Tab2 Determination results of cell apoptosis rate in each group(±s,n=3)

表2 各组细胞凋亡率的测定结果(±s,n=3)Tab2 Determination results of cell apoptosis rate in each group(±s,n=3)
注:与空白对照组比较,*P<0.05;与人参皂苷CK组比较,#P<0.05;与5-FU组比较,ΔP<0.05Note:vs.blank control group,*P<0.05;vs.ginsenoside CK group,#P<0.05;vs.5-FU group,ΔP<0.05
晚期2.39±0.25 7.28±1.57*9.34±1.32*#15.06±2.40*#Δ组别空白对照组人参皂苷CK组5-FU组联用组细胞凋亡率,%早期3.22±0.47 15.51±2.34*19.62±3.68*#41.19±6.64*#Δ
3.3 PANC-1细胞中纤连蛋白表达水平
与空白对照组比较,人参皂苷CK组、5-FU组和联用组细胞作用24、48、72、96 h后细胞中纤连蛋白表达水平均显著降低(P<0.05),且随着作用时间的增加,表达水平逐渐降低。与人参皂苷CK组和5-FU组比较,联用组细胞作用24、48、72、96 h后细胞中纤连蛋白表达水平均显著降低(P<0.05)。各组细胞中纤连蛋白表达的测定结果见表3。
表3 各组细胞中纤连蛋白表达的测定结果(±s,n=3)Tab3 Determination results of fibronectin expression in cells in each group(±s,n=3)

表3 各组细胞中纤连蛋白表达的测定结果(±s,n=3)Tab3 Determination results of fibronectin expression in cells in each group(±s,n=3)
注:与空白对照组比较,*P<0.05;与人参皂苷CK组比较,#P<0.05;与5-FU组比较,ΔP<0.05Note:vs.blank control group,*P<0.05;vs.ginsenoside CK group,#P<0.05;vs.5-FU group,ΔP<0.05
组别空白对照组人参皂苷CK组5-FU组联用组纤连蛋白,ng/mL 96 h 68.76±8.21 48.84±5.29*35.21±3.18*#28.66±4.34*#Δ 24 h 74.50±8.33 66.64±8.34*63.58±7.05*52.82±7.80*#Δ 48 h 69.25±7.59 60.02±6.12*52.92±6.11*#43.40±5.53*#Δ 72 h 70.38±8.96 54.07±6.24*45.49±6.06*#32.48±4.13*#Δ
3.4 PANC-1细胞中波形蛋白、N-钙黏蛋白及E-钙黏蛋白表达水平
与空白对照组比较,人参皂苷CK组、5-FU组和联用组细胞作用48 h后细胞中波形蛋白、N-钙黏蛋白表达水平均显著降低,E-钙黏蛋白表达水平显著升高(P<0.05)。与人参皂苷CK组和5-FU组比较,联用组细胞作用48 h后细胞中波形蛋白、N-钙黏蛋白表达水平显著降低,E-钙黏蛋白表达水平显著升高(P<0.05)。各组细胞中波形蛋白、N-钙黏蛋白及E-钙黏蛋白表达的电泳图见图2,测定结果见表4。

图2 各组细胞中波形蛋白、N-钙黏蛋白及E-钙黏蛋白表达的电泳图Fig2 Electrophoresis charts of expressions of vimentin,N-cadherin and E-cadherin in cells in each group
表4 各组细胞中波形蛋白、N-钙黏蛋白及E-钙黏蛋白表达的测定结果(±s,n=3)Tab4 Determination results of expressions of vimentin,N-cadherin and E-cadherin in cells in each group(±s,n=3)

表4 各组细胞中波形蛋白、N-钙黏蛋白及E-钙黏蛋白表达的测定结果(±s,n=3)Tab4 Determination results of expressions of vimentin,N-cadherin and E-cadherin in cells in each group(±s,n=3)
注:与空白对照组比较,*P<0.05;与人参皂苷CK组比较,#P<0.05;与5-FU组比较,ΔP<0.05Note:vs.blank control group,*P<0.05;vs.ginsenoside CK group,#P<0.05;vs.5-FU group,ΔP<0.05
E-钙黏蛋白/GAPDH 0.22±0.04 0.30±0.05*0.35±0.06*#0.43±0.06*#Δ组别空白对照组人参皂苷CK组5-FU组联用组波形蛋白/GAPDH 0.45±0.06 0.33±0.04*0.26±0.04*#0.21±0.03*#Δ N-钙黏蛋白/GAPDH 0.62±0.08 0.51±0.06*0.38±0.05*#0.29±0.05*#Δ
3.5 PANC-1细胞中Akt、p-Akt蛋白表达
空白对照组、人参皂苷CK组、5-FU组和联用组细胞作用48 h后细胞中p-Akt/Akt分别为0.45±0.06、0.27±0.02、0.25±0.02、0.18±0.01。与空白对照组比较,人参皂苷CK组、5-FU组和联用组细胞中p-Akt/Akt均显著降低(P<0.05)。与人参皂苷CK组和5-FU组比较,联用组细胞中p-Akt/Akt显著降低(P<0.05)。各组细胞中Akt、p-Akt蛋白表达的电泳图见图3。
4 讨论
人参皂苷是人参的主要活性成分,目前已分离、鉴定出40余种单体化合物,而人参皂苷CK为二醇型皂苷,是其他类型的二醇型人参皂苷在肠道内的活性代谢产物,在天然人参中并不存在。研究表明,人参的许多生物活性都与人参皂苷CK有关,如人参皂苷Rb1在肠道中很少被吸收,只是以“天然活性前体”形式存在,而人参皂苷CK才是被吸收和发挥生物学作用的真正活性物质[6]。与其他人参皂苷单体比较,人参皂苷CK的抗肿瘤活性和增强免疫活性是最强的,且由于其具有较好的水溶性,可以直接制成注射剂发挥作用,因此得到了研究者越来越多的关注[7]。人参皂苷CK的抗肿瘤作用报道较多,其对膀胱癌、鼻咽癌、肝细胞癌、乳腺癌及结肠癌等均具有一定的抑制作用,而对胰腺癌的抑制作用及与现有化疗药物联用的相关研究较少[8]。本研究发现,与空白对照组比较,人参皂苷CK组、5-FU组和联用组的细胞增殖抑制率均显著升高,且联用组高于人参皂苷CK组和5-FU组。有研究发现,人参皂苷CK可以通过降低线粒体跨膜电位、增加细胞色素C释放、激活半胱氨酸天冬氨酸蛋白酶3(Caspase-3)等途径,诱导前列腺癌PC-3细胞及人白血病HL-60细胞发生凋亡[9]。由此可见,人参皂苷CK的抗肿瘤作用主要是通过诱导肿瘤细胞凋亡而实现的。本研究结果表明,与空白对照组比较,人参皂苷CK组、5-FU组和联用组PANC-1细胞的早、晚期凋亡率均显著升高,且联用组高于人参皂苷CK组和5-FU组。以上结果表明,人参皂苷CK、5-FU均具有抑制PANC-1细胞增殖及诱导凋亡作用,而联用的效果强于单用。
EMT是以上皮细胞特性丧失及间质细胞特性获得为特征,是肿瘤细胞发生侵袭及转移的重要依据。纤连蛋白是参与细胞和基质以及细胞与细胞之间黏附、迁移的细胞外基质糖蛋白。在EMT进程中,纤连蛋白表达明显升高[10]。本研究发现,与空白对照组比较,人参皂苷CK组、5-FU组和联用组的PANC-1细胞中纤连蛋白表达水平均显著降低,且联用组低于人参皂苷CK组和5-FU组。波形蛋白、N-钙黏蛋白和E-钙黏蛋白是EMT进程的重要标志性分子,在EMT进程中,波形蛋白、N-钙黏蛋白表达增加,E-钙黏蛋白表达降低[11]。本研究进一步发现,与空白对照组比较,人参皂苷CK组、5-FU组和联用组PANC-1细胞中波形蛋白及N-钙黏蛋白表达水平均显著降低,而E-钙黏蛋白表达水平显著升高,且联用组效果较人参皂苷CK组和5-FU组更明显。以上结果表明,人参皂苷CK和5-FU均具有抑制EMT的作用,总体上两者联用效果强于单用。
在肿瘤细胞的增殖与凋亡过程中,磷脂酰肌醇3-激酶(PI3K)/Akt信号通路扮演着重要角色,多数肿瘤细胞中的PI3K/Akt信号通路处于活化状态[12]。PI3K可促使Akt发生磷酸化,当PI3K/Akt信号通路处于活化状态时,Akt的磷酸化形式p-Akt的比例升高,反之降低。多种化疗药物均可以通过阻断PI3K/Akt信号通路而发挥抗肿瘤作用[13]。此外,PI3K/Akt信号通路的激活可以促进EMT的发生。研究证实,抑制PI3K/Akt信号通路的激活可以抑制乳腺癌MCF-7细胞和BT-20细胞的EMT进程[14-15]。本研究发现,与空白对照组比较,人参皂苷CK组、5-FU组和联用组细胞中p-Akt/Akt均显著降低,且联用组低于人参皂苷CK组和5-FU组。以上结果提示,抑制PANC-1细胞的PI3K/Akt信号通路活化可能是人参皂苷CK、5-FU及二者联合给药发挥抑制细胞增殖、诱导细胞凋亡及抑制EMT进程的潜在机制之一。
综上所述,人参皂苷CK和5-FU对人胰腺癌PANC-1细胞均具有抑制增殖、诱导凋亡及抑制EMT的作用,该作用可能与抑制PI3K/Akt信号通路活化有关,且两者联用时效果更好。
[1] Kimbara S,Kondo S.Immune checkpoint and inflammation as therapeutic targets in pancreatic carcinoma[J].World J Gastroenterol,2016,22(33):7440-7452.
[2] Li Z,Wang N,Huang C,et al.Downregulation of caveolin-1 increases the sensitivity of drug-resistant colorectal cancer HCT116 cells to 5-fluorouracil[J].Oncol Lett,2017,13(1):483-487.
[3] Zheng ZZ,Ming YL,Chen LH,et al.Compound K-induced apoptosis of human hepatocellular carcinoma MHCC97-H cells in vitro[J].Oncol Rep,2014,32(1):325-331.
[4] 管振华,李学良.榄香烯乳联合5-氟尿嘧啶对人胃癌细胞AGS增殖的抑制作用研究[J].中国药房,2014,25(25):2332-2334.
[5] 冯怡锟,付春景,黄幼田,等.丹皮酚联合5-FU对食管癌EC9706细胞增殖及凋亡的影响[J].世界华人消化杂志,2010,18(7):646-651.
[6] Upadhyaya J,Kim MJ,Kim YH,et al.Enzymatic formation of compound-K from ginsenoside Rb1 by enzyme preparation from cultured mycelia of Armillaria mellea[J].J Ginseng Res,2016,40(2):105-112.
[7] 邓晶,蒋永新.人参皂苷CK抗肿瘤活性研究进展[J].现代肿瘤医学,2009,17(11):2234-2236.
[8] Wang H,Jiang D,Liu J,et al.Compound K induces apoptosis of bladder cancer T24 cells via reactive oxygen speciesmediated p38 MAPK pathway[J].Cancer Biother Radiopharm,2013,28(8):607-614.
[9] Kang KA,Piao MJ,Kim KC,et al.Compound K,a metabolite of ginseng saponin,inhibits colorectal cancer cell growth and induces apoptosis through inhibition of histone deacetylase activity[J].Int J Oncol,2013,43(6):1907-1914.
[10] 郭锰,魏艳霞,任佳伟,等.青蒿素联合顺铂对胃癌细胞增殖、凋亡及上皮间质转化的影响[J].中成药,2016,38(2):431-434.
[11] Agajanian M,Runa F,Kelber JA.Identification of a PEAK1/ZEB1signalingaxisduringTGFβ/fibronectin-induced EMT in breast cancer[J].Biochem Biophys Res Commun,2015,465(3):606-612.
[12] Gu HZ,Lin RR,Wang HC,et al.Effect of momordica charantia protein on proliferation,apoptosis and the AKT signal transduction pathway in the human endometrial carcinoma Ishikawa H cell line in vitro[J].Oncol Lett,2017,13(5):3032-3038.
[13] Peng Y,Pu J,Tang C,et al.Curcumin inhibits heat-induced apoptosis by suppressing NADPH oxidase 2 and activating the Akt/mTOR signaling pathway in bronchial epithelial cells[J].Cell Physiol Biochem,2017,41(5):2091-2103.
[14] Wang R,Song Y,Liu X,et al.UBE2C induces EMT through Wnt/β-catenin and PI3K/Akt signaling pathways by regulating phosphorylation levels of Aurora-A[J].Int J Oncol,2017,50(4):1116-1126.
[15] Yang Z,Xie H,He D,et al.Infiltrating macrophages increase RCC epithelial mesenchymal transition(EMT)and stem cell-like populations via AKT and mTOR signaling[J].Oncotarget,2016,7(28):44478-44491.
Effects of Ginsenoside CK Combined with 5-Fluorouracil on the Proliferation,Apoptosis and Epithelial Mesenchymal Transition of Human Pancreatic Cancer PANC-1 Cells
CUI Jianghe1,HAN Guangyu2,HE Guangmei3,YIN Yuanyuan1,MA Na1,LIU Lin1(1.Dept.of Gastroenterology,Hongqi Hospital Affiliated to Mudanjiang Medical University,Heilongjiang Mudanjiang 157011,China;2.Dept.of General Surgery,Hongqi Hospital Affiliated to Mudanjiang Medical University,Heilongjiang Mudanjiang 157011,China;3.Dept.of Urology Surgery,Hongqi Hospital Affiliated to Mudanjiang Medical University,Heilongjiang Mudanjiang 157011,China)
OBJECTIVE:To study the effects of ginsenoside CK combined with 5-fluorouracil(5-FU)on the proliferation,apoptosis and epithelial mesenchymal transition(EMT)of human pancreatic cancer PANC-1 cells.METHODS:PANC-1 cells of logarithmic growth phase were randomly divided into blank control group,ginsenoside CK group(30 mg/L),5-FU group(25mg/L)and combination group(ginsenoside CK 30 mg/L+5-FU 25 mg/L).MTT method was used to detect the cell proliferation inhibition rate in each group after 24,48,72 h;flow cytometry was used to detect the cell apoptosis rate after 48 h;enzyme-linked immunosorbent assay was used to detect the fibronectin expression in cells after 24,48,72,96 h;and Western blot was used to detect the expressions of vimentin,N-cadherin,E-cadherin,protein kinase(Akt)and phosphorylated Akt(p-Akt)protein in cells after 48 h.RESULTS:Compared with blank control group,the cell proliferation inhibition rate,early and late apoptotic rates,protein expression level of E-cadherin in ginsenoside CK group,5-FU group and combination group were obviously increased(P<0.05),while the protein expression levels of fibronectin,vimentin,N-cadherin,and p-Akt/Akt levels were obviously decreased(P<0.05);the effects of above-mentioned indexes in combination group were superior to ginsenoside CK group and 5-FU group(P<0.05).CONCLUSIONS:Both ginsenoside CK and 5-FU can inhibit the proliferation of PANC-1 cells,induce their apoptosis and inhibit EMT,which may be associated with inhibiting phosphatidylinositol 3-kinase/Akt pathway.In addition,the combination of ginsenoside CK and 5-FU can produce a better effect.
Ginsenoside CK;5-fluorouracil;Human pancreatic cancer PANC-1 cells;Combined administration;Proliferation;Apoptosis;Epithelial mesenchymal transition
R361+.3
A
1001-0408(2017)31-4388-05
DOI 10.6039/j.issn.1001-0408.2017.31.18
牡丹江市科学技术计划项目(No.Z2015s0055)
*主治医师。研究方向:消化系统疾病的诊断及治疗。电话:0453-6582800。E-mail:18215039@qq.com
#通信作者:主治医师。研究方向:普外科临床与科研。电话:0453-6582800。E-mail:hanguangyu1981@163.com
2017-03-06
2017-06-09)
(编辑:邹丽娟)
