粉尘螨滴剂舌下含服治疗成人支气管哮喘的效果及其机制
2017-11-14邓洁汤渝玲祝戎飞
邓洁,汤渝玲,祝戎飞
(1长沙市第一医院,长沙410005;2华中科技大学附属同济医院)
粉尘螨滴剂舌下含服治疗成人支气管哮喘的效果及其机制
邓洁1,汤渝玲1,祝戎飞2
(1长沙市第一医院,长沙410005;2华中科技大学附属同济医院)
目的观察粉尘螨滴剂舌下含服治疗成人支气管哮喘的疗效,并探讨其相关机制。方法尘螨致敏的成人支气管哮喘患者80例,随机分为观察组和对照组各40例。观察组舌下含服粉尘螨滴剂,前3周为递增量期,3周后每天1次,每次3滴,共用药2年。对照组给予常规的吸氧、解痉、平喘、抗感染等治疗。分别于治疗前后对两组进行哮喘症状评分;采用哮喘控制测试(ACT)评估哮喘控制程度;使用Master Screen肺功能仪进行肺功能检测,测定指标包括第一秒用力呼气量(FEV1)、FEV1占预计值百分比(FEV1%预计值)、用力肺活量(FVC)、FVC占预计值的百分比(FVC%预计值);采集外周血,检测CD4+CD25Foxp3+调节性T细胞、Th3细胞及IL-10、TGF-β。结果观察组治疗后哮喘症状评分及ACT评分低于治疗前和对照组治疗后(P均<0.05)。两组治疗后FEV1、FEV1%预计值、FVC、FVC%预计值均较治疗前有所提高,且观察组治疗后FEV1%预计值、FVC、FVC%预计值高于对照组(P<0.05)。观察组与对照组治疗后外周血CD4+CD25Foxp3+调节性T细胞、Th3细胞比例及IL-10水平均升高,TGF-β水平均降低;观察组治疗后外周血Th3细胞水平、IL-10水平高于对照组,TGF-β水平低于对照组(P均<0.05)。结论粉尘螨滴剂舌下含服治疗成年支气管哮喘可有效控制哮喘症状、改善肺功能,其机制可能与活化CD4+CD25Foxp3+调节性T细胞、Th3细胞及调节IL-10、TGF-β水平有关。
支气管哮喘;特异性免疫治疗;粉尘螨滴剂;调节性T细胞;辅助性T细胞;白细胞介素10;转化生长因子β
自二十世纪九十年代以来支气管哮喘的发病率和病死率加速增长[1]。支气管哮喘是由免疫、遗传、环境等单一因素或多因素相互作用引起的呼吸道慢性炎症性和变态反应性疾病[2],治疗方法包括糖皮质激素、β2受体激动剂、茶碱、抗胆碱类、他汀类、白三烯、心理疗法、中药治疗、特异性免疫治疗(SIT)等[3]。SIT是目前惟一的针对支气管哮喘病因的治疗方式,主要包括两种治疗手段,一种是皮下注射特异性免疫治疗,另一种是舌下SIT(SLIT)。SLIT具有方便、安全、易于管理等优点,是近年来的首选方案。目前关于SIT的作用机制已有一些研究,但主要集中在对儿童患者的有效性、安全性及严重不良事件等相关问题[4],关于SIT对成人患者的临床效果及机制的研究较少。粉尘螨滴剂主要运用于粉尘螨过敏引起的过敏性鼻炎、过敏性哮喘的脱敏治疗。本研究观察了粉尘螨滴剂舌下含服治疗成人支气管哮喘的疗效,并探讨其相关机制。现报告如下。
1 资料与方法
1.1 临床资料 收集同济医院过敏反应科2014年3月~2015年1月就诊的大于18周岁的支气管哮喘患者。纳入标准:①户尘螨粉尘螨致敏者,均进行皮肤点刺试验(SPT)结果为++及以上;②患者处于无症状期;③第一秒用力呼气量(FEV1)在预计值的70%以上;④接受并签署知情同意书者且能配合治疗和管理者。排除依从性较差者,呼吸道感染伴或不伴炎症的患者,哮喘未控制或不可逆者,合并严重免疫功能低下的患者,严重精神疾病不能配合治疗和管理者,使用N型胆碱受体阻断剂者,合并其他严重心脑血管等系统疾病者。共纳入患者80例,男50例、女30例,年龄为(29.0±8.5)岁。本研究通过了医院伦理委员会批准,患者对研究方案知情同意。将80例患者随机分为观察组和对照组各40例。两组一般资料具有可比性。
1.2 粉尘螨滴剂使用方法 观察组采用SIT,即舌下含服粉尘螨滴剂(浙江我武生物科技股份有限公司),每日早饭前滴于舌下含服,时间1~3 min。前3周为递增量期,第1周使用粉尘螨滴剂1号,第1天1滴,依次递增,第7天7滴;第2周给予粉尘螨滴剂2号,第1天1滴,依次递增,第7天7滴;第3周给予粉尘螨滴剂3号,第1天1滴,依次递增,第7天7滴。3周后维持剂量,给予粉尘螨滴剂4号,每天1次,每次3滴。共用药2年。对照组给予常规的吸氧、解痉、平喘、抗感染等治疗。
1.3 哮喘症状评分及哮喘控制程度评分 分别于治疗前及治疗2年后进行哮喘症状评分,分为白天症状评分及夜间症状评分。白天症状评分标准:无任何症状如咳嗽、喘息、胸闷、呼吸困难等计0分;有轻微上诉症状计1分;有中度上述症状或出现频率较高计2分;症状较重,或影响日常生活计3分。夜间症状评分标准:无症状计0分;睡眠时憋醒次数为1次计1分;憋醒次数2次及以上计2分;多次憋醒、严重影响睡眠计3分。哮喘症状控制程度评估采用哮喘控制测试(ACT)评分:根据4周内哮喘妨碍日常生活时间的多少评分,没有计0分、极少时候计1分、有时计2分、多数时间计3分、所有时间计4分;根据4周内呼吸困难的次数评分,没有计0分、1~2次计1分、1次/周计2分、2~3次/周计3分、4次/周及以上计4分;根据4周内使用急救药物的次数评分,没有计0分、<1次/周计1分、2~3次/周计2分、1~2次/d计3分、3次/d及以上计4分;根据4周内哮喘控制情况评分,完全控制计0分、很好控制计1分、控制可计2分、控制较差计3分、未控制计4分。
1.4 肺功能检测 两组治疗前后使用Master Screen肺功能仪进行肺功能检测,测定指标包括第一秒用力呼气量(FEV1)、FEV1占预计值百分比(FEV1%预计值)、用力肺活量(FVC)、FVC占预计值的百分比(FVC%预计值)等。
1.5 CD4+CD25Foxp3+调节性T细胞、Th3细胞水平及IL-10、TGF-β检测 两组在治疗前及治疗后采集外周静脉血,采用流式细胞仪检测外周静脉血中的CD4+CD25Foxp3+调节性T细胞、Th3细胞,采用双抗夹心ELISA法检测IL-10、TGF-β[5]。
1.6 统计学方法 采用SPSS17.0软件进行统计处理。符合正态分布的计量资料比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组治疗前后哮喘症状评分及ACT评分比较 观察组治疗前后哮喘症状评分分别为(1.80±0.63)、(0.22±0.51)分,对照组分别为(1.79±0.48)、(1.21±0.63)分。观察组治疗前后ACT评分分别为(1.96±0.65)、(0.83±0.59)分,对照组分别为(1.86±0.73)、(1.67±0.57)分。观察组治疗后哮喘症状评分及ACT评分低于治疗前和对照组治疗后(P均<0.05)。
2.2 两组治疗前后肺功能指标比较 两组治疗后FEV1、FEV1%预计值、FVC、FVC%预计值均较治疗前有所提高,且观察组治疗后FEV1%预计值、FVC、FVC%预计值高于对照组(P<0.05)。详见表1。
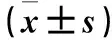
表1 两组治疗前后肺功能指标比较
注:与同组治疗前相比,*P<0.05;与对照组治疗后相比,#P<0.05。
2.3 两组治疗前后外周血CD4+CD25Foxp3+调节性T细胞、Th3细胞比例及IL-10、TGF-β水平比较 观察组治疗后外周血CD4+CD25Foxp3+调节性T细胞、Th3细胞比例及IL-10水平升高,TGF-β水平降低(P均<0.05);对照组治疗后外周血CD4+CD25Foxp3+调节性T细胞水平升高(P<0.05)。治疗后观察组较对照组外周血Th3细胞比例、IL-10水平升高(P<0.05),TGF-β水平降低(P均<0.05)。见表2。
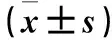
表2 两组治疗前后外周血CD4+CD25Foxp3+调节性T细胞、Th3细胞比例及IL-10、TGF-β水平比较
注:与同组治疗前相比,*P<0.05;与对照组治疗后相比,#P<0.05。
3 讨论
上世纪已提出应用特异性免疫的治疗手段治疗支气管哮喘,但由于其作用机制的复杂性及效果的有限性,大多数研究处于临床试验的阶段。SIT主要是通过增加患者过敏原的剂量,进而来诱导患者产生免疫耐受,使患者的发病次数及发病严重程度减轻[6]。对于SIT目前的研究主要集中于儿童[7~9]。Djuric-Filipovic等[9]研究结果表明SIT可缓解儿童哮喘患者的症状并改善肺功能。但目前尚缺乏对成年支气管哮喘免疫治疗的相关研究。
粉尘螨是具有强的致敏性过敏原,其在自然界中广泛存在,过敏体质者吸入微量过敏原即可引起哮喘或其他过敏性疾病。粉尘螨滴剂可使对尘螨过敏患者产生特异性的阻断抗体和免疫耐受,减轻患者对尘螨产生的过敏反应,从而达到治疗目的,该滴剂是针对病因进行治疗。本研究对支气管哮喘患者采用SIT,观察治疗效果并探讨其具体机制,结果显示,成年支气管哮喘患者采用SIT后哮喘症状得到有效控制,哮喘控制程度明显提高,肺功能明显改善,效果优于采用常规治疗手段的对照组,表明SIT对成人支气管哮喘有效,且效果优于常规疗法。
调节性T细胞在哮喘的免疫应答中起到关键作用,可抑制免疫应答和炎症反应,促进免疫耐受。Choi等[10]研究发现调节性T细胞减少后小鼠气道高反应的发生率明显增加。Maazi等[11]研究表明SIT可诱导调节性T细胞的产生。调节性T细胞可分泌IL-10及TGF-β,此外可减少特异性变应原分泌的IgE,使嗜酸性粒细胞凋亡增加,还可调节Th1/Th2平衡,使机体对抗原不产生反应或低过敏状态,有助于减少支气管哮喘的复发率。IL-10在哮喘的免疫应答过程中起着重要作用[12],TNF、IL-4、IL-5等细胞因子被IL-10抑制后可减少特异性变应原IgE的分泌,通过这种机制来减轻哮喘患者的炎症反应[13]。
关于Th3细胞在哮喘发病中的作用目前报道较少。研究者[14,15]发现Th3细胞可起到抑制免疫效应细胞增殖、分化等功能,抑制过敏反应。TGF-β由调节性T细胞及Th3细胞等产生[18],可调节细胞生长、分化,被认为具有促进哮喘患者肺纤维化的作用及抗炎作用,高水平TGF-β可代偿性抑制炎症细胞的活化和气道高反应,以此来发挥抵抗哮喘的作用。李敏等[17]研究发现哮喘缓解期较急性发作期TGF-β水平低。Fukushima等[18]也认为TGF-β有益于气道平滑肌的重塑。
本研究结果显示,经粉尘螨滴剂治疗后CD4+CD25Foxp3+调节性T细胞、Th3细胞比例及IL-10水平升高,TGF-β水平降低。上述结果提示粉尘螨滴剂治疗支气管哮喘的机制可能与活化调节性T细胞、Th3细胞功能及调节IL-10、TGF-β水平有关。但是对于SIT在不同年龄阶段患者中的使用效果及差异性目前尚无大数据的临床研究,本研究结论仍需进一步证实。
[1] Gupta A, Gupta LK, Rehan HS, et al. Response to inhaled corticosteroids on serum CD28, quality of life, and peak expiratory flow rate in bronchial asthma[J]. Allergy Asthma Proc, 2017,38(2):13-18.
[2] 刘心存.沙丁胺醇联合布地奈德治疗支气管哮喘急性发作的临床疗效分析[J].中国继续医学教育,2017,9(1):161-163.
[3] Horak F, Doberer D, Eber E, et al. Diagnosis and management of asthma - Statement on the 2015 GINA Guidelines[J]. Wien Klin Wochenschr, 2016,128(15-16):541-554.
[4] 郑忠梅,毛萌.儿童过敏性哮喘舌下特异性免疫治疗的研究进展[J].华西医学,2017(2):286-289.
[5] Sugimoto A, Kawakami R, Mikami N. Transcription Factors Downstream of IL-4 and TGF-β Signals: Analysis by Quantitative PCR, Western Blot, and Flow Cytometry Th9 Cells[J]. Springer New York, 2017(6):141-153.
[6] Elqutob D, Mencia G, Fernandezcaldas E. Recent advances in immunotherapy for allergic diseases[J]. Recent Pat Inflamm Allergy Drug Discov, 2014,8(1):24-35.
[7] 刘晓颖,王群,皇惠杰,等.舌下含服尘螨特异性免疫治疗小儿支气管哮喘合并变应性鼻炎临床观察[J].山东医药,2016,56(20):5-8.
[8] Singhal S, Bansal S, Goel Y. Efficacy of Inhalation Therapy in Bronchial Asthma in Children between (6-18 Years) of Age[J]. Indian J Publ Health Res Develop, 2016,7(4):294.
[9] Djuric-Filipovic I, Caminati M, Filipovic D, et al. Effects of specific allergen immunotherapy on biological markers and clinical parameters in asthmatic children: a controlled-real life study[J]. Clin Mol Allergy, 2017(15):7.
[10] Choi MS, Park S, Choi T, et al. Bee venom ameliorates ovalbumin induced allergic asthma via modulating CD4+CD25+ regulatory T cells in mice[J]. CYTOKINE, 2013,61(1):256-265.
[11] Maazi H, Shirinbak S, Willart M, et al. Contribution of regulatory T cells to alleviation of experimental allergic asthma after specific immunotherapy[J]. Clin Exp Allergy, 2012,42(10):1519-1528.
[12] Kawano H, Kayama H, Nakama T, et al. IL-10-producing lung interstitial macrophages prevent neutrophilic asthma[J]. Int Immunol, 2016,28(10):489-501.
[13] Draijer C, Boorsma CE, Robbe P, et al. Human asthma is characterized by more IRF5+ M1 and CD206+ M2 macrophages and less IL-10+ M2-like macrophages around airways compared with healthy airways[J]. J Allergy Clin Immunol, 2017,140(1):280-283.
[14] 郑莉,陈紫君,刘纯.Th3、Th17及相关细胞因子在自身免疫性甲状腺疾病发病中的作用[J].中国免疫学杂志,2013,29(1):43-47.
[15] 庞权,白素娟,闫佩毅,等.变应性鼻炎患者外周血中Tr1/Th3细胞的检测和分析[J].现代生物医学进展,2014,14(18):3509-3512.
[16] Cvetanovich GL, Hafler DA. Human regulatory T cells in autoimmune diseases[J]. Current Opin Immunol, 2010,22(6):753-760.
[17] 李敏,宋丽,张建波,等.哮喘患儿CD4+CD25+调节性T细胞及IL-10和TGF-β1的变化[J].中国当代儿科杂志,2009,11(10):829-832.
[18] Fukushima T, Yamasaki A, Harada T, et al. gamma-Tocotrienol Inhibits TGF-beta1-Induced Contractile Phenotype Expression of Human Airway Smooth Muscle Cells[J]. Yonago Acta Med, 2017,60(1):16-23.
10.3969/j.issn.1002-266X.2017.39.021
R562.2
B
1002-266X(2017)39-0068-03
2017-05-23)
