环氧合酶-2抑制剂对创伤后应激障碍大鼠神经功能的改善*
2017-11-14何主强段发亮王孟阳吴京雷韦君武
何主强, 段发亮, 王孟阳, 吴京雷, 罗 明, 韦君武
武汉市第一医院神经外科,武汉 430022
环氧合酶-2抑制剂对创伤后应激障碍大鼠神经功能的改善*
何主强, 段发亮△, 王孟阳, 吴京雷, 罗 明, 韦君武
武汉市第一医院神经外科,武汉 430022
目的检测创伤后应激障碍(post traumatic stress disorder,PTSD)大鼠海马区环氧合酶-2(cyclooxygenase-2,COX-2)水平和应用COX-2抑制剂塞来昔布(celecoxib)后对大鼠神经功能的改善作用,研究COX-2在PTSD中的可能作用。方法成年雄性大鼠分为正常对照组、PTSD组、COX-2抑制剂治疗组,通过旷场实验、高架十字迷宫实验、水迷宫实验评估大鼠行为能力;通过免疫组织化学染色、RT-PCR与Western blot测量大鼠海马组织COX-2表达情况;ELISA法检测大鼠海马组织白介素-1(interleukin-1,IL-1)、白介素-6(interleukin-6,IL-6)以及前列腺素E2(prostaglandin E2,PGE2)的水平;应用Griess法检测海马组织一氧化氮(nitric oxide,NO)的表达。结果RT-PCR及Western blot检测显示,治疗组COX-2 mRNA及蛋白表达低于模型组而高于正常对照组,差异有统计学意义(均P<0.05),ELISA检测显示治疗组IL-1、IL-6、PEG2含量低于模型组而高于正常对照组,差异有统计学意义(均P<0.05),Griess法检测治疗组NO含量低于模型组而高于正常对照组,差异有统计学意义(均P<0.05),且治疗组较模型组行为学功能得到改善。结论PTSD大鼠海马中IL-1、IL-6及COX-2的水平升高,同时其下游NO、PGE2的表达增加,推测COX-2是PTSD致病机制中的重要环节,COX-2抑制剂可能通过抑制炎性因子表达改善PTSD大鼠神经功能。
创伤后应激障碍; 环氧合酶-2; 白细胞介素-1; 白细胞介素-6; 一氧化氮; 前列腺素E2; 塞来昔布
创伤后应激障碍(post traumatic stress disorder,PTSD)是指由重大灾害、战争、恐怖事件、交通意外、虐待等强烈外界刺激引发的心理及生理病态反应,是一种典型的应激精神障碍性疾病[1-2]。患者往往有持久精神障碍,由于经常陷入对恐怖经历的回忆,从而丧失与社会沟通的能力。患者不仅个人生活质量严重下降,也给社会带来了巨大安全隐患及沉重的经济负担[3-4]。研究认为PTSD是机体在过度应激下,人体免疫基因与关联蛋白表达异常升高所致,然而相关的调节通路尚不清楚[5]。环氧合酶-2(cyclooxygenase-2,COX-2)是前列腺素E2(prostaglandin E2,PGE2)合成过程中的限速酶[6-7]。它是一种诱导型异构体,在一些细胞中表达并对细胞因子产生应答。本研究在建立PTSD模型大鼠的基础上,检测该模型大鼠海马区IL-1、IL-6、PGE2、NO及COX-2水平,并利用COX-2抑制剂塞来昔布(celecoxib),观察阻断COX-2信号通路是否对PTSD大鼠神经功能具有改善作用,以阐明COX-2在PTSD发病机制中的作用以及COX-2抑制剂在PTSD治疗中的应用价值。
1 材料与方法
1.1 动物分组及PTSD模型复制
SPF级健康成年雄性Wistar大鼠60只(体质量120~160 g),由湖北省实验动物研究中心提供,动物合格证号:SCXK(鄂)2015-0018。常规在实验室适应环境7 d,随机分成3组,分别为:正常对照组(对照组)、PTSD模型组(PTSD组)、COX-2抑制剂治疗组(治疗组),每组20只。运用国际通用的单次延长应激(single-prolonged stress,SPS)刺激法复制PTSD大鼠模型[8]。造模成功后PTSD组大鼠仅单纯鼻饲纯净水,COX-2抑制剂治疗组鼻饲塞来昔布25 mg/(kg•d),正常对照组也同时给予鼻饲纯净水。造模14 d后断颈处死大鼠并采集脑组织样本,本研究所有操作步骤均通过医院动物伦理委员会审核。
1.2 主要检测试剂
免疫组化用兔抗大鼠COX-2多克隆抗体(吉凯基因公司,BA0738);羊抗小鼠/兔IgG聚合物(博士德公司,BC1254)。Western blot用一抗选择羊抗小鼠IgG(吉凯基因公司);二抗兔抗羊IgG/HRP(Earthox,E030130)。一氧化氮检测试剂盒(碧云天公司,S0021);ELISA试剂盒(武汉华联科生物科技公司)。
1.3 大鼠行为功能评定
行为功能评定在专门的动物行为学实验室进行,为避免外界光源干扰,采取室内白炽灯漫反射作为照明,照度150~300 LX,亮度恒定。室内温度维持在20~25℃之间。运用红外摄像仪记录评定过程,分别对各组大鼠依次进行旷场实验、水迷宫实验和高架十字迷宫实验。旷场试验(openfield test,OF test)主要用于检测动物惊厥、恐慌行为及对周围状况的顺应性。Morris水迷宫试验(Morris water mace,MWW)主要用于检测应激对Wistar大鼠时间与空间适应力的改变。高架十字迷宫实验(elevated plus mace,EPM)主要用于检测Wistar大鼠抑郁水平,记录检测数据并评定。
1.4 大鼠海马区COX-2免疫组化染色
大鼠断颈处死后解剖海马组织,先用石蜡包埋然后行切片处理。常规采用双氧水中和内源性过氧化物酶干扰,加入兔抗大鼠COX-2多克隆抗体,在4℃下孵育12 h。第2天滴入羊抗小鼠/兔IgG聚合物,复温30 min后滴入DAB进行显色、复染、脱水、透明,加盖玻片后计数。在光学显微镜(×400)下对各组COX-2染色切片进行COX-2阳性细胞观察。
1.5 RT-PCR测量大鼠海马组织COX-2 mRNA表达
常规提取海马总RNA,采用逆转录方法获取cDNA,上机(Applied Biosystems)行PCR扩增。PCR扩增顺序及设置为:94℃,5 min;然后94℃,30 s,58℃,30 s,72℃,10 s,进行28个循环;最后72℃,10 min。COX-2正向引物:5′-TCGCTGTGCCTGATGATTG-3′,反向引物:5′-TCGCTTATGA-TCTGTCTTG-3′,产物190 bp。β-actin正向引物:5′-TGACGTGGACATCCGCAAAG-3′,反向引物:5′-CTGGAAGGTGGACAGCGAGG-3′,产物205 bp。最终扩增产物加入琼脂糖凝胶孔中,以5 V/cm的电压电泳15 min,进行灰度值扫描,比较各组COX-2/β-actin灰度比值。
1.6 Western blot检测大鼠海马组织COX-2蛋白表达
提取海马总蛋白,BCA试剂盒校准蛋白浓度。一抗选择羊抗鼠IgG,二抗兔抗羊IgG/HRP。COX-2分子量为72 kD。蛋白变性,用10%SDS-PAGE胶进行电泳,转膜后以3%小牛血清白蛋白在37℃中和抗原2 h,一抗(1∶500),40℃下孵育12 h。二抗(1∶200),常温中静置1 h。洗涤后滴加化学发光显色液着色,胶片曝光、冲洗。以COX-2/β-actin灰度比值代表COX-2蛋白相对表达量。
1.7 Griess法检测大鼠海马组织一氧化氮(NO)代谢物含量
使用一氧化氮检测试剂盒,Griess法测定海马组织NO代谢物含量,实验步骤按说明书进行。
1.8 ELISA法检测大鼠海马组织IL-1、IL-6和PGE2水平
取大鼠海马组织,提取总蛋白,对蛋白样本依据试剂盒说明书进行操作。
1.9 统计学处理
2 结果
2.1 大鼠行为功能评定
如表1,在检测动物反应及顺应性的旷场实验中,PTSD模型组大鼠较正常对照组水平行动间隔明显减少,中间逗留时间显著增加(均P<0.05),COX-2抑制剂治疗组与模型组比较则有明显改善(均P<0.05)。在评估抑郁水平的高架十字迷宫实验中,模型组大鼠开臂活动频率与逗留间隔百分比明显低于正常对照组(均P<0.05),而COX-2抑制剂治疗组的抑郁水平则比模型组明显好转(均P<0.05)。水迷宫实验中,PTSD模型组大鼠潜伏上台时间较正常对照显著延迟(P<0.05),而在COX-2抑制剂治疗组则同样得到明显改善(P<0.05)。
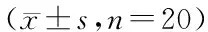
表1 三组大鼠旷场实验、高架十字迷宫实验、水迷宫实验结果Table 1 Results of open field test,elevated plus-maze test and Morris water-maze test in three groups(±s,n=20)
与对照组比较,aP<0.05;与PTSD组比较,bP<0.05
2.2 免疫组化检测大鼠海马区COX-2蛋白表达
COX-2基本不表达于正常对照组大鼠海马区神经元,PTSD组COX-2表达阳性细胞显著增多,阳性染色主要位于海马区神经元的细胞膜上,而治疗组COX-2阳性表达与PTSD组相比显著减少(图1)。
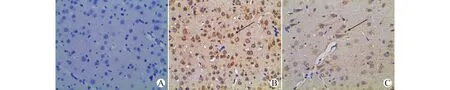
A:对照组;B:PTSD组;C:治疗组;黑色箭头所指为染色阳性细胞图1 大鼠海马区神经元细胞COX-2免疫组化染色(×400)Fig.1 Immunohistochemical staining of COX-2 in rat hippocampal tissues(×400)
2.3 大鼠海马区COX-2 mRNA表达情况
如图2、表2所示,正常对照组海马区有少量COX-2 mRNA表达,PTSD组COX-2 mRNA显著上升,组间比较有显著差异(P<0.05)。给予塞来昔布治疗后,COX-2 mRNA表达显著减少,同PTSD组比较有显著差异(P<0.05)。
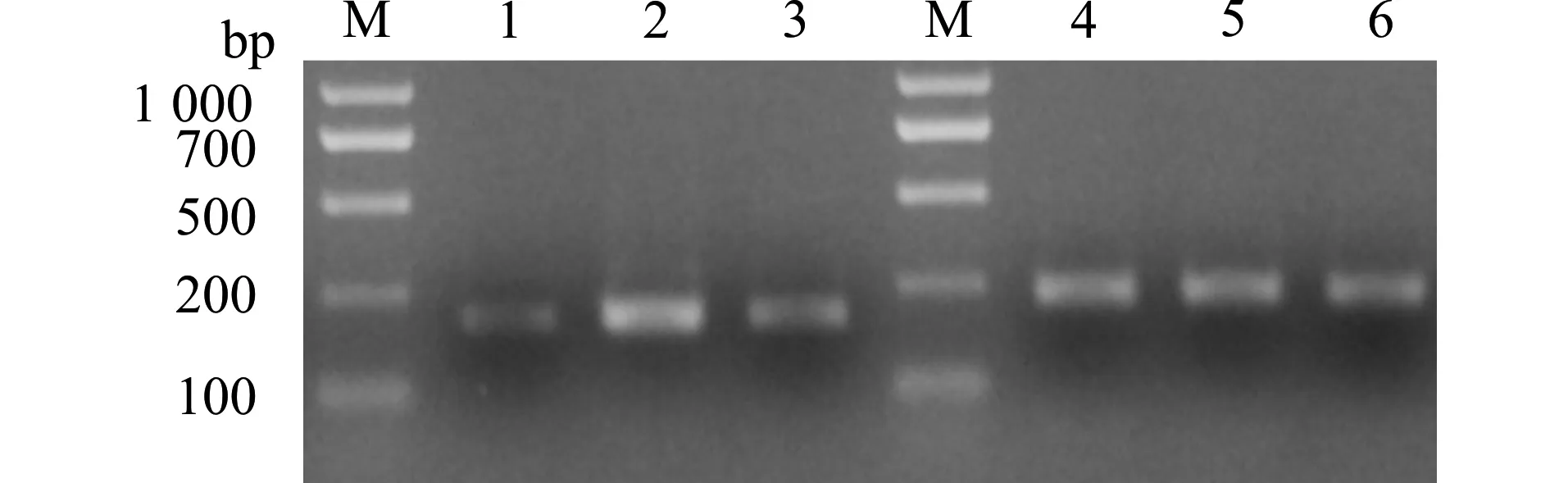
M:Marker;1:对照组COX-2;2:PTSD组COX-2;3:治疗组COX-2;4:对照组内参;5:PTSD组内参;6:治疗组内参图2 RT-PCR检测COX-2 mRNA表达Fig.2 RT-PCR of the expression of COX-2
2.4 大鼠海马区COX-2蛋白表达情况
COX-2蛋白表达变化与mRNA基本一致。对照组表达低,PTSD大鼠海马区COX-2蛋白含量显著升高(P<0.05)。给予塞来昔布治疗后,COX-2蛋白表达显著减少,同PTSD组比较有显著差异(P<0.05)(图3,表2)。
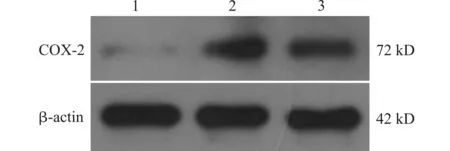
1:对照组;2:PTSD组;3:治疗组图3 Western blot检测大鼠海马组织中COX-2蛋白表达Fig.3 Western blot analysis of the expression of COX-2 protein in rat hippocampal tissues
2.5 各组大鼠海马区中NO水平
PTSD组大鼠海马组织中有大量NO表达,塞来昔布干预后(治疗组)脑组织中NO含量下降,虽然未恢复至正常水平,但与PTSD组比较差异有统计学意义(P<0.05),见表2。
2.6 各组大鼠海马区IL-1、IL-6、PGE2表达
ELISA检测海马组织PGE2含量,结果显示PTSD组海马区PGE2水平升高,治疗组PGE2表达较之下降(P<0.05)。同时测定大鼠海马区IL-1、IL-6表达情况,PTSD组大鼠海马区表达较对照组明显升高(均P<0.05);塞来昔布治疗组较对照组仍有增加(均P<0.05),但同PTSD组相比显著下降(均P<0.05),检测数据见表2。
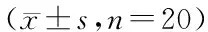
表2 3组大鼠IL-1、IL-6、NO、PEG2、COX-2含量表达Table 2 Concentrations of IL-1,IL-6,NO,PEG2,and COX-2 in three groups(±s,n=20)
与对照组比较,aP<0.05;与PTSD组比较,bP<0.05
3 讨论
目前PTSD发病机制尚不清楚。一般认为机体过度的精神应激反应可引发下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal,HPA)分泌失衡,炎性因子异常增高。有研究证实:中枢神经系统并非传统认为的免疫真空区域,许多炎性因子如:IL-1、IL-6可由细胞膜上跨膜转运蛋白通过主动转运进入大脑中枢神经系统,有观点认为炎性因子是启动中枢神经系统免疫损伤的重要扳机点。炎性因子可通过激活中枢小胶质细胞启动免疫损伤,PTSD发病机制中较为关键的便是炎性细胞因子激活小胶质细胞启动自噬机制。
本研究通过SPS法建立大鼠PTSD模型,证实了强烈的外界刺激可导致鼠中枢神经系统海马区域IL-1、IL-6表达升高。同时,推测应激导致的促炎性因子增加上调COX-2表达,而COX-2异常表达使其下游各产物如NO、PGE2的含量升高,最终引发神经损伤及细胞凋亡。有文献报道抑郁症患者血清中COX-2水平显著升高[9],我们发现COX-2在PTSD大鼠脑内的表达显著增强,而经塞来昔布治疗后症状得到明显改善,表明COX-2的增强表达参与了创伤后应激的发病过程,推测COX-2可能作为药物治疗创伤后应激障碍的一个潜在靶点。COX-2蛋白的异常升高与机体内发生的炎症反应密切相关[10-11]。本研究发现促炎性因子的升高伴有COX-2含量的增加,同时PGE2、NO及氧化应激产物的表达上调。氧化应激在细胞凋亡中的作用已被证实[12-13],PGE2可引起细胞的凋亡,有学者的相关实验表明,在小鼠神经元中加入PGE2后48 h,PGE2以剂量依赖方式诱导细胞凋亡,其机制与激活半胱氨酸蛋白激酶有关[14]。NO是一种活性极强的自由基,可诱导更强自由基如ONOO-的连锁反应,ONOO-可直接抑制线粒体呼吸链及损伤细胞内DNA,抑制NO产生可起到保护神经元的作用。已有的研究表明激活NF-κB上调iNOS进而合成大量NO是造成神经元细胞凋亡的关键途径[15]。本实验证明PTSD大鼠海马的NO表达明显升高,治疗组的NO含量下降,说明COX-2抑制剂可能通过减少NO的通路的激活,进而减轻神经损伤。
氧化应激是细胞内多种信号转导通路的共同途径[16],COX-2抑制剂可以显著减轻PTSD的行为学改变。COX-2在PTSD致病通路上可能起到扳机点的作用,COX-2抑制剂能够减少氧化应激并降低免疫应答发挥改善创伤后应激的作用。探索PTSD患者大脑中炎性细胞因子传导通路,有可能成为临床中研发新药及干预的重要手段。
[1] Cisler J M,Bush K,James G A,et al.Decoding the traumatic memory among women with PTSD:implications for neurocircuitry models of PTSD and real-time fMRI neurofeedback[J].PLoS One,2015,10(8):e0134717.
[2] Pietrzak R H,Goldstein R B,Southwick S M,et al.Psychiatric comorbidity of full and partial posttraumatic stress disorder among older adults in the United States:results from wave 2 of the national epidemiologic survey on alcohol and related conditions[J].Am J Geriatr Psychiatry,2012,20(5):380-390.
[3] Cohen H,Kaplan Z,Koresh O,et al.Early post-stressor intervention with propranolol is ineffective in preventing posttraumatic stress responses in an animal model for PTSD[J].Eur Neuropsycho Pharmacol,2011,21(3):230-240.
[4] 殷莉,黄姗姗,何主强.吲哚胺2,3-双加氧酶及细胞因子在创伤后应激障碍患者中的表达变化及意义[J].华中科技大学学报:医学版,2016,45(1):108-110.
[5] Moeller D R,Duffy J M,Goolsby A M,et al.Use of a removable mandibular neuroprosthesis for the reduction of posttraumatic stress disorder(PTSD)and mild traumatic brain injury/PTSD/associated nightmares,headaches,and sleep disturbances[J].Spec Oper Med,2014,14(3):64-73.
[6] Koek R J,Langevin J P,Krahl S E,et al.Deep brain stimulation of the basolateral amygdala for treatment-refractory combat post-traumatic stress disorder(PTSD):study protocol for a pilot randomized controlled trial with blinded,staggered onset of stimulation[J].Trials,2014,15(1):356.
[7] Kousha M,Mehdizadeh T S.Normative life events and PTSD in children:how easy stress can affect children’s brain[J].Acta Med Iran,2013,51(1):47-51.
[8] Zhao W,Han F,Shi Y.IRE1α pathway of endoplasmic reticulum stress induces neuronal apoptosis in the locus coeruleus of rats under single prolonged stress[J].Prog Neuropsychopharmacol Biol Psychiatry,2016,69:11-18.
[9] Robinson R.A molecular clue to PTSD[J].PLoS Biol,2015,13(10):e1002283.
[10] Gao H M,Liu B,Zhang W,et al.Synergistic dopaminergic neurotoxicity of MPTP and inflammogen lipopolysaccharide:relevance to the etiology of Parkinson’s disease[J].FASEB J,2003,17(13):1957-1959.
[11] Hinz B,Brune K.Paracetamol and cyclooxygenase inhibition:is there a cause for concern?[J].Ann Rheum Dis,2012,71(1):20-25.
[12] Said R S,Badr A M,Nada A S,et al.Sodium selenite treatment restores long-lasting ovarian damage induced by irradiation in rats:impact on oxidative stress and apoptosis[J].Reprod Toxicol,2014,43:85-93.
[13] Nury T,Zarrouk A,Vejux A,et al.Induction of oxiapoptophagy,a mixed mode of cell death associated with oxidative stress,apoptosis and autophagy,on 7-ketocholesterol-treated 158 N murine oligodendrocytes:impairment by α-tocopherol[J].Biochem Biophys Res Commun,2014,446(3):714-719.
[14] Takadera T,Yumoto H,Tozuka Y,et al.Prostaglandin E2 induces caspase-dependent apoptosis in rat cortical cells[J].Neurosci Lett,2002,317(2):61-64.
[15] Morioka N,Inoue A,Hanada T,et al.Nitric oxide synergistically potentiates interleukin-1 beta-induced increase of cyclooxygenase-2 mRNA levels,resulting in the facilitation of substance P release from primary afferent neurons:involvement of cGMP-independent mechanisms[J].Neuropharmacology,2002,43(5):868-876.
[16] Puetz T W,Youngstedt S D,Herring M P.Effects of pharmacotherapy on combat-related ptsd,anxiety,and depression:a systematic review and meta-regression analysis[J].PLoS One,2015,10(5):e0126529.
EffectoftheCyclooxygenase-2InhibitoronNeurologicalFunctionofRatswithPost-traumaticStressDisorder
He Zhuqiang,Duan Faliang△,Wang Mengyang et al
DepartmentofNeurosurgery,WuhanFirstHospital,Wuhan430022,China
ObjectiveTo observe the expression of cyclooxygenase-2(COX-2)in the hippocampi of rats with post-traumatic stress disorder(PTSD)and the protective effect of the COX-2 inhibitor(celecoxib)on the neurological function of the rats in order to examine the role of COX-2 in the pathogenesis of PTSD.MethodsAdult male Wistar rats were randomly divided into three groups:normal control group,PTSD model group,and COX-2 inhibitor group.The open field test,elevated plus-maze test and water maze test were used to evaluate the rat behaviors.The expression of COX-2 was detected by immunohistochemistry,RT-PCR,and Western blotting,respectively.The levels of interleukin-1(IL-1),interleukin-6(IL-6),prostaglandin E2(PGE2)were measured by ELISA and the expression of nitric oxide(NO)by Griess method.ResultsRT-RCR and Western blotting showed that the expression of COX-2 mRNA and protein was significantly lower in COX-2 inhibitor group than in PTSD model group but still greater in COX-2 inhibitor group than in normal control group,with significant differences found(P<0.05 for all).ELSIA showed that the levels of IL-1,IL-6 and PEG2 were profoundly decreased in COX-2 inhibitor group as compared with PTSD group(P<0.05).The Griess method revealed that the change of NO was similar to that of the indicators mentioned above in the three groups.Behavioral function was greatly improved in COX-2 inhibitor group(P<0.05).ConclusionThe levels of IL-1,IL-6 and COX-2 are conspicuously increased and their downstream factors NO and PGE2 are over-expressed in the hippocampi of rats with PTSD,suggesting the involvement of COX-2 in the pathogenesis of PTSD.The COX-2 inhibitor may improve the neurological function of PTSD rats by inhibiting the expression of inflammatory factors.
post-traumatic stress disorder;cyclooxygenase-2;interleukin-1;interleukin-6;nitric oxide;prostaglandin E2;celecoxib
*湖北省自然科学基金资助项目(No.2015CFB694),武汉市卫生计生委资助项目(No.WZ16C10)
何主强,男,1978年生,副主任医师,医学博士,E-mail:colei@sina.com
△通讯作者,Corresponding author,E-mail:Duanfaliang@126.com
R749.5
10.3870/j.issn.1672-0741.2017.05.009
(2017-03-08 收稿)
