重组草酸降解酶乳酸菌治疗高草酸尿症的实验研究*
2017-11-14赵晨明朱晓敬郭小林陈志强叶章群
杨 欢, 赵晨明, 朱晓敬, 李 洋, 郑 涛, 管 维, 郭小林, 陈志强, 叶章群△
1华中科技大学同济医学院附属同济医院泌尿外科,武汉 430030 2湖北大学生命科学学院,武汉 430063 3武汉市普爱医院泌尿外科,武汉 430033
重组草酸降解酶乳酸菌治疗高草酸尿症的实验研究*
杨 欢1, 赵晨明1, 朱晓敬2, 李 洋2, 郑 涛3, 管 维1, 郭小林1, 陈志强1, 叶章群1△
1华中科技大学同济医学院附属同济医院泌尿外科,武汉 4300302湖北大学生命科学学院,武汉 4300633武汉市普爱医院泌尿外科,武汉 430033
目的构建表达重组草酸降解酶的乳酸菌,并探讨对高草酸尿症大鼠的治疗作用。方法将草酸脱羧酶(oxalate decarboxylase,ODC)和草酸氧化酶(oxalate oxidase,OxO)基因与表达质粒pMG36e重组,通过电转化将重组质粒转入乳酸菌MG1363中。在含100 mmol/L草酸的培养液中培养48 h,测量其生长情况及培养液中草酸含量变化。以含5%草酸食物喂养SD大鼠,并同时进行重组乳酸菌灌胃治疗,1周后收集大鼠24 h尿液测量草酸含量。结果成功构建重组pMG36e-ODC,pMG36e-OxO乳酸菌,两者都可在含100 mmol/L草酸的培养液中生长,20 h左右开始进入对数期,40 h左右进入稳定期。其中pMG36e-ODC乳酸菌可明显降低培养液内草酸浓度,48 h内可降解30%,而培养pMG36e-OxO乳酸菌和正常乳酸菌后培养液中草酸含量无明显变化,48 h内草酸含量水平下降了约15%。pMG36e-ODC乳酸菌喂养可显著降低高草酸饮食大鼠尿液中草酸含量。结论重组ODC乳酸菌可有效降解草酸,并可通过降解食物中草酸缓解模型大鼠高草酸尿症。
草酸脱羧酶; 草酸氧化酶; 乳酸菌; 基因重组; 草酸钙结石
尿石症是泌尿外科的常见疾病之一,人群患病率约为5%~10%,伴有50%的复发率[1],给患者带来极大的身心痛苦和沉重的经济负担。草酸钙结石是最常见的尿石成分类型,尿草酸和尿钙升高均会增加草酸钙结石形成的风险,一项研究提示高草酸尿促进草酸钙结晶形成的作用比高钙尿大15倍[2]。尿草酸主要来源于肝脏合成的内源性草酸和胃肠道从饮食中摄入的外源性草酸,人体中无降解草酸的代谢途径,因此针对高草酸尿目前缺乏有效的防治措施。自然界中存在数种降解草酸的途径,包括人体肠道菌群以及草酸脱羧酶(oxalate decarboxylase,ODC)和草酸氧化酶(oxalate oxidase,OxO)等。其中人体肠道寄生菌产甲酸草酸杆菌已被证明可有效缓解高草酸尿症,预防草酸钙结石[3],但因其寄生条件苛刻,寄生成功率很低。其他肠道菌群如乳酸杆菌、双歧杆菌等虽具有降解草酸的能力,但在体内难以有效减少尿草酸排泄量[4]。草酸脱羧酶和草酸氧化酶分别来自于枯草芽孢杆菌和大麦,它们具有高效、结构稳定、耐高温、耐酸等优点,在治疗高草酸尿症方面显示出良好的前景。本研究拟将草酸脱羧酶和草酸氧化酶基因通过基因重组技术转入乳酸菌中,使其表达草酸降解酶,从而提高草酸降解效率,利用口服途径降解食源性草酸,减少尿草酸排泄量,预防草酸钙结石的形成。
1 材料与方法
1.1 实验材料
枯草芽孢杆菌及大麦基因组(华中农业大学赠);DNA凝胶回收试剂盒;乳酸菌表达质粒pMG36e(BiovectorCo.,LTD);大肠埃希菌DH5α菌;乳酸菌MG1363(BiovectorCo.,LTD);MRS培养液(蛋白胨10 g、牛肉浸取物10 g、酵母提取液5 g、葡萄糖5 g、乙酸钠5 g、柠檬酸二胺2 g、吐温80 1 g、磷酸氢二钾2 g、七水硫酸镁0.2 g、七水硫酸锰0.05 g、碳酸钙20 g、蒸馏水1 L);乳酸菌感受态制备培养液(MRS+0.5 mol/L蔗糖+2.5%甘氨酸);乳酸菌复苏培养液(MRS+0.5 mol/L蔗糖+20 mmol/L氯化镁);PB缓冲液(5 mol/L蔗糖、10%甘油,用双蒸水配制)。雌性SD大鼠购自同济医院动物中心,8周龄,体质量200~220 g。
1.2 重组表达质粒的构建
根据GenBank中的基因序列,利用Primer Premier 5.0软件设计PCR反应引物,分别从枯草芽孢杆菌及大麦基因组中扩增提取草酸脱羧酶(ODC)及草酸氧化酶(OxO)编码基因。目的基因两端加入酶切位点(XbaⅠ:TCTAGA;HindⅢ:AAGCTT)。ODC上游引物5′-TCTAGAATGA-AAAAACAAAATGACATTC-3′,下游引物:5′-AAGCTTTTACTGCATTTCTTTTTCACTA-3′;OxO上游引物:5′-TCTAGAATGGGTTACTC-TAAAAACCTAGG-3′,下游引物:5′-AAGCTTTTAAGACCCACCGGC-3′。利用PCR反应及DNA凝胶回收试剂盒扩增、纯化ODC和OxO基因片段,经测序确定序列正确后,利用XbaⅠ/HindⅢ双酶切,并通过DNA连接酶连接到乳酸菌表达质粒pMG36e上,如图1。连接产物转化感受态大肠埃希菌DH5α,平板选择性培养,挑取单菌落,培养,提取质粒,测序。
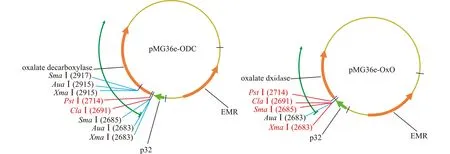
EMR为红霉素抗性基因,p32启动子后分别连接草酸脱羧酶和草酸氧化酶编码基因图1 重组质粒pMG36e-ODC(左)和pMG36e-OxO(右)示意图Fig.1 The schematic diagram of recombinant plasmids pMG36e-ODC(left)and pMG36e-OxO(right)
1.3 重组质粒电转化
乳酸菌电转化:将乳酸菌MG1363在感受态制备培养液中培养至对数期,冷却(将培养物置于冰上30 min),6 000 r/min离心10 min,收集菌体,用PB缓冲液洗涤3次后,再用1 mL PB缓冲液重悬菌体,取50 μL新制备的感受态细胞悬液到预冷的无菌EP管中,加入1 μL重组质粒,冰浴5 min,将此混合液加入预冷的2 mm电转化杯中电场强度10 kV/cm,电阻200 Q、电容25 μF电击,电击完毕后迅速向电转化杯中加入950 μL的复苏培养液,混匀后倒入无菌EP管中,37℃静置培养2 h,取用再生液体培养液稀释后的电击转化细胞液100 μL,涂布到含红霉素的MRS平板上,挑取红霉素筛选的阳性菌落进行培养,提取质粒后测序验证。
1.4 重组乳酸菌体外降解草酸效果评估
将重组ODC基因乳酸菌(pMG36e-ODC Lab)、重组OxO基因乳酸菌(pMG36e-OxO Lab)以及正常乳酸菌(wild-type Lab)分别接种入含有100 mmol/L草酸的MRS培养液中,37℃静置培养48 h,每4 h取2 mL培养液,利用分光光度计测量600 nm波长下吸光度(A600 nm)评估细菌生长情况;将培养液通过0.22 μm孔径滤器,利用高效液相色谱法(HPLC)测量培养液中草酸浓度[5]。
1.5 动物实验
将15只220~240 g雌性SD大鼠随机分为3组,每组5只,全部给予含5%草酸的食物,第1组为对照组,第2组高草酸饮食的同时每天灌胃5×1010CFU pMG36e-ODC Lab,第3组高草酸饮食同时每天灌胃5×1010CFU pMG36e-OxO Lab[6]。1周后将所有大鼠置于代谢笼中,收集24 h尿液,收集瓶中放入1 mL浓盐酸防止维生素C等物质转化为草酸。采用HPLC法测量尿液中草酸浓度,与尿液体积相乘计算得到24 h尿草酸量。应用IBM SPSS软件进行独立样本t检验,比较各组之间尿草酸含量的差异。
2 结果
2.1 重组草酸降解酶乳酸菌构建成功
成功构建pMG36e-ODC及pMG36e-OxO重组质粒,并成功电转入乳酸菌MG1363中,培养转基因乳酸菌后提取质粒,利用双酶切(XbaⅠ/HindⅢ)验证,基因片段大小正确(图2),并经过测序无误。

1:pMG36e-ODC重组质粒酶切;2:pMG36e-OxO重组质粒酶切;3:pMG36e质粒酶切图2 重组质粒pMG36e-ODC和pMG36e-OxO双酶切(XbaⅠ/HindⅢ)验证凝胶电泳图Fig.2 Gel electrophoresis of recombinant plasmids pMG36e-ODC and pMG36e-OxO by the double enzyme digestion(XbaⅠ/HindⅢ)
2.2 重组乳酸菌降解草酸的体外实验
wild-type Lab、pMG36e-ODC Lab和pMG36e-OxO Lab分别接种于含100 mmol/L草酸的MRS培养液中37℃培养48 h。pMG36e-ODC Lab和pMG36e-OxO Lab可在高浓度草酸环境中生长,约20 h后进入对数期,生长40 h后两者都进入稳定期。而wild-type Lab无法生长;pMG36e-ODC Lab可明显减少培养液中草酸含量,48 h内大约下降30%,而pMG36e-OxO Lab与wild-type Lab相比较,培养液内草酸含量并无明显下降。通过测量不同时间点培养液的A600 nm以及草酸浓度,绘制出生长曲线(图3)以及草酸含量变化曲线(图4)。

图3 重组乳酸菌在含100 mmol/L草酸的MRS培养液中的生长曲线Fig.3 The growth curve of wild-type lab,recombinant Labs pMG36e-ODC and pMG36e-OxO in MRS culture medium containing 100 mmol/L oxalate

图4 各组乳酸菌的MRS培养液中草酸浓度变化曲线Fig.4 The oxalate concentration curve of wild-type lab,recombinant Labs pMG36e-ODC and pMG36e-OxO in MRS culture medium
2.3 重组草酸降解酶乳酸菌饲养大鼠的体内实验
5%草酸喂食1周的对照组大鼠24 h尿草酸含量平均为(30.35±6.51) mg;第2组经过pMG36e-ODC Lab灌胃治疗,尿草酸含量为(20.71±5.02) mg,明显低于对照组(P<0.05);第3组经过pMG36e-OxO Lab灌胃治疗,尿草酸含量为(30.77±11.68) mg,与对照组比较并无明显差异(P>0.05)。
3 讨论
高草酸尿症是草酸钙结石最主要的风险因素之一,按起病原因可分为原发性高草酸尿,肠源性高草酸尿和特发性高草酸尿,其中特发性高草酸尿占绝大多数。实验表明无论是正常人还是草酸钙结石患者,高草酸饮食后尿草酸排泄量都会明显增加,并且在特发性高草酸尿患者中草酸的吸收率明显高于正常人[7],相反高草酸尿患者经过低草酸或者无草酸饮食调整后,尿草酸排泄量平均可下降5.7~18.9 mg/d[8]。因此通过降低食物中草酸摄取量是种可有效预防高草酸尿的方法。但草酸广泛存在于各类蔬菜、水果、谷类等食物中,很难单纯通过限制饮食达到减少食物来源草酸的目的。
乳酸菌是目前应用最为广泛的益生菌,同时也是一种理想的生物药物载体,在治疗代谢性疾病,口服疫苗等方面具有广阔的应用前景。草酸脱羧酶和草酸氧化酶是自然界最常见的2种草酸降解酶,具有防治高草酸尿症的潜力,但作为异源蛋白无论是通过肠道还是静脉途径都很容易被蛋白酶降解或引发免疫反应而无法有效发挥其生物学效应。因而我们将草酸降解酶基因通过基因重组技术转入乳酸菌中,实现两者的优势互补,使其持续表达草酸降解酶,可安全而高效地降解肠道中的草酸,减少草酸的吸收。
本实验利用目前应用最为广泛而又简便的表达质粒pMG36e作为表达载体,将草酸脱羧酶基因和草酸氧化酶基因成功转入乳酸菌中,pMG36e带有乳酸菌启动子p32,无需诱导便可持续表达。pMG36e-ODC Lab展现出了理想的降解草酸效率,而pMG36e-OxO Lab并无明显的草酸降解效果。这可能与草酸脱羧酶和草酸氧化酶不同的生物学性质有关[9]。虽然如此,我们成功构建了一种可有效降解草酸的重组草酸脱羧酶基因的乳酸菌,通过口服途径即可在肠道中充分发挥生物学效应,在动物实验中取得了理想缓解高草酸尿症的效果。理论上乳酸菌不仅可安全口服,并可以在人体肠道中正常寄生,因此口服表达草酸脱羧酶的乳酸菌是种简单、安全而又持续有效的防治高草酸尿症的方法,为预防草酸钙结石提供了一种新的思路。
[1] Skolarikos A,Straub M,Knoll T,et al.Metabolic evaluation and recurrence prevention for urinary stone patients:EAU guidelines[J].Eur Urol,2015,67(4):750-763.
[2] Siener R,Hesse A.The effect of different diets on urine composition and the risk of calcium oxalate crystallisation in healthy subjects[J].Eur Urol,2002,42(3):289-296.
[3] 陈志强,郭辉,叶章群,等.人肠道产甲酸草酸杆菌的分离培养[J].中华实验外科杂志,2005,22(11):1402-1403.
[4] Siener R,Bade D J,Hesse A,et al.Dietary hyperoxaluria is not reduced by treatment with lactic acid bacteria[J].J Transl Med,2013,11:306.
[5] Anbazhagan K,Sasikumar P,Gomathi S,et al.Invitrodegradation of oxalate by recombinantLactobacillusplantarumexpressing heterologous oxalate decarboxylase[J].J Appl Microbiol,2013,115(3):880-887.
[6] Sasikumar P,Gomathi S,Anbazhagan K,et al.RecombinantLactobacillusplantarumexpressing and secreting heterologous oxalate decarboxylase prevents renal calcium oxalate stone deposition in experimental rats[J].J Biomed Sci,2014,21:86.
[7] Voss S,Hesse A,Zimmermann D J,et al.Intestinal oxalate absorption is higher in idiopathic calcium oxalate stone formers than in healthy controls:measurements with the oxalate absorption test[J].J Urol,2006,175(5):1711-1715.
[8] Penniston K L,Nakada S Y.Effect of dietary changes on urinary oxalate excretion and calcium oxalate supersaturation in patients with hyperoxaluric stone formation[J].Urology,2009,73(3):484-489.
[9] Cassland P,Larsson S,Nilvebrant N O,et al.Heterologous expression of barley and wheat oxalate oxidase in anE.colitrxBgordouble mutant[J].J Biotechnol,2004,109(1/2):53-62.
TreatmentofHyperoxaluriawithRecombinantLactobacilluspMG36e-ODC
Yang Huan1,Zhao Chenming1,Zhu Xiaojing2et al
1DepartmentofUrology,TongjiHospital,TongjijiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030,China2CollegeofLifeScience,HubeiUniversity,Wuhan430063,China
ObjectiveTo transfer oxalate decarboxylase(ODC)and oxalate oxidase(OxO)into Lactobacillus(Lab)to express oxalate-degrading enzyme,which could continuously degrade oxalate,degrade dietary oxalate via oral administration and prevent the formation of calcium oxalate stones.MethodsRecombinant plasmids pMG36e expressing ODC or OxO were established and electrotransformed into Labs MG1363,which were cultured in the medium containing 100 mmol/L oxalate for 48 h to examine the oxalate degradation.SD rats were fed on 5% oxalate diet and treated with recombinant Labs by gavage.One week later,the 24-h urinary oxalate content was measured.ResultsThe recombinant Labs pMG36e-ODC and pMG36e-OxO were successfully constructed and both could grow in oxalate-containing medium.The growth curve showed that the logarithmic phase began at about 20 h and the stable phase at about 40 h.The recombinant Lab pMG36e-ODC could degrade oxalate significantly,by 30% in 48 h,while the recombinant Lab pMG36e-OxO and the wild type Lab showed little efficiency,and they decreased oxalate by nearly 15% in 48 h.Additionally,the recombinant Lab pMG36e-ODC could significantly decrease the amount of urinary oxalate in rats on high oxalate diet.ConclusionThe recombinant Lab pMG36e-ODC degrades oxalate effectively and prevents hyperoxaluria by reducing dietary oxalate.
oxalate decarboxylase; oxalate oxidase; lactic acid bacteria; gene recombination; calcium oxalate stones
*国家自然科学基金资助项目(No.81270788,No.81500534,No.81370805);湖北省自然科学基金资助项目(No.2015CFB289,No.2012FFB02412,No.2013CFB174);武汉市青年科技晨光计划项目(No.2013072304010833,No.2015070404010199);教育部高等学校博士学科点专项科研基金新教师基金(No.20130142120072)
杨 欢,男,1980年生,医学博士,主治医师,讲师,E-mail:yhpz123@163.com
△通讯作者,Corresponding author,E-mail:zhangqun-ye@163.com
R692.4
10.3870/j.issn.1672-0741.2017.05.013
(2017-06-18 收稿)
